豆薯多孔淀粉的制备、理化性质及吸附性能的研究
黄晶晶,施晓丹,汪少芸
(福州大学生物科学与工程学院,福建 福州 350108)
淀粉是各种食品和工业产品的主要成分,具有价格低廉、安全无毒害、可生物降解等优势,被广泛应用于食品、医药和化妆品等领域[1]。然而,天然淀粉存在热稳定性差、低热分解性、低抗剪切性等问题,限制了它在工业上的应用[2-3]。为此,大量研究通过改性来提高淀粉稳定性、吸附性等性能。目前已有的改性方法主要有物理改性、化学改性和生物改性(酶改性)[4-5]。多孔淀粉是一种表面分布着相对均一孔洞结构或者孔洞结构贯穿整个淀粉颗粒的改性淀粉。近年来,越来越多的学者选择用物理复合酶法这种绿色、环保的方法制备多孔淀粉[6]。已有研究表明,多孔淀粉的孔洞结构一般在无定形区形成。由于无定形区被部分水解,所以结晶度会略高于原淀粉,但淀粉的晶型不会发生改变。多孔淀粉颗粒结构的变化会导致其理化性质发生改变。相对原淀粉,多孔淀粉的比表面积会增大,吸附性能、溶胀能力和热力学等性质也会发生改变[7]。在食品行业,多孔淀粉可被用于包埋和缓释不稳定食品物质;在医药工业,多孔淀粉可作为药物控释载体和骨、软骨组织的替代物;在环境工程方面,多孔淀粉常被用作吸附剂,吸附废水中的重金属等[8]。
豆薯,别名沙葛、凉薯,原产于热带美洲,于17世纪末传入中国[9]。豆薯营养成分丰富,是药食同源的食物[10]。豆薯成熟块根淀粉含量在24%左右,是极具开发价值的淀粉资源,因此豆薯可作为一种可持续作物以缓解全球人口对淀粉需求的压力[11-12]。本实验室前期研究发现豆薯淀粉颗粒呈现球体或多面体等形状,颗粒直径为3 μm~9 μm。豆薯淀粉糊化后淀粉糊透明度低于土豆淀粉,呈现弱凝胶状态。豆薯淀粉中慢性消化淀粉和抗消化性淀粉含量相对较高,是一种低热量食物资源[13]。为进一步开发和利用豆薯淀粉资源,本试验采用超声辅助复合酶法制备多孔淀粉,然后用扫描电子显微镜(scanning electron microscope,SEM)和比表面积及孔隙分析仪表征淀粉颗粒孔隙的表观形貌和孔隙参数,用差示扫描量热法(differential scanning calorimetry,DSC)和 X-射线衍射技术(X-ray diffraction,XRD)对多孔淀粉进行热力学分析和晶型结构表征,以期为后续豆薯多孔淀粉的研究与应用提供参考。
1 材料与方法
1.1 材料与试剂
豆薯淀粉:福州大学食品与海洋生物资源研究所实验室自制[13];葵花籽油:上海佳格食品有限公司。
α-淀粉酶(35 μ/mg):麦克林公司;淀粉葡萄糖苷酶(70 μ/mg):西格玛奥德里奇贸易有限公司;NaOH、Na2HPO4、柠檬酸(均为分析纯):西陇科学股份有限公司;亚甲基蓝(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
场发射扫描电子显微镜(Nova NanoSEM230):捷克FEI CZECH REPUBLIC S.R.O.公司;射线多晶衍射仪(Xpert3X):美国CEM公司;差示扫描量热仪(DSC214):德国耐驰公司;比表面积及孔隙度分析仪(asap2460):美国麦克公司;恒温水浴摇床(YC-S30):天津市泰斯特仪器有限公司;紫外可见分光光度计(UV-1100):上海美谱达仪器有限公司;电热鼓风干燥箱(DHG-9140A):上海精宏实验设备有限公司;高速冷冻离心机(XZ-21K):长沙湘智离心机仪器有限公司。
1.3 方法
1.3.1 豆薯多孔淀粉的制备
参考Qian等[14]的方法制备多孔淀粉。称取一定量的豆薯淀粉,加入pH5.0磷酸氢二钠-柠檬酸缓冲液制成淀粉乳,在一定温度下磁力搅拌预热15 min。250 W超声30 min后加入一定量的复合酶(α-淀粉酶和淀粉葡萄糖苷酶的质量比为1∶5),恒温水浴反应一定时间后,加入1%NaOH溶液结束反应。然后3 800 r/min离心10 min,弃去上清液,将沉淀水洗3次,50℃烘干备用。
1.3.2 单因素试验优化制备工艺
以吸水率和多孔淀粉得率为制备多孔淀粉的指标,研究淀粉乳浓度、加酶量、酶解温度和酶解时间4个因素的影响。初始试验条件为淀粉乳浓度0.3g/mL、加酶量0.25%(质量分数)、酶解温度50℃、酶解时间4 h。因素变化范围分别为淀粉乳浓度0.1、0.2、0.3、0.4和 0.5 g/mL,加酶量 0.05%、0.10%、0.20%、0.25%和0.30%,酶解温度40、45、50、55℃和60℃,酶解时间 3.0、3.5、4.0、4.5 h和5.0 h。多孔淀粉得率的计算公式如下。

式中:w1为多孔淀粉质量,g;w2为原淀粉质量,g。
参考Xu等[15]的方法测定吸水率。称量并记录空离心管质量(m1)。准确称取一定质量的样品(m)于2 mL离心管中,加入1mL蒸馏水,涡旋1min后静置30min。在10 000 r/min离心10 min,吸出上清液,称量沉淀及离心管总重(m2)。每个样品做3个平行。吸水率的计算公式如下。
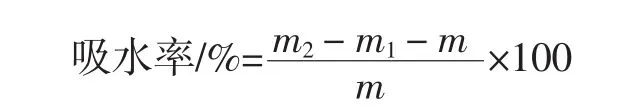
式中:m2为沉淀及离心管质量,g;m1为离心管质量,g;m 为样品质量,g。
1.3.3 颗粒微观形貌表征
原淀粉、多孔淀粉样品于50℃烘箱干燥后,将其固定在样品台的导电胶上,用离子溅射仪对其进行喷金处理,采用扫描电子显微镜于5.00 kV电压下观察淀粉颗粒形貌特征[16]。
1.3.4 比表面积及孔隙测定
将样品在105℃真空脱气脱水2 h,然后采用比表面积及孔隙度分析仪在液氮温度(77.35 K)下进行N2-吸附脱附分析测定吸附等温线,用BET方程计算比表面积,用BHJ法分析计算孔径及孔径分布[17]。
1.3.5 热力学分析
参考Miao等[18]的方法研究淀粉的糊化行为。准确称量0.003 0 g淀粉样品(干基)置于铝坩埚中,在铝坩埚中加入纯水溶液,使水与淀粉质量比达到3∶1,密封后于室温下(25℃)平衡24 h,以空铝坩埚为对照,并扣除基线,然后以升温速率10℃/min,从30℃扫描升温到100℃,测定淀粉糊化起始温度TO,峰值温度TP,终止糊化温度TC以及糊化焓值ΔH。
1.3.6 结晶度分析
将淀粉样品置于50℃烘箱干燥。X-射线衍射的特征射线是Cu-Kα,在电压40 kV、电流40 mA、测量角度 2θ范围为 5°~35°、步长 0.01、扫描速率 2°/min条件下测定。根据Yang等[19]的方法,使用MDI Jade6软件计算相对结晶度。
1.3.7 吸附能力测试
1.3.7.1 吸油率测定
参考Xu等[15]的方法测定吸油率。称量并记录空离心管的质量(O1)。准确称取一定质量的样品(O)于2 mL离心管中,加入1 mL葵花籽油,涡旋1 min后静置30 min。在10 000 r/min条件下离心10 min,吸出上清液,称量沉淀及离心管总重(O2)。每个样品重复测定3次。吸油率的计算公式如下。

式中:O2为沉淀及离心管质量,g;O1为离心管质量,g;O 为样品质量,g。
1.3.7.2 吸水率测定
按照1.3.2方法测定原淀粉和多孔淀粉吸水率。
1.3.7.3 亚甲基蓝吸附能力测定
亚甲基蓝标准曲线的绘制:配制浓度为0.001、0.002、0.003、0.004、0.005、0.006、0.007、0.008、0.009、0.010 mg/mL亚甲基蓝标准溶液,于波长660 nm处测溶液吸光度。以亚甲基蓝溶液浓度为横坐标,溶液所测吸光度为纵坐标,绘制亚甲基蓝标准曲线。
亚甲基蓝吸附量的测定:准确称取0.10g原淀粉、多孔淀粉样品于100 mL锥形瓶中,加入10 mL 0.1 mg/mL亚甲基蓝溶液,密封瓶口。然后在水浴温度30℃、转速130 r/min摇床中振摇2 h后,于10 000 r/min离心10 min,将上清液稀释20倍,用分光光度计在660 nm处测其吸光度,计算亚甲基蓝吸附量[20]。每个样品重复测定3次。亚甲基蓝吸附量计算公式如下。
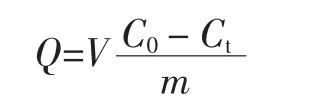
式中:Q为淀粉样品的亚甲基蓝吸附量,mg/g;V为亚甲基蓝溶液体积,mL;C0为亚甲基蓝溶液起始质量浓度,mg/mL;Ct为吸附后的亚甲基蓝溶液质量浓度,mg/g;m 为样品质量,g。
1.3.8 数据处理与统计分析
采用SPSS 26.0软件统计分析试验数据,用Origin 2018和WPS Office 2019软件绘制图表。
2 结果与分析
2.1 单因素试验结果
不同因素对豆薯多孔淀粉吸水率和得率的影响见图1。
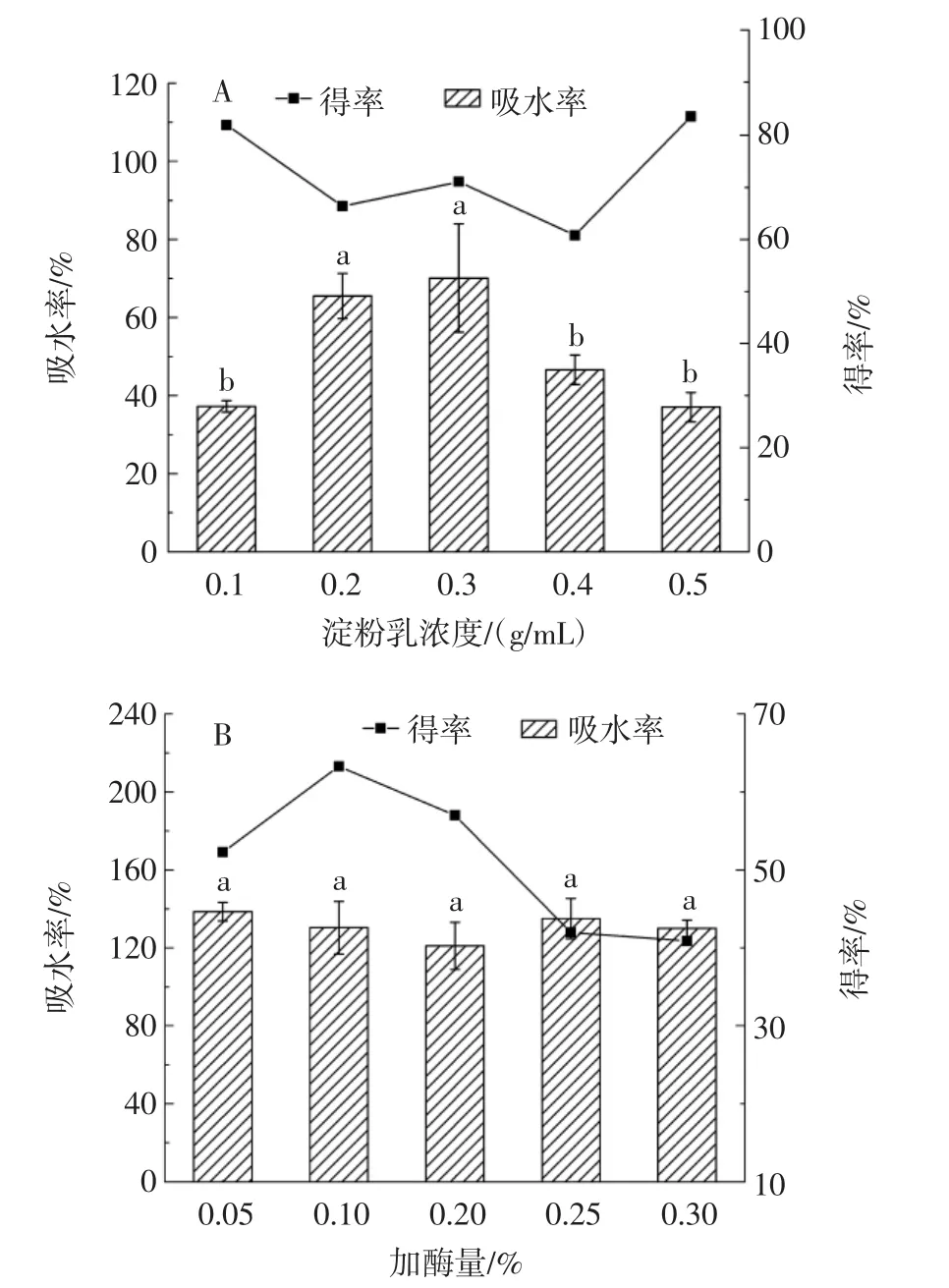

图1 不同因素对豆薯多孔淀粉吸水率和得率的影响Fig.1 Effect of different factors on rate of water absorption and yield of Pachyrrhizus erosus porous starch
由图1A可知,随着淀粉乳浓度的增加,多孔淀粉的吸水率先上升后降低。在淀粉乳浓度为0.3 g/mL时,多孔淀粉的吸水率最高,此时的多孔淀粉得率也较高,所以选定0.3 g/mL为最终淀粉乳制备浓度。由图1B可知,随着加酶量从0.05%增加到0.30%,多孔淀粉的吸水率出现一定程度的波动。但是,在误差允许的范围内,总体吸水率相差不大。在加酶量为0.10%时,多孔淀粉得率最高,最终选择0.10%加酶量为最终加酶量。由图1C可知,随着酶解温度的升高,多孔淀粉的吸水率整体先上升后降低,分析可能是当酶解温度小于或大于50℃时,抑制了酶的活性,淀粉酶的水解速率降低,致使淀粉颗粒孔隙较小,吸水率较低[21]。多孔淀粉在50℃时吸水率最高,且得率较高,因此确定50℃为最终的酶解温度。由图1D可知,随着酶解时间的延长,多孔淀粉的吸水率先上升后下降。水解前期,淀粉颗粒的孔隙随着水解时间的延长而变大,所以吸水率上升。在水解后期,因为过度水解导致孔隙过大引起淀粉颗粒结构坍塌,吸水率下降[22]。综合试验效率考虑,选择4.0 h作为最终的酶解时间。
因此制备豆薯多孔淀粉的最优条件确定为淀粉乳浓度0.3 g/mL、加酶量0.10%、酶解温度50℃、酶解时间4.0 h。
2.2 淀粉颗粒微观形貌分析
淀粉颗粒改性前后的微观形貌图见图2。

图2 豆薯原淀粉与多孔淀粉的扫描电子显微镜图Fig.2 Scanning electron micrographs of Pachyrrhizus erosus native starch and porous starch
由图2可知,豆薯原淀粉颗粒多数呈椭球状,小部分是多面体且表面出现凹陷。多孔淀粉颗粒表面出现大小适中且较为均一的孔隙。同时,部分多孔淀粉颗粒表面出现了破损,这可能是因为部分淀粉的水解程度较深,使淀粉颗粒部分表面孔洞较大,孔洞相连引起结构坍塌。Jia等[23]和Keeratiburana等[24]以玉米和大米为材料制备的多孔淀粉,孔隙较大且不均匀,可用于吸附益生菌、大分子物质等。而本文中用豆薯制备的多孔淀粉孔隙较小,且遍布于整个淀粉颗粒,更适合于吸附一些香气物质或者重金属。
2.3 比表面积及孔隙分析
豆薯原淀粉和多孔淀粉的微粒参数见表1。

表1 豆薯原淀粉和多孔淀粉的微粒参数Table 1 Particle parameters of native and porous starch of Pachyrrhizus erosus
由表1可知,多孔淀粉颗粒的BET比表面积、孔容、孔径、总孔面积均大于原淀粉,表明用复合酶酶解无定形区域,使淀粉颗粒的孔隙增大,即复合酶法制备豆薯多孔淀粉是可行的试验方案。而多孔淀粉的平均粒径小于原淀粉,可能是因为加酶量较多,淀粉的水解程度较深,使淀粉颗粒部分表面孔洞较大,孔洞相连引起结构坍塌,致使淀粉颗粒出现破损,所以粒径变小。图2的结果也证实了此结论。按照孔径大小的不同,多孔材料可以分为微孔材料(孔径小于2 nm)、介孔材料(孔径2 nm~50 nm)、大孔材料(孔径大于50 nm)。豆薯多孔淀粉的孔径为11.64 nm,所以豆薯多孔淀粉是介孔材料[25]。
2.4 X-射线衍射分析
豆薯原淀粉和多孔淀粉的X射线衍射图谱见图3。

图3 豆薯原淀粉和多孔淀粉的X射线衍射图谱Fig.3 X-ray diffraction spectrum of Pachyrrhizus erosus native starch and porous starch
淀粉的晶型可以根据X射线衍射图谱的尖峰衍射特征峰分为A-型、B-型和C-型。豆薯原淀粉在15°、17°、23°附近有强的尖峰衍射特征峰,并且 17°和18°的衍射峰为相连的双峰,在20°附近有很弱的衍射峰,这是典型的A-型淀粉晶型的X-射线衍射特征波谱,说明豆薯淀粉的晶型为A-型[26]。多孔淀粉与原淀粉相比,没有出现新的衍射特征峰,并且峰值变化很小。说明用淀粉酶对豆薯淀粉进行处理并没有改变淀粉的晶型,仍保持A-型。此结果与Jiang等[27]的报道结果一致。但是,多孔淀粉的尖峰衍射特征峰明显比原淀粉陡峭,这表明淀粉水解作用点是在无定形区域,使得无定形区的比例下降,结晶区比例相应升高[21]。如图3所示,多孔淀粉的相对结晶度为35.57%,比原淀粉29.52%的相对结晶度高,符合上述结论。
2.5 淀粉热力学分析
豆薯原淀粉和多孔淀粉的热性质参数结果见表2。

表2 豆薯原淀粉与多孔淀粉的热性质参数Table 2 Thermal property parameters of native and porous starch of Pachyrrhizus erosus
豆薯原淀粉和多孔淀粉的DSC热分析图见图4。

图4 豆薯原淀粉和多孔淀粉的差示扫描量热图谱Fig.4 Differential scanning calorimetry spectra of Pachyrrhizus erosus native starch and porous starch
由图4可知,多孔淀粉的初始糊化温度TO、峰值糊化温度TP、终止糊化温度TC和糊化焓值ΔH均高于原淀粉,即多孔淀粉的热吸收峰出现后移,此结果表明酶解处理提高了淀粉的热稳定性。这是因为淀粉酶水解了无定形区域,无定形区域减少,结晶区比例增大,结晶度也因此变高。淀粉的结晶区域比例与糊化温度成正比,所以说淀粉的热稳定性得到提升[28]。
2.6 吸附能力分析
2.6.1 吸水率和吸油率分析
吸水率和吸油率分析见图5。

图5 豆薯原淀粉与多孔淀粉的吸水率和吸油率Fig.5 Rate of oil absorption and rate of water absorption of native and porous starch of Pachyrrhizus erosus
由图5可知,豆薯多孔淀粉的吸水率和吸油率均大于原淀粉。多孔淀粉与原淀粉相比,多孔淀粉吸水率和吸油率分别提高了41.9%和24.1%。Nadaf等[29]制备的绿豆多孔淀粉,其吸水率和吸油率分别为126%、113%。相比原淀粉,吸水率和吸油率分别提高了21%和29%,与本试验结果相近。
2.6.2 亚甲基蓝吸附量
以亚甲基蓝浓度为横坐标,吸光度为纵坐标,得到亚甲基蓝的标准曲线y=134.050 0+0.057 5x,R2=0.998 9。原淀粉和多孔淀粉的亚甲基蓝吸附量分别是2.26 mg/g和4.38 mg/g,改性后提高了93.8%。张甲奇等[30]制备的大米多孔淀粉亚甲基蓝吸附量为4.88 mg/g,改性后的酯化大米多孔淀粉吸附量为5.97 mg/g。淀粉经过酯化改性后,吸附能力会有所提高。因此可以考虑对豆薯淀粉酯化改性再用酶解处理。
3 结论
本文采用超声辅助复合酶法制备豆薯多孔淀粉,并测定其理化性质、热力学性能和吸附性能。单因素试验结果表明,最佳制备条件为淀粉乳浓度0.3 g/mL、加酶量0.10%(α-淀粉酶与淀粉葡萄糖苷酶质量比为1∶5),酶解温度50℃、酶解时间4.0 h。豆薯淀粉表面出现较为均一且适中的孔隙,少部分表面出现破损。豆薯淀粉的BET比表面积、孔容、孔径、总孔面积增加。酶解处理后淀粉的晶型仍为A-型,但是相对结晶度有所提升。相对比原淀粉,多孔淀粉糊化温度提高,结晶区域变大,热稳定性上升。同时,多孔淀粉吸水率、吸油率和亚甲基蓝吸附量均有所提高。

