雷公藤多苷片抗人急性单核细胞白血病的物质基础研究
方冰倩,王亚楠,刘琰,王吓长,康迪,胡立宏
(南京中医药大学药学院,江苏省中药功效物质重点实验室,江苏 南京 210023)
雷公藤TripterygiumwilfordiiHook.f.为卫矛科雷公藤属植物,具有祛风除湿,通络止痛的功效[1]。基于雷公藤根提取物制成的雷公藤多苷片在中医药临床实践中应用广泛,可用于类风湿性关节炎、强直性脊柱炎[2-3]、慢性肾炎[4-6]、系统性红斑狼疮[7-8]等自身免疫性疾病的治疗。近年来其适应症不断扩大,研究发现雷公藤制剂具有广谱的抗肿瘤活性,可以抑制多种不同来源的肿瘤细胞增殖,在抗肿瘤领域显示了独特的疗效[9-10]。然而,高剂量的雷公藤诱发多组织器官的毒副作用制约了其在临床中的应用与相关制剂的研发[11-12]。
雷公藤中的化学成分复杂多样,迄今为止,已经报道的该属化合物单体达400多种,主要成分有生物碱类、二萜类、三萜类等[13-14]。目前有100多种单体化合物被证实具有生物活性,以二萜类雷公藤甲素(Triptolide,TP)与三萜类雷公藤红素(Celastrol,Cel)为代表[14-15]。其中,Cel是最早被分离出来的活性成分,可通过调控细胞增殖、凋亡等多种途径发挥抗炎与抗肿瘤等多种药理作用[16-18]。TP是从雷公藤中提取出的最具代表性的一种环氧二萜内酯类化合物。自1972年首次分离以来,TP在近60株不同来源的肿瘤细胞系中表现出良好的抗增殖活性[9,19]。然而,TP既是药效成分,又是毒性成分,其对转录复合体(Transcription factor IIH,TFIIH)中人着色性干皮病B(Xeroderma pigmentosum group B,XPB)的ATP酶活性的抑制导致其毒副作用不可避免[20]。本实验室前期研究发现不同来源的肿瘤细胞系对TP敏感性不同。其中,单核细胞来源的急性髓系白血病细胞对TP较敏感,TP作用48 h的半数抑制浓度(The half maximal inhibitory concentration,IC50)可达到10 nmol·L-1以下;体内动物实验表明TP在25 μg·kg-1·d-1的腹腔注射剂量下可以有效抑制异种移植瘤的生长[19]。目前全球科研机构正在积极开展TP前药治疗白血病的临床研究[21-22]。
雷公藤多苷片是目前使用较广泛的雷公藤制剂,主要应用于类风湿性关节炎等自身免疫性疾病的治疗,临床上尚未能应用于抗肿瘤,同时针对抗白血病的作用鲜有报道[8,23-24]。本研究通过寻找雷公藤多苷片敏感的血液肿瘤细胞株,在敏感瘤株的异种移植瘤模型上进行雷公藤多苷片体内活性验证;进一步对自制雷公藤多苷片提取物中的化合物进行系统分离,然后对其进行细胞水平上的活性评价;最后通过制备液相定向敲除雷公藤多苷片以及自制雷公藤多苷片提取物中的TP,考察其细胞毒活性的变化。旨在发现雷公藤多苷片的敏感瘤株并验证雷公藤多苷片发挥抗人急性单核细胞白血病(Acute monocytic leukemia,AMOL)作用的物质基础,为扩大雷公藤多苷片的临床适应症和提升质量控制标准提供参考。
1 材料
1.1 药物
雷公藤药材,产地云南(批号:20210125),楚雄千草药王谷农业发展有限公司;TP(批号:ST02050120)和Cel(批号:ST07880120),上海诗丹德标准技术服务有限公司;柔红霉素盐酸盐(Daunorubicin Hydrochloride,DNR,批号:HY-13062),南京迈博生物科技有限公司;雷公藤多苷片(不同厂家雷公藤多苷片均购自于南京市各大药店);羧甲基纤维素钠(CMC-Na,货号:C104984),上海阿拉丁生化科技股份有限公司。
1.2 细胞株
AMOL细胞MV-4-11(货号:CRL-9591),人B细胞淋巴瘤细胞SU-DHL-10(货号:CBP60560),购自ATCC;AMOL细胞SHI-1、人急性原粒细胞白血病细胞Kasumi-1、人慢性髓原白血病细胞K562,江苏省中医院赠;人肾皮质近曲小管上皮细胞系HK2、人正常肝细胞系L02,中国药科大学赠。
1.3 实验动物
BALB/c裸鼠,雌雄各半,4~6周龄,18~22 g,购于南京集萃药康生物科技股份有限公司,生产许可证号:SCXK(苏)2018-0008。将其饲养于南京中医药大学实验动物中心无病原体的屏障环境内,12 h/12 h光暗照明,自由饮食饮水,环境温度在20~26 ℃,湿度在40%~70%,适应性饲养1周后用于实验。实验方案由南京中医药大学动物伦理委员会执行并批准,实验动物伦理批准编号:202111A008。
1.4 试剂与仪器
细胞活力检测试剂盒(CCK-8,货号:A311-02),购自南京诺唯赞生物科技股份有限公司;胎牛血清(FBS,货号:10091148)、RPMI1640培养基(货号:C11875500BT)、青霉素/链霉素(P/S,货号:15140112),购自Gibco;IMDM培养基(货号:lw-SH30228.01),购自南京凯基生物科技发展有限公司;巯基还原剂(β-巯基乙醇,货号:M8210),购自北京索莱宝科技有限公司。
电子分析天平(Mettler Toledo,型号:MS105);酶标仪(Tecan,型号:Infinite 200 pro);纯水仪(Merck millipore,型号:Milli-Q Direct8);旋转蒸发仪(Buchi,型号:Buchi R-100);冷却水循环装置(EYELA,型号:CA-1116A);核磁共振波谱仪(Bruker,型号:BrukerAV500);液相色谱仪(Waters,型号:e2695-2998);制备液相色谱仪(Waters,型号:1525);液质联用色谱仪(Agilent,型号:Agilent1290-6120)。
2 方法
2.1 雷公藤的提取分离和结构鉴定
2.1.1 药材提取 为保证实验用样品的一致性,本研究按照制备雷公藤多苷片提取物的制备工艺进行实验用样品制备,简称雷公藤多苷片提取物[25]:取云南产雷公藤药材10 kg,粉碎后加95%乙醇超声提取3次(40 ℃、40 min,物料比为1∶7、1∶6、1∶6),过滤,收集滤液,将滤液浓缩至无醇味,将浓缩液倒入5 L分液漏斗中,每次加入1 L乙酸乙酯进行萃取,直至乙酸乙酯萃取液接近无色,浓缩并干燥得到浸膏208 g。
2.1.2 化合物分离和结构鉴定 将浸膏(208 g)进行硅胶柱层析,石油醚∶乙酸乙酯(10∶1~0∶1)梯度洗脱,得到8个流分X1~X8。对活性较好的组分X4、X6、X7和X8进行系统分离,综合运用质谱和核磁共振波谱数据,并结合文献鉴定了15个化合物的结构,分别为雷酚内酯(Triptophnolide,1)、异雷酚新内酯(Isoneotriptophenolide,2)、雷酚萜醇(Triptonoterpenol,3)、Triptobenzene J(4)、TP(5)、雷公藤晋碱(Wilforgine,6)、雷公藤定碱(Wilfordine,7)、雷公藤次碱(Wilforine,8)、雷公藤春碱(Wilfortrine,9)、雷公藤新碱(Euonine,10)、Peritassine A(11)、Cel(12)、雷公藤酚A(Wilforol A,13)、雷公藤三萜酸A(Triptotriterpenic acid A,14)和23-Nor-6-oxodemethylpristimerol(15),具体分离过程如下。
流分X4(13.3 g)经MCI柱色谱分离,甲醇/水梯度洗脱,得到3个亚组分X4-1~3,亚组分X4-1(1.2 g)经Sephadex LH-20凝胶柱色谱和制备液相(45%乙腈/水)得到化合物1(24 mg)、化合物2(10 mg)、化合物3(2 mg)。
流分X6(4.3 g)经MCI柱色谱分离,甲醇/水梯度洗脱,得到7个亚组分X6-1~7,亚组分X6-2(215 mg)经制备液相(20%乙腈/水)得到化合物5(5 mg),亚组分X6-4(726 mg)经硅胶柱色谱分离,石油醚/乙酸乙酯梯度洗脱,得到化合物4(5 mg)。
流分X7(49.0 g)采用硅胶柱分离,经石油醚/乙酸乙酯梯度洗脱得到4个亚组分X7-1~4。亚组分X7-1(28.6 g)经MCI柱色谱分离,甲醇/水梯度洗脱,得到4个亚组分X7-1-1~4,亚组分X7-1-3(5.1 g)经Sephadex LH-20凝胶柱色谱(甲醇)洗脱,得到亚组分X7-1-3-1~7,亚组分X7-1-3-1(479 mg)经制备液相(50%乙腈/水等度洗脱)得到化合物14(8 mg),亚组分X7-1-3-2(51 mg)经制备液相(60%乙腈/水)得到化合物15(8 mg)和化合物13(2 mg)。亚组分X7-1-4(217 mg)经硅胶柱色谱和Sephadex LH-20凝胶柱色谱(甲醇)洗脱,得到化合物12(4 mg)。亚组分X7-2(9.8 g)经MCI柱色谱分离,甲醇/水梯度洗脱,得到2个亚组分X7-2-1~2,亚组分X7-2-2(2.1 g)经Sephadex LH-20凝胶柱色谱(甲醇)和中性氧化铝柱色谱(石油醚/乙酸乙酯梯度)洗脱得到亚组分X7-2-2-1-1(818 mg),再经制备液相(43%乙腈/水)得到化合物8(3 mg)。
流分X8(21.0 g)经MCI柱色谱分离,甲醇/水梯度洗脱,经高效液相合并得到3个组分X8-1~3,组分X8-1(7.9 g)经Sephadex LH-20凝胶柱色谱(甲醇)洗脱,得到亚组分X8-1-1~3,亚组分X8-1-1(1.3 g)经制备液相(38%乙腈/水)得到化合物9(22 mg)、化合物10(12 mg);亚组分X8-1-2(3.8 g)经MCI柱色谱和制备液相得到化合物11(25 mg)。亚组分X8-2(3.1 g)经中性氧化铝柱色谱,石油醚/乙酸乙酯梯度洗脱,得到亚组分X8-2-1~3,亚组分X8-2-1(216 mg)经制备液相(43%乙腈/水)得到化合物6(14 mg);亚组分X8-2-2(140 mg)经制备液相(40%乙腈/水)得到化合物7(4 mg)。
2.2 CCK8法检测肿瘤细胞增殖抑制活性
2.2.1 样品溶液的制备 雷公藤多苷片测试溶液的制备:每个厂家取雷公藤多苷片20片,研成粉末,称定质量,称取1.0 g,置100 mL具塞锥形瓶中,加入50 mL乙酸乙酯,40 ℃超声处理(功率400 W,频率40 kHz)30 min,过滤,滤液蒸干,称定质量,加二甲基亚砜(Dimethyl sulfoxide,DMSO)后振荡10 s溶解,配成雷公藤多苷片测试溶液。
单体化合物溶液的制备:称取一定量的化合物,加DMSO后振荡10 s溶解,配成25 mg·mL-1母液。将母液稀释1 000倍使其为25 μg·mL-1,再依次5倍稀释使其分别为5 μg·mL-1和1 μg·mL-1,振荡10 s使其溶解,置于-20 ℃冰箱低温保存。
2.2.2 细胞培养 MV-4-11细胞培养于含10%胎牛血清的IMDM培养基中,并添加有1%P/S及0.05 mmol·L-1β-巯基乙醇;SU-DHL-10、K562、Kasumi-1及SHI-1细胞培养于含10%胎牛血清和1%双抗的1640培养基中;HK2细胞培养于含有10%胎牛血清和1%双抗的DMEM/F12培养基中;L02细胞培养于含有10%胎牛血清和1%双抗的DMEM培养基中。
2.2.3 细胞增殖抑制活性测试 取对数期生长的肿瘤细胞计数,根据计数结果从培养皿中取出所需体积的细胞转移到15 mL离心管里,1 200 r·min-1离心3 min,用真空泵吸走上清,并以培养基重悬。将不同浓度的药物和细胞按照1∶1体积比混匀后加入100 μL于96孔板中。96孔板置于37 ℃,5%CO2培养48 h,并提前2 h在每孔加入10 μL CCK8,利用酶标仪测定其在450 nm波长下的吸光度(A),计算细胞增殖抑制率(%)。细胞增殖抑制率=100%-(A给药-A空白)/(A对照-A空白)×100%。
2.3 雷公藤多苷片对异种移植瘤裸鼠的抗肿瘤活性
2.3.1 异种移植瘤裸鼠的模型构建 将BALB/c裸鼠在实验室适应性喂养7 d。取对数生长期MV-4-11细胞重悬于IMDM和Matrigel(1∶1)混合液中,计数后调整细胞浓度为5.0×107mL-1,以每只100 μL注射于小鼠右侧腋窝皮下,待肿瘤长至100~300 mm3用于试验。
2.3.2 实验动物分组与给药 采用随机区组法把荷瘤小鼠分成4组,每组5只,分别为:①溶剂对照(0.5%CMC-Na)组;②雷公藤多苷片10 mg·kg-1组;③雷公藤多苷片20 mg·kg-1组;④雷公藤多苷片30 mg·kg-1组。配药方法:将雷公藤多苷片研磨粉碎后,加入0.5%CMC-Na混悬,并稀释到所需浓度。试验期间,每天灌胃给药,给药体积为10 mL·kg-1,连续给药15 d,每天记录小鼠肿瘤体积和体质量。
2.4 TP定向敲除实验
2.4.1 对照样品溶液的制备 精密称取TP或Cel对照品适量,加甲醇制成50 μg·L-1的溶液,滤过,即得。
2.4.2 色谱条件 Poroshell 120 C18色谱柱(3 mm×150 mm,2.7 μm);以水为流动相A,乙腈为流动相B,柱温为30 ℃;流速为0.2 mL·min-1;检测波长为218 nm;进样量:20 μL。梯度条件见表1。TP的保留时间为8.5 min。
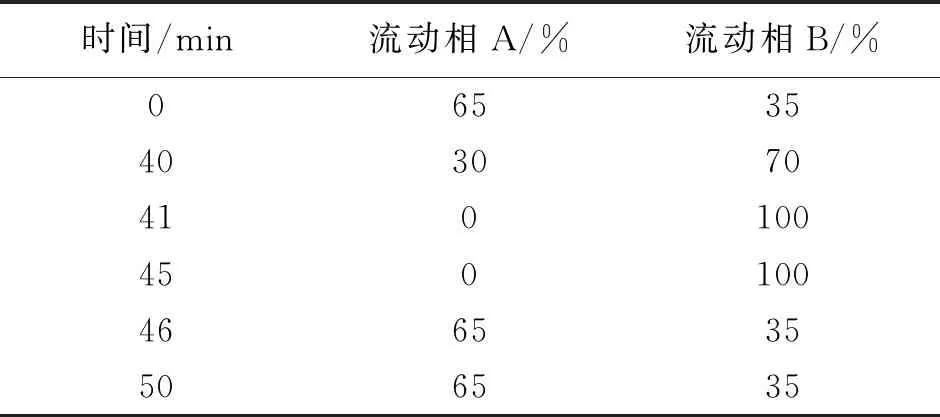
表1 TP定向敲除色谱条件
2.4.3 TP的定向敲除 取雷公藤多苷片提取物溶液和雷公藤多苷片溶液,进样液相色谱,接收TP的出峰位置溶液,其余流分合并,蒸干,即得TP敲除样品。
2.5 统计学方法

3 结果
3.1 雷公藤多苷片提取物对不同来源肿瘤细胞的增殖抑制作用
体外CCK-8实验结果表明,雷公藤多苷片提取物可以显著抑制血液肿瘤细胞的增殖。其中,雷公藤多苷片提取物在单核细胞来源的肿瘤细胞系SHI-1及MV-4-11中作用48 h的IC50小于3 μg·mL-1,抑制活性强于其在非单核细胞白血病细胞株中的作用(表2)。

表2 雷公藤多苷片提取物作用于不同肿瘤细胞系48 h的IC50值
3.2 雷公藤多苷片体外和体内抗急性单核细胞白血病的活性
进一步考察不同厂家的雷公藤多苷片对肿瘤细胞MV-4-11的增殖影响。体外实验结果表明,雷公藤多苷片与雷公藤多苷片提取物的活性相当,可显著抑制血液肿瘤细胞的增殖;其中,厂家1(浙江得恩德制药股份有限公司)与厂家2(江苏美通制药有限公司)雷公藤多苷片活性较强,作用48 h的IC50分别为(3.33±0.01)μg·mL-1和(3.57±0.10)μg·mL-1(表3)。

表3 不同厂家雷公藤多苷片作用MV-4-11细胞48 h的IC50值
选取厂家1的雷公藤多苷片考察其对体内皮下异种移植瘤的抑制作用。与对照组相比,雷公藤多苷片各剂量组均可使皮下移植瘤的体积显著减小(P<0.05,P<0.001),小鼠体质量无明显变化。终末给药结束后,对肿瘤进行称质量,雷公藤多苷片各剂量组可使瘤质量显著下降(P<0.01,P<0.001),抑瘤率分别为35.79%、96.93%、97.56%(图3)。其中,雷公藤多苷片中、高剂量组对肿瘤抑制作用的剂量依赖性不高,原因可能与雷公藤多苷片的溶解性较差有关。体内与体外实验结果表明,雷公藤多苷片具有显著的抗AMOL作用(图1)。

注:与对照组比较,*P<0.05,**P<0.01,***P<0.001。
3.3 雷公藤多苷片提取物中单体化合物的活性跟踪
3.3.1 雷公藤多苷片提取物不同流分的活性筛选 考虑各厂家雷公藤多苷片的制备方法不同,活性成分的含量存在差异,质量标准不统一,本研究将自制的雷公藤多苷片提取物进行系统成分分离,并在细胞水平上对得到的单体化合物进行活性评价。首先我们通过CCK8实验对雷公藤多苷片提取物的8个流分进行活性筛选,其中X1与X2两个流分因极性较小,溶解性差,无法得到有效的活性筛选数据。X3~X8的活性筛选结果表明流分X6及X7的活性较强,在1 μg·mL-1的浓度下抑制率可达到90.23%及89.37%(表4)。

表4 雷公藤多苷片提取物的不同流分对MV-4-11细胞的增殖抑制率
3.3.2 化合物结构鉴定 采用色谱分离技术,从活性较强的流分X4、X6、X7与X8中分离鉴定了15个化合物,包括5个二萜类(1~5)、6个倍半萜大环内酯生物碱类(6~11)和4个三萜类(12~15),具体如下:
化合物1:白色固体,C20H24O3,(+)-ESI-MSm/z:313.2[M+H]+;(-)-ESI-MSm/z:311.2[M-H]-。1H NMR(CDCl3,500 MHz):1.72(1H,m,H-1a),2.52(1H,m,H-1b),2.41(1H,m,H-2a),2.56(1H,m,H-2b),2.73(1H,m,H-5),1.96(1H,m,H-6a),2.03(1H,m,H-6b),2.84(1H,m,H-7a),2.94(1H,m,H-7b),6.98(1H,d,J=8.0 Hz,H-11),7.10(1H,d,J=8.0 Hz,H-12),3.13(1H,m,H-15),1.28,1.29(各3H,d,J=7.0 Hz,H-16,17);13C NMR(CDCl3,125 MHz):32.6(C-1),18.2(C-2),162.9(C-3),125.2(C-4),40.9(C-5),19.6(C-6),22.7(C-7),120.5(C-8),143.9(C-9),36.2(C-10),116.3(C-11),123.4(C-12),131.0(C-13),150.8(C-14),27.0(C-15),22.5(C-16),22.5(C-17),174.2(C-18),70.5(C-19),22.4(C-20)。以上数据与文献[26]一致,故确定化合物为雷酚内酯(Triptophnolide)。
化合物2:黄色固体,C21H26O4,(+)-ESI-MSm/z:343.2[M+H]+;(-)-ESI-MSm/z:341.2[M-H]-。1H NMR(CDCl3,500 MHz):6.45(1H,s,H-11),3.70(3H,s,CH3O-14),3.27(1H,m,H-15),1.21(6H,d,J=7.0 Hz,H-16,H-17),4.78(2H,m,H-19),1.18(3H,s,H-20);13C NMR(CDCl3,125 MHz):18.6(C-1),31.1(C-2),125.2(C-3),163.3(C-4),44.0(C-5),19.5(C-6),26.1(C-7),129.9(C-8),130.8(C-9),37.3(C-10),111.9(C-11),150.8(C-12),139.9(C-13),149.2(C-14),25.5(C-15),23.8(C-15),23.8(C-16),60.7(C-17),174.5(C-18),70.6(C-19),17.3(C-20),60.7(C-21)。以上数据与文献[27]一致,故确定化合物为异雷酚新内酯(Isoneotriptophenolide)
化合物3:无定型粉末,C21H26O4,(+)-ESI-MSm/z:347.2[M+H]+;(-)-ESI-MSm/z:345.4[M-H]-。1H NMR(CDCl3,500 MHz):2.07(1H,m,H-1a),3.08(1H,m,H-1b),2.39(1H,m,H-2a),2.76(1H,dd,J=10.6,4.1 Hz,H-2b),2.21(1H,brd,H-5),1.46(1H,dd,J=12.8,4.8 Hz,H-6a),1.85(1H,m,H-6b),2.55(1H,m,H-7a),3.10(1H,m,H-7b),6.38(1H,s,H-12),3.67(3H,s,CH3O-14),3.24(1H,m,H-15),1.17(6H,d,J=6.8 Hz,H-16,H-17),1.42(3H,s,H-18),4.18(1H,d,J=11.4 Hz,H-19),1.30(3H,s,H-20);13C NMR(CDCl3,125 MHz):35.4(C-1),34.7(C-2),223.8(C-3),50.1(C-4),52.7(C-5),19.2(C-6),26.6(C-7),130.5(C-8),130.7(C-9),37.7(C-10),150.4(C-11),112.1(C-12),139.7(C-13),148.8(C-14),26.2(C-15),23.7(C-16),23.8(C-17),22.9(C-18),66.1(C-19),21.1(C-20)。以上数据与文献[28]一致,故确定化合物为雷酚萜醇(Triptonoterpenol)。
化合物4:白色固体,C20H30O3,(+)-ESI-MSm/z:319.2[M+H]+;(-)-ESI-MSm/z:317.2[M-H]-。1H NMR(CDCl3,500 MHz):1.55(1H,m,H-1a),2.35(1H,m,H-1b),1.91(1H,m,H-2a),2.02(1H,m,H-2b),3.52(1H,dd,J=11.8,4.3 Hz,H-3),1.43(1H,dd,J=12.7,1.9 Hz,H-5),2.08(1H,m,H-6a),2.62(1H,m,H-7a),2.87(1H,m,H-7b),6.84(1H,d,J=8.0 Hz,H-11),7.03(1H,d,J=8.0 Hz,H-12),3.14(1H,sqt,H-15),1.25(6H,d,J=7.0 Hz,H-16,H-17),1.34(3H,s,H-18),3.45(1H,d,J=11.2 Hz,H-19a),4.34(1H,d,J=11.2 Hz,H-19b),1.18(3H,s,H-20);13C NMR(CDCl3,125 MHz):36.9(C-1),28.5(C-2),80.6(C-3),42.8(C-4),50.0(C-5),18.3(C-6),25.0(C-7),120.4(C-8),147.7(C-9),37.1(C-10),116.6(C-11),123.5(C-12),130.3(C-13),150.2(C-14),26.9(C-15),22.5(C-16),22.5(C-17),22.7(C-18),64.1(C-19),25.8(C-20)。以上数据与文献[29]一致,故确定化合物为Triptobenzene J。
化合物5:白色固体,C20H24O6,(+)-ESI-MSm/z:361.2[M+H]+;(-)-ESI-MSm/z:359.2[M-H]-。1H NMR(CDCl3,500 MHz):1.24(1H,m,H-1a),1.59(1H,m,H-1b),1.99(1H,t,J=12.8 Hz,H-2a),2.22(1H,m,H-2b),2.75(1H,brd,J=13.2 Hz,H-5),2.35(1H,m,H-6a),2.14(1H,m,H-6b),3.40(1H,d,J=5.2 Hz,H-7),3.93(1H,d,J=3.2 Hz,H-11),3.54(1H,d,J=2.8 Hz,H-12),3.44(1H,d,J=6.4 Hz,H-14),0.91(1H,d,J=7.2 Hz,H-16),1.03(1H,d,J=6.8 Hz,H-17),4.70(2H,m,H-19),1.14(1H,s,H-20);13C NMR(CDCl3,125 MHz):17.0(C-1),29.7(C-2),125.4(C-3),160.0(C-4),40.4(C-5),23.6(C-6),55.7(C-7),54.5(C-8),60.7(C-9),35.8(C-10),60.1(C-11),65.7(C-12),66.2(C-13),73.4(C-14),25.2(C-15),17.7(C-16),16.8(C-17),173.8(C-18),70.0(C-19),13.6(C-20)。以上数据与文献[19]一致,故确定化合物为TP。
化合物6:无色片晶,C41H47NO19,(+)-ESI-MSm/z:858.2[M+H]+。1H NMR(CDCl3,500 MHz):5.73(1H,d,J=3.7 Hz,H-1),5.39(1H,dd,J=3.7,2.6 Hz,H-2),5.05(1H,d,J=2.6 Hz,H-3),6.98(1H,brs,H-5),2.37(1H,d,J=4.0 Hz,H-6),5.56(1H,m,H-7),5.43(1H,d,J=6.7 Hz,H-8),4.31(1H,d,J=13.4 Hz,H-11a),5.53(1H,d,J=13.4 Hz,H-11b),1.58(1H,s,H-12),1.70(1H,s,H-14),3.79(1H,d,J=11.7 Hz,H-15a),5.79(1H,d,J=11.7 Hz,H-15b),2.95(1H,m,H-16a),4.00(1H,m,H-16b),2.24(1H,m,H-17a),2.37(1H,m,H-17b),1.22(1H,d,J=6.9 Hz,H-19),8.78(1H,dd,J=4.6,1.8 Hz,H-2'),7.31(1H,dd,J=7.9,4.6 Hz,H-3'),8.36(1H,dd,J=7.9,1.8 Hz,H-4'),7.51(1H,t,J=1.8 Hz,H-2''),6.86(1H,dd,J=0.7,1.8 Hz,H-3''),8.29(1H,dd,J=0.7,1.4 Hz,H-5''),1.87(3H,s,1-OAc),2.31(3H,s,5-OAc),2.20(6H,s,7-OAc,11-OAc),2.00(3H,s,8-OAc);13C NMR(CDCl3,125 MHz):73.4(C-1),68.9(C-2),75.8(C-3),69.7(C-4),73.6(C-5),51.2(C-6),69.2(C-7),70.8(C-8),52.1(C-9),93.8(C-10),60.5(C-11),22.8(C-12),84.5(C-13),18.0(C-14),70.3(C-15),33.3(C-16),33.5(C-17),38.4(C-18),21.1(C-19),175.1(C-20),166.8(C-21),164.3(C-2'),124.3(C-3'),138.7(C-4'),121.2(C-5'),153.3(C-6'),144.3(C-2''),109.7(C-3''),118.3(C-4''),148.7(C-5''),20.5,169.1(1-OAc),21.1,169.9(5-OAc),20.5,170.1(7-OAc),18.9,169.3(8-OAc),21.6,170.7(11-OAc)。以上数据与文献[30]一致,故确定化合物为雷公藤晋碱(Wilforgine)。
化合物7:无色片晶,C43H49NO19,(+)-ESI-MSm/z:884.2[M+H]+。1H NMR(CDCl3,500 MHz):5.77(1H,d,J=3.2 Hz,H-1),5.48(1H,t,J=3.0 Hz,H-2),5.10(1H,d,J=2.9 Hz,H-3),6.87(1H,brs,H-5),2.41(1H,d,J=3.8 Hz,H-6),5.56(1H,dd,J=4.0,5.9 Hz,H-7),5.41(1H,d,J=5.7 Hz,H-8),4.42(1H,d,J=13.0 Hz,H-11a),5.60(1H,d,J=13.0 Hz,H-11b),1.74(1H,s,H-12),1.67(1H,s,H-14),3.77(1H,d,J=12.1 Hz,H-15a),5.84(1H,d,J=12.1 Hz,H-15b),2.88(1H,m,H-16a),4.09(1H,m,H-16b),2.49(1H,m,H-17),1.52(1H,s,H-19),8.72(1H,dd,J=4.8,1.7 Hz,H-2'),7.24(1H,dd,J=7.9,4.9 Hz,H-3'),8.16(1H,dd,J=7.9,1.7 Hz,H-4'),8.09(1H,d,J=8.0 Hz,H-2''),7.54(1H,t,J=7.3 Hz,H-3''),7.66(1H,t,J=7.3 Hz,H-4''),7.54(1H,t,J=7.3 Hz,H-5''),8.09(1H,d,J=8.0 Hz,H-6''),1.90(3H,s,1-OAc),2.22(6H,s,5-OAc,11-OAc),2.12(3H,s,7-OAc),1.97(3H,s,8-Ac);13C NMR(CDCl3,125 MHz):73.2(C-1),69.3(C-2),76.9(C-3),69.8(C-4),73.6(C-5),51.0(C-6),68.9(C-7),70.8(C-8),51.9(C-9),94.0(C-10),60.6(C-11),23.0(C-12),84.8C-13),17.9(C-14),69.8(C-15),31.4(C-16),38.4(C-17),77.7(C-18),28.0(C-19),172.5(C-20),168.0(C-21),164.9(C-22),152.2(C-2'),120.6(C-3'),137.8(C-4'),125.5(C-5'),164.8(C-6'),128.7(C-1''),129.9(C-2''),128.8(C-3''),133.9(C-4''),128.8(C-5''),129.9(C-6''),20.5,169.8(1-OAc),21.6,169.8(5-OAc),21.0,170.1(7-OAc),20.45,169.0(8-OAc),21.0,170.1(11-OAc)。以上数据与文献[30]一致,故确定化合物为雷公藤定碱(Wilfordine)。
化合物8:无色片晶,C43H49NO18,(+)-ESI-MSm/z:868.2[M+H]+。1H NMR(CDCl3,500 MHz):5.78(1H,d,J=3.8 Hz,H-1),5.37(1H,dd,J=2.6,3.7 Hz,H-2),5.10(1H,d,J=2.6 Hz,H-3),6.93(1H,brs,H-5),2.39(1H,d,J=4.0 Hz,H-6),5.57(1H,m,H-7),5.40(1H,d,J=6.0 Hz,H-8),4.41(1H,d,J=13.2 Hz,H-11a),5.50(1H,d,J=13.2 Hz,H-11b),1.70(3H,s,H-12),1.68(1H,s,H-14),3.81(1H,d,J=12.0 Hz,H-15a),5.80(1H,d,J=12 Hz,H-15b),2.97(1H,m,H-16a),3.98(1H,m,H-16b),2.24(1H,m,H-17a),2.41(1H,m,H-17b),1.24(3H,d,J=7.0 Hz,H-19),8.78(1H,dd,J=1.8,4.7 Hz,H-2'),7.31(1H,dd,J=4.7,7.9 Hz,H-3'),8.36(1H,dd,J=1.8,7.9 Hz,H-4'),8.10(1H,d,J=7.1 Hz,H-2''),7.53(1H,t,J=7.9 Hz,H-3''),7.64(1H,t,J=7.4 Hz,H-4''),7.53(1H,t,J=7.9 Hz,H-5''),8.10(1H,d,J=7.1 Hz,H-6''),1.85(3H,s,1-OAc),2.20(9H,s,5-OAc,7-OAc,11-OAc),1.97(3H,s,8-OAc);13C NMR(CDCl3,125 MHz):73.5(C-1),69.1(C-2),76.0(C-3),69.7(C-4),73.8(C-5),51.2(C-6),69.9(C-7),71.0(C-8),52.2(C-9),93.8(C-10),60.6(C-11),22.9(C-12),84.5(C-13),20.5(C-14),70.3(C-15),33.3(C-16),33.5(C-17),38.5(C-18),23.2(C-19),175.1(C-20),165.0(C-21),161.1(C-22),153.2(C-2'),121.1(C-3'),138.7(C-4'),124.5(C-5'),164.1(C-6'),128.9(C-1''),129.9(C-2''),128.8(C-3''),133.8(C-4''),128.8(C-5''),129.9(C-6''),21.0,169.0(1-OAc),21.6,169.9(5-OAc),21.1,170.1(7-OAc),20.5,169.3(8-OAc),21.6,170.3(11-OAc)。以上数据与文献[30]一致,故确定化合物为雷公藤次碱(Wilforine)。
化合物9:无色片晶,C41H47NO20,(+)-ESI-MSm/z:874.2[M+H]+。1H NMR(CDCl3,500 MHz):5.70(1H,d,J=3.6 Hz,H-1),5.35(1H,dd,J=3.0,3.5 Hz,H-2),5.05(1H,d,J=2.7 Hz,H-3),6.96(1H,s,H-5),2.39(1H,d,J=3.9 Hz,H-6),5.42(1H,d,J=6.0 Hz,H-8),4.32(1H,d,J=13.5 Hz,H-11a),5.56(1H,d,J=13.5 Hz,H-11b),1.64(1H,s,H-12),1.66(3H,s,H-14),3.73(1H,d,J=12.0 Hz,H-15a),5.87(1H,d,J=12.0 Hz,H-15b),2.88(1H,m,H-16a),4.10(1H,m,H-16b),2.18(1H,m,H-17a),2.52(1H,m,H-17b),1.49(3H,s,H-19),8.72(1H,dd,J=1.8,4.8 Hz,H-2'),7.25(1H,dd,J=4.8,7.9 Hz,H-3'),8.17(1H,dd,J=1.8,7.9 Hz,H-4'),7.52(1H,t,J=1.8 Hz,H-2''),6.85(1H,dd,J=0.7,1.8 Hz,H-3''),8.28(1H,dd,J=0.7,1.4 Hz,H-5''),1.88(3H,s,1-OAc),2.28(3H,s,5-OAc),2.20(3H,s,7-OAc),2.00(3H,s,8-OAc),2.21(3H,s,11-OAc);13C NMR(CDCl3,125 MHz):73.1(C-1),68.8(C-2),76.8(C-3),69.8(C-4),73.6(C-5),51.2(C-6),68.9(C-7),70.7(C-8),52.1(C-9),94.1(C-10),60.5(C-11),22.7(C-12),84.8(C-13),17.9(C-14),69.8(C-15),31.4(C-16),38.4(C-17),77.8(C-18),28.2(C-19),172.5(C-20),168.0(C-21),161.1(C-22),152.3(C-2'),120.6(C-3'),137.8(C-4'),125.6(C-5'),165.0(C-6'),144.4(C-2''),109.7(C-3''),118.2(C-4''),148.8(C-5''),20.5,169.8(1-OAc),21.2,169.6(5-OAc),20.5,170.0(7-OAc),18.8,169.3(8-OAc),21.0,170.6(11-OAc)。以上数据与文献[30]一致,故确定化合物为雷公藤春碱(Wilfortrine)。
化合物10:无色片晶,C38H47NO18,(+)-ESI-MSm/z:806.2[M+H]+。1H NMR(CDCl3,500 MHz):5.63(1H,d,J=4.0 Hz,H-1),5.24(1H,dd,J=3.5,4.0 Hz,H-2),4.96(1H,d,J=3.5 Hz,H-3),6.94(1H,s,H-5),2.34(1H,d,J=3.8 Hz,H-6),5.38(1H,d,J=5.8 Hz,H-8),4.47(1H,d,J=13.4 Hz,H-11a),5.24(1H,d,J=13.4 Hz,H-11b),1.57(1H,s,H-12),1.67(3H,s,H-14),3.78(1H,d,J=11.7 Hz,H-15a),5.77(1H,d,J=11.7 Hz,H-15b),3.97(2H,m,H-16),2.36(1H,m,H-17a),2.95(1H,m,H-17b),2.50(1H,m,H-18),1.19(1H,d,J=6.9 Hz,H-19),8.77(1H,dd,J=1.7,4.8 Hz,H-2'),7.25(1H,dd,J=4.8,7.9 Hz,H-3'),8.17(1H,dd,J=1.7,7.9 Hz,H-4'),1.67(3H,s,1-OAc),1.88(3H,s,2-OAc),2.01(3H,s,5-OAc),2.16(3H,s,7-OAc),2.20(3H,s,8-OAc),2.31(3H,s,11-OAc);13C NMR(CDCl3,125 MHz):73.4(C-1),68.8(C-2),75.4(C-3),71.6(C-4),73.2(C-5),51.0(C-6),69.6(C-7),70.2(C-8),52.9(C-9),98.7(C-10),60.5(C-11),23.1(C-12),84.4(C-13),21.6(C-14),70.3(C-15),33.5(C-16),33.5(C-17),38.1(C-18),20.2(C-19),175.5(C-20),166.2(C-21),153.1(C-2'),121.7(C-3'),138.6(C-4'),124.5(C-5'),164.8(C-6'),20.3,166.9(1-OAc),21.2,169.2(2-OAc),21.2,169.9(5-OAc),21.5,170.3(7-OAc),21.5,170.3(8-OAc),21.9,170.2(11-OAc)。以上数据与文献[31]一致,故确定化合物为雷公藤新碱(Euonine)。
化合物11:无色片晶,C38H47NO18,(+)-ESI-MSm/z:806.2[M+H]+。1H NMR(CDCl3,500 MHz):5.56(1H,d,J=4.0 Hz,H-1),5.24(1H,dd,J=2.8,4.0 Hz,H-2),4.74(1H,d,J=2.8 Hz,H-3),7.06(1H,s,H-5),2.37(1H,d,J=3.8 Hz,H-6),5.53(1H,dd,J=3.8,5.8 Hz,H-7),5.38(1H,d,J=5.8 Hz,H-8),4.50(1H,d,J=13.5 Hz,H-11a),5.14(1H,d,J=13.5 Hz,H-11b),1.73(1H,s,H-12),1.56(3H,s,H-14),3.71(1H,d,J=11.7 Hz,H-15a),6.06(1H,d,J=11.7 Hz,H-15b),4.71(2H,m,H-16),2.47(1H,m,H-17),1.38(1H,m,H-18),1.10(1H,d,J=6.9 Hz,H-19),9.02(1H,s,H-2'),7.39(1H,dd,J=4.8,7.9 Hz,H-5'),8.73(1H,dd,J=1.7,7.9 Hz,H-6'),1.56(3H,s,1-OAc),1.86(3H,s,2-OAc),2.02(3H,s,5-OAc),2.18(3H,s,7-OAc),2.22(3H,s,8-OAc),2.35(3H,s,11-OAc);13C NMR(CDCl3,125 MHz):73.2(C-1),68.8(C-2),75.8(C-3),70.2(C-4),73.5(C-5),50.6(C-6),69.0(C-7),70.9(C-8),52.5(C-9),94.1(C-10),60.1(C-11),22.3(C-12),84.6(C-13),18.5(C-14),70.4(C-15),33.5(C-16),45.9(C-17),11.6(C-18),10.1(C-19),173.5(C-20),168.2(C-21),150.8(C-2'),125.8(C-3'),156.6(C-4'),121.4(C-5'),152.7(C-6'),20.3,168.9(1-OAc),21.1,168.7(2-OAc),21.6,170.8(5-OAc),21.2,170.3(7-OAc),20.4,169.1(8-OAc),21.6,170.1(11-OAc)。以上数据与文献[31]一致,故确定化合物为Peritassine A。
化合物12:红色片状晶,C29H38O4,(+)-ESI-MSm/z:451.2[M+H]+;(-)-ESI-MSm/z:449.2[M-H]-。1H NMR(MeOD,500 MHz):6.50(1H,s,H-1),7.24(1H,brd,H-7),2.24(3H,s,H-23),1.49(3H,s,H-24),1.33(3H,s,H-25),0.76(3H,s,H-26),1.15(3H,s,H-27),1.21(3H,s,H-29);13C NMR(MeOD,125 MHz):119.0(C-1),178.7(C-2),146.5(C-3),118.7(C-4),127.2(C-5),135.0(C-6),118.3(C-7),170.8(C-8),42.8(C-9),165.1(C-10),33.2(C-11),29.4(C-12),39.3(C-13),44.9(C-14),28.4(C-15),36.2(C-16),30.5(C-17),44.3(C-18),30.2(C-19),39.8(C-20),29.2(C-21),34.6(C-22),8.9(C-23),37.5(C-25),20.8(C-26),18.2(C-27),30.6(C-28),31.8(C-29),181.1(C-30)。以上数据与文献[32]一致,故确定化合物为Cel。
化合物13:白色固体,C29H38O5,(+)-ESI-MSm/z:467.3[M+H]+;(-)-ESI-MSm/z:465.3[M-H]-。1H NMR(MeOD,500 MHz):6.87(1H,s,H-1),6.19(1H,s,H-7),2.57(3H,s,H-23),1.56(3H,s,H-24),1.37(3H,s,H-25),0.78(3H,s,H-26),1.16(3H,s,H-27),1.20(3H,s,H-29);13C NMR(MeOD,125 MHz):108.4(C-1),141.8(C-2),149.1(C-3),124.8(C-4),121.0(C-5),170.2(C-8),149.3(C-10),33.6(C-11),29.3(C-12),38.5(C-13),44.0(C-14),28.0(C-15),36.0(C-16),30.0(C-17),43.6(C-18),30.0(C-19),39.3(C-20),29.3(C-21),34.5(C-22),13.5(C-23),37.4(C-24),20.7(C-25),18.0(C-26),31.3(C-27),179.3(C-28),32.2(C-29)。以上数据与文献[29]一致,故确定化合物为雷公藤酚A(Wilforol A)。
化合物14:白色结晶,C30H48O4,(+)-ESI-MSm/z:473.3[M+H]+;(-)-ESI-MSm/z:471.4[M-H]-。1H NMR(MeOD,500 MHz):3.54(1H,m,H-3),5.28(1H,brd,H-12),1.01(9H,s,H-21,H-22,H-24),0.81(3H,s,H-23),1.04(3H,s,H-25),1.21(3H,s,H-26),1.27(3H,s,H-27)。以上数据与文献[33]一致,故确定化合物为雷公藤三萜酸A(Triptotriterpenic acid A)。
化合物15:白色结晶,C28H36O5,(+)-ESI-MSm/z:453.3[M+H]+;(-)-ESI-MSm/z:451.3[M-H]-。1H NMR(MeOD,500 MHz):6.87(1H,s,H-1),7.82(1H,s,H-4),6.30(3H,s,H-7),1.50(3H,s,H-23),0.51(3H,s,H-24),1.28(6H,s,H-25,H-27),1.16(3H,s,H-26)。以上数据与文献[34]一致,故确定化合物为23-Nor-6-oxodemethylpristimerol。
3.3.3 单体化合物的细胞毒活性评价 细胞活性评价结果表明,TP(5)和Cel(12)的活性较强(表5,结构式见图2),通过CCK8实验测得IC50值(图2),其中TP抗AMOL活性最强[IC50值为(3.35±0.03)ng·mL-1],优于DNR阳性对照组[IC50值为(55.41±0.28)ng·mL-1],Cel的活性比TP弱[IC50值为(1.19±0.01)μg·mL-1]。相同摩尔剂量下的TP比Cel活性强约300倍,雷公藤多苷片提取物中的Cel的含量(约5.5%)是TP(约0.5%)的10倍,由此我们推断TP可能是雷公藤抗急性白血病单核细胞的主要药效物质基础。

表5 化合物1~15对MV-4-11细胞的增殖抑制率
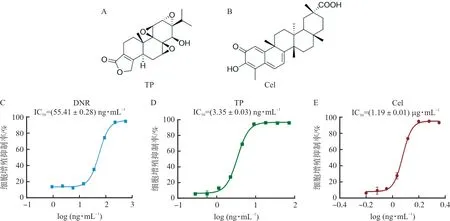
图2 TP和Cel的化学结构及对MV-4-11细胞的增殖抑制作用
3.4 TP抑制AMOL活性具有选择性
为验证TP是否与雷公藤多苷片提取物有着相同的血液肿瘤敏感瘤谱,我们考察了TP对不同血液肿瘤细胞系的抑制作用,结果表明与雷公藤多苷片提取物的结果一致,TP对单核细胞来源的白血病细胞SHI-1及MV-4-11增殖抑制作用最强,IC50小于3.5 ng·mL-1,优于其在Kasumi-1、SU-DHL-10和K562等非单核细胞白血病细胞系中的抑制活性(表6),进一步说明TP是雷公藤多苷片抗AMOL的主要药效物质基础。本实验的前期工作发现TP通过阻滞MV-4-11细胞的周期于G1期引起细胞凋亡来发挥抗肿瘤活性[35]。同时,我们考察发现TP对人肾皮质近曲小管上皮细胞系HK2与人正常肝细胞系L02有一定的抑制作用,其活性弱于AMOL细胞系(图3)。

表6 TP作用于不同肿瘤细胞系48 h的IC50值
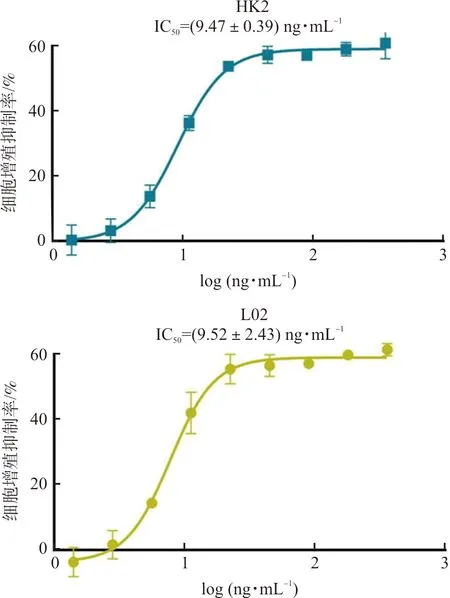
图3 TP对HK2和L02细胞的抑制作用
3.5 TP定向敲除前后雷公藤多苷片及其提取物对MV-4-11细胞增殖抑制活性变化
为了进一步验证TP是否为雷公藤多苷片的抗白血病的物质基础,本文通过CCK8实验测得雷公藤多苷片及雷公藤多苷片提取物定向敲除TP前后的IC50值。实验结果表明,雷公藤多苷片及雷公藤多苷片提取物定向敲除TP后的IC50值分别升高了8及13倍(表7),进一步验证了TP是其发挥抗AMOL细胞增殖活性的物质基础。

表7 雷公藤多苷片及其提取物定向敲除TP前后作用MV-4-11细胞48 h的IC50值
4 讨论
本研究通过考察雷公藤多苷片提取物以及TP的敏感瘤株,发现AMOL细胞对其敏感;进一步采用体内外实验验证了雷公藤多苷片的抗肿瘤作用;最后通过色谱分离技术定向敲除TP,结果表明TP敲除后的雷公藤多苷片及雷公藤多苷片提取物的IC50值分别升高了8倍和13倍。上述研究提示TP是雷公藤发挥抗AMOL的物质基础。然而,敲除TP后的雷公藤活性并没有完全消失,推测存在2种可能性:①另有尚未分离出的强效微量抗肿瘤活性成分;②含量相对较高的Cel发挥一定的抗肿瘤作用。
中药是中华传统医学的主要医治手段,如何从传统中药中获得确证药效的化学成分一直是国际医药界的关注焦点。青蒿素治疗疟疾[36-37]、砒霜治疗白血病[38-39]——这些中药上的突破与现代科学严谨的研究方法密切相关。有着“中草药激素”之称的雷公藤在临床治疗类风湿性关节炎等自身免疫性疾病中疗效确证,但毒副作用常使临床医生不敢贸然使用[40-41],这与其物质基础不明确有着一定的关系。雷公藤的化学成分复杂,被认可的有效成分TP在不同产地药材以及药材不同部位中的含量变化很大,应用粗药材入药存在中毒风险[42]。国内上市制剂雷公藤多苷片的质量参差不齐,TP含量差异较大,质量标准不统一[43]。所以,在不同疾病类型中明确雷公藤发挥药效的物质基础,并在此基础上研发新药或许可以克服其临床转化等难题。
TP既是中药雷公藤的活性成分,又是毒性成分,在雷公藤制剂中的含量低微。与XPB共价结合对整体转录水平的抑制可能是TP发挥广谱抗肿瘤作用与毒性作用的共同分子基础。因此,寻找雷公藤的敏感瘤株及适应症或许可以提高其临床治疗窗口。此外,雷公藤敏感疾病谱的作用靶标有哪些?是否与XPB关系密切,这些终将为雷公藤在临床应用上的突破做出重大贡献。

