急性肾损伤患者血清IgA 水平与远期临床结局的相关性研究
张强,王海波,王笑然,丁文森
急性肾损伤最常见的病因是急性肾小管损伤[1]。在急性肾损伤患者中,血清免疫球蛋白A(immunoglobulin A,IgA)水平往往有不同程度的升高,而组织学改变可能有所不同[2]。据报道,高达54.6%的急性肾损伤患者出现了肾内动脉壁增厚[3]。
急性肾损伤患者往往伴有较严重的血管损伤和组织学病变,严重的甚至会进展为终末期肾病(end-stage renal disease,ESRD)[4-5]。目前关于急性肾损伤患者临床结局评估的研究十分有限,无法精准预测其临床结局风险。既往研究表明,IgA 的表达水平可能与急性肾损伤的严重程度密切相关,对于血管检查无明显损伤的患者,IgA 水平一定程度上可以预测远期结局的风险[6-7]。本研究旨在通过调查164 例急性肾损伤患者,对其IgA 水平进行评估,进一步阐明急性肾损伤患者的IgA 水平与远期临床结局的相关性。
1 对象与方法
1.1 研究对象 选取2018 年1 月至2019 年12 月在海安市人民医院就诊的164 例急性肾损伤患者作为研究对象。纳入标准:(1)被诊断为急性肾损伤,血肌酐48 h 内快速上升≥3 mg/L,或肾功能损伤发生7 d 内血肌酐上升至≥基础值的1.5 倍,尿量<0.5 ml/(kg·h),时间>6 h;(2)行IgA 检查并有完整数据;(3)完成12 个月的随访。
1.2 方法 收集每位患者的临床资料,包括年龄、性别、体重、血压和实验室数据,如血红蛋白(hemoglobin,HGB)、血清白蛋白(albumin,ALB)、血肌酐(serum creatinine,SCr)、血尿酸(uric acid,UA)、总胆固醇、三酰甘油、尿蛋白排泄率和尿红细胞。采用成人CKD-EPI 方程计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR)。主要随访终点定义为患者死亡,次要随访终点定义为肾功能减退50%。
2 结果
2.1 肾功能下降患者与肾功能正常患者临床资料比较 164 例急性肾损伤患者中,肾功能下降患者63 例,肾功能正常患者101 例,其中肾功能下降患者中合并患有高血压病比例(63.49%)高于肾功能正常患者(43.56%),差异有统计学意义(P=0.013);肾功能下降患者中合并患有糖尿病患者比例高于肾功能正常患者(P=0.041);肾功能下降患者IgA 水平高于肾功能正常患者(P<0.001);肾功能下降患者的eGFR 低于肾功能正常患者(P<0.001);肾功能下降患者的血肌酐水平高于肾功能正常患者(P<0.001);肾功能下降患者的血红蛋白水平低于肾功能正常患者(P<0.001);肾功能下降患者的血清白蛋白水平低于肾功能正常患者(P<0.001);肾功能下降患者的血尿酸水平高于肾功能正常患者(P<0.001)。见表1。
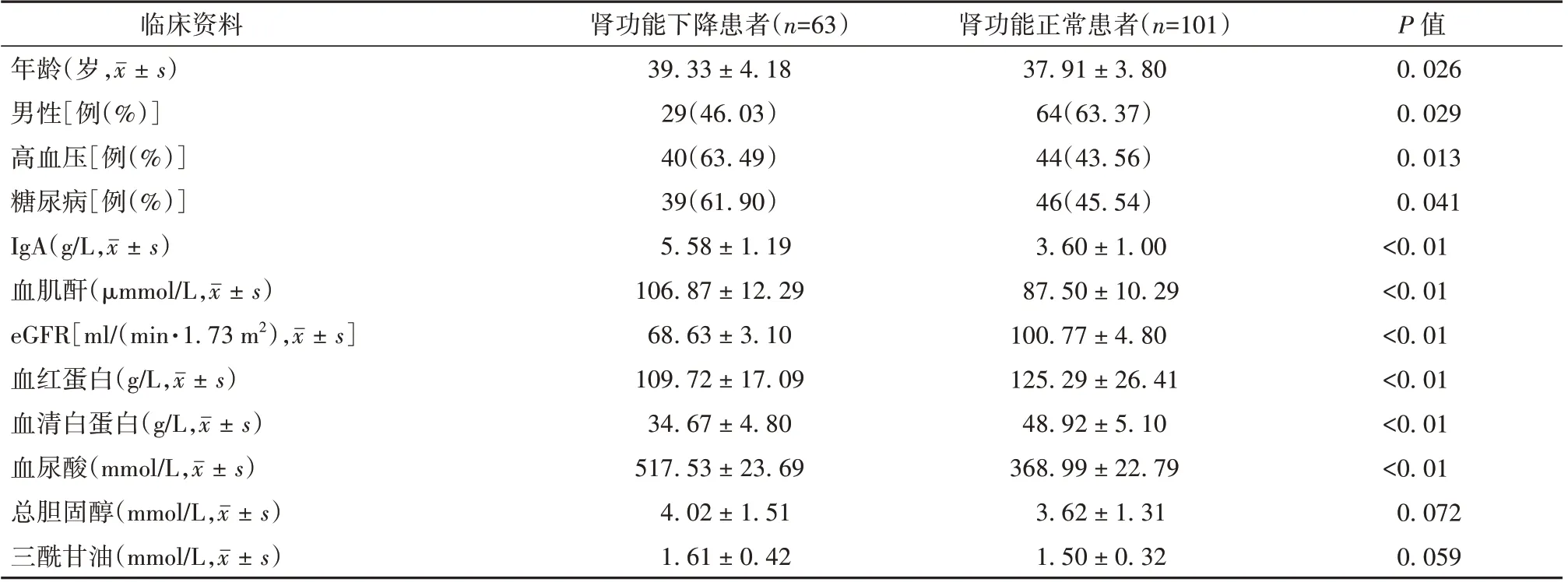
表1 肾功能下降患者与肾功能正常患者临床资料比较
2.2 死亡患者与存活患者临床资料比较 164 例急性肾损伤患者中,死亡患者31 例,存活患者133 例,其中死亡患者中高血压病比例高于存活患者(P=0.041);死亡患者中合并患有糖尿病患者比例高于存活患者(P=0.018);死亡患者的IgA 水平高于存活患者(P<0.01);死亡患者的eGFR 低于存活患者(P<0.01);死亡患者的血肌酐高于存活患者(P<0.01);死亡患者的血红蛋白低于存活患者(P=0.035);死亡患者的血尿酸高于存活患者(P<0.01)。见表2。

表2 死亡患者与存活患者临床资料比较
2.3 急性肾损伤患者IgA 水平与肾功能减退50%的相关性 分析急性肾损伤患者IgA 与随访12 个月后肾功能减退50%的相关性发现,未校正任何变量时(模型1),IgA 每升高1g/L,肾功能减退50%的风险增加29%(HR=1.29,95%CI1.13~1.46,P<0.001);校正年龄、性别变量后(模型2),IgA 每升高1 g/L,肾功能减退50% 的风险增加17%(HR=1.17,95%CI1.09~1.32,P<0.01);进一步校正糖尿病和高血压变量后(模型3),IgA 每升高1g/L,肾功能减退50% 的风险增加8%(HR=1.08,95%CI1.02~1.28,P=0.030)。见表3。

表3 急性肾损伤患者IgA 水平与肾功能减退50%的相关性
2.4 急性肾损伤患者IgA 水平与死亡风险的相关性 分析急性肾损伤患者IgA 水平与随访12 个月后死亡风险的相关性发现,未校正任何变量时(模型1),IgA 每升高1g/L,死亡的风险增加6%(HR=1.06,95%CI1.02~1.17,P=0.007);校正年龄、性别变量后(模型2),IgA 每升高1g/L,死亡的风险增加4%(HR=1.04,95%CI1.02~1.12,P=0.010);进一步校正糖尿病和高血压变量后(模型3),IgA每升高1g/L,死亡的风险增加2%(HR=1.02,95%CI1.01~1.08,P=0.040)。见表4。以最优截断值为界限,高水平IgA 患者预后劣于低水平IgA患者。见图1。
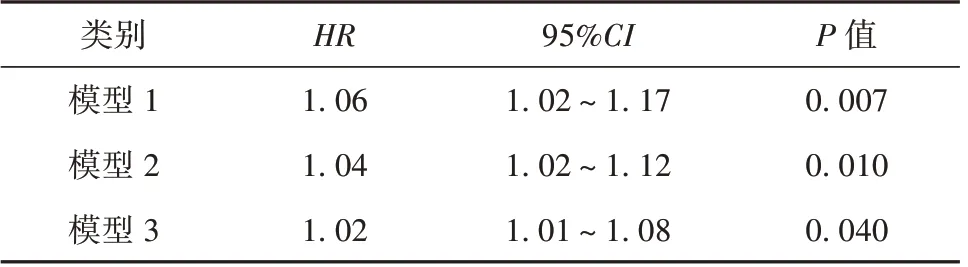
表4 急性肾损伤患者IgA 水平与死亡风险的相关性

图1 IgA 高水平患者与IgA 低水平患者生存曲线比较
3 讨论
急性肾损伤患者的IgA 水平对于临床转归是否具有提示意义一直存在争议[8]。有研究指出血清IgA 水平升高可能介导内皮细胞急性病理损伤,如小动脉内皮细胞肿胀、小动脉血栓形成和小动脉硬化、炎症细胞浸润等。也有研究指出IgA 水平高低,不能准确反映疾病严重程度和判定疾病是否转归[9-11]。在本研究中,调查了急性肾损伤患者的血清IgA 水平与远期临床结局的相关性,发现肾功能正常的患者IgA 水平低于肾功能下降的患者,存活患者IgA 水平低于死亡患者。进一步通过Cox 分析证实,IgA 水平是肾功能转归、不良转归和死亡的独立危险因素。生存曲线表明,高水平IgA 的患者预后不良。IgA 水平可以作为急性肾损伤患者临床转归的血清学预测标志物。
近年来,许多研究通过临床样本的回顾性分析筛选出急性肾损伤患者的预后因子。李敏等[12]通过美国重症监护医学信息数据库筛选出急性肾损伤患者死亡的独立危险因素,包括肾脏替代治疗、住院时间、年龄、淋巴瘤、凝血功能异常等,并据此构建了预测模型。陈丽植等[13]通过回顾性分析118 例儿童急性肾损伤病例发现,急性肾损伤患儿常见病因是感染,败血症或感染性休克是患儿死亡的独立危险因素。陈罡等[14]通过研究证实,炎症反应与急性损伤患者预后相关。血清IgA 水平升高提示患者预后不良。这与本研究结果趋势相符合。本研究证实,IgA 每升高1g/L,肾功能减退50% 的风险增加8%,死亡的风险增加2%。遗憾的是,临床缺乏关于IgA 水平的量化研究证实本研究结果。
值得注意的是,既往研究表明,患有高血压病或糖尿病可能影响急性肾功能损伤患者预后[15]。本研究也提示肾功能下降的患者中合并高血压的的比例和合并患有糖尿病的比例均高于肾功能正常的患者;死亡患者中合并高血压的比例和合并患有糖尿病的比例高于存活患者。这可能与糖尿病和高血压患者中微血管病变的发生率更高有关,其潜在机制是机械牵张和炎症反应引起的内皮细胞损伤[16]。
本研究仍存在一些不足。首先,本研究纳入的样本量十分有限,对于研究结论的证实和推广需要更大样本量、更丰富人群的研究进行支持。其次,本研究仅随访12 个月,观察到的终点事件十分有限,无法进行更多的分层分析,希望以后可以进行更多更长期的随访研究对本研究的结论进行验证。最后,本研究纳入的临床变量较少,需要进一步纳入更多的预后相关因素,构建多因素联合判断预后的模型。
综上所述,急性肾损伤患者的IgA 水平是肾功能不良转归和死亡的独立预测因素,在临床诊疗中应密切关注和随访此指标。

