脂质体包被SARS-CoV-2 N 基因的候选DNA疫苗转染人源细胞效率研究
周 健,左原源,赵雨芊,赖清润,郑惠文,赵 鑫,秦 丽,张兴龙,施海晶,刘龙丁,李 恒**
(1.中国医学科学院 北京协和医学院 医学生物学研究所,云南 昆明 650118;2.云南大学 生命科学学院,云南 昆明 650091)
新型冠状病毒肺炎(COVID-19)是由急性呼吸系统综合症冠状病毒2(SARS-CoV-2)导致的急性呼吸道疾病.SARS-CoV-2 属于冠状病毒家族中β属的新成员,其由单股正链RNA、刺突蛋白(S)、包膜蛋白(E),膜蛋白(M)和核衣壳蛋白(N)及其他辅助蛋白构成[1].由于RNA 病毒易突变的特性,随着疫情的蔓延,世界各地相继发现了多个SARSCoV-2 突变株,例如Alpha、Beta、Delta、Omicron等[2].目前,疫苗是防控此类传染病的最佳手段.DNA 疫苗以其制作简单经济、稳定等特点[3]在SARS-CoV-2 的疫苗研发过程中受到了广泛关注.
作为组成SARS-CoV-2 的重要结构蛋白之一的N 蛋白由3 个高度保守的结构域构成:N 末端结构域(NTD);C 末端结构域(CTD);RNA 结合结构域(CLR)[4].N 蛋白具有结构稳定、保守性强等特点,参与了病毒感染过程中的转录及编码蛋白质过程,在整个病毒感染过程中呈现高度免疫原性,是抗体结合的重要目标,同时包含T 细胞表位[5-7],使其可能成为疫苗研发的潜在靶点之一.
脂质体(LNP)具有细胞样膜结构、生物相容性高、免疫原性低、保护药物或活性基团、延长药物半衰期、降低毒性、提高效率等优点,并且通过基于经典脂质分子的结构修饰和表面修饰,可以产生具有特定生物学效应的新型脂质体,扩展了脂质体在生物医学中的应用[8-10].1965 年,Bangham 等[11]首次发现磷脂分子可以自发地在水中形成闭合的双层囊泡.大小范围为5~200 nm 之间的脂质体可以利用囊泡的亲和力将亲水性或亲脂性药物封装在水相或双层膜相中,由此将脂质体引入药物输送系统领域[12],并且后期技术的进步提高了脂质体药物递送系统的包封率和药物的稳定性[13].随着SARS-CoV-2 在全球范围内蔓延,脂质体在疫苗开发领域获得了极大地关注,尤其是在mRNA 疫苗研发领域,有多款针对SARS-CoV-2 的mRNA-LNP疫苗在进行临床试验并成功上市.相对于“裸mRNA”,用脂质体包被的mRNA 疫苗表现出更强的免疫原性[14].
DNA 疫苗是伴随着基因疗法发展而出现的新型疫苗,通过将含有编码目的抗原蛋白基因序列的重组真核表达质粒导入机体细胞中,借助细胞内的转录机制表达相应抗原蛋白,从而诱导机体产生针对此抗原蛋白的免疫应答,最终达到免疫的目的.作为第三代疫苗中的代表,DNA 疫苗相较于传统的灭活/减毒疫苗以及蛋白质/肽类疫苗具有更稳定、更经济、更容易制备、处理更安全的特点[3].基于这些优点以及其独特的理化性质和免疫效应,DNA疫苗受到了生物医学界的广泛重视,被应用于包括癌症治疗[15]、过敏[16]、自身免疫疾病[17]以及传染病治疗[18]等方面.尽管DNA 疫苗具有诸多优势,但是其诱导机体免疫应答效率低下的问题一直阻碍了DNA 疫苗的临床应用[19-20].
我们使用脂质体包被SARS-CoV-2 的N 蛋白编码基因,经过脂质体的纯化、电镜观察、并进行定量将其转染真核细胞293T,发现LNP-SARSCoV-2 N 能够实现高效转染真核细胞293T.本研究为脂质体包被的新型冠状病毒DNA 疫苗的研发提供理论基础和实践基础.
1 材料与方法
1.1 材料与试剂293T 细胞由中国医学科学院医学生物学研究所呼吸道病毒实验室提供;pcDNA3.1 真核表达载体为中国医学科学院医学生物学研究所呼吸道病毒实验室保持和制备;大肠杆菌DH-5α 感受态细胞来自TaKaRa 公司;PCR 引物由北京擎科生物有限公司合成;兔来源的SARSCoV-2 N 蛋白抗体来自北京义翘神州科技股份有限公司;辣根过氧化酶(HRP)标记的羊抗兔IgG 来自abcam 公司;质粒大提试剂盒来自TIANGEN 公司;PrimeScript™ IV 1st strand cDNA Synthesis Mix试 剂 盒 及Pyrobest™ DNA Polymerase 试剂来自TaKaRa 公司;FUGENE®HD 转染试剂盒来自Promega 公司.
1.2 仪器微流控系统(Precision Nanosystems,NANOASSEMBLR®IGNITE™);凝胶成像系统(Biorad,GEL DOC XR+);定量梯度PCR 仪(Bio-rad,C1000);紫外分光光度计(ThermoFisher,Nanodrop 2000C);超速冷冻离心机(Hitachi,CP70ME).
1.3 实验方法
1.3.1 N 蛋白编码基因的PCR 扩增 根据NCBI网站上编号为NC-045512.2 的SARS-CoV-2 毒株序列和真核表达载体pcDNA3.1 的序列,利用Oligo 7.0 软件设计了用于扩增N 蛋白全长序列的PCR 引物.引物序列如下,Forward primer:TAGCG TTTAAACTTAAGCTTGACATGGGCATGTCTGA TAATGGA;Reverse primer:CCACACTGGACTAG TGGATCCTTAATGGTGATGGTGATGATGGGCC TGAGTTGAGTCAGC.上游引物中的GACATG GGC 为引入的Kozak 序列,AAGCTT 为引入的HindⅢ酶切位点,TAGCGTTTAAACTT 为真核表达载体pcDNA3.1 上HindⅢ酶切位点上游的同源区段.下游引物中终止密码子TTA 与密码子GGC之间的序列:ATGGTGATGGTGATGATG 为引入的6X His 蛋白标签的编码序列用于后续的蛋白纯化,GGATCC 为引入的BamH Ⅰ酶切位点,而CCACACTGGACTAGT 为真核表达载体pcDNA3.1上的BamH Ⅰ酶切位点下游同源区段.
取10 μL RNA 模板,参照PrimeScript™ IV 1st strand cDNA Synthesis Mix 试剂盒说明书进行逆转录,并以cDNA 为模板进行PCR 扩增,扩增结束后经1.2%琼脂糖凝胶电泳纯化回收.
1.3.2 重组质粒的构建及鉴定 对真核表达载体pcDNA3.1(+)用HindⅢ和BamH Ⅰ双酶切后,经1.2%琼脂糖凝胶电泳纯化回收.利用NEB 公司的同源重组酶,按PCR 产物与质粒载体物质的量比2∶1,50 ℃ 30 min 进行连接,转化DH-5α 感受态细胞,涂布于含质量浓度为50 μg/mL 的AMP 抗生素的LB 固态培养基上,37 ℃培养过夜.获得重组真核表达载体pcDNA3.1-N-His,利用扩增N 蛋白全长的PCR 引物经菌落PCR 鉴定正确后,进行测序鉴定.
1.3.3 重组质粒的表达鉴定 重组质粒鉴定成功后,对含重组质粒的DH-5α 大肠杆菌进行扩大化培养,挑选单菌落于含质量浓度为50 μg/mL 的AMP 抗生素的LB 液态培养基上,37 ℃、180 r/min摇床上培养过夜.利用质粒大提试剂盒提取质粒用于转染.参照FUGENE®HD 转染试剂盒说明书进行转染,每孔3 μg 质粒和9 μL FUGENE®HD 转染试剂混合.转染后培养48 h,收集细胞进行Westernblot 以及银染−蛋白质谱分析.Western-blot 实验操作如下:蛋白进行SDS-PAGE 分离并进行转膜PVDF 后,用兔来源的SARS-CoV-2 N 蛋白抗体按体积比1∶1 000 稀释,4 ℃孵育过夜;洗涤后再按体积比1∶5 000 稀释的羊抗兔IgG-HRP 于37 ℃孵育1 h;洗涤后进行曝光观察结果.银染实验操作如下:提取的细胞蛋白经镍柱亲和层析,梯度洗脱后收集纯化产物并利用30 ku 超滤管富集.产物经SDS-PAGE 分离后,按照碧云天快速银染试剂盒说明书对SDS-PAGE 胶进行处理,产物送上海生工公司进行蛋白质谱分析.
1.3.4 脂质体包被和鉴定 脂质体由阳离子脂质、结构脂质、胆固醇构成,包裹核酸形成完整的核酸疫苗[21].我们采用无水乙醇溶解后的阳离子脂质、DSPC、胆固醇、PEG2000(物质的量比40∶10∶47.5∶2.5)来制备脂质体.将质粒溶解于pH=5的PBS 中,利用微流控技术将脂质体与质粒按体积比1∶1 的比例以12 mL/min 进行脂质体配制[22].利用蔗糖密度梯度离心法分离纯化脂质体,通过核酸电泳确定脂质体中是否含有质粒,再通过TEM电镜观察形态确定是否形成脂质体纳米颗粒.
1.3.5 脂质体转染 本实验设计了PBS、空脂质体、DNA-LNP、FuGENE®HD 转染试剂4 个实验组.将DNA-LNP 和1.5% Triton 按体积比1∶1 混合,裂解脂质体,然后利用紫外分光光度计测定脂质体裂解后的DNA 质量浓度,根据此质量浓度按6 孔板每孔3 μg DNA,用opti-MEM 培养基定容到200 μL 进行转染.PBS 以及空脂质体实验组按每孔200 μL 加入293T 细胞中,FuGENE®HD 转染试剂实验组以每孔3 μg DNA 加入293T 细胞中.另外,还进行了梯度质量转染,使用含0.1,0.3,1,3,10 μg DNA 的脂质体纳米颗粒转染293T 细胞.培养30 h后提取蛋白进行Western-blot 检测.
2 结果
2.1 重组质粒的构建与鉴定SARS-CoV-2 N 编码基因经逆转录后通过PCR 扩增,经电泳显示成功扩增出目的大小的片段,约为1 328 bp(图1(a)).经胶回收后与pcDNA3.1 载体连接,转入DH-5α 感受态细胞中,经菌落PCR,获得目的大小片段,并进行测序鉴定与预期结果一致(图1(b)).

图1 SARS-CoV-2 N 编码基因PCR 扩增及pcDNA3.1(+)-N 载体构建Fig.1 PCR amplification of SARS-CoV-2 N coding gene and construction of pcDNA3.1(+)-N
2.2 重组质粒的表达鉴定将pcDNA3.1-N 转染293T 后进行Western-blot 检测,并经镍柱纯化后银染进行蛋白质谱分析,Western-blot 杂交得到约46 ku 的特异性条带,为预期大小的蛋白(图2(a)).蛋白质质谱分析表明该条带蛋白为正确表达的SARS-CoV-2 N 蛋白(图2(b)、(c)).
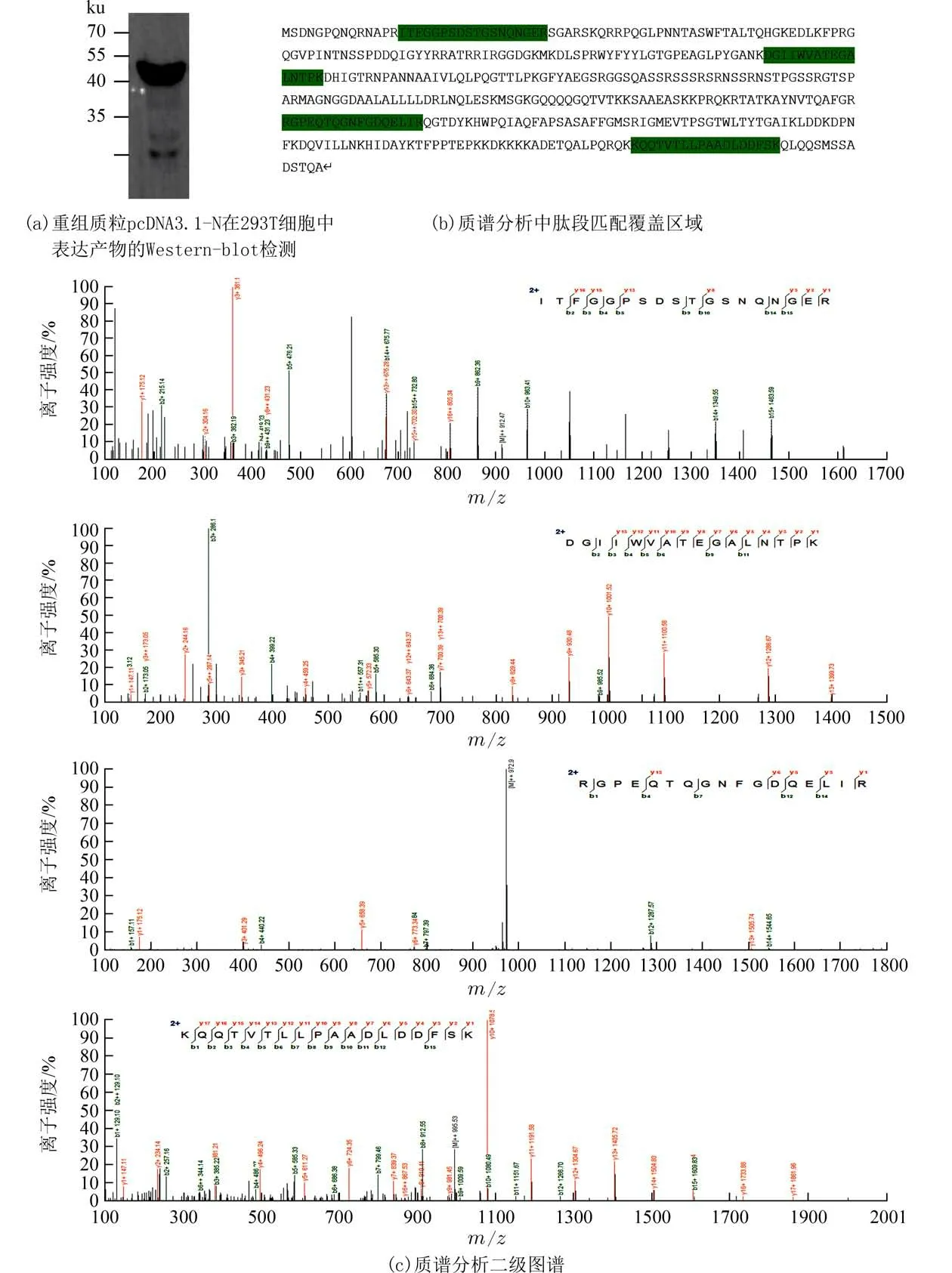
图2 重组质粒pcDNA3.1-N 在293T 细胞中表达产物的Western-blot 及质谱检测Fig.2 Western blot results of the expression product of recombinant plasmid pcDNA3.1-N in 293T cells and protein mass spectrometry
2.3 SARS-CoV-2 NDNA-LNP 包被鉴定 配制好的LNP-DNA 经蔗糖密度梯度离心分离富集后,进行核酸电泳,超离前3 层都有核酸条带(图3(a)).TEM 观察经蔗糖密度梯度离心后的SARS-CoV-2 N DNA-LNP,在超离第2 层发现大小在50~100 nm的脂质体纳米颗粒(图3(b)),表明脂质体成功包被N 基因质粒.Triton 裂解后检测脂质体中DNA质量浓度为530 ng/μL,将LNP-N 转染293T 细胞发现,LNP-N、FuGENE®HD 转染试剂组都可以在约46 ku 附近看到明显条带(图4(a)).梯度质量转染293T 细胞表明,含0.3 μg DNA 的脂质体能够看到明显的转染产物,在六孔板中每孔含1 μg DNA的脂质体即可实现高效转染(图4(b)),说明脂质体包被的N 基因质粒具有较高的转染效率.
图3 密度梯度离心后电泳结果及透射电镜观察结果Fig.3 Electrophoresis results after density gradient centrifugation and SARS-CoV-2 N DNA-LNP in TEM observation

图4 脂质体转染与FuGENE®HD 转染效果对比Fig.4 Transfection efficiency by LNP and FuGENE® HD
3 讨论和结论
从2019 年底至今,新型冠状病毒一直在全球范围内蔓延.根据世界卫生组织官网上提供的数据,截止到2021 年12 月28 号,新型冠状病毒已造成全球范围内将近2.79 亿人感染,其中超过500 万人死亡[23].目前国内以灭活疫苗为主,起到了较好的保护效率,且不良反应也较低.然而,SARS-CoV-2 易发生突变,导致疫苗的免疫效果下降,疫苗可能需要根据突变株更新换代[24].体液免疫和细胞免疫被认为在预防病毒感染过程中起到重要作用[25].DNA 疫苗既能产生细胞免疫应答,也能引起体液免疫应答,并且通过基因工程技术可使DNA疫苗质粒上结合多个抗原基因,可以实现通用疫苗的研发.当病毒发生突变时,可直接对DNA 疫苗质粒上的抗原种类基因进行替换以适应突变型疫苗研发[26-27].并且DNA 疫苗生物安全性高,容易大量制备,成本低廉,便于储存和运输.
在脂质体递送抗原应用方面,目前具有新型脂质分子或偶联物的新型脂质体和新型制剂为安全有效地治疗多种疾病开辟了可能性.新型脂质体可以延长循环时间或专门将药物输送到治疗靶点,且在体内没有表现出可检测的毒性[28-29].基于此优点,脂质体在疫苗开发领域也获得了极大的关注,强化了疫苗的免疫保护效果[30-31].
我们将SARS-CoV-2 N 的编码序列逆转录成DNA 克隆入pcDNA3.1 载体中,含有可以促进下游基因在哺乳动物细胞中有效表达的CMV 启动子.将此重组质粒用脂质体包被后可以形成大小在50~100 nm 的脂质体纳米颗粒.自从1965 年Bangham 等[11]第1 次尝试将脂质体引入到药物输送系统领域以来,脂质体制备过程中颗粒均一性及大小的问题一直是关注的焦点.脂质体功能的实现依赖于脂质体大小及均一性[32-33].我们使用的微流控技术是脂质体制备领域新兴的技术,通过微流控芯片中高度受控的流体混合条件产生大小均一、结构稳定的脂质体纳米颗粒.相比于传统的加热法[34]、溶剂分散法/反溶剂法[35]、溶剂交换法[36]等制备方法,微流控技术省略了脂质体的水合步骤和挤出步骤,只需要一步工艺即可以精确地完成不同大小和层状的脂质体的生产,且避免了脂质体制备过程中颗粒大小不均一的问题[37].在微流控混合制备前,我们将各类脂质在90%乙醇中37 ℃孵育1 h 以上,降低各类脂质的溶解度,使其距离更加接近,提高脂质体形成效率.
综上所述,DNA-脂质体纳米颗粒经转染293T细胞,Western-blot 表明目的蛋白得到了正确高效表达,即脂质体包被SARS-CoV-2 N 基因的候选DNA 疫苗能够高效转染人源细胞.下一步将开展动物体内免疫学的评价,为高效通用的SARS-CoV-2 LNP-DNA 疫苗的研发提供理论和实践基础.

