ZIF-8-Pt纳米颗粒对乳腺癌的放疗増敏作用研究
钟 凯,赵正阳,怀 千,李笑秋
作者单位:安徽医科大学第一附属医院肿瘤科,合肥 230022
乳腺癌是女性常见的第2大恶性肿瘤[1],其发病率呈逐年上升趋势,严重威胁着女性的生命健康。目前,乳腺癌的治疗方法有手术、内分泌治疗、放疗、化疗等。放疗(radiotherapy,RT)作为传统治疗手段之一,在乳腺癌的局部治疗中占有重要地位,但肿瘤病灶内部的剂量衰减以及肿瘤微环境的乏氧抵抗,会在一定程度上影响放疗疗效[2-3]。该研究旨在通过设计一种多孔铂纳米颗粒作为新的纳米药物来解决这个问题。由于高Z元素(是指铂在元素周期表上的高原子序数)和氧气生成功能的综合优势,铂纳米颗粒可以与目标DNA相结合,显著增强放疗过程中的DNA损伤[4-6]。此外,铂纳米颗粒通过将内源性H2O2转化为O2来增加肿瘤的氧合作用,大大增强了放疗效果,有良好的生物安全性,从而达到理想的放疗增敏效果。
1 材料与方法
1.1 材料2-甲基咪唑、水合硝酸锌购自上海阿拉丁试剂公司;氯铂酸、硼氢化钠购自上海国药集团试剂有限公司;DMEM培养液、胰酶(浓度0.25%)购自美国Gibco公司;胎牛血清(FBS)购自美国Hyclone公司;溴化噻唑蓝四氮唑(MTT)购买自生工生物工程(上海)股份有限公司;20只体质量20 g左右的6~8周龄的雌性Balb/c小鼠购自安徽医科大学实验动物中心并在SPF级动物房进行饲养。
1.2 方法
1.2.1ZIF-8-Pt纳米颗粒的制备以及表征的测定 2-甲基咪唑1 ml(0.2 mol/L)与水合硝酸锌100 μl(0.1 mol/L)剧烈反应,待到溶液呈乳白色停止反应。取反应液离心5 min(5 000 r/min)后去除沉淀,取上清液。上清液离心5 min(8 000 r/min)后取其沉淀,并摇匀重悬于1 ml去离子水中,再加入含有0.019 mol/L氯铂酸的去离子水50 μl搅拌1 h,后加入100 μl硼氢化钠(4 mg/ml),再搅拌3 h得到ZIF-8-Pt纳米颗粒。尺寸和电势以及血清稳定性的测量是在Malvern ZS90动态光散射(DLS)仪器(Malvern Instruments Ltd.,Worcs,英国)上使用He-Ne激光(633 nm)和90个收集光学器件在水溶液中进行的。使用Malvern分散技术软件5.10分析数据。使用透射电子显微镜(TEM;JEM-F200,JEOL Ltd,日本)观察到ZIF-8-Pt纳米颗粒的形态。取出样品,离心后得沉淀ZIF-8-Pt纳米颗粒,用硝酸溶解ZIF-8-Pt纳米颗粒,再用王水溶解瓶中残留物质,加入去离子水定容到5 ml后用电感耦合等离子体质谱(ICP-MS)去测量Pt的浓度。计算出单个样品Pt的含量。使用便携式溶解氧(DO)仪(Seven2GOproS9DO,Mettler Toledo,中国)测量水溶液中的氧气生成。将ZIF-8-Pt纳米颗粒的储备溶液以各种浓度分散和稀释在脱氧水中,然后在温和搅拌下与H2O2水溶液混合。H2O2的最终浓度为0.001 mol/ml,混合物的总体积为8 ml。使用溶解氧仪每60 s实时测量一次溶液中的氧气浓度。
1.2.2细胞培养 使用1%的双抗(100 U/ml 青霉素和 100 μg/ml 链霉素)及10%的胎牛血清的DMEM培养基培养所需的4T1细胞并在37 ℃、5% CO2温箱进行孵育。用倒置显微镜观察细胞生长状态,当细胞生长到占培养皿80%时进行传代,选对数生长期细胞进行实验。
1.2.3ICP-MS测量细胞对颗粒的摄取情况 细胞计数后将4T1细胞种植到24孔板上,平均每孔种104个细胞。CO2温箱孵育24 h后,每孔加入50 μg/ml的ZIF-8-Pt纳米颗粒溶解于DMEM培养基所形成的溶液。以摄取时间2、4、6 h分为3组,每组有3孔,摄取纳米颗粒后用1×PBS清洗孔内残留液体并用胰酶消化吸出孔内贴壁细胞。用硝酸溶解各组细胞后高温煮直至瓶底只见一层灰色物质附着,再用王水溶解瓶中残留物质,加入去离子水定容到5 ml后用电感耦合等离子体质谱(ICP-MS)去测量Pt的浓度。
1.2.4MTT实验评估ZIF-8-Pt 纳米颗粒的毒性 以ZIF-8-Pt纳米颗粒中Pt的浓度将实验设置为5组:200、100、50、25、12.5 μg/ml。将4T1细胞种植到96孔板上,每孔5 000个细胞,孵育24 h后去除上清液培养基,分别加入5种浓度的纳米颗粒溶液。继续孵育24 h后,每孔加入25 μl 5 mg/ml MTT溶液,孵育4 h后,弃去旧培养基,每孔加入100 μl DMSO混匀,摇床震荡1 h后,酶标仪488 nm波长进行检测。用软件Excel 2013和 GraphPad.Prism.V8.0.处理测好的对应孔的吸光度(optical density,OD)值,根据存活率=(实验组-空白对照组)/(阴性对照组-空白对照组)×100%的公式计算细胞存活率。
1.2.5评估纳米颗粒联合放疗对乳腺癌细胞的杀伤效果 实验设置为3组:空白对照组(不含ZIF-8-Pt纳米颗粒,且不放疗),联合放疗组(其中加入ZIF-8-Pt纳米颗粒50 μg/ml),单纯放疗组(不含ZIF-8-Pt纳米颗粒)。以放疗剂量将实验设置为4组:0 Gy;1 Gy;3 Gy;6 Gy。分别将4T1细胞种入5块96孔板,孵育24 h后,去除废弃培养基,每块96 孔板都加入50 μg/ml的ZIF-8-Pt纳米颗粒或者相同体积的DMEM。孵育6 h后分别对每块96孔板实施不同剂量的放疗,再孵育24 h。之后用MTT法评估细胞的存活率。
1.2.6克隆形成实验验证纳米颗粒联合放疗对乳腺癌细胞的杀伤与其颗粒浓度呈剂量相关 实验设置为5组:① 单纯放疗组(即不加入颗粒),② RT+NP 200 μg/ml,③ RT+NP 100 μg/ml,④ RT+NP 50 μg/ml,⑤ RT+NP 25 μg/ml。6孔板每孔接种1 000个4T1细胞(2 ml DMEM),每组取两个孔,培养箱过夜。分别加入不同浓度的纳米颗粒,4 h后给予6 Gy剂量的放疗,换液后放回培养箱继续无菌培养5 d,取出6孔板,PBS洗1次,用结晶紫染色1 h,PBS洗净(5次)拍照观察计算。根据存活率=实验组(NP+RT)/(单纯放疗组)×100%的公式计算细胞存活率。
1.2.7构建4T1小鼠肿瘤模型 20只20 g左右6~8周龄的雌性 Balb/c 小鼠购自安徽医科大学动物房。 所有动物均按照《实验动物护理和使用指南》中概述的指南进行饲养,所有程序均经中国科学技术大学动物护理和使用委员会批准。将2×105个4T1细胞(重悬于100 μl 1×PBS中)注射到Balb/c小鼠的右侧腰部皮下,建立肿瘤模型。
1.2.8评估纳米颗粒联合放疗体内对乳腺癌的杀伤效果 当荷瘤小鼠肿瘤体积约为100 mm3时,4T1荷瘤小鼠静脉注射以下分组的制剂(每组n=4)。注射后12 h,小鼠接受或者不接受6 Gy剂量的X射线照射。① PBS组(即既不加入颗粒也不经过放疗),② 单纯放疗组(即不加入颗粒),③ 单纯颗粒组(即只加入颗粒却不经过放疗),④ 颗粒联合放疗组(RT+NP 50 μg/ml),注射的颗粒ZIF-8-Pt的剂量为每千克小鼠注射2 mg剂量的ZIF-8-Pt制剂(ZIF-8-Pt纳米颗粒溶于1×PBS所形成的与体内等渗的溶液)。通过每2 d使用卡尺测量肿瘤的垂直直径(即分别为长度和宽度)来监测肿瘤生长。根据以下公式计算估计体积:肿瘤体积(mm3)=0.5×长度×宽度2。并且每2 d测量每只小鼠的体质量。
1.2.9HE染色检测纳米颗粒联合放疗后对肿瘤以及其他脏器组织结构的破坏 X射线照射15 d后处死小鼠,取出肿瘤以及小鼠的心、肝、脾、肺、肾等脏器;测量每块肿瘤的重量。肿瘤以及脏器用4%甲醛固定,石蜡包埋。随后,通过HE染色观察。

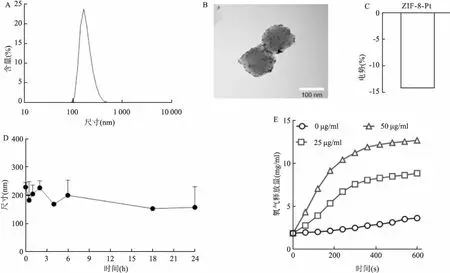
图1 ZIF-8-Pt纳米颗粒相关表征
2 结果
2.1 ZIF-8-Pt纳米颗粒的表征通过DLS测量得出ZIF-8-Pt纳米颗粒的粒径在160 nm左右(图1 A),与透射电镜观察的结果一致(图1 B);其电势为-14 mV(图1 C); DLS测量ZIF-8-Pt纳米颗粒在10%的FBS中可以稳定存在,粒径维持在200 nm左右(图1 D);通过将H2O2溶液与各种浓度的ZIF-8-Pt纳米颗粒混合后测量水溶液中的溶解氧浓度来评估该颗粒的氧气产生能力,氧气产生的程度高度取决于溶液中ZIF-8-Pt纳米颗粒的浓度,ZIF-8-Pt纳米颗粒的浓度为50 μg/ml时产生氧气的能力明显强于25 μg/ml以及不加颗粒的对照组(图1E);ICP-MS测量合成ZIF-8-Pt纳米颗粒样品中Pt的含量为837.8 μg。
2.2 细胞对ZIF-8-Pt纳米颗粒的摄取4T1细胞与ZIF-8-Pt纳米颗粒共同孵育2、4、6 h后,经过ICP-MS测量,4T1细胞对颗粒的摄取率分别为28.9%、34.4%、39.4%,细胞对颗粒的摄取随着时间的延长而增多。
2.3 ZIF-8-Pt颗粒的生物安全性该实验测试了各种浓度(0~200 μg/ml)的ZIF-8-Pt 颗粒的细胞毒性。将4T1细胞与ZIF-8-Pt 颗粒共孵育6 h并在24 h后测量生存率,当颗粒浓度为50 μg/ml时细胞存活率为89.28%(P<0.05),差异有统计学意义,但总体来说具有较好的生物安全性(图2)。
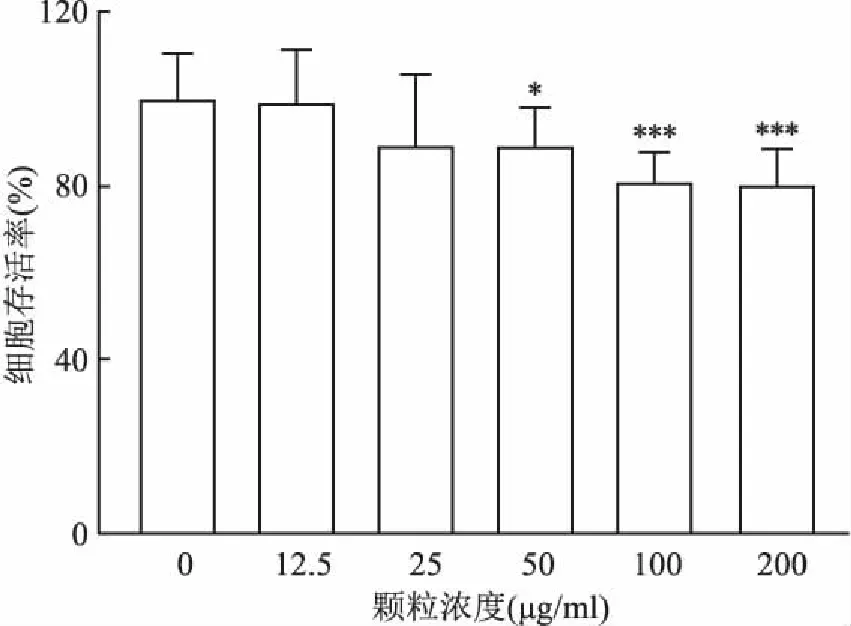
图2 不同浓度 ZIF-8-Pt 颗粒的生物安全性
2.4 MTT法评估体外放疗増敏效果为了评估4T1的放疗増敏效果,将4T1细胞用ZIF-8-Pt纳米颗粒以50 μg/ml的浓度处理6 h,对照组用1×PBS处理6 h。然后分别以0、1、3、6 Gy的剂量给予放疗,24 h后使用MTT法测定细胞活力(图3)。与单纯放疗组相比,用ZIF-8-Pt纳米颗粒预处理的细胞在放疗后显示出更高的细胞死亡率,在给予6 Gy剂量的放疗时,联合放疗组的细胞存活率仅为(50.096±12.948)%,明显低于单纯放疗组的(80.391±15.628)% (P=0.010 2,t=2.968),差异有统计学意义,这表明ZIF-8-Pt纳米颗粒具有放疗增敏效果。
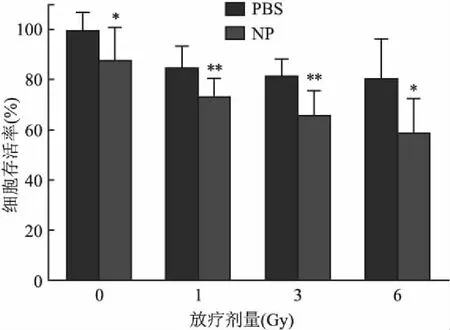
图3 ZIF-8-Pt纳米颗粒在不同放疗剂量下对4T1细胞的杀伤效果
2.5 克隆形成实验验证纳米颗粒联合放疗对4T1细胞的杀伤效果与其颗粒浓度相关通过克隆形成试验进一步评估了ZIF-8-Pt纳米颗粒的放疗增敏效果。将4T1细胞与不同浓度的ZIF-8-Pt 颗粒孵育4 h,然后给予6 Gy处理。 在照射5 d后检查每组4T1细胞的集落形成(图4 A)。通过计数集落数确定的细胞存活分数随着ZIF-8-Pt纳米颗粒浓度的增加而下降。当颗粒浓度达到200 μg/ml时,细胞存活率最低,仅为21%(图4 B)。
2.6 ZIF-8-Pt纳米颗粒的体内放疗增敏效果在ZIF-8-Pt纳米颗粒体外治疗实验的基础上,本研究进一步在小鼠体内验证颗粒的放疗增敏效果。以2 mg/kg剂量的ZIF-8-Pt纳米颗粒联合6 Gy的电离辐射进行体内治疗实验。4T1荷瘤小鼠注射不同的纳米颗粒溶液或PBS,12 h后,用6 Gy的X射线照射肿瘤。最终结果显示(图5 A),NP+RT组有效抑制了78.4%的肿瘤生长(F=10.95,P<0.000 1),明显强于单纯放疗组的34.5% (F=10.95,P=0.012 7)与单纯颗粒组的19.1%,(F=10.95,P=0.003 0),差异有统计学意义,说明了体内高Z元素ZIF-8-Pt的放疗增敏效果。在RT治疗后第15天处死小鼠,取出肿瘤后观察(图5D)并且测量治疗后肿瘤的重量(图5 C),其中经ZIF-8-Pt联合放疗治疗组肿瘤重量明显轻于单纯放疗组的肿瘤重量(F=11.76,P=0.044 4),差异有统计学意义,同样证明了ZIF-8-Pt 联合放疗明显优于单纯放疗。治疗前后小鼠体质量无明显变化(图5 B),可以说明ZIF-8-Pt在体内具有较好的生物安全性。在RT治疗后第15天解剖小鼠获取肿瘤以及脏器并进行HE染色(图5 E),各治疗组对小鼠的脏器均未有明显损伤,这不仅可以说明ZIF-8-Pt 联合放疗对肿瘤组织的杀伤效果优于单纯放疗,也可以说明ZIF-8-Pt纳米颗粒在小鼠体内具有良好的生物安全性。
3 讨论
放射治疗是目前临床上广泛应用的治疗方法之一。RT利用高能X射线直接损伤DNA或产生活性氧自由基杀死癌细胞[7]。但是由于放疗缺乏组织特异性以及靶向性,且肿瘤部位相对乏氧,会导致放疗后断裂的DNA周围缺少足够的O2形成的稳定氧化合物,不能有效地抑制DNA损伤的自动修复,从而导致放疗效果不明显。目前增敏放疗的策略是将血管内皮生长因子(vascular endothelial growth factor,VEGF),趋化因子受体(chemokine receptor 4,CXCR4),雄激素受体作为增敏靶点,通过抑制细胞增殖并诱导凋亡来增强放疗对细胞的杀伤作用,但是由于放疗抵抗机制网络的复杂性导致针对靶点治疗的疗效不明显[8-9]。因此如何通过改善肿瘤的乏氧微环境从而缓解放疗抵抗是目前的一个研究热点。
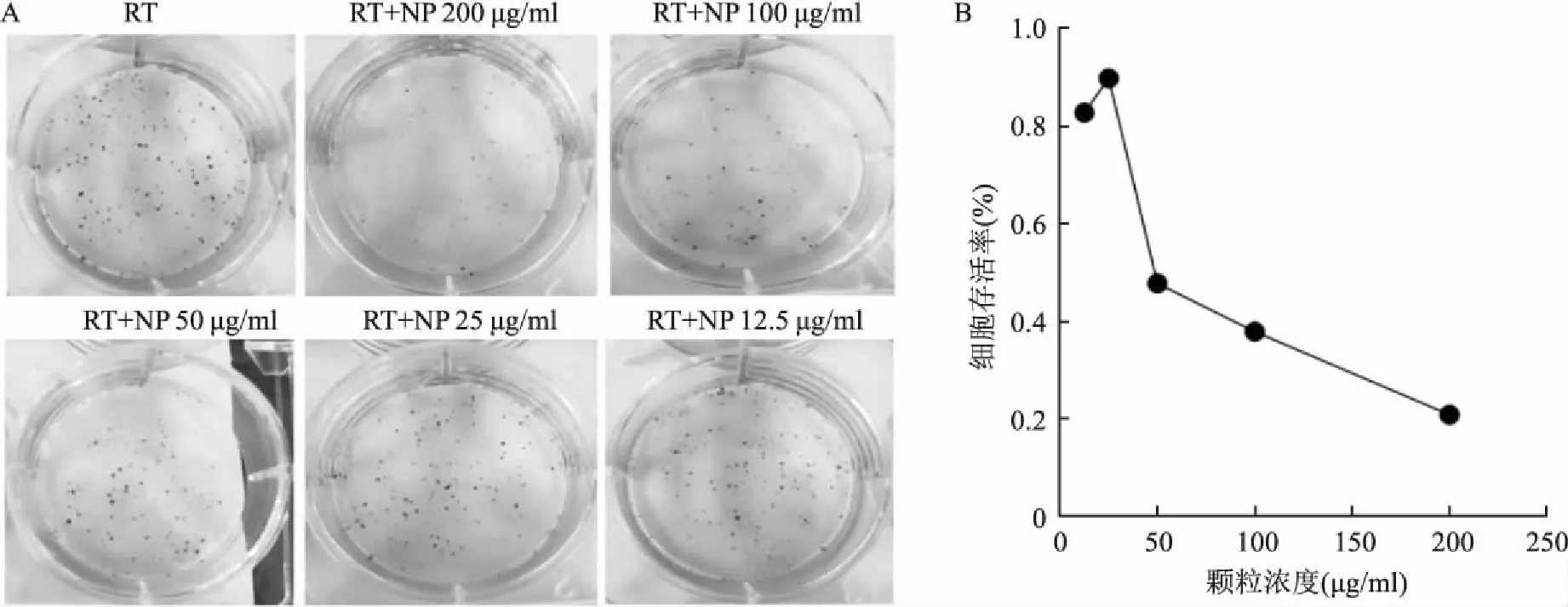
图4 验证ZIF-8-Pt纳米颗粒对4T1细胞的杀伤效果与其浓度之间的关系
本研究所设计并制备的ZIF-8-Pt纳米颗粒具备三点优势。① 可以通过其“高渗透长滞留”效应(enhanced permeability and retention effect, EPR)效应来发挥被动靶向和肿瘤富集的作用[10-12](EPR效应是指由于正常组织中的微血管内皮间隙致密、结构完整,大分子和脂质颗粒不易透过血管壁,而实体瘤组织中血管丰富、血管壁间隙较宽、结构完整性差,淋巴回流缺失,造成大分子类物质和脂质颗粒具有选择性高通透性和滞留性,可以使ZIF-8-Pt纳米颗粒在肿瘤部位靶向富集。)。② ZIF-8-Pt纳米颗粒,作为一种多孔铂纳米颗粒,由于具备高Z元素的优势,可以在在与肿瘤中的X射线相互作用后有效地发射电子辐射,从而最大限度地增强放疗诱导的DNA损伤、细胞周期停滞和ROS应激[13]。③ ZIF-8-Pt纳米颗粒可以通过将内源性H2O2转化为O2,改善乏氧微环境,进而增强了RT的疗效[14]。材料的表征结果显示,ZIF-8-Pt纳米颗粒可以有效地促进H2O2转化为O2;体内以及体外治疗实验结果显示,ZIF-8-Pt纳米颗粒联合放疗对乳腺癌的杀伤效果明显强于单纯放疗,并且联合ZIF-8-Pt纳米颗粒的放疗不会导致小鼠出现明显的器官毒性迹象或体质量变化,保证了材料具有增敏放疗效果的同时具备良好的生物安全性。

