瓜类细菌性果斑病生防菌的筛选、鉴定及发酵液抑菌稳定性研究
王雪妍, 岳丹丹, 潘梦诗, 张志龙, 张英涛
(河南省科学院生物研究所有限责任公司,郑州 450008)
瓜类细菌性果斑病是由燕麦嗜酸菌西瓜亚种(Acidovorax avenaesubsp.citrulli)引起的种传性细菌病害,可侵染叶子也可侵染果实[1-2]. 目前该病害的防治手段主要以化学防治为主,但化学防治手段不利于环境保护,且残留的药物会危害人畜健康,因此生物防治成为解决化学防治弊端的重要措施. 本试验从土壤中分离筛选得到一株瓜类细菌性果斑病的生物防治菌株BP-12,并对其进行了鉴定,又从温度耐受性、pH耐受性以及紫外照射时间耐受性3个方面对该菌株发酵液的抑菌稳定性展开研究.
1 材料与方法
1.1 材料
1.1.1 样品来源
土壤样品取自河南省周口市种植西瓜的土壤. 病原菌来自中国农业微生物菌种保藏管理中心,菌种编号ACCC05732.
1.1.2 培养基
NB培养基:蛋白胨10 g/L、牛肉膏3 g/L、NaCl 5 g/L,pH 7.3.
NA培养基:蛋白胨10 g/L、牛肉膏3 g/L、NaCl 5 g/L、琼脂18 g/L,pH 7.3.
KB培养基:蛋白胨20 g/L、K2HPO41.5 g/L、MgSO4·7H2O 1.5 g/L、琼脂18 g/L、甘油10 mL/L,pH 7.2.
1.2 方法
1.2.1 生物防治菌株的筛选
初筛:取10 g 土壤样品,加入装有90 mL 无菌水和8~10 个已灭菌的玻璃珠的三角瓶中,180 r/min 振荡30 min,充分打散土样,梯度稀释后取100 μL涂布于NA平板,30 ℃,培养1~2 d;挑取具有明显差异的菌落,经平板划线纯化后,编号并保藏备用.
复筛:挑取病原菌种于NB培养基中,30 ℃,180 r/min,培养48 h;吸取病原菌液2 mL于KB平板上,轻轻晃动平板,将菌液布满整个平板,放置5~10 min;将平板倾斜吸出多余的菌液,开盖在无菌环境中晾干培养基平板表面[3],将初筛得到的菌株点种到平板上,30 ℃,培养48 h;筛选出具有抑菌圈的菌株,并将其进行多次继代培养,选择拮抗作用稳定且效果较好的菌株.
1.2.2 菌株的鉴定
形态学观察及生理生化鉴定:将初筛出来的菌株BP-12接种于NA培养基上,30 ℃,培养24 h;肉眼观察菌株菌落形态,再在显微镜下观察菌体形态,并参照《常见细菌鉴定手册》进行生理生化特征试验[4].
分子生物学鉴定:提取菌株的基因组DNA,采用通用引物27F/1492R 进行PCR 扩增,引物为27F:5’-AGAGTTTGATCCTGGCTCAG-3’;1492R:5’-GGTTACCTTGTTACGACTT-3’,PCR扩增体系为25.0 μL,包括无菌双蒸水17.0 μL,10×Buffer 2.5 μL,dNTP 1.0 μL,正向和反向引物各1.0 μL,模板DNA 1.0 μL,Taq DNA 聚合酶0.3 μL. PCR 反应条件为95 ℃,4 min;95 ℃,1 min;52 ℃,30 s;72 ℃,2 min;30 个循环;72 ℃10 min. 将PCR扩增产物经琼脂糖凝胶电泳后测序,测序结果在GenBank数据库中进行BLAST比对,做相似性分析.
系统发育树构建:测序获得的16S rRNA部分序列经BLAST同源比对后,从GenBank中获取同源性较高且相邻的种、属的序列,同时查找相邻种、属中模式种的16S rRNA序列,使用MEGA6软件进行构建系统发育树.
1.2.3 发酵液抑菌稳定性研究
热稳定性试验:将菌株BP-12发酵液均分5份,分别在40、50、60、70、80 ℃条件下处理30 min. 待发酵液降至室温后,取不同温度处理下的发酵液100 μL在涂有病原菌的KB平板上打孔点样,以未处理的发酵液为阳性对照,NB培养基为空白对照,每个处理重复3次,30 ℃静置培养48 h,观察抑菌圈的大小.
pH稳定性试验:用1 mol/L的HCl和1 mol/L的NaOH将菌株BP-12发酵液的pH值分别调节为3、4、5、6、7、8、9、10,室温下静置12 h;再将这些发酵液的pH值调回到其初始pH值7.3. 取不同pH值处理条件下的发酵液100 μL在涂有病原菌的KB平板上打孔点样,以未处理的发酵液为阳性对照,NB培养基为空白对照,每个处理重复3次,30 ℃静置培养48 h,观察抑菌圈的大小.
紫外线稳定性试验:将菌株BP-12发酵液于紫外灯下静置照射,波长254 nm,功率36 W,高度25 cm,照射时间分别为1、2、3、4、5、6 h. 取不同紫外照射时间处理下的发酵液100 μL在涂有病原菌的KB平板上打孔点样,以未处理的发酵液为阳性对照,NB培养基为空白对照,每个处理重复3次,30 ℃静置培养48 h,观察抑菌圈的大小.
2 结果与分析
2.1 菌株的筛选与鉴定
从土样中分离得到的菌株BP-12对病原菌的抑菌圈直径达20.3 mm,30 ℃条件下,在NA平板上培养48 h,肉眼观测到菌落呈白色圆形不透明状,表面无褶皱(图1);显微镜下观察呈杆状,产芽孢,革兰染色阳性;生理生化特性见表1. 提取菌株BP-12基因组DNA,采用细菌16S rRNA基因通用引物扩增菌株的16S rRNA基因片段,将测序结果通过BLAST 软件进行同源性比较,并选取同源性较高的参考菌株的16S rRNA 序列,通过MEGA6软件构建系统发育树(图2). 菌株BP-12为芽孢杆菌属,且与解淀粉芽孢杆菌(B.amyloliquefaciens)亲缘关系较近.

图1 菌株BP-12菌落形态结果Fig.1 The colony morphology of the strain BP-12

表1 菌株BP-12的生理生化特性Tab.1 Physiological and biochemical characteristics of strain BP-12

图2 基于16S rRNA序列构建的菌株BP-12的系统发育树Fig.2 Phylogenetic tree of strain BP-12 based on 16S rRNA sequence
2.2 发酵液抑菌稳定性研究
2.2.1 热稳定性
菌株BP-12 发酵液经不同温度处理后的抑菌圈变化如图3 所示. 由图可知,菌株BP-12 发酵液经40、50、60 ℃处理30 min后,抑菌圈直径与未处理的发酵液相比差别不明显;当温度升高到70 ℃和80 ℃时,抑菌圈直径变小. 由此说明,随着温度的升高,菌株BP-12发酵液的抑菌活性逐渐降低.

图3 温度对菌株BP-12发酵液抑菌活性的影响Fig.3 Influence of temperature on antimicrobial activity of strain BP-12 fermentation broth
2.2.2 pH稳定性
菌株BP-12发酵液经不同pH处理后的抑菌圈变化如图4所示. 当pH<5和pH=10时,菌株BP-12发酵液的抑菌圈直径较小,说明抑菌效果不理想;pH值在5~9的范围内,菌株BP-12发酵液的抑菌圈直径与对照相比差别不明显. 由此说明,菌株BP-12发酵液在弱酸、中性以及弱碱条件下能保持相对稳定的抑菌活性.
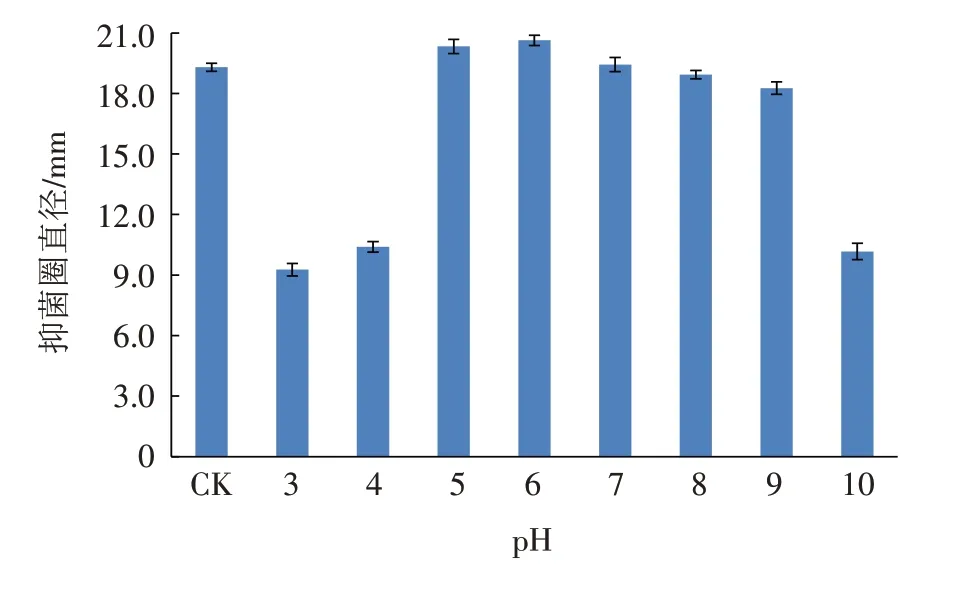
图4 pH对菌株BP-12发酵液抑菌活性的影响Fig.4 Influence of pH on antimicrobial activity of strain BP-12 fermentation broth
2.2.3 紫外线稳定性
菌株BP-12 发酵液经不同时间紫外线照射后的抑菌圈变化如图5 所示. 随着紫外线照射时间的增加,菌株BP-12 发酵液的抑菌圈变化不明显,当紫外照射时间达到6 h 时,抑菌圈直径仍能达到19.8 mm.由此说明,菌株BP-12发酵液对紫外线照射有较好的稳定性.
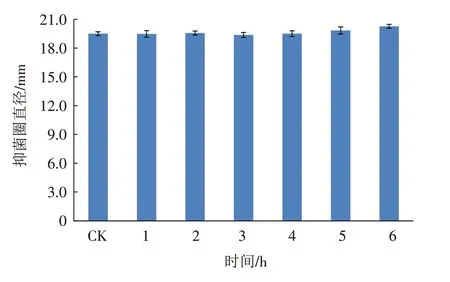
图5 紫外照射对菌株BP-12发酵液抑菌活性的影响Fig.5 Influence of ultraviolet irradiation on antimicrobial activity of strain BP-12 fermentation broth
3 讨论与结论
目前,已报道的瓜类细菌性果斑病的生防菌有酵母菌(Pichia anomala)、荧光假单胞菌(Pseudomonas Fluorescens)工程菌株(染色体整合了2,4-二乙酰基间苯三酚)以及芽孢杆菌等[5-7]. 本试验通过梯度稀释和平板对峙试验相结合的方法筛选得到一株对瓜类细菌性果斑病有拮抗作用的菌株BP-12,抑菌圈直径20.3 mm. 利用形态学、生理生化以及分子生物学相结合的方法对其进行分类学地位的确定,鉴定该菌株为解淀粉芽孢杆菌(B.amyloliquefaciens). 芽孢杆菌是一类种类多、分布广的好氧性革兰阳性菌,是土壤和植物微生态中的优势种群,在植物病害生物防治研究中占有重要地位[8-9]. 其中解淀粉芽孢杆菌能够防治多种真菌和细菌病害,能够产生抑菌物质,且营养要求简单,繁殖速度快,是公认的植物病害的生防细菌[10]. 张凤杰等研究发现,生防菌解淀粉芽孢杆菌B15的发酵液对23种植物病原菌具有抑制作用,且对香菇烂筒病、苹果腐烂病以及黄瓜枯萎病等5种病原真菌的抑制率在90%以上,具有广谱抑菌性[11];贾慧慧等从杏树根系土壤中分离到一株解淀粉芽孢杆菌BJ-6,经研究该菌对甜瓜细菌性果斑病病原菌有很好的抑制作用,并对甜瓜苗有很好的促生作用[12].
相关研究发现,生防菌株的抑菌稳定性易受到周围环境因素的影响,因此,抑菌的稳定性对于实际应用中的防治效果具有重要作用[13]. 吴艳清等[14]研究发现,芽孢杆菌YQ5 发酵液在温度高于100 ℃时,抑菌率仍高于50%,另对极端pH 环境以及紫外线照射均不敏感;张亮等[15]研究表明,多黏类芽孢杆菌LRS-1在30~60 ℃范围内对辣椒疫霉病病原菌的抑菌率达60%以上,且在中碱性中抑菌效果保持稳定. 本研究筛选到的解淀粉芽孢杆菌BP-12 对瓜类细菌性果斑病病原菌具有良好的抑制作用,发现发酵液经40、50、60 ℃处理后活性稳定,当温度升高到70 ℃和80 ℃时,抑菌活性降低;发酵液pH 值为5~9 时,其抑菌圈直径仍能达到18.3 mm 以上;经紫外照射6 h 后,发酵液的抑菌圈直径不受影响,表明菌株BP-12 发酵液具有较好的抗紫外线能力.
综上,解淀粉芽孢杆菌BP-12在瓜类细菌性果斑病的防治方面具有良好的应用前景.

