升流式污泥床对无机废水中氮硫转化及相互影响
朱 淼,袁林江,牛泽栋,周旭红,贺向峰,钟冰冰
升流式污泥床对无机废水中氮硫转化及相互影响
朱 淼,袁林江*,牛泽栋,周旭红,贺向峰,钟冰冰
(西安建筑科技大学环境与市政工程学院,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
采用无机含氨和硫酸盐(SO42-)废水作为升流式污泥床(USB)反应器进水,研究了其对铵(NH4+)和SO42-的去除以及不同高度污泥层含氮、硫元素的转化途径.结果表明在反应器进水口处由于进水自含氧(外源性氧)和兼性厌氧菌受到氧化应激产生过氧化氢(内源性氧),两种“氧”共同存在下,反应器内生物脱氨量(以氮计)最高达40mg/L左右,且在USB反应器不同高度污泥层含氮化合物和含硫化合物的转化途径不同.在反应器底部污泥层,颗粒污泥表面氨氧化菌利用O2将氨(NH4+)氧化成亚硝酸盐(NO2-),在颗粒污泥内部厌氧氨氧化菌利用 NH4+和NO2-生成氮气(N2)和硝酸盐(NO3-);同时,O2的存在使得反应器底部污泥层部分厌氧颗粒污泥裂解,产生少量有机物,在颗粒污泥内部硫酸盐还原菌利用有机物将SO42-还原生成硫离子(S2-);硫自养反硝化菌利用NO2-/ NO3-将S2-重新氧化为SO42-.在反应器上部污泥层,由于只有少量内源性氧的存在,硫自养反硝化菌只能利用少量NO2-/ NO3-将S2-氧化为硫单质(S0);在USB反应器底部污泥层实现NH4+的去除和SO42-的循环,在上部污泥层实现了SO42-的去除.
升流式污泥床;厌氧氨氧化;硫自养反硝化;脱氮除硫
污水中含氮化合物主要以还原态氮即有机氮化合物和NH4+-N的形态存在[1].在厌氧条件下,有机氮化合物会发生氨化作用转变成NH4+-N[2].因此,如何廉价高效地去除NH4+-N是污水处理领域研究的热点.近年来,研究者发现通过构造一些特殊环境或富集一些特殊的细菌,NH4+-N可以直接在厌氧条件下得以去除,如(亚硝酸盐型)厌氧氨氧化(ANAMMOX)工艺[3].在工艺中,NH4+-N的去除往往高于理论值[4-5],现有的研究结果不能完全解释这一现象.并且含硫化合物通常伴随着含氮化合物的转化而转化[6-7].与此同时,硫酸盐型厌氧氨氧化(SRAO)[8-9]和硫自养反硝化[10]等过程的发现证实了含硫化合物和含氮化合物的转化过程可能存在一定程度上的耦合[11].目前众多研究者[12-14]为了减少厌氧氨氧化过程中NO3-的产生,采用向厌氧氨氧化反应器中投加S0或S2-的方式,促使反应器内发生厌氧氨氧化耦合硫自养反硝化的反应达到降低出水NO3-的目的.此外,袁林杰等[15]和Sabumon[16]分别在无机条件和有机条件研究生物脱氮过程时均检测到有过氧化氢(H2O2)的产生,细菌通过产生过氧化氢酶来保护自己免受H2O2的攻击,过氧化氢酶能分解H2O2产生O2,产生的O2可用于硝化反应[17].有研究者发现NH4+-N“超量”去除现象发生在USB反应器中[15,18-19].但在USB反应器兼性厌氧菌受到氧化应激产生H2O2过程是短暂且有限的,为何反应器内会出现NH4+-N持续去除且去除量逐渐增加的现象.不存在供氧条件的USB特殊的运行状态和模式是否是NH4+-N去除的原因尚不清晰.同时袁林杰等[15]在USB反应器内观察到污泥分层现象,反应器底部污泥层处于微氧环境,反应器上部污泥层处于厌氧环境.USB反应器内不同高度污泥层O2含量的不同是否会引起反应器内菌群结构不同,导致反应器内氮硫存在多种复杂生物转化,并未进行研究.
因此,本研究采用对无机条件下进水只投加NH4+-N和SO42-的USB反应器, 通过批式实验考察反应器内NH4+-N的去除机制,并通过解析不同高度污泥层的微生物群落、微生物活性以及不同高度污泥层含氮和含硫元素的变化,揭示反应器内SO42-的循环和代谢以及SO42-转化与NH4+-N去除过程的耦合.
1 材料与方法
1.1 实验装置
采用由有机玻璃制成的USB反应器(图1),反应器内径100mm,高600mm,有效容积4.71L,外侧水浴保温层厚度20mm,利用加热水槽和温控装置保持温度为(32±2)℃.在保温层外包裹铝箔纸进行隔光.反应器出水及三相分离器排气口均进行水封处理,减少空气中溶解氧对反应器运行的影响.
1.2 接种污泥
接种污泥为西安市雪花啤酒厂内循环厌氧(IC)反应器内厌氧颗粒污泥与西安市江村沟垃圾渗滤液处理厂反硝化污泥的混合污泥,接种污泥量分别为3和1.5L,MLSS(悬浮物)为88.25g/L,MLVSS(可挥发性悬浮物)为47.32g/L,MLVSS/MLSS=0.54.

图1 实验装置示意
1-进水桶;2-蠕动泵;3-保温层;4-三相分离器;5-出水;6-液封;a-取样口1(进水口);b-取样口2;c-取样口3;d-取样口4;e-取样口5;f-取样口;6(出水口);S-上部污泥层;D-底部污泥层
1.3 实验用水
采用人工模拟废水,主要以NH4Cl、Na2SO4按需配制,具体见表1,其他成分含量:NaHCO3800mg/L, KH2PO427mg/L,CaCl2·2H2O 200mg/L,MgCl2·6H2O 250mg/L.在反应器运行期间保持进水pH值为8.0±0.3.

表1 反应器内进水各组分浓度
1.3.1 指标测定 NH4+-N、NO2--N、NO3--N、SO42-、S2-等常规项目的测定参照《水和废水监测分析方法》第四版中的方法[20];pH值采用PHS-3EpH计测定; DO采用HQ40d型溶氧仪测定;ORP采用ORP仪测定;污泥粒径采用激光粒度分布仪(LS230/ SVM);H2O2采用钛-硫酸钛法[21];污泥的微观结构采用场发射扫描电子显微镜(Fe-SEM)观察[22];微生物测序分析由上海生工生物工程公司测序.
1.3.2 活性测定 氨氧化细菌(AOB)、硝化细菌(NOB)[23]活性测定:从反应器不同污泥层取泥水混合物,用PBS溶液(PBS:0.14g/L KH2PO4和0.75g/L Na2HPO4)清洗3次.称取3g湿污泥置于150mL的锥形瓶内,加入含NH4+-N 50mg/L、NO2--N 50mg/L的基质至150mL,在34℃水浴中充分曝入空气(控制锥形瓶内DO (7±0.5)mg/L),每间隔2h取样经0.22μm的滤头过滤后分别测量NH4+-N和NO2--N浓度.由基质降解曲线计算AOB、NOB活性.
厌氧氨氧化(AnAOB)[24]、硫酸盐还原(SRB)[25]、硫酸盐型厌氧氨氧化(SRAO)[11]、硫自养反硝化(SADN)菌活性测定[26]:称取3g湿污泥置于130mL的血清瓶,加入基质至130mL.(AnAOB活性测定主要基质为NH4+-N 50mg/L、NO2--N 66mg/L,取样间隔为12h;SRB活性测定主要基质为COD 200mg/L、SO42-170mg/L,取样间隔为6h;SRAO活性测定主要基质为NH4+-N 50mg/L、SO42-170mg/L,取样间隔为12h;硫自养反硝化活性测定主要基质为硫磺粉 32mg/L、NO3--N 14mg/L,取样间隔为6h).以高纯氩气曝气10min后置于恒温水浴摇床(34℃、160r/min),取样经0.22 μm的滤头过滤后测量基质的浓度,由基质降解曲线计算活性.
上述活性实验均设定3组平行试验同时进行空白试验(瓶内不加污泥,只加基质).
1.3.3 批次实验 从反应器(第335d)底部取泥水混合物,用PBS洗涤3次.加入适量污泥和反应液(主要基质为NH4+-N 50mg/L)至130mL血清瓶,以高纯氩气曝气10min后置于恒温水浴摇床(34℃、160r/ min),方案见表2.

表2 批次实验方案
1.3.4 过氧化氢酶活性测定 取反应器内不同污泥层泥水混合液于离心管,在4000r/min离心5min,倒掉上清液,将离心后的湿污泥称取2g置于100mL三角瓶中,加入40mL超纯水,再加5mL 0.3%的H2O2溶液,随后在25℃、150r/min的恒温摇床中振荡20min,然后将其取出加入1mL饱和铝钾矾,立即过滤于盛有5mL 1.5mol/L硫酸的三角瓶中,过滤后的污泥样品放入烘箱(105℃,2h)烘干,称重(记为),取25mL滤液,用0.002mol/L高锰酸钾溶液滴定至紫色,同时做无土空白实验,设置3组平行实验[27].过氧化氢酶活性按下式计算:
=(-V)×51/0×17/(1)
式中:为过氧化氢酶活性,mg H2O2/(g·min);是0体积空白溶液所消耗的高锰酸钾体积, mL;是0体积样品溶液所消耗的高锰酸钾体积, mL;是高锰酸钾的浓度, mg/L;是污泥的干重, g.
2 结果与讨论
2.1 反应器对氮硫的脱除
由图2可知,在USB反应器运行过程中,NH4+-N有明显的去除,而SO42-几乎没有去除,出水无NO2--N和NO3--N的生成.阶段Ⅰ(1~76d)由于在反应器刚启动时接种的厌氧颗粒污泥和反硝化污泥中的异氧微生物及部分无法获取营养物质的微生物不适合现有的生存条件,出现污泥死亡现象,释放大量的NH4+和有机物.导致在反应器运行前12d,出水NH4+-N浓度一直高于进水;同时硫酸盐还原菌利用污泥死亡释放的有机物将SO42-还原,出水SO42-浓度低于进水浓度,将反应器产气进行气相色谱分析后发现含有少量硫化氢(H2S).12d后,阶段ⅠNH4+-N的平均去除量在10mg/L左右;随后进出水SO42-浓度变化不大.阶段 II (77~106d)NH4+-N的平均去除量仍在10mg/L左右.阶段III(107~156d)和阶段IV(157~196d),NH4+-N的平均去除量在20mg/L左右.阶段V(197~262d),NH4+-N的平均去除量在30mg/L左右;阶段VI (263~338d),NH4+-N的平均去除量在40mg/L左右.结合表1和图2可知,NH4+-N去除量似乎与NH4+-N进水负荷的变化无关,与进水SO42-的浓度也无关.这种NH4+-N独立转化现象在很多文献中也都报道过[6,15,28-29].
由图3可知,DO浓度从0.1mg/L提高到0.49mg/ L,ORP从-380mV提高到-166.9mV,NH4+-N的去除量从10mg/L提高到40mg/L.这表明反应器不同阶段NH4+-N的去除量与DO和ORP有很明显的联系,即DO和ORP的值越高,反应器内NH4+-N的去除量越高.有文献报道[7]厌氧程度越高(ORP和DO越低)氨转化速率越慢,微氧条件下氨转化速率明显高于缺氧条件下,而厌氧条件下氨无法被转化.由于在反应器进水未添加亚硝酸盐、硝酸盐等氧化态化合物,故氨氧化的电子受体为O2,USB反应器内发生了氨氧化反应去除NH4+-N.

图2 USB对NH4+-N与SO42-的去除情况

图3 取样口2处不同阶段ORP、DO与NH4+-N去除量
由图4可知,pH值的变化主要发生在取样口1到取样口2之间.取样口1(进水口处)pH值为(8.12±0.09),取样口2处pH值为(7.57±0.059),pH值有明显的下降,说明在此处发生了消耗碱度的生化反应.进水NH4+-N浓度为(203.30±5.50)mg/L,经过底部污泥层后在取样口2处测得NH4+-N浓度为(161.05±2.42) mg/L,NH4+- N的平均去除量在42.25mg/L左右,同时在取样口2处检测到(0.69±0.18) mg/L左右NO2--N的生成和(1.46±0.22) mg/L左右NO3--N的生成,NO2--N的存在说明发生了亚硝化反应,NO3--N的来源还有待进一步证实.取样口3、4处NH4+-N浓度较取样口2处变化不大,这主要是因为底部进水处的DO会被底部污泥层(ORP= -166.9mV、DO=0.49mg/L)中的AOB菌消耗殆尽,从而为上部污泥层(ORP= -310.8mV、DO=0.14mg/ L)创造一个厌氧环境.
如图5所示,在A0、A1、A2检测到的AOB菌属主要是,其相对丰度分别为0.95%、0.31%、0.15%,它是目前亚硝酸菌中代谢途径最丰富的菌种,DO 浓度较低时该菌可能起着厌氧条件下氧化氨的功能[30].如图6所示,A1、A2中AOB活性分别为 59.98和34.38mg NH4+-N/(gVSS·d).反应器底部AOB菌的丰度及活性均高于反应器上部,这说明反应器内氨氧化过程主要发生在反应器的底部.在A0、A1、A2处均未检测到NOB菌属,A1、A2处NOB菌的活性极其微弱.这说明反应器内NO3--N (取样口2处)并非来自NOB的NO2--N氧化过程.在A0、A1、A2处均检测到AnAOB菌属.在反应器运行稳定后,AnAOB菌属(unclassified)从0.01%增加到了7.70%(底部污泥)和0.38%(上部污泥).说明(取样口2处)产生的NO3--N来自于厌氧氨氧化过程.
反应器内底部和上部污泥的粒径测定结果表明,底部污泥中粒径>200μm的占比为51.67%,上部污泥中粒径>200μm的占比为27.73%.粒径小于200μm被视为絮状污泥,粒径大于200μm 被视为颗粒污泥[31].说明反应器底部污泥颗粒化程度明显.颗粒污泥具有大量的生物群体,对复杂的环境条件具有更强的适应性[32-33].

图4 反应器不同高度NH4+-N、NO2--N、NO3--N浓度和pH值

图5 属水平物种相对丰度
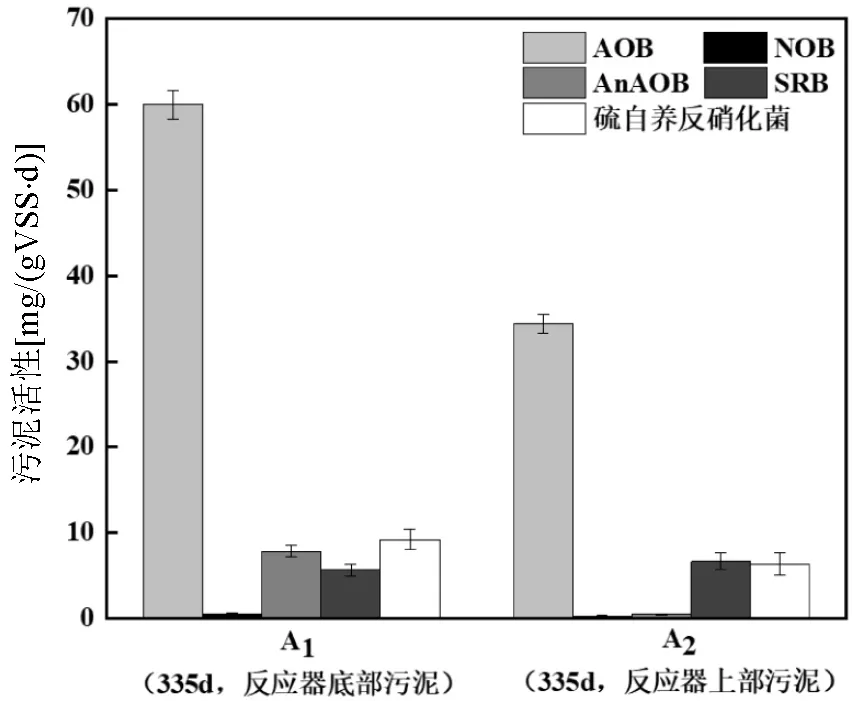
图6 反应器不同污泥层污泥活性
本实验的反应器进水采用未经消氧的自来水配制模拟废水,在反应器底部污泥层低DO环境中,AOB菌分布于颗粒污泥表面利用O2将NH4+-N氧化为NO2--N,缓解O2对AnAOB菌的抑制[34]; AnAOB菌存在于颗粒污泥内部利用亚硝化生成的NO2--N进一步消耗NH4+-N.在AOB菌和AnAOB菌的共同作用下,反应器内的NH4+-N得到不断去除.
2.2 反应器内NH4+-N“超量”去除机理解析
由图7可知,第Ⅵ阶段过氧化氢酶活性均高于第Ⅴ阶段,反应器底部污泥过氧化氢酶活性高于上部污泥.与此对应,在第Ⅵ阶段反应器底部(取样口2)检测到H2O2浓度最高[(1.58±0.018)mg/L],且第Ⅵ阶段H2O2浓度均高于第Ⅴ阶段,在反应器内有污泥存在的区域都检测到H2O2的存在.这说明反应器NH4+-N去除量增加与反应器内H2O2的浓度有关.

批次实验结果图8所示,初始每个血清瓶中NH4+-N浓度均为50mg/L左右,前24h NH4+-N浓度基本都没有变化,说明在绝对厌氧只含NH4+-N的体系内,NH4+-N不会发生转化.24h后向血清瓶2中注入O2和血清瓶3中注入H2O2后发现NH4+-N浓度都有所降低,说明NH4+-N的去除与系统内存在的O2和过氧化氢酶分解H2O2产生O2有关.当O2或H2O2添加后,血清瓶2中NH4+-N浓度减少了11.45mg/L,血清瓶3中NH4+-N浓度减少了7.49mg/ L,血清瓶4中NH4+-N浓度减少了24.42mg/L.血清瓶4中NH4+-N的减少量多于血清瓶2和血清瓶3中NH4+-N减少量之和.这说明H2O2的出现不仅会产生一定的O2,在内源性和外源性的O2共同存在的条件下会促进系统内产生更多的O2,反应器内NH4+-N的去除量也不断增加.

图8 添加O2和H2O2对NH4+的去除
2.3 反应器内SO42-代谢机理
由图9可知,进水SO42-浓度为(677.40± 11.11)mg/L,经过底部污泥层后在取样口2处测得SO42-浓度为(701.53±14.43) mg/L,这可能与反应器进水桶未进行除氧,进水中携带少量的溶解氧(进水DO约8mg/L)导致不断有DO进入和产生导致底部厌氧微生物死亡释放有机碳(TOC)和SO42-有关.经过上部污泥层,取样口4处SO42-的浓度为(681.03± 16.55) mg/L,SO42-的平均去除量约20.50mg/L,然而反应器进出水SO42-浓度变化不大.由图5可知在A1、A2中检测到的SRB菌属unclassifiedunclassified、可以利用有机物将SO42-还原为S2-.在无机条件运行的反应器中检测到SRB菌,这可能是因为反应器底部厌氧微生物受DO影响,不断衰亡释放有机物.同时受水力冲击影响,污泥上浮裂解释放有机物,导致反应器上部也存在少量的SRB菌.在反应器运行的300~330d,反应器内TOC浓度在3mg/L左右.图10b表明,污泥发生了细胞自溶现象[35].同时在A1、A2中检测到大量的菌属,种泥A0中菌属的丰度为0.01%,A1中的丰度为17.06%,A2中的丰度为 13.27%.菌属是最为广泛报道的SADN菌属,它具有将脱氮与硫化合物氧化耦合的能力,可利用还原态硫素与NO3--N、NO2--N反应生成N2[36].由图6可知A1中SRB菌活性为5.6mg SO42-/ (gVSS·d),SADN菌活性为9.16mg NO3--N/(gVSS·d); A2中SRB菌活性为6.6mg SO42-/(gVSS·d), SADN菌活性为6.33m mg NO3--N/(gVSS·d).在反应器内取样口3处检测到S2-的生成,但在出水处未检测到S2-.说明在反应器内发生了硫酸盐还原和硫自养反硝化反应.

图9 反应器不同取样口SO42-、S2-浓度变化

a、b:第 Ⅵ 阶段反应器上部、底部污泥SEM图;c:污泥硫元素含量
由图10a、c可知, 在反应器上部污泥中发现了S0的产生,S元素所占质量百分比从1.11%增加到2.22%.而反应器底部污泥中S元素所占质量百分比基本没有出现变化.有文献报道硫化物的氧化通常分为两个步骤进行[37]:首先,硫化物被氧化成中间产物S0;在NO3--N足够的情况下,S0会进一步被氧化成SO42-.研究证明,S0被氧化成SO42-的速度要比硫化物被氧化成S0的速度慢很多,利用S0的反硝化速率比利用硫化物时要低一个数量级[38].这说明了在反应器底部出现了SO42-“循环过程”,在反应器上部出现了SO42-的去除.
2.4 反应器内N、S代谢的耦合作用
由图5和图6可知未检测到SRAO菌属及其活性,说明反应器内没有发生SRAO反应.
如图11所示,反应器底部由于进水自含外源性O2和兼性厌氧菌受到氧化应激产生H2O2而生成的内源性O2,两者共同存在的条件下会产生更多的O2,导致反应器内NH4+的去除量不断增加.同时O2在反应器底部污泥层被AOB菌消耗,从而为上部污泥层创造一个厌氧环境(ORP= -310.8mV、DO=0.14mg/ L),USB反应器不同高度污泥层中由于O2含量不同,导致在污泥床不同高度含氮化合物和含硫化合物的转化途径不同.在反应器底部污泥层,由于有内源性O2和外源性O2的存在,在颗粒污泥表面氨氧化菌利用O2将NH4+氧化成NO2-,在颗粒污泥内部厌氧氨氧化菌利用NH4+和NO2-生成N2和NO3-;同时,O2的存在使得反应器底部污泥层部分厌氧颗粒污泥裂解,产生少量SO42-和有机物,在颗粒污泥内部硫酸盐还原菌利用有机物将SO42-还原生成S2-;硫自养反硝化菌利用NO2-/NO3-将S2-重新氧化为SO42-.在反应器上部污泥层,由于只有少量H2O2产生的内源性O2的存在,少量NH4+被氧化为NO2-,AnAOB菌生成少量NO3-,SRB菌利用细胞死亡释放的有机物将SO42-还原为S2-,硫自养反硝化菌只能利用生成的少量NO2-/NO3-将S2-氧化为S0.并用Fe-SEM观察到S0的生成,反应器运行的第255~335d上部污泥中硫元素的含量从1.11%增加到2.22%.在USB反应器底部污泥层实现NH4+的去除和SO42-的循环,在上部污泥层实现SO42-的去除.

图11 反应器内NH4+去除途径及SO42-变化
3 结论
3.1 随着运行时间延长,USB反应器对无机废水中NH4+-N的去除量不断增加,而对SO42-的去除量却不变化.
3.2 反应器内NH4+-N的去除与反应器内随进水带入的微量氧及微生物代谢过程中H2O2的产生有关,DO浓度在反应器进水口处不断升高,NH4+-N的去除量逐渐增加,最高可达到40mg/L左右.
3.3 USB反应器内不同高度污泥层O2含量的不同导致不同高度污泥层的微生物菌群以及活性不同,反应器内N、S代谢是分层进行.TN的去除主要发生在反应器底部污泥层通过氨氧化、厌氧氨氧化、硫自养反硝化途径.SO42-的去除主要发生在反应器上部污泥层,硫酸盐还原菌以有机物为电子供体将SO42-还原为S2-,然后硫自养反硝化菌利用少量NO2--N/NO3--N将S2-氧化为S0,实现S0的积累和SO42-的去除.
[1] Vlaeminck S E, Terada A, Smets B F, et al. Nitrogen removal from digested black water by one-stage partial nitritation and anammox [J]. Environmental Science & Technology, 2009,43(13):5035-5041.
[2] Zehr J P, Ward B B. Nitrogen cycling in the ocean: New perspectives on processes and paradigms [J]. Applied and Environmental Microbiology, 2002,68(3):1015-1024.
[3] Van der Star W R L, Abma W R, Blommers D, et al. Startup of reactors for anoxic ammonium oxidation: experiences from the first full scale anammox reactor in Rotterdam [J]. Water Research, 2007, 41(18):4149-4163.
[4] Udert K M, Kind E, Teunissen M, et al. Effect of heterotrophic growth on nitritation/anammox in a single sequencing batch reactor [J]. Water Science and Technology, 2008,58(2):277-284.
[5] Yu J J, Jin R C. The ANAMMOX reactor under transient-state conditions: process stability with fluctuations of the nitrogen concentration, inflow rate, pH and sodium chloride addition [J]. Bioresource Technology, 2012,119:166-173.
[6] Liu S, Yang F, Zheng G, et al. Application of anaerobic ammonium- oxidizing consortium to achieve completely autotrophic ammonium and sulfate removal [J]. Bioresource Technology, 2008,99(15):6817-6825.
[7] 毕 贞,董石语,黄 勇.ANAMMOX培养物中硫酸盐型氨氧化生物转化机制[J]. 环境科学, 2021,42(3):1477-1487.
Bi Z, Dong S Y, Huang Y. Biological Conversion Mechanism of Sulfate Reduction Ammonium Oxidation in ANAMMOX Consortia [J]. Environmental Science, 2021,42(3):1477-1487.
[8] Fdz-Polanco F, Fdz-Polanco M, Fernandez N, et al. New process for simultaneous removal of nitrogen and sulphur under anaerobic conditions [J]. Water Research, 2001,35(4):1111-1114.
[9] Fdz-Polanco F, Fdz-Polanco M, Fernandez N, et al. Simultaneous organic nitrogen and sulfate removal in an anaerobic GAC fluidised bed reactor [J]. Water Science and Technology, 2001,44(4):15-22.
[10] 于振国.自养脱硫反硝化反应器微生物群落动态及功能菌群分析[D]. 哈尔滨:哈尔滨工业大学, 2007.
Yu Z G. The analysises of microbial community dynamics and functional groups in autotrophic denitrifying sulfide removal reactor [D]. Harbin: Harbin Institution of Technology, 2007.
[11] 王 洋.厌氧氨氧化污泥EPS功能解析及对氮,硫的耦合转化研究[D]. 西安:西安建筑科技大学, 2019.
Wang Y. Study on the oxidation of ammonium coupling with sulfur transformation and the function of EPS of anammox sludge [D]. Xi'an: Xi'an University of Architecture and Technology, 2019.
[12] Chen F, Li X, Yuan Y, et al. An efficient way to enhance the total nitrogen removal efficiency of the Anammox process by S0-based short-cut autotrophic denitrification [J]. Journal of Environmental Sciences, 2019,81:214-224.
[13] 周 健,黄 勇,刘 忻,等.硫自养反硝化耦合厌氧氨氧化脱氮条件控制研究[J]. 环境科学, 2016,37(3):1061-1069.
Zhou J, Huang Y, Liu X, et al. Element Sulfur Autotrophic Denitrification Combined Anaerobic Ammonia Oxidation [J]. Environmental Science, 2016,37(3):1061-1069.
[14] Fajardo C, Mosquera-Corral A, Campos J L, et al. Autotrophic denitrification with sulphide in a sequencing batch reactor [J]. Journal of Environmental Management, 2012,113:552-556.
[15] 袁林杰,袁林江,陈 希,等.厌氧氨氧化UASB系统对氨氮的超量去除机制研究[J]. 中国环境科学, 2021,41(10):4686-4694.
Yuan L J, Yuan L J, Chen X, et al. Mechanism of excessive removal of ammonia nitrogen by anammox UASB system [J]. China Environmental Science, 2021,41(10):4686-4694.
[16] Sabumon P C. Anaerobic ammonia removal in presence of organic matter: a novel route [J]. Journal of Hazardous Materials, 2007,149(1):49-59.
[17] Fu H, Yuan J, Gao H. Microbial oxidative stress response: novel insights from environmental facultative anaerobic bacteria [J]. Archives of Biochemistry and Biophysics, 2015,584:28-35.
[18] 于丽萍,王 茹,袁林江,等.Anammox的硫酸盐利用特性及脱氮性能[J]. 中国给水排水, 2021,37(15):1-7.
Yu L P, Wang R, Yuan L J, et al. Sulfate Utilization Characteristics and Denitrification Performance of Anammox Process [J]. China Water and Wastewater, 2021,37(15):1-7.
[19] 牛晚霞,袁林江,有小龙,等.进水亚硝氮限制下Anammox去除氨氮研究[J]. 中国环境科学, 2021,41(7):3212-3220.
Niu W X, Yuan L J, You X L, et al. Study on removal of ammonia nitrogen by Anammox with or free of nitrite nitrogen [J]. China Environmental Science, 2021,41(7):3212-3220.
[20] 国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2004.
State Environmental Protection Administration. Water and wastewater monitoring and analysis methods [M]. Beijing: China Environmental Science Press, 2004.
[21] Knowles R K H R . Production of nitrous oxide by Nitrosomonas europaea: Effects of acetylene, pH, and oxygen [J]. Canadian Journal of Microbiology, 1984,30(11):1397-1404.
[22] 王彬斌.颗粒态有机物及胞外聚合物对活性污泥结构和特性影响研究 [D]. 西安:西安建筑科技大学, 2014.
Wang B B. Effects of particulate organic matter and extracellular polymeric substances (EPS) on the structure and characteristics of activated sludge [D]. Xi'an: Xi'an University of Architecture and Technology, 2014.
[23] 赵良杰,彭党聪,吕 恺,等.一段式部分亚硝化-厌氧氨氧化工艺处理中低浓度模拟氨氮废水[J]. 环境工程学报, 2021,15(1):143-151.
Zhao L J, Peng D C, Lv K, et al. Treatment of simulated medium and low-strength ammonia wastewater by single-stage partial nitritation- anammox process [J]. Chinese Journal of Environmental Engineering, 2021,15(1):143-151.
[24] 郑照明,杨函青,马 静,等.SNAD反应器中颗粒污泥和絮体污泥脱氮特性[J]. 中国环境科学, 2015,35(10):2996-3002.
Zheng Z M, Yang H Q, Ma J, et al. The nitrogen removal performance of granules and flocs in SNAD reactor [J]. China Environmental Science, 2015,35(10):2996-3002.
[25] 王 辉,戴友芝,刘 川,等.混合硫酸盐还原菌代谢过程的影响因素[J]. 环境工程学报, 2012,6(6):1795-1800.
Wang H, Dai Y Z, Liu C, et al. Influencing factors on metabolism process of mixed sulfate-reducing bacteria [J]. Chinese Journal of Environmental Engineering, 2012,6(6):1795-1800.
[26] 马潇然,郑照明,卞 伟,等.硫自养反硝化系统运行效能和微生物群落结构研究[J]. 中国环境科学, 2020,40(10):4335-4341.
Ma X R, Zheng Z M, Bian W, et al. Study on operation efficiency and microbial community structure of sulfur-based autotrophic denitrification system [J]. China Environmental Science, 2020,40(10): 4335-4341.
[27] 杨兰芳,曾 巧,李海波,等.紫外分光光度法测定土壤过氧化氢酶活性[J]. 土壤通报, 2011,42(1):207-210.
Yang L F, Zeng Q, Li H B, et al. Measurement of catalase activity in soil by ultraviolet spectrophotometry [J]. Chinese Journal of Soil Science, 2011,42(1):207-210.
[28] 赖杨岚,周少奇.硫酸盐型厌氧氨氧化反应器的启动特征分析[J]. 中国给水排水, 2010,26(15):41-44.
Lai Y L, Zhou S Q. Start-up characteristics of sulfate-dependent anaerobic ammonium oxidation reactor [J]. China Water and Wastewater, 2010,26(15):41-44.
[29] Prachakittikul P, Wantawin C, Noophan P, et al. ANAMMOX-like performances for nitrogen removal from ammonium-sulfate-rich wastewater in an anaerobic sequencing batch reactor [J]. Journal of Environmental Science and Health, Part A, 2016,51(3):220-228.
[30] Koops H P, Stehr G. Classification of eight new species of ammonia-oxidizing bacteria: Nitrosomonas communis sp. nov., Nitrosomonas ureae sp. nov., Nitrosomonas aestuarii sp. nov., Nitrosomonas marina sp. nov., Nitrosomonas nitrosa sp. nov., Nitrosomonas eutropha sp. nov., Nitrosomonas oligotropha sp. nov. and Nitrosomonas halophila sp. nov [J]. Microbiology, 1991,137(7): 1689-1699.
[31] Miao Y , Peng Y , Liang Z , et al. Partial nitrification-anammox (PNA) treating sewage with intermittent aeration mode: Effect of influent C/N ratios [J]. Chemical Engineering Journal, 2018,334:664-672.
[32] Lu H, Zheng P, Ji Q, et al. The structure, density and settlability of anammox granular sludge in high-rate reactors [J]. Bioresource Technology, 2012,123:312-317.
[33] 许冬冬,康 达,郭磊艳,等.厌氧氨氧化颗粒污泥研究进展[J]. 微生物学通报, 2019,46(8):1653-1665.
Xu D D, Kang D, Guo L Y, et al. Research progress on Anammox granular sludge [J]. Microbiology China, 2019,46(8):1653-1665.
[34] Cho S, Fujii N, Lee T, et al. Development of a simultaneous partial nitrification and anaerobic ammonia oxidation process in a single reactor [J]. Bioresource Technology, 2011,102(2):652-659.
[35] Cao S, Du R, Li B, et al. High-throughput profiling of microbial community structures in an ANAMMOX-UASB reactor treating high-strength wastewater [J]. Applied Microbiology and Biotechnology, 2016,100(14):6457-6467.
[36] Kelly D P, Wood A P. Confirmation of Thiobacillus denitrificans as a species of the genus Thiobacillus, in the beta-subclass of the Proteobacteria, with strain NCIMB 9548as the type strain [J]. International Journal of Systematic and Evolutionary Microbiology, 2000,50(2):547-550.
[37] Xu G, Yin F, Chen S, et al. Mathematical modeling of autotrophic denitrification (AD) process with sulphide as electron donor [J]. Water Research, 2016,91:225-234.
[38] Liu Y , Lai P , Ngo H H , et al. Evaluation of nitrous oxide emission from sulfide and sulfur-based autotrophic denitrification processes. [J]. Environmental Science & Technology, 2016,50(17):9407.
Mechanisms of biological conversion and removal of nitrogen and sulfur from the inorganic influent in Upflow Sludge Bed Reactor.
ZHU Miao, YUAN Lin-jiang*, NIU Ze-dong, ZHOU Xu-hong, HE Xiang-feng, ZHONG Bing-bing
(Key Laboratory of Environmental Engineering of Shaanxi Province, Key Laboratory of Northwest Water Resources and Environmental Ecology, Ministry of Education, School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055, China)., 2022,42(9):4174~4182
The inorganic wastewater containing ammonium and sulfate was used as influent of upflow sludge bed (USB) reactor, and the removal of ammonium and sulfate and the transformation of nitrogen and sulfur elements in the sludge layers with different heights were studied. The results show that at the inlet of the reactor, the influent water contained dissolved oxygen (exogenous oxygen) and facultative anaerobes subjected to oxidative stress to produce hydrogen peroxide (endogenous oxygen). In the coexistence of two kinds of "oxygen", the biological deamination amount (calculated as nitrogen) in the reactor was up to about 40mg/L, and the conversion pathways of nitrogen-containing compounds and sulfur-containing compounds in the sludge layer varied with the position (height) of the USB reactor. In the sludge layer at the bottom of the reactor, ammonia oxidizing bacteria on the surface of granular sludge used molecule oxygen to oxidize ammonium to nitrite, and anaerobic ammonia oxidizing bacteria inside the granular sludge used ammonium and nitrite to generate nitrogen gas and nitrate; at the same time, the presence of oxygen made the anaerobic granular sludge in the sludge layer at the bottom of the reactor be cracked and produced a small amount of organic matter; the sulfate-reducing bacteria in the granular sludge use organic matter to reduce sulfateto form sulfide ion; and sulfur autotrophic denitrifying bacteria utilize nitrite/nitrate to re-oxidize sulfide to sulfate. In the upper sludge layer of the reactor, due to the existence of only a small amount of endogenous oxygen, the sulfur autotrophic denitrifying bacteria could only use a small amount of nitrite/nitrateto oxidize sulfide to sulfur element. The removal of ammonium and the circulation of sulfatewere realized in the sludge layer at the bottom of the USB reactor, and the removal of sulfatewas achieved in the upper sludge layer.
upflow sludge bed;anammox;sulfur autotrophic denitrification;nitrogen and sulfur removal
X703
A
1000-6923(2022)09-4174-09
2022-02-09
国家自然科学基金资助项目(51878538)
*责任作者, 教授, yuanlinjiang@xauat.edu.cn
朱 淼(1997-),女,陕西西安人,西安建筑科技大学硕士研究生,主要从事城市污水处理理论与技术.

