石斛属植物抗糖尿病本草学、物质基础及作用机制研究进展
周忠瑜,蒲婷婷,张 蕾,王 婧, ,徐志超,刘颖琳*,段宝忠*
石斛属植物抗糖尿病本草学、物质基础及作用机制研究进展
周忠瑜1,蒲婷婷1,张 蕾2,王 婧1, 3,徐志超3,刘颖琳1*,段宝忠1*
1. 大理大学药学院,云南 大理 671000 2. 大理州种子管理站,云南 大理 671000 3. 东北林业大学生命科学院,黑龙江 哈尔滨 150040
石斛属Sw.隶属于兰科,该属多数植物的新鲜或干燥茎均作为中药石斛使用,民间用于“热病伤津,口干烦渴”等证,临床广泛用于糖尿病及其并发症治疗。随着研究的深入,石斛属植物抗糖尿病的物质基础及作用机制不断被揭示。在梳理古代本草和现代文献的基础上,对近年来国内外石斛属植物抗糖尿病的本草学、物质基础及其作用机制的研究进行综述。结果显示,石斛属植物具有良好的降血糖活性,在抗糖尿病药物及功能食品研发方面具有极大的开发潜力。尽管已有学者对石斛属植物抗糖尿病药效和物质基础开展了相关研究,但所关注的物种较为分散,且缺乏临床证据支撑,今后应进一步基于古代本草、民间经验和临床应用,选择抗糖尿病药效显著的物种,从物质基础和作用机制等多角度深入展开研究,尤其是新作用靶点、新机制的关注,对抗糖尿病药物的研发和石斛属植物的开发利用具有重要的意义。
石斛属;抗糖尿病;本草学;物质基础;作用机制
糖尿病已成为世界性公共卫生问题,严重危害人类健康[1],虽然降糖化学药能有效控制高血糖,但不良反应严重,如治疗糖尿病的一线药物磺酰脲类、双胍类毒副作用大,用药时间长容易引起低血糖、乳酸性酸中毒、腹胀、腹泻等不良反应[2],而天然药物因其较小的不良反应受到人们的青睐,其在防治糖尿病及其并发症的研究受到医药界普遍关注,从天然药物中开发新型、高效、低毒药物已成为生物医药领域研究的热点[3-4]。石斛属Sw.隶属于兰科,该属多个物种是中药石斛的基原植物,石斛始载于《神农本草经》,被列为上品[5],有“九大仙草”的美誉,具有益胃生津,滋阴清热功效[6],在历代本草中多有用于“消渴症”的记载,也是抗糖尿病中成药清胃消渴胶囊、石斛夜光丸等成药的重要原料。目前,已有多位学者研究表明,石斛属植物主要含有生物碱、多糖、联苄、菲类等化学成分,具有免疫调节、抗肿瘤、抗炎、抗糖尿病等多种生物活性[7-9],但对该属植物抗糖尿病的物质基础和作用机制,尚停留在对单个物种或某个化合物的认识,缺乏系统整理和分析,限制了石斛属植物资源在抗糖尿病药物开发和利用方面的认识。鉴于此,本文基于古代本草和现代研究资料,从石斛属植物抗糖尿病的本草考证、物质基础和作用机制等方面进行系统梳理,并分析了存在问题,以期为该属植物资源的深入研究和开发利用提供科学参考。
1 石斛属植物治疗糖尿病的本草学研究
1.1 历代本草对石斛治疗糖尿病的论述
糖尿病在中医学上又称消渴症,治疗常辨“三消”施治,即口渴多饮为上消;胃火炙盛、消谷善饥为中消;肾不摄水、小便频数为下消。在历代本草中,东汉《神农本草经》[5]记载:“石斛,……,除痹下气,补五脏,虚劳赢瘦”;魏晋《名医别录》[10]载:“益精补内绝不足,平胃气,一名禁生,一名杜兰,一名石蓫”,据赵菊润等[11]考证上述“禁生,杜兰,石蓫”均为石斛属植物;宋《鸡峰普济方》[12]载:“大石斛丸补肝脏,益精髓”;清汪昂《本草备要》[13]载“石斛养胃圣药,鲜者性更凉,润燥生津”。可见,上述本草虽未明确记载石斛属植物用于消渴症,但记载石斛“补五脏,虚劳羸瘦”,恰是针对消渴症的根本[14],“益精补内绝不足”“益精髓”“润燥生津”,表明石斛既滋补阴液之不足,又滋阴润燥以清热,可谓标本兼顾。此后,明张介宾《景岳全书》[15]载:“石斛,此药有二种,……,形如钗股者,颇有苦味,……,其性轻清和缓,有从容分解之妙,故能退火养阴,除烦清肺下气,亦止消渴热汗”;清《本草纲目拾遗》[16]载:“霍石斛,彼土人以代茶茗,云极解暑醒脾,止渴利水,益人气力”;《得配本草》[17]记载“石斛,入足太阴、少阴,……,兼入足阳明经。清肾中浮火而摄元气,除胃中虚热而止烦渴”;《本草再新》[18]补载“石斛,理胃气,清胃火,除心中烦渴,疗经肾虚热”;《中药大辞典》[19]记载:“石斛,生津益胃,清热养阴。用于热病伤津,口干烦渴,病后虚热,阴伤目暗”;历版中国药典记载石斛“益胃生津,滋阴清热,用于热病津伤,口干烦渴,胃阴不足,食少干呕,病后虚热不退,阴虚火旺,骨蒸劳热,目暗不明,筋骨萎软”症[6]。因此,从历代本草记载来看,石斛属植物治疗糖尿病是有实践依据的。
1.2 石斛治疗糖尿病的应用考证
历代本草著作均有记载将石斛用于消渴症的治疗,如《证治准绳·杂病》中将石斛与麦冬、生地黄、黄芪等配伍,治虚热烦闷,泄精等下消之症[20];“消渴饮”中将石斛与白术、茵陈、桂枝等配伍,用于治疗阴虚湿热型消渴[21];“茯神煮散”中石斛用到八两,治虚热,四肢羸乏,渴热不止[22];历版《中国药典》记载成药“石斛夜光丸”用于糖尿病视网膜病变及糖尿病性白内障;《新药转正标准》中以石斛为主要处方的天芪降糖胶囊具益气养阴,清热生津功效,用于2型糖尿病气阴两虚证[23]。近代的名老中医也多用石斛治疗消渴、虚劳、病后虚热等症,如京城四大名医的施今墨老先生创立养阴生津法,用鲜石斛和生地黄等配伍治疗上焦型糖尿病[24];王升贵[25]将霍山石斛口服液用于糖尿病的治疗,发现降血糖效果显著。除此之外,还有多个含石斛并运用于临床的处方,如石斛清胃方,用于胃热津伤、脾气虚弱、不欲饮食、口干作渴等症;石斛滋阴生津方联合消渴丸可有效缓解2型糖尿病患者临床症状,改善血糖水平[26];复方石斛消渴饮的降血糖及调血脂作用明显,可有效缓解糖尿病所致肾损伤[27-28]。从上述记载来看,石斛属植物在糖尿病的治疗中广泛应用。
1.3 石斛治疗糖尿病的石斛属植物资源
石斛属多种植物在民间及众多文献中记载用于糖尿病的治疗,见表1。可以看出,金钗石斛Lindl.,铁皮石斛Kimura et Migo,细茎石斛(L.) Sw.等12种石斛属植物在藏、傣等民族中均有用于糖尿病治疗的记载[28-30],其中金钗石斛在傣、纳西、阿昌、德昂和景颇药中记载用于热病伤津、口干烦渴、病后虚热等证;铁皮石斛在拉祜族中记载为“黑节草”,其全草用于治疗热病伤津、口干烦渴、病后虚热、阳痿、夜汗等症;细茎石斛在傈僳族药中记载为“四补堵”,其茎用于治疗治热病伤津、口干烦渴、病后虚热、阴伤目暗等症;此外,现代药理学研究也证实金钗石斛、铁皮石斛、细茎石斛等具有抗糖尿病作用[31]。
表1 抗糖尿病石斛属植物资源
Table 1 Plant resources of Dendrobiumwith anti-diabetic activity
编号中文名及拉丁名药用部位功能主治记载使用民族文献 1兜唇石斛D. cucullatum茎热病生津、烦渴、病后虚弱、阴伤目暗傣29 2密花石斛D. densiflorum全草感冒、黄疸型肝炎、热病烦渴、肺病咳嗽瑶30 3鼓槌石斛D.chrysotoxum茎病后虚热、口干烦渴、肿痛傣32 4叠鞘石斛D. denneanum茎热病伤津、口干烦渴、病后虚弱傣33 5串珠石斛D. falconeri茎滋阴消热、养胃生津傈僳34 6流苏石斛D. fimbriatum茎滋阴清热、养胃生津傈僳34 7细叶石斛D. hancockii茎热病伤津、喉咙肿痛、上消渴羌35 8铁皮石斛D. officinale全草热病伤津、口干烦渴、病后虚热、阳痿、夜汗及消耗性诸症拉祜36 9报春石斛D. polyanthum茎水塔不足引起的口干烦渴、水火烫伤、湿疹瘙痒傣37 10黑毛石斛D. williamsonii茎热高伤阴、口干烦渴、产后虚热白38 11细茎石斛D. moniliforme茎热病伤津、口干烦渴、病后虚热、阴伤目暗傈僳34 全草热病伤津、口干烦渴、外伤出血苗39 茎呕吐症、解渴、培根热病藏40 全草热病伤津、口干烦渴、病后虚热、干咳无痰土家41 12金钗石斛D. nobile全草、茎热病伤津、口干烦渴、病后虚热阿昌、德昂、景颇、傣、纳西38, 42 茎热病伤津、口干烦渴苗43 茎呕吐症、解渴、培根热病藏28
2 石斛属植物抗糖尿病的物质基础
2.1 多糖类成分
多糖是石斛属植物中一类重要的化学成分。目前,石斛属植物多糖抗糖尿病活性成分的研究主要集中于总多糖,多位学者对石斛属植物总多糖的抗糖尿病相关活性进行了研究[44-46],而均一组分多糖的研究报道较少,仅见铁皮石斛和金钗石斛多糖的结构、抗糖尿病及其并发症的效应方面研究[47-49],见表2。
2.2 生物碱类成分
生物碱类成分在石斛属植物中广泛存在,是该属植物重要的生理活性成分,具有抗炎、抗肿瘤、降血糖、调血脂等生物活性。目前已从金钗石斛、束花石斛Wall. ex Lindl.和玫瑰石斛Lindl. ex Paxt. 等19种石斛属植物中,分离获得52个生物碱类成分[50]。但目前石斛属植物生物碱抗糖尿病活性成分的研究主要集中于总生物碱,在单体生物碱的研究方面报道较少,仅见对金钗石斛分离获得的石斛碱dendrobine(1)的报道[51],其化学结构见表3和图1。
2.3 酚类成分
酚类成分包括菲类及其衍生物、联苄及其衍生物、芴酮类等,为石斛属植物的特征性成分[52]。近年来,酚类化合物被发现具有抗氧化、抗癌、抗糖尿病等多种药理活性[7, 53]。已有报道从铁皮石斛、金钗石斛和美花石斛等中分离得到17个具有抗糖尿病药效活性的酚类单体化合物(2~18),详细信息见表3和图1。
2.4 其他
石斛属植物中还报道含有萜类、氨基酸、香豆素、鞣质、甾醇、微量元素等多种成分[9],但未见上述成分抗糖尿病活性的相关研究。
3 抗糖尿病及其并发症药效及作用机制
3.1 调节糖代谢
高血糖是糖尿病及并发症患者最主要的临床表现[49]。近年来,多位学者研究证实金钗石斛、鼓槌石斛、美花石斛等植物可有效降低糖尿病小鼠模型的血糖水平,其可能机制包括促进肝糖原的合成,抑制肝糖原的分解;抑制糖异生,促进糖酵解,加速糖的氧化利用;以及抑制α-糖苷酶,减少糖的吸收等。如李菲等[58]、吴昊姝等[59]研究发现,金钗石斛和铁皮石斛可抑制肝糖原分解,促进肝糖原合成,提高外周组织对葡萄糖的摄取和利用,对维持机体血糖平稳具有重要作用;其次,铁皮石斛、霍山石斛及石斛合剂可抑制糖异生途径的关键酶磷酸烯醇丙酮酸羧化激酶(phosphoenolpyruvate carboxykinase,PEPCK)、葡萄糖-6-磷酸酶(glucose-6- phosphatase,G-6-pase)等的表达,进而降低血糖水平[60];此外,研究发现美花石斛、细茎石斛、华石斛和高山石斛中所含的酚类化合物,具有抑制α-糖苷酶、α-淀粉酶、蛋白酪氨酸磷酸酯酶的活性,可水解小肠内多糖,延缓糖尿病的发展速度[31, 54, 56]。详见表4。
表2 石斛属植物中分离得到的抗糖尿病均一多糖
Table 2 Homogeneous polysaccharide with anti-diabetic active isolated from genus Dendrobium
植物组分名称相对分子质量单糖组成(物质的量比)结构信息文献 金钗石斛DNP-W1A(1)2.4×104Man∶Glu∶Gal(5.4∶1.6∶1.0)主链由“α-(1→6)-linked Manp和α-(1→3)-linked Manp”组成,Glcp和Galp残基支链分别通过“α-(1→6)-linked Manp”的3位和2位连接在主链上48 DNP-W1B(2)7.7×105Glu∶Ara∶Gal(6.2∶3.1∶0.9)主链为“→4)-β-Glcp-(1→6)-β-Glcp-(1→”在“β-(1→6)-linked Glcp”的4位形成分支,支链由Galp和Arap残基组成 DNP-W2(3)1.8×104Glu∶Man∶Gal(6.1∶2.9∶2.0)主链由“β-(1→4)-linked Glcp、β-(1→6)-linked Glcp及β-(1→4)-linked Manp”组成,其中部分“β-(1→4)-linked Glcp及β-(1→4)-linked Manp”的6位连接有末端Galp DNP-W3(4)7.1×105Ara∶Rha∶Gal(1.0∶1.1∶3.1)主链由“β-(1→3)-linked Galp”组成,在其4位连接Arap和Rhap残基支链 DNP-W4(5)5.0×105Man∶Glu∶Gal∶Xyl∶Rha∶Gal A(1.0∶4.9∶2.5∶0.5∶1.0∶0.9)主链由“β-(1→4)-Glcp、β-(1→6)-linked Glcp、β-(1→6)-linked Galp”组成的酸性杂多糖 DNP-W5(6)4.6×105Rha∶Gal A∶Gal∶Glu∶ Man∶Xyl R(1.0∶4.9∶2.5∶0.5∶1.0∶ 0.9主链由“→4)-α-GalAp-(1→2)-α-Rhap-(1→”二糖重复单位构成,主链GalAp的3位和Rha的4位存在分支,侧链包括Gal区域和葡萄Man区域和木糖链 DNP-W6(7)6.6×105Man∶Glu∶Gal∶Rha∶Gal A(0.6∶1.0∶1.5∶1.0∶1.1)主链为“→4)-α-GalAp-(1→2)-α-Rhap-(1→”主链Rhap的4位存在分支,支链区包括Gal区域和Man区域 铁皮石斛DOP1(8)−Ara∶Gal∶Glu∶Man(3.5∶ 1.2∶1.5∶1.0)−49 DOP2(9)−Xyl∶Gal∶Glu(7∶1∶2)− DOP3(10)−Ara∶Rha∶Glu∶Man(7∶1∶2∶1)− DOP4(11)−Ara∶Glu∶Man(7∶1∶2)−
Man-甘露糖 Glu-葡萄糖 Gal-半乳糖 Ara-阿拉伯糖 Rha-鼠李糖 Xyl-木糖
an-mannose Glu-glucose Gal-galactose Ara-arabinose Rha-rhamnose Xyl-xylose
表3 石斛属植物中分离到的抗糖尿病活性单体化合物
Table 3 Monomeric compounds with anti-diabetic active isolated from genus Dendrobium
结构类型植物来源化合物名称及编号文献 生物碱金钗石斛石斛碱 dendrobine (1)51 酚类美花石斛loddigesiinol G (2)、loddigesiinol H (3)、loddigesiinol I (4)、loddigesiinol J (5)、crepidatuol B (6)54 铁皮石斛3, 4-dihydroxy-4′,5-dimethoxybibenzyl (7)、dendrocandin U (8)、3, 4, 4′-trihydroxy-5-methoxybibenzyl (9)55 鼓槌石斛毛兰素 (10)31, 56 美花石斛、杯鞘石斛、金钗石斛tristin (11)31 密花石斛5-hydroxy-3-methoxy-flavone-7-O-[β-D-apiosyl-(1→6)]-β-D-glucoside (12)57 细茎石斛moniliformine (13)31 金钗石斛石斛酚(14)31 D. infundibulum山药素III (15)56 D. infundibulum、紫瓣石斛D. parishiidendrosinen B (16)56

图1 石斛属植物中分离到的抗糖尿病活性单体化合物结构
3.2 改善胰岛β细胞功能
胰岛素是目前发现的动物体内唯一可降血糖的激素[61],其可通过促进外周组织对葡萄糖的摄取和利用,抑制糖异生和肝糖原的分解,平衡糖和脂质代谢[49]。胰岛β细胞功能受损,会导致胰岛素分泌不足引发糖尿病[62]。目前认为抑制β细胞损伤和凋亡,并促进胰岛素分泌仍是改善机体对血糖水平控制的关键。研究发现,金钗石斛总生物碱可保护胰岛细胞形态和功能[63-64],降低血清甘油三酯(triglyceride,TG)、胆固醇(cholesterol,CHOL)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平,并改善脂质代谢[63];同时,可延缓db/db小鼠胰腺组织端粒长度缩短,调节端粒酶、端粒酶逆转录酶、端粒酶RNA基因(telomerase RNA gene,TERC)mRNA、端粒保护蛋白1(protection of telomeres 1,POT1)、端粒结合因子2(telomeric repeat factor 2,TRF2)的表达[65];亦有研究发现,石斛合剂可通过调控胰岛素受体(insulin receptor,InsR),进而影响其下游因子胰岛素受体底物1/2(insulin receptor substrates 1/2,IRS 1/2)和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)等信号因子,改善胰岛素抵抗现象[66]。详见表4。
3.3 增强抗氧化应激
氧化应激与糖尿病及其并发症的发生和发展密切相关[67],由于胰岛β细胞表达抗氧化酶的水平相对较低,容易受到活性氧和活性氮的攻击而受到损伤[68]。多位学者研究表明,石斛中所含的酚类及多糖化合物可提高机体超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽(glutathione,GSH)含量,并降低丙二醛(malondialdehyde,MDA)含量,改善β细胞功能障碍并减少凋亡[69-71];亦有研究显示,线叶石斛提取物可抑制多元醇通路的关键限速酶醛糖还原酶(aldose reductase,AR)表达,破坏多元醇途径,改善细胞缺氧损伤所致的糖尿病性白内障[72]。有研究人员[31, 73-75]研究显示铁皮石斛、金钗石斛和霍山石斛可下调诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)基因的表达,显著抑制一氧化氮合酶(no synthetase,NOS)的活性,减少一氧化氮(nitric oxide,NO)与糖基化终末产物(advanced glycation end products,AGEs)生成,进而促进机体防御氧化应激的能力,减轻氧化损伤;此外,张梅等[76]研究发现金钗石斛酚类化合物可抑制人视网膜微血管内皮细胞氧化应激反应,减少新生血管生成;其多糖可上调NADPH醌氧化还原酶1(NADPH-quinone oxidoreductase 1,NQO1)mRNA基因表达,抵抗高糖诱导下氧化应激损伤[77]。详见表4。
表4 石斛属植物抗糖尿病及并发症作用机制
Table 4 Mechanism of anti-diabetic and diabetes complications of Dendrobium plants
效应样品有效成分/组分实验模型DM类型/并发症检测指标/作用机制文献 动物/细胞造模方式给药方式给药剂量/持续时间 调节糖代谢金钗石斛多糖小鼠AD−80、160 mg·kg−1,7 d−抑制肝糖元分解;提高外周组织对葡萄糖的摄取和利用58 铁皮石斛多糖小鼠HFD+STZig100、200、400 mg·kg−1,28 d2下调cAMP-PKA表达,促进肝糖原合成,抑制肝糖原分解60 浸膏小鼠/大鼠AD、STZig500 mg·kg−1,3 d−抑制肝糖原分解,促进肝糖原合成59 多糖小鼠HFD+STZig100、200、400 mg·kg−1,28 d2下调G6Pase/PEPCK表达;促进肝糖原合成,抑制肝糖原降解60 铁皮石斛多糖小鼠HSD+HFD+STZig100、200、400 mg·kg−1,28 d2降低糖尿病模型小鼠的空腹血糖、提高血清胰岛素水平,促进肝糖原合成,抑制肝糖原分解以及肝糖异生46 霍山石斛多糖大鼠STZ−50、100 mg·kg−1,35 d 2上调IRS1-PI3K-Akt磷酸化;下调FoxO1/GSK3β磷酸化;抑制糖异生85 石斛合剂−大鼠HSD+HFD+STZig11.3 g·kg−1,84 d2上调InsR、p-PKB,p-FoxO1表达;下调FoxO1、PEPCK表达;抑制糖异生86 美花石斛生物碱db/db小鼠−po50 mg·kg−1,56 d2上调AMPK和Glut4表达87 酚类−−−−−抑制α-糖苷酶54 细茎石斛酚类−−−−−抑制α-糖苷酶、α-淀粉酶57 华石斛酚类−−−−−抑制α-糖苷酶、蛋白酪氨酸磷酸酯酶31 铁皮石斛酚类−−−−2抑制α-糖苷酶55 高山石斛酚类−−−−−抑制α-糖苷酶、胰脂肪酶56 石斛合剂−大鼠−ig12 g·kg−1,24 d2调节WNT/β-catenin信号通路,降低血清LDL、TG、CHOL,升高HDL88 改善胰岛β细胞功能金钗石斛总生物碱db/db小鼠−ig20、40、80 mg·kg−1,112 d2上调脂肪酸β氧化基因Acox1和Cpt1a,抗氧化基因MT-1和NQO1表达63 −−ig20 mg·kg−1,20 d妊娠期糖尿病抑制IL-1β、IL-6、IL-17和TNF-α分泌;增加胰岛素敏感性51 大鼠HSD+HFD+STZig20、40 mg·kg−1,28 d2增加GLP-1的含量;下调半胱天冬氨酸蛋白酶3表达64 KK-Ay小鼠HFDig10、20、40 mg·kg−1,10 d2上调胰岛素信号转导通路p-IR-Y1185/IRS-1/Glut4/IDE和抗氧化通路Cat/HO-1/NQO1/SOD1表达89 db/db小鼠−−20、40、80 mg·kg−1,119 d2上调端粒酶、端粒酶逆转录酶、TERC mRNA/POT1/TRF2表达;下调TRF1表达65 小鼠HSD+HFD+STZ−20、40、80 mg·kg−1,28 d2上调IRS-2 mRNA、IGF-1 mRNA表达90
续表4
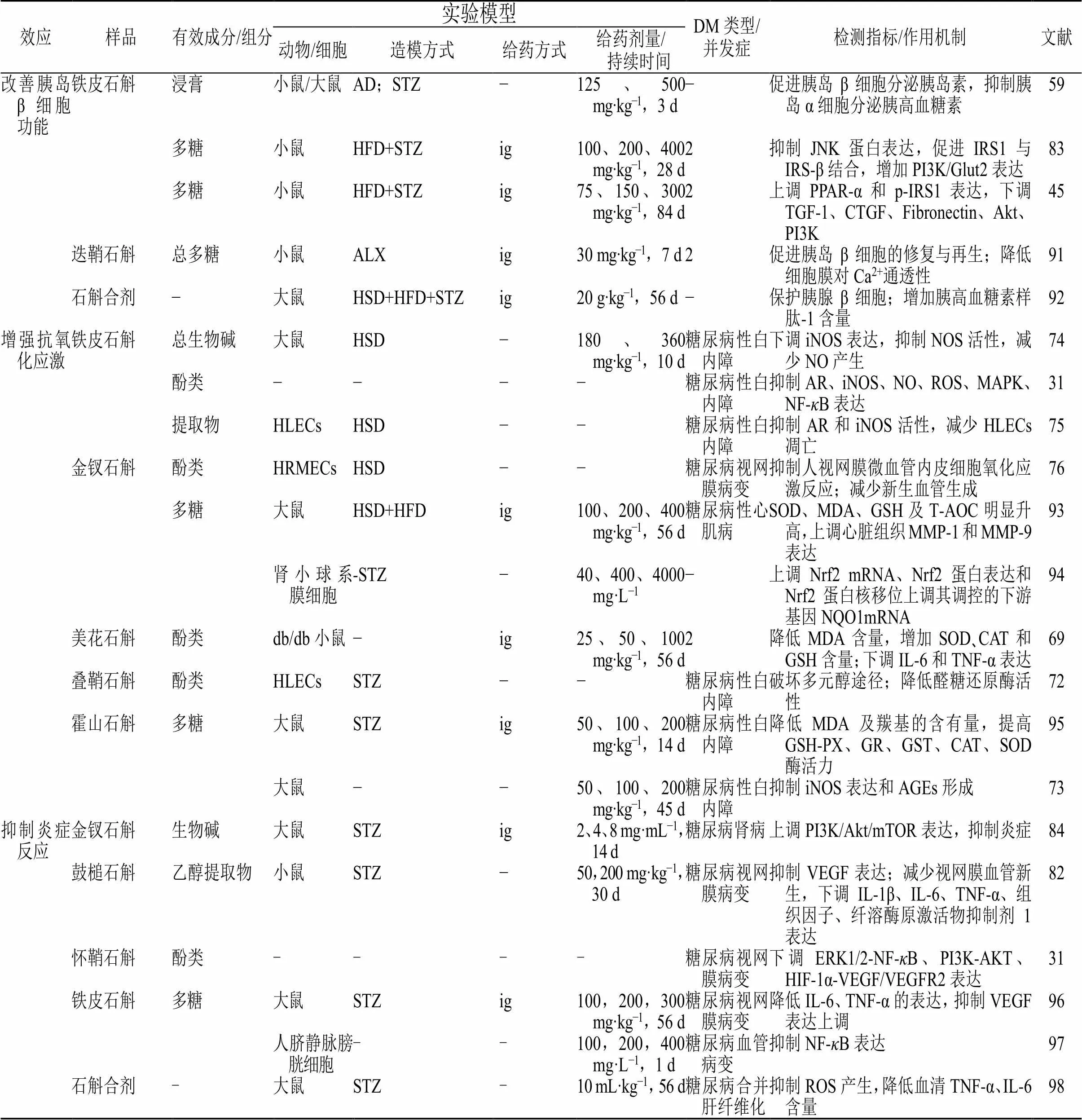
效应样品有效成分/组分实验模型DM类型/并发症检测指标/作用机制文献 动物/细胞造模方式给药方式给药剂量/ 持续时间 改善胰岛β细胞功能铁皮石斛浸膏小鼠/大鼠AD;STZ−125、500 mg·kg−1,3 d−促进胰岛β细胞分泌胰岛素,抑制胰岛α细胞分泌胰高血糖素59 多糖小鼠HFD+STZig100、200、400 mg·kg−1,28 d2抑制JNK蛋白表达,促进IRS1与IRS-β结合,增加PI3K/Glut2表达83 多糖小鼠HFD+STZig75、150、300 mg·kg−1,84 d2上调PPAR-α和p-IRS1表达,下调TGF-1、CTGF、Fibronectin、Akt、PI3K45 迭鞘石斛总多糖小鼠ALXig30 mg·kg−1,7 d2促进胰岛β细胞的修复与再生;降低细胞膜对Ca2+通透性91 石斛合剂−大鼠HSD+HFD+STZig20 g·kg−1,56 d−保护胰腺β细胞;增加胰高血糖素样肽-1含量92 增强抗氧化应激铁皮石斛总生物碱大鼠HSD−180、360 mg·kg−1,10 d糖尿病性白内障下调iNOS表达,抑制NOS活性,减少NO产生74 酚类−−−−糖尿病性白内障抑制AR、iNOS、NO、ROS、MAPK、NF-κB表达31 提取物HLECsHSD−−糖尿病性白内障抑制AR和iNOS活性,减少HLECs凋亡75 金钗石斛酚类HRMECsHSD−−糖尿病视网膜病变抑制人视网膜微血管内皮细胞氧化应激反应;减少新生血管生成76 多糖大鼠HSD+HFDig100、200、400 mg·kg−1,56 d糖尿病性心肌病SOD、MDA、GSH及T-AOC明显升高,上调心脏组织MMP-1和MMP-9表达93 肾小球系膜细胞-STZ−40、400、4000 mg·L−1−上调Nrf2 mRNA、Nrf2蛋白表达和Nrf2蛋白核移位上调其调控的下游基因NQO1mRNA94 美花石斛酚类db/db小鼠−ig25、50、100 mg·kg−1,56 d2降低MDA含量,增加SOD、CAT和GSH含量;下调IL-6和TNF-α表达69 叠鞘石斛酚类HLECsSTZ−−糖尿病性白内障破坏多元醇途径;降低醛糖还原酶活性72 霍山石斛多糖大鼠STZig50、100、200 mg·kg−1,14 d糖尿病性白内障降低MDA及羰基的含有量,提高GSH-PX、GR、GST、CAT、SOD酶活力95 大鼠−−50、100、200 mg·kg−1,45 d糖尿病性白内障抑制iNOS表达和AGEs形成73 抑制炎症反应金钗石斛生物碱大鼠STZig2、4、8 mg·mL−1,14 d 糖尿病肾病上调PI3K/Akt/mTOR表达,抑制炎症84 鼓槌石斛乙醇提取物小鼠STZ−50,200 mg·kg−1,30 d糖尿病视网膜病变抑制VEGF表达;减少视网膜血管新生,下调IL-1β、IL-6、TNF-α、组织因子、纤溶酶原激活物抑制剂1表达82 怀鞘石斛酚类----糖尿病视网膜病变下调ERK1/2-NF-κB、PI3K-AKT、HIF-1α-VEGF/VEGFR2表达31 铁皮石斛多糖大鼠STZig100,200,300 mg·kg−1,56 d糖尿病视网膜病变降低IL-6、TNF-α的表达,抑制VEGF表达上调96 人脐静脉膀胱细胞--100,200,400 mg·L−1,1 d糖尿病血管病变抑制NF-κB表达97 石斛合剂-大鼠STZ-10 mL·kg−1,56 d糖尿病合并肝纤维化抑制ROS产生,降低血清TNF-α、IL-6含量98
AD-肾上腺素 STZ-链脲佐菌素 HFD-高脂饮食 HSD-高糖饮食 ig-灌胃 po-口服 cAMP-环磷酸腺苷 PKA-蛋白激酶A FoxO1-叉头框转录因子O亚族1 GSK3β-糖原合成酶激酶3β Glut-葡萄糖转运蛋白 AMPK-单磷酸腺苷激活的蛋白激酶 HDL-低密度脂蛋白胆固醇 ALX-四氧嘧啶 VEGF-血管内皮生长因子 Nrf2-核转录因子E2相关因子2 IDE-胰岛素降解酶 MAPK-丝裂原活化蛋白激酶 HLECs-人淋巴管内皮细胞 HRMECs-人视网膜微血管内皮细胞 HO-1-血红素氧合酶1 ERK-细胞外信号调节激酶 HIF-1α-缺氧诱导因子-1 GR-谷胱甘肽还原酶 GST-谷胱甘肽巯基转移酶 MMP-基质金属蛋白酶 IGF-1-胰岛素样生长因子 JNK-氨基末端激酶 Acox1-酰基辅酶A氧化酶1 Cpt1a-肉毒碱棕榈酰转移酶1a MT-金属硫蛋白 IR-胰岛素抵抗 PPAR-α-过氧化物酶体增殖物激活受体-α TGF-转化生长因子 CTGF-结缔组织生长因子 GLP-胰高血糖素样肽
AD-adrenaline STZ-streptozocin HFD-high fat diet HSD-high sugar diet ig-intragastric po-peros cAMP-cyclic adenosine monophosphate PKA-protein kinase A FoxO1-forkhead box transcription factor O1 GSK3β-recombinant glycogen synthase kinase 3β Glut-glucose transporter AMPK-adenosine monophosphate protein kinase HDL-high-density lipoprotein cholesterol ALX-alloxan VEGF-vascular endothelial growth factor Nrf2-nuclear factor erythroid 2 related factor 2 IDE-insulin-degrading enzyme MAPK-mitogen-activated protein kinases HLECs-human lymphatic endothelial cells HRMECs-human retinal microvascular endothelial cells HO-1-heme oxygenase 1 ERK-extracellular regulated protein kinases HIF-1α-hypoxia-inducible factor 1-α GR-gluathione reductase GST-glutathione S-transferase MMP-matrix metalloproteinase IGF-1-insulin like growth factor 1 JNK-jun n-terminal kinases Acox1-acyl-CoA oxidase 1 Cpt1a-carnitine palmitoyl transferase 1a MT-metallothionein IR-insulin resistance PPAR-α-peroxiisome proliferator-activated receptor-α TGF-transforming growth factor CTGF-connective tissue growth factor GLP-glucagon-like peptide
3.4 抑制炎症反应
糖尿病及其并发症的发生发展,常伴随炎症因子水平的显著升高[78]。多项研究证实,2型糖尿病是一种炎症性疾病,炎症因子通过多种途径影响机体葡萄糖转运及胰岛素分泌[79-80],抗炎治疗可以改善糖尿病患者的异常糖代谢[81]。近年来,余增洋等[82]、税维智等[83]研究发现,铁皮石斛和鼓槌石斛提取物,以及石斛合剂可有效下调白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)、核因子-B(nuclear factor-B,NF-B)、和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子的过量表达;樊小宝等[84]研究显示金钗石斛中分离得到的石斛碱可上调PI3K/蛋白激酶B(protein kinase B,PKB)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,调控氧化应激、炎性反应、细胞凋亡等生理病理过程,减轻糖尿病肾病大鼠足细胞功能障碍,改善其临床症状。详见表4。
4 结语与展望
糖尿病是人类三大致死疾病之一,其治疗仍然是世界性难题,患者需注射外源性胰岛素或口服降血糖药物,长期使用对身体造成极大伤害[99]。从历代本草、民间经验、临床应用和药用记载来看,石斛属植物多为“药食同源”,来源于天然,不良反应小[100],该属多个物种被作为中药或民族药用于糖尿病(消渴症)的治疗。从已有研究来看,石斛属植物抗糖尿病药效活性较好,其物质基础主要为多糖、生物碱和酚类成分,但目前的相关研究主要集中于总多糖、总生物碱等成分,对于石斛属植物中单体化合物的相关研究还较为薄弱,且缺乏系统性,亟待深入;从抗糖尿病作用机制看,呈现多途径、多通路的特点,主要通过调节糖代谢、改善胰岛β细胞功能、增强抗氧化应激和抑制炎症反应等多种途径,同时通过GLP-1/GLP-1R、PI3K/Akt/mTOR、IRS1-PI3K-Akt、FoxO1/GSK3β、G6Pase/PEPCK等多个通路发挥抗糖尿病活性;结合化合物和药效机制来看,石斛属植物中生物碱、多糖和酚类化合物的抗糖尿病作用机制既有交叉,又存在差异,推测这3类成分可产生协同作用。综上,石斛属植物具有良好的降血糖活性,对治疗糖尿病,尤其是2型糖尿病,应用潜力巨大,在抗糖尿病药品研发方面具有先天优势,但目前所关注的物种较为分散,且缺乏临床证据支撑,今后应进一步基于古代本草、民间经验和临床应用,选择抗糖尿病药效显著的物种,并从多角度、多层面对其物质基础和作用机制进行深入研究,尤其是对新作用靶点、新机制的关注。
利益冲突 所有作者均声明不存在利益冲突
[1] Forslund K, Hildebrand F, Nielsen T,. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota [J]., 2015, 528(7581): 262-266.
[2] Tzoulaki I, Molokhia M, Curcin V,. Risk of cardiovascular disease and all cause mortality among patients with type 2 diabetes prescribed oral antidiabetes drugs: Retrospective cohort study using UK general practice research database [J]., 2009, 339: b4731.
[3] 王文晓, 乐世俊, 刘娟, 等. 基于肠道菌群的中药改善胰岛素抵抗的作用机制研究进展 [J]. 中草药, 2020, 51(1): 216-228.
[4] Bojar D, Scheller L, Hamri G C E,. Caffeine-inducible gene switches controlling experimental diabetes [J]., 2018, 9(1): 2318.
[5] 魏·吴普等述. (清)·孙星衍(清)孙冯翼辑. 神农本草经 [M]. 北京: 科学技术文献出版社, 1996: 19.
[6] 中国药典[S]. 一部. 2020: 94.
[7] 王东晖, 范蓓, 孙晶, 等. 石斛属植物化学成分的研究进展 [J]. 中国食物与营养, 2019, 25(3): 12-18.
[8] 张雪琴, 赵庭梅, 刘静, 等. 石斛化学成分及药理作用研究进展 [J]. 中草药, 2018, 49(13): 3174-3182.
[9] 郁美娟, 孟庆华, 黄德音, 赵亚平. 石斛属植物有效成分及药理作用研究 [J]. 中成药, 2003, 25(11): 918-921.
[10] 梁·陶弘景集. 尚志钧辑校. 名医别录 [M]. 北京: 人民卫生出版社, 1986: 29.
[11] 赵菊润, 赵佳琛, 王艺涵, 等. 经典名方中石斛的本草考证[J]. 中国实验方剂学杂志, 2022, 28(10): 215-228.
[12] 宋·张锐. 鸡峰普济方 [M]. 上海: 上海科学技术出版社, 1987: 9.
[13] 清·汪昂. 本草备要 [M]. 北京: 中国医药科技出版社, 2019: 11.
[14] 袁海建, 林淑媛, 张光际, 等. 补阴中药治疗糖尿病及其并发症物质基础及机制研究新思路 [J]. 中国中药杂志, 2020, 45(3): 531-538.
[15] 明·张介宾. 景岳全书 [M]. 北京: 中国中医药出版社, 1994: 767.
[16] 清·赵学敏著. 闫志安,肖培新校注. 本草纲目拾遗2版 [M]. 北京: 中国中医药出版社, 2007: 71-72.
[17] 清·严西亭. 得配本草 [M]. 上海: 科技卫生出版社, 1958: 20.
[18] 叶天士. 本草再新[M]. 武昌: 羣学社, 1841: 13.
[19] 赵国平,戴慎,陈仁寿主编.南京中医药大学编著. 中药大辞典 2版 [M]. 上海: 上海科学技术出版社, 2006: 123.
[20] 明·王肯堂辑. 宋立人点校. 证治准绳-三-伤寒证治准绳 [M]. 北京: 人民卫生出版社, 2014: 1759.
[21] 李兆全. 2型糖尿病气阴两虚证采用中医消渴饮治疗的效果探讨[J]. 健康之友, 2020, 5(2): 152.
[22] 康小明. 茯神补虚汤合单行鬼箭汤加味治疗老年2型糖尿病66例 [J]. 陕西中医, 2007, 28(10): 1336-1337.
[23] 张文龙. 天芪降糖胶囊治疗2型糖尿病40例临床观察 [A] // 中华中医药学会糖尿病分会全国中医药糖尿病大会(第十九次)资料汇编 [C]. 合肥: 中华中医药学会糖尿病分会, 2018.
[24] 李德珍. 施今墨治疗糖尿病探析 [J]. 中医杂志, 2001, 42(5): 261-262.
[25] 王升贵, 马荣锋, 张东东, 等. 霍山石斛口服液降血糖作用临床观察 [J]. 亚太传统医药, 2020, 16(3): 149-154.
[26] 龙太荣. 石斛滋阴生津方联合消渴丸治疗2型糖尿病临床疗效观察 [J]. 中国处方药, 2021, 19(7): 150-152.
[27] 姚淑琼, 李志华, 蒋梅香, 等. 石斛消渴饮对糖尿病肾病大鼠肾脏保护作用的研究 [J]. 山东化工, 2021, 50(5): 23-24.
[28] 贾敏如, 李星炜. 中国民族药志要 [M]. 北京: 中国医药科技出版社, 2005: 216-217.
[29] 崔箭, 唐丽. 中国少数民族传统医学概论 [M]. 修订版. 北京: 中央民族大学出版社, 2016: 417.
[30] 黄燮才. 广西民族药简编 [M]. 南宁: 广西壮族自治区卫生局药品检验所, 1980: 327.
[31] He L, Su Q, Bai L,. Recent research progress on natural small molecule bibenzyls and its derivatives inspecies [J]., 2020, 204: 112530.
[32] 段宝忠. 傣药志 [M]. 昆明: 云南科技出版社, 2018: 518-519.
[33] 云南省地方志编纂委员会总纂. 云南省人大常委会办公厅编纂. 云南省志-卷七十-民族志 [M]. 昆明: 云南人民出版社, 2003: 961.
[34] 云南省怒江傈僳族自治州卫生局. 怒江中草药 [M]. 昆明: 云南科技出版社, 1991: 310.
[35] 张艺, 钟国跃. 羌族医药[M]. 北京: 中国文史出版社, 2005: 188.
[36] 奇玲, 罗达尚. 中国少数民族传统医药大系 [M]. 呼和浩特: 内蒙古科学技术出版社, 2000: 1069.
[37] 林艳芳等编著. 玉腊波等译. 中国傣医药彩色图谱: [傣文] [M]. 昆明: 云南民族出版社, 2003: 159.
[38] 贾敏如, 张艺. 中国民族药辞典 [M]. 北京: 中国医药科技出版社, 2016: 274-275.
[39] 彭再生. 湖北苗药 [M]. 北京: 中医古籍出版社, 2006: 381.
[40] 嘎务. 藏药晶镜本草: 藏文 [M]. 北京: 民族出版社, 1995: 230-231.
[41] 方志先, 赵晖, 赵敬华. 土家族药物志 [M]. 北京: 中国医药科技出版社, 2007: 347.
[42] 和丽生, 马伟光. 中国纳西东巴医药学 [M]. 昆明: 云南民族出版社, 2006: 814.
[43] 张敬杰, 罗迎春. 苗族常用植物药 [M]. 贵阳: 贵州科技出版社, 2010: 172.
[44] 李静文, 李国文, 陆骏, 等. 石斛多糖对糖尿病大鼠血-视网膜屏障的保护作用及其机制 [J]. 中华实验眼科杂志, 2017, 35(7): 611-616.
[45] 曾杰. 铁皮石斛多糖对II型糖尿病小鼠心脏和肾脏并发症改善作用及机制的研究 [D]. 重庆: 西南大学, 2020.
[46] 刘亚鸽. 铁皮石斛多糖对2型糖尿病小鼠高血糖症的缓解作用及其机制研究 [D]. 武汉: 华中科技大学, 2019.
[47] 汤志远, 周晓宇, 冯健, 等. 铁皮石斛多糖降血糖作用研究 [J]. 南京中医药大学学报, 2016, 32(6): 566-570.
[48] 王军辉. 金钗石斛多糖的化学结构与抗白内障活性研究 [D]. 合肥: 合肥工业大学, 2011.
[49] 方静宇, 谢华凌, 冯思敏, 等. 石斛多糖改善糖尿病作用的影响因素及机制研究进展 [J]. 食品与发酵工业, 2021, 47(3): 237-244.
[50] 李振坚, 王元成, 韩彬, 等. 石斛属植物生物碱成分研究进展 [J]. 中草药, 2019, 50(13): 3246-3254.
[51] Feng Y, Jia B, Feng Q,. Dendrobine attenuates gestational diabetes mellitus in mice by inhibiting Th17 cells [J]., 2021, 128(3): 379-385.
[52] 钱桂敏, 章华泼. 金钗石斛化学成分及药理作用研究进展 [J]. 中国中医药现代远程教育, 2011, 9(4): 194-196.
[53] 王玲平, 周生茂, 戴丹丽, 等. 植物酚类物质研究进展 [J]. 浙江农业学报, 2010, 22(5): 696-701.
[54] Lu Y, Kuang M, Hu G P,. Loddigesiinols G-J: α-glucosidase inhibitors from[J]., 2014, 19(6): 8544-8555.
[55] Chu C, Li T, Pedersen H A,. Antidiabetic constituents ofas determined by high-resolution profiling of radical scavenging and α-glucosidase and α-amylase inhibition combined with HPLC-PDA-HRMS-SPE-NMR analysis [J]., 2019, 31: 47-52.
[56] Na Ranong S, Likhitwitayawuid K, Mekboonsonglarp W,. New dihydrophenanthrenes from[J]., 2019, 33(3): 420-426.
[57] Sun J, Zhang F D, Yang M,. Isolation of α-glucosidase inhibitors including a new flavonol glycoside from[J]., 2014, 28(21): 1900-1905.
[58] 李菲, 黄琦, 李向阳, 等. 金钗石斛提取物对肾上腺素所致血糖升高的影响 [J]. 遵义医学院学报, 2008, 31(1): 11-12.
[59] 吴昊姝, 徐建华, 陈立钻, 等. 铁皮石斛降血糖作用及其机制的研究 [J]. 中国中药杂志, 2004, 29(2): 160-163.
[60] Wang K P, Wang H X, Liu Y G,.polysaccharide attenuates type 2 diabetes mellitus via the regulation of PI3K/Akt-mediated glycogen synthesis and glucose metabolism [J]., 2018, 40: 261-271.
[61] Mudaliar S. Inhaled insulin using AERx insulin Diabetes Management System (AERx iDMS) [J]., 2007, 16(10): 1673-1681.
[62] 代荣, 刘如明, 肖建辉. 菌类中药多糖降血糖效应机制研究进展 [J]. 中国中药杂志, 2015, 40(2): 174-179.
[63] 徐云燕. 金钗石斛总生物碱对小鼠糖、脂代谢的影响[D]. 遵义: 遵义医学院, 2014.
[64] 蔡春容. 金钗石斛总生物碱对糖尿病动物模型的影响 [D]. 遵义: 遵义医学院, 2011.
[65] 张明辉. 金钗石斛总生物碱对db/db小鼠血糖的影响及机制研究 [D]. 遵义: 遵义医学院, 2016.
[66] 张捷平, 王晓宁, 余文珍, 等. 石斛合剂对db/db小鼠肝胰岛素信号通路蛋白表达的影响 [J]. 世界中医药, 2016, 11(10): 2094-2097.
[67] Ly L D, Xu S H, Choi S K,. Oxidative stress and calcium dysregulation by palmitate in type 2 diabetes [J]., 2017, 49(2): e291.
[68] Zhang Z, Yang L, Lei L,. Glucagon-like peptide-1 attenuates advanced oxidation protein product-mediated damage in islet microvascular endothelial cells partly through the RAGE pathway [J]., 2016, 38(4): 1161-1169.
[69] Li X W, Chen H P, He Y Y,. Effects of rich-polyphenols extract ofon anti-diabetic, anti-inflammatory, anti-oxidant, and gut microbiota modulation in db/db mice [J]., 2018, 23(12): E3245.
[70] 刘莹莹, 武俊紫, 李伟, 等. 金钗石斛多糖对2型糖尿病大鼠心肌组织凋亡相关蛋白的影响 [J]. 中西医结合心脑血管病杂志, 2018, 16(18): 2621-2626.
[71] 李秀芳, 邓媛元, 潘利华, 等. 霍山石斛多糖对糖尿病性白内障大鼠眼球晶状体组织抗氧化作用的研究 [J]. 中成药, 2012, 34(3): 418-421.
[72] Wu J, Li X, Fang H,. Investigation of synergistic mechanism and identification of interaction site of aldose reductase with the combination of gigantol and syringic acid for prevention of diabetic cataract [J]., 2016, 16(1): 286.
[73] Luo J P, Deng Y Y, Zha X Q. Mechanism of polysaccharides from. on streptozotocin-induced diabetic cataract [J]., 2008, 46(4): 243-249.
[74] 魏小勇, 龙艳. 金钗石斛生物碱对糖性白内障大鼠诱导型一氧化氮合酶基因的调控 [J]. 解剖学研究, 2008, 30(3): 177-180.
[75] Wu J, Lu C J, Li X,. Synthesis and biological evaluation of novel gigantol derivatives as potential agents in prevention of diabetic cataract [J]., 2015, 10(10): e0141092.
[76] 张梅, 李春霞, 韦芳, 等. 石斛酚对高糖诱导的人视网膜微血管内皮细胞的保护作用 [J]. 国际眼科杂志, 2019, 19(2): 209-213.
[77] 何晓然, 张艳磊, 刘园园, 等. 金钗石斛多糖对高糖诱导的大鼠肾系膜细胞Nrf2表达的影响 [J]. 时珍国医国药, 2013, 24(11): 2577-2579.
[78] Kowluru R A, Kanwar M. Effects of curcumin on retinal oxidative stress and inflammation in diabetes [J].(), 2007, 4: 8.
[79] 李骋, 何金枝, 周学东, 等. 黄连素调控胰岛素抵抗相关2型糖尿病的研究进展 [J]. 中国中药杂志, 2017, 42(12): 2254-2260.
[80] 王春亮, 齐鹏, 陈爱荣. 桑叶多糖治疗糖尿病机制的研究进展 [J]. 中国临床药理学杂志, 2019, 35(1): 91-95.
[81] Donath M Y, Shoelson S E. Type 2 diabetes as an inflammatory disease [J]., 2011, 11(2): 98-107.
[82] 余增洋, 盛雨辰, 周玲玉, 等. 鼓槌石斛对小鼠非增殖性糖尿病视网膜病变的改善作用及其机制研究 [J]. 中草药, 2016, 47(11): 1908-1913.
[83] 税维智. 铁皮石斛多糖的分离纯化及调节糖代谢紊乱的机制研究 [D]. 武汉: 华中科技大学, 2016.
[84] 樊小宝, 丁通, 孙燕, 等. 石斛碱对糖尿病肾病大鼠PI3K/Akt/mTOR信号通路及足细胞功能障碍的影响 [J]. 河北医药, 2021, 43(11): 1631-1634, 1639.
[85] Wang H Y, Li Q M, Yu N J,.polysaccharide regulates hepatic glucose homeostasis and pancreatic β-cell function in type 2 diabetic mice [J]., 2019, 211: 39-48.
[86] 林心君, 胡海霞, 何昱霖, 等. 石斛合剂基于PKB/FoxO1通路抑制糖尿病大鼠肝糖异生的机制研究 [J]. 湖南中医药大学学报, 2021, 41(8): 1166-1171.
[87] Li X W, Huang M X, Lo K,. Anti-diabetic effect of a shihunine-rich extract ofon 3T3-L1 cells and db/db mice by up-regulating AMPK-GLUT4-PPARα [J]., 2019, 24(14): 2673.
[88] 刘赟, 林心君, 施红, 等. 基于WNT/β-catenin通路研究石斛合剂对衰老糖尿病大鼠脂代谢的调控机制 [J]. 福建中医药, 2018, 49(3): 31-34.
[89] 陈洪. 金钗石斛总生物碱对KK-Ay小鼠血糖的影响及机制研究 [D]. 遵义: 遵义医学院, 2018.
[90] 黄琦, 廖鑫, 吴芹, 等. 金钗石斛生物总碱对糖尿病大鼠血糖及肝脏组织IRS-2 mRNA, IGF-1 mRNA表达的影响 [J]. 中国实验方剂学杂志, 2014, 20(19): 155-158.
[91] 罗傲霜, 淳泽, 葛绍荣, 等. 迭鞘石斛多糖降血糖作用研究 [J]. 应用与环境生物学报, 2006, 12(3): 334-337.
[92] 高长花, 余文珍, 施红, 等. 石斛合剂对糖尿病模型大鼠胰高血糖素样肽-1的影响 [J]. 中医临床研究, 2013, 5(23): 5-7.
[93] 刘莹莹, 武俊紫, 李伟, 等. 金钗石斛多糖对Ⅱ型糖尿病大鼠心肌组织中MMP-1和MMP-9表达的影响 [J]. 西部医学, 2017, 29(10): 1346-1351.
[94] 何晓然. 金钗石斛总碱对高糖诱导的大鼠肾系膜细胞增殖及PPAR-γ表达的影响 [D]. 遵义: 遵义医学院, 2013.
[95] 李秀芳. 霍山石斛和四种药典石斛多糖降血糖活性比较研究 [D]. 合肥: 合肥工业大学, 2012.
[96] 李静文, 李国文, 秦瑜, 等. 铁皮石斛多糖对糖尿病大鼠视网膜炎症因子表达干预的研究 [J]. 中国中医眼科杂志, 2016, 26(1): 7-11.
[97] 陈泳荪, 刘文洪. 铁皮石斛多糖提取工艺及其对高糖诱导血管内皮细胞NF-B表达干预的研究 [J]. 山西中医学院学报, 2011, 12(2): 28-31.
[98] 萧自智. 石斛合剂序贯法对糖尿病合并肝损伤肝纤维化的作用机制研究 [D]. 福州: 福建中医药大学, 2017.
[99] Whiting D R, Guariguata L, Weil C,. IDF diabetes atlas: Global estimates of the prevalence of diabetes for 2011 and 2030 [J]., 2011, 94(3): 311-321.
[100] 陈栋才. 铁皮石斛多糖的提取、分离纯化、结构及生物活性研究 [D]. 福州: 福建师范大学, 2015.
Research progress on anti-diabetic herbalism, material basis and mechanism ofgenus
ZHOU Zhong-yu1, PU Ting-ting1, ZHANG Lei2, WANG Jing1, 3, XU Zhi-chao3, LIU Ying-lin1, DUAN Bao-zhong1
1. College of Pharmaceutical Sciences, Dali University Dali 671000, China 2. Dali Seed Management Station, Dali 671000, China 3. College of Life Sciences, Northeast Forestry University Harbin 150040, China
is the largest genus of the Orchidaceae family. The fresh and dried stems of many species of this genus had been used as Shihu () in traditional Chinese medicine to treat diabetes in clinic with wide application, which had also been recorded to treat the symptom of “fever hurts body fluid, dry mouth and polydipsia”. With the deepening of research, the anti-diabetic components and mechanisms ofhave been revealed constantly. In the present study, the research on anti-diabetic herbalism, material basis, and action mechanism of this genus was summarized based on ancient materia medica and modern literatures. The results indicated thatcould reduce plasma glucose levels and has excellent potential in anti-diabetic drugs and functional foods development. Although the efficacy and material basis ofplants against diabetes had also been studied, the focused species were dispersed and lacked clinical evidence. Accordingly, we should chooseplant with remarkable anti-diabetic effects through ancient herbs, folk experience, and clinical application. In addition, the material basis and mechanism should be studied from different angles and levels, especially in new targets and mechanisms. It is essential for the development of anti-diabetic drugs and the utilization ofplants.
Sw.; anti-diabete; herbalism; material basis; mechanisms
R286
A
0253 - 2670(2022)18 - 5934 - 11
10.7501/j.issn.0253-2670.2022.18.035
2022-02-03
云南省院士专家工作站项目(202205AF150026);云南省重大科技专项(202002AA100007);云南省兴滇英才支持计划(YNWR-QNBJ-2020251)
周忠瑜(1996—),男,硕士研究生,研究方向为中药资源与鉴定。Tel: 18846789315 E-mail: zyzhou21@126.com
刘颖琳,研究方向为中药资源及其品质评价。Tel: (0872)2257401 E-mail: lyldaliedu@163.com
段宝忠,博士,教授,主要从事中药资源与种质创新研究。Tel: (0872)2257411 E-mail: bzduan@126.com
[责任编辑 时圣明]

