WNT16B对体外培养宫骶韧带成纤维细胞增殖和胶原分泌的影响
李蕾,陈娟,史宏晖,朱兰
(中国医学科学院 北京协和医学院 北京协和医院普通妇科中心,国家妇产疾病临床医学研究中心,北京 100730)
盆腔器官脱垂(pelvic organ prolapse,POP)是盆底支持结构缺陷、损伤及退化等因素,导致支持薄弱,使生殖器官与其相邻脏器发生移位,引起一系列功能紊乱,临床上表现为子宫脱垂、阴道壁膨出等[1]。随着人口老年化进程加快,该类疾患已成为严重影响中老年妇女健康和生活质量的医疗问题和突出的社会问题,给家庭和社会带来沉重的负担。该病的病因和发病机制并不十分清楚。
根据Dellancy的三水平理论[2],宫骶韧带是承托盆腔器官的第一水平支持结构,主要由成纤维细胞及其分泌的细胞外基质构成,成纤维细胞是组织塑型的关键细胞。WNT通路是调节细胞增殖、细胞极性和细胞命运决定的重要信号通路,WNT家族蛋白共有19种[3]。我们先期研究发现POP患者宫骶韧带成纤维细胞中分泌型糖蛋白WNT16B表达量减少,且细胞的生长增殖活性下降[4],推测与盆底支持结构薄弱有关,但是两者之间是否有关联目前尚无报道。本实验通过转染WNT16B至体外培养的原代成纤维细胞,观察WNT16B信号通路持续激活对宫骶韧带成纤维细胞增殖和胶原分泌的影响,探讨其在POP发病中的作用机制。
资料与方法
一、研究对象
选择2018年10月至2021年6月在北京协和医院妇产科行阴式子宫全切除术的绝经后POP患者4例,取同期因妇科良性疾病行全子宫切除术的绝经后非POP患者2例作为对照。对照患者的年龄、绝经时间和产次与POP患者相匹配。
POP患者和对照患者既往均无慢性盆腔炎症、子宫内膜异位症、妇科恶性肿瘤、结缔组织疾病等。POP患者由资深临床医师按照POP定量分度(POP-Q)法进行诊断,均为子宫脱垂合并阴道前壁膨出Ⅲ~Ⅳ度,不伴有压力性尿失禁。对照患者为腹腔镜辅助阴式全子宫切除的妇科良性疾病患者(宫颈癌前病变、无功能卵巢囊肿等),无POP及尿失禁症状。
本研究经本院伦理委员会批准,患者均知情同意。
二、主要试剂与仪器
RNeasy Micro Kit提取试剂盒(Qiagen,德国);AMV Reverse Transcriptase反转录试剂(Promega,美国);SYBR Premix Ex Taq IIRR820A荧光定量PCR试剂盒(TaKaRa,日本);PCR引物由上海生工生物工程公司合成;E-Plate 16培养板(艾森生物,美国);培养基和胎牛血清(Gibco,美国)。
BX51型正立式显微镜(Olympus,日本);7500实时荧光定量PCR仪(ABI,美国);LEICA SP8激光共聚焦显微镜(LEICA,德国);低速离心机(Thermo,美国);Maestro Z实时无标记细胞分析仪(RTCA)(AxionBiosystems,美国)。
三、研究方法
1.细胞来源:由资深医师在妇科子宫全切术中取材,宫骶韧带取自韧带与宫颈连接处以外0.5~1.0 cm处。取后的组织标本用1% Ⅰ型胶原酶消化2 h,离心后,用含15%胎牛血清的M199培养基进行原代细胞培养。差时贴壁法对培养出的宫骶韧带成纤维细胞进行纯化,3代至8代的宫骶韧带成纤维细胞用于实验研究。
2.细胞培养:将分离自不同患者的宫骶韧带成纤维细胞用含有10%胎牛血清的高糖DMEM培养基,置于37℃、5%CO2培养箱中培养,细胞融合度达到70%~80%时,以0.25% 胰酶消化细胞传代培养。
3.宫骶韧带成纤维细胞中WNT16B和I型胶原蛋白(COLI)mRNA表达水平的检测:将体外培养的宫骶韧带成纤维细胞消化后,使用RNA提取试剂盒提取细胞总RNA,使用RT-PCR方法检测WNT16B和I型胶原蛋白基因的表达水平,3-磷酸甘油醛脱氢酶(GAPDH)作为内参基因。用相对定量的方法(2-ΔΔCt),比较POP各病例与对照各病例之间WNT16BmRNA表达,以及转染细胞前后WNT16B和COLImRNA的表达水平。每个实验均重复3次。引物序列见表1。

表1 引物序列
4.实时无标记细胞分析系统(RTCA)检测细胞增殖:将培养至第3代的宫骶韧带成纤维细胞以0.25%胰酶消化成单细胞悬液,台盼蓝计数后调整细胞密度为30 000/ml,取100 μl细胞悬液加入预处理过的E-Plate 16培养板,选取细胞对数生长期的生长曲线,计算细胞的倍增时间。实验重复3次。
5.WNT16B过表达载体构建:人WNT16B编码区由上海捷瑞生物工程有限公司合成,一个自剪切序列2A被引入到WNT16B基因的N端。将合成的2A-WNT16B序列插入到pEGFP-C1质粒的BamHI位点。之后将CMV-EGFP-2A-WNT16B-polyA表达框插入慢病毒表达载体PLKO-puro的ClaI和EcoRI位点之间,得到慢病毒表达载体pLKO-CMV-EGFP-2A-WNT16B(图1)。

将人WNT16B编码区插入到ClaI和EcoRI位点,得到慢病毒表达载体pLKO-CMV-EGFP-2A-WNT16B。
6.病毒包装以及细胞感染:转染实验的前一天,将(1.5~2.5)×106对数期293T细胞种到60 mm培养皿中,使用5 ml含有10%FBS的DMEM培养基培养过夜。将慢病毒表达载体pLKO-CMV-EGFP-2A-WNT16B与包装质粒delta8.9及水泡性口炎包装质粒(VSVG)以2∶2∶1的比例混合,以脂质体lipofectamine LTX 转染进入293T细胞,4~6 h后,将培养基更换为含有30%FBS的DMEM培养基,继续培养48 h后收集培养基上清,以0.45 μm滤膜过滤后分装备用。将制备的病毒上清加入培养的宫骶韧带成纤维细胞上清,同时加入聚凝胺(polybrene)至终浓度为8 μg/ml。48 h后,更换为新鲜培养基,使用中浓度(1 μg/ml)的嘌呤霉素筛选7 d后收集细胞,用RT-PCR方法检测WNT16B和COLImRNA表达水平(详见前述)。
四、统计方法
采用SPSS17.0软件包进行统计学分析。患者两两间比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、样本信息
收集POP患者4例(编号121029、121127、130115以及121123am),非POP对照患者2例(编号130129、121207)。患者间年龄、绝经时间和产次相匹配(表2)。
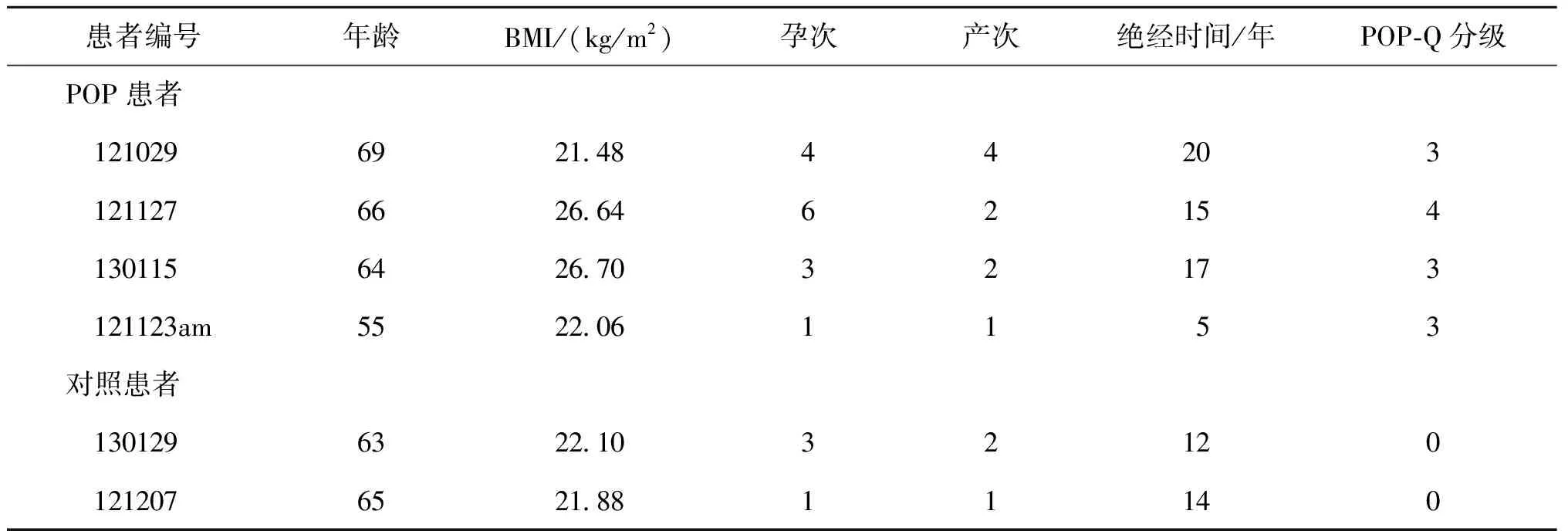
表2 患者收样信息
二、POP患者与非POP对照患者宫骶韧带成纤维细胞WNT16B基因的表达
消化培养宫骶韧带组织成纤维细胞,提取细胞的总RNA,使用RT-PCR检测非POP对照患者2例(编号130129和121207)以及POP患者4例(编号121029、121127、130115以及121123am)的宫骶韧带成纤维细胞中WNT16B的mRNA的表达水平。与对照病例比较,所检测的4例POP病例中3例的宫骶韧带成纤维细胞WNT16BmRNA水平均显著低于2例对照病例(P<0.001)(图2)。
与对照病例121207比较,*P<0.001;与对照病例130129比较,#P<0.001。
三、WNT16B慢病毒转染原代成纤维细胞
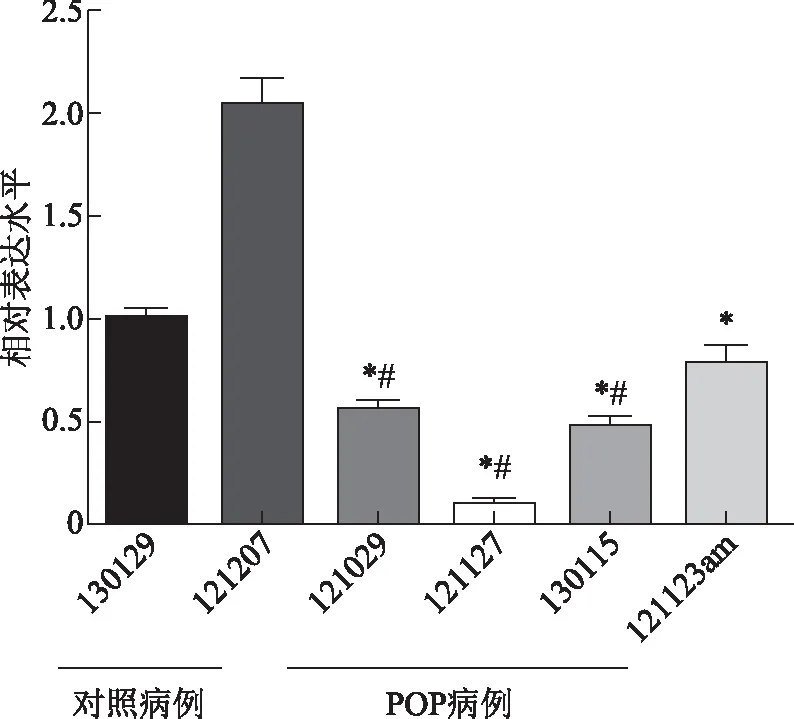
由于POP患者宫骶韧带成纤维细胞WNT16B表达水平低于非POP对照患者,以WNT16B慢病毒转染POP患者宫骶韧带成纤维细胞后,提取总RNA,以RT-PCR法检测转染前后细胞中WNT16BmRNA的水平。结果显示病毒转染后的成纤维细胞,WNT16BmRNA水平均比转染前有显著提高(P<0.001)(图3)。
与各自转染前比较,*P<0.001。
四、WNT16B慢病毒转染原代成纤维细胞后细胞的增殖情况
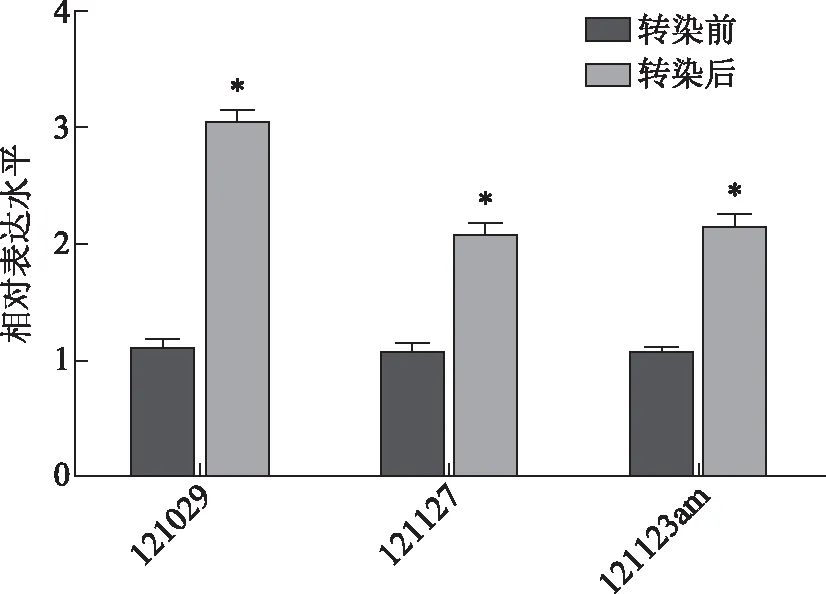
以WNT16B慢病毒转染POP患者宫骶韧带成纤维细胞后,以实时无标记细胞分析系统(RTCA)检测细胞的倍增时间。结果发现,POP患者宫骶韧带成纤维细胞在WNT16B慢病毒转染后倍增时间均比未转染细胞显著缩短(P<0.05)(图4),说明WNT16B能够显著提高POP患者成纤维细胞的增殖活性。

与各自转染前比较,*P<0.05,#P<0.001。
五、WNT16B慢病毒转染原代宫骶韧带成纤维细胞后胶原I的表达
以WNT16B慢病毒感染POP患者宫骶韧带成纤维细胞后,提取总RNA,以RT-PCR法检测感染前后细胞中胶原I(COLⅠ)mRNA的表达水平。结果显示慢病毒感染后的成纤维细胞COLImRNA水平均比转染前有显著提高(P<0.05)(图5)。
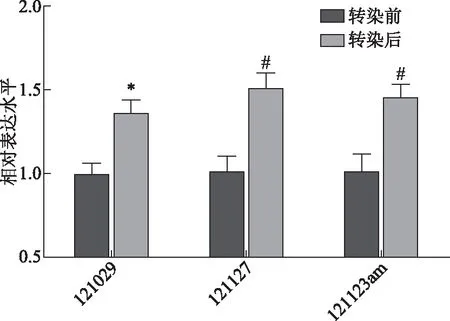
与各自转染前比较,*P<0.05,#P<0.01。
讨 论
在盆底的支撑系统中,盆腔器官周围的纤维结缔组织形成筋膜和韧带,对抗腹压和重力,维持阴道及其邻近器官的解剖位置。有关POP的发病机制中,盆底支持结构中细胞外基质的组成和功能异常被人们所熟知,但是有关成纤维细胞的形态及功能研究还非常有限[5]。
成纤维细胞是结缔组织中主要细胞,能分泌细胞外基质及相关代谢酶(如金属基质蛋白酶和金属蛋白酶组织抑制剂),参与胶原纤维合成、成熟和降解过程。盆底支持结构中的成纤维细胞能感受机械力和局部生物化学刺激,维持细胞外基质合成代谢和分解代谢的动态平衡,在组织塑型中起关键作用[6]。因此成纤维细胞的功能状态是影响盆底功能的重要环节。研究发现,与非POP患者盆底组织相比,POP患者盆底支持韧带中成纤维细胞的增殖能力降低、细胞存活率低,POP患者盆底组织宫骶韧带胞外基质的Ⅰ型、Ⅲ型胶原以及弹性蛋白水平下降,对异常牵拉产生的应力反应性降低[7-9]。
WNT为分泌型糖蛋白,WNT信号通路可以在不同发育阶段调节细胞基本功能,如增殖、分化、迁移和细胞极性等。目前已鉴定出至少19个人类WNT基因,WNT16是WNT家族的新成员,有WNT16A和WNT16B两种异构体,WNT16B能在人体多种组织中表达[10-11],且在体外能够通过载体进行稳定转染和表达[12]。我们先期的研究通过基因组表达芯片,在国内外首次发现POP患者的WNT16相关信号通路的基因表达与年龄、绝经状态相匹配的正常对照相比有明显异常[13]。Xie等[14]通过RNA-seq的方法也筛选到POP患者有异常的WNT16表达,并与POP分度有关。目前已有的研究表明,WNT16B与细胞的增殖、衰老和肿瘤进展相关,可能是通过经典或非经典的β-连环蛋白信号通路调节[11,15]。另外,WNT16B信号通路还参与组织修复和组织纤维化异常性疾病,比如成人关节软骨机械性损伤后,WNT16信号通路的激活使关节滑膜细胞过度分泌胶原纤维,与骨关节炎的发生密切相关[16]。但是在WNT16B信号通路对盆底支持结构中成纤维细胞的增殖和胶原分泌功能有无影响,目前尚无报道。
本研究中,POP病例原代培养的宫骶韧带成纤维细胞与非POP对照病例相比,WNT16B的表达水平显著下降,这与我们以往已经发表的结果[4]一致。本研究的主要工作是成功构建了WNT16B过表达慢病毒载体,在POP病例过表达目的蛋白,以挽救POP患者宫骶韧带成纤维细胞WNT16B的低表达水平。在WNT16B的持续激活状态下,成纤维细胞的倍增时间缩短,分泌胶原I功能增加,能潜在增强组织的支撑功能,提示WNT16B可能是调节成纤维细胞功能、治疗POP的一个潜在靶点,值得我们扩大样本量进一步探索。

