橡胶树多主棒孢拮抗细菌BACYitc8-7的分离鉴定及其挥发性抑菌物质组分分析
戴利铭,李岚岚,施玉萍,刘一贤,邓乐晔,吴忠华,蔡志英
橡胶树多主棒孢拮抗细菌BACYitc8-7的分离鉴定及其挥发性抑菌物质组分分析
戴利铭,李岚岚,施玉萍,刘一贤,邓乐晔,吴忠华,蔡志英*
云南省热带作物科学研究所,云南景洪 666100
多主棒孢菌()是为害橡胶叶片的一种重要病原真菌,目前生产上普遍使用化学农药防治该病害,给植胶区的生态环境带来很多负面影响,从橡胶树根际土壤中筛选对橡胶树多主棒孢菌具有高拮抗活性的细菌,可为橡胶树棒孢霉落叶病生防药剂的研发提供理论依据。本研究通过稀释涂布、平板对峙法从发病橡胶树根际土壤中分离筛选到1株对橡胶树多主棒孢菌具有高拮抗活性的细菌,抑菌带为(57.68±0.66)mm,且该菌株对9种重要的植物病原真菌均具有抑制作用;经过形态观察、生理生化检测及基因序列分析,结果发现其与铜绿假单孢菌基本相符,命名为BACYitc8-7;以LB、NA、高氏、金氏B和PDA为营养来源,评定不同营养条件下菌株BACYitc8-7挥发性物质对多主棒孢菌的抑制作用,发现菌株BACYitc8-7在金氏B和LB培养基上的拮抗作用最强,抑菌率达43.47%~48.69%;利用顶空固相微萃取-气相色谱-质谱法(HS-SPME-GC-MS)收集并检测菌株BACYitc8-7挥发性物质的抑菌组分,获得包括胺类、醇类、烯类、酚类、酯类、吡嗪类等35种物质,其中含量前5的物质为胺、硼烷二甲硫醚络合物、异戊醇、1-十三烯和2-甲基-3-甲硫基呋喃。
多主棒孢;拮抗细菌;分离鉴定;挥发性物质;抑菌组分
橡胶树棒孢霉落叶病病原菌为多主棒孢[(Berk and curt.) Wei],属半知菌类(Deuteromycotina)丝孢纲(Hyphomycetes)丝孢目(Hyphomycetales)暗色菌科(Dematiaceae)棒孢属()[1],可侵害橡胶树的幼苗、老叶、幼树和成龄树的嫩叶,导致植株树冠稀疏和矮缩,对我国橡胶生产造成严重的经济损失[2]。多主棒孢菌是一种寄主范围广泛、世界性分布的植物病原真菌,能侵染葫芦科、无患子科、大戟科及楝科等380属530种植物[3]。多主棒孢的发生、流行与寄主植物抗病性、环境条件和人类活动等因素有关,其孢子可借助风雨传播[4]。
目前,化学药剂结合农业防治是防治橡胶树棒孢霉落叶病的主要方法[5-6]。农业防治措施为选育和嫁接抗病品系、避免在发病林地附近建苗圃、严禁从发病胶园采种、发病严重的苗圃需全部砍除并对土壤进行消毒。化学药剂主要有咪鲜胺、苯来特、百菌清、代森锰锌和甲基托布津等。随着农业快速发展,农药用量不断增加,使用化学农药所带来的高残留、高污染及对人畜的危害等问题正逐渐突显。
目前兼具安全、绿色、高效等特性的绿色防控技术成为当下的研究热点,其中应用生物拮抗菌来防治各种病害被证实是一种安全有效的新方法[7]。国内报道对多主棒孢菌有拮抗作用的细菌属芽孢杆菌类最为丰富。赵昱榕等[8]从黄瓜植株体内分离筛选得到贝莱斯芽胞杆菌,该菌株能产生大量活性物质,对多主棒孢菌具有显著的拮抗效果。时涛等[9]从橡胶树组织中分离到2株对橡胶树多主棒孢菌有拮抗作用的内生枯草芽孢杆菌。李岚岚等[10]从橡胶根部组织发现4株解淀粉芽孢杆菌对橡胶树多主棒孢菌和尖孢炭疽菌有一定的抑制效果。桑建伟[11]从健康的香蕉植株根部组织中分离得到1株对番茄多主棒孢菌和辣椒炭疽菌有拮抗作用的解淀粉芽孢杆菌。此外,吴利民等[12]研究发现真菌哈茨木霉()对黄瓜多主棒孢菌的抑制率高达98.2%。刘一贤等[13]发现桑树链霉菌对橡胶树褐根病、橡胶树多主棒孢菌具有一定的抑制作用。陈旭玉等[14]从广藿香的根际土壤中分离得到能抑制广藿香多主棒孢菌的铜绿假单胞菌()CC1。目前芽孢杆菌类是对多主棒孢菌有拮抗作用报道最多的生防菌,其他微生物报道甚少。微生物生活在生物圈的各个角落,分泌的活性物质多种多样,不同来源的拮抗菌株抑菌效果和抑菌谱均不同,因此对不同环境来源新拮抗菌株资源的筛选与评价,对生防菌资源的开发有着重要的实际意义。
铜绿假单胞菌是一类具有生物研究价值的微生物资源菌,能够产生多种抗菌物质铁载体、绿脓菌素、吩嗪-1-羧酸、吩嗪-1-酰胺、鼠李糖脂和胞外多糖等[15]。铜绿假单胞菌产生的抗菌物质在农作物病虫害的生物防治上也有广泛的应用[16],但目前尚未见铜绿假单胞菌防治橡胶多主棒孢菌的报道。本研究从云南西双版纳橡胶树根际土壤中筛选具有生防作用的菌株,并对筛选出的菌株进行形态学、生理生化和分子生物学鉴定;同时对拮抗菌抑菌谱、挥发性物质抑菌能力及挥发性物质组分进行分析。为开发防治多主棒孢菌的新型杀菌剂奠定基础,同时也为菌株的进一步开发应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试样品 从云南省西双版纳州景洪市橡胶树(棒孢霉落叶病)根区土壤采集土样,利用5点采样法,去除地表土壤,取深度约为5~20 cm的土壤装入无菌自封袋,带回实验室于4℃冷藏备用。
1.1.2 主要仪器及培养基 PCR引物,购自北京六合华大基因科技有限公司;细菌基因组提取试剂盒,购自北京康为世纪公司。LB培养基、高氏一号培养基、金氏B、NA培养基为常规配方。
1.1.3 供试菌株 靶标病原菌尖孢炭疽菌()DFMP1E和MLZZP3、胶孢炭疽菌()NPS1a-2、多主棒孢菌()JCMP7A、橡胶树褐根菌()JPNC4、小孢拟盘多毛孢()MF375898、橡胶疫霉菌()OJ20180523、五隔大无性孢丽赤壳菌()OJ20180629及茄类镰刀菌()XJ160901均由本实验室分离保存[13]。
1.2 方法
1.2.1 拮抗细菌的分离和筛选 (1)拮抗细菌的分离:称取1 g土样放入加有100 mL的LB培养基的三角瓶中,振荡培养30 min(30℃,180 r/min)后,采用梯度稀释法取300倍稀释液200 μL涂布在LB培养基中。倒置于30℃培养箱中培养2~3 d,挑取菌落形态不同的单菌落进行编号,甘油管‒20℃保存。
(2)拮抗细菌的筛选:采用对峙培养法筛选拮抗细菌,将多主棒孢菌接种在平板中央,然后在其四周等距离处接种待测菌,以仅接种多主棒孢菌饼的平板为对照,将平板置于30℃培养箱内4~5 d后,取出平板十字交叉法测量病原菌直径,每个菌株重复测试3次。
采用指示菌的生长抑制率评价拮抗细菌的能力。抑菌带宽=对照组菌落生长直径-处理组菌落生长直径;抑制率=(对照组菌落生长直径-处理组菌落生长直径)/(对照组菌落生长直径-接种菌块直径)×100%。
1.2.2 拮抗细菌的鉴定 将拮抗细菌单菌落划线接种于LB、NA、PDA、高氏、金氏B培养基上,在30℃的恒温箱中培养1 d后,观察菌落形态特征。生理生化指标的测定参考申顺善等[17]和宁爽[18]的方法。
1.2.3 拮抗细菌抑菌广谱性测定 以尖孢炭疽菌、胶孢炭疽菌、多主棒孢菌、橡胶树褐根菌、小孢拟盘多毛孢、橡胶疫霉菌、五隔大无性孢丽赤壳菌和茄类镰刀菌为病原菌,采用对峙培养法测定拮抗细菌对不同病原菌的抑制作用。
1.2.4基因和基因鉴定基因的扩增引物及吩嗪-1-羧酸(phenazine-1- carboxylic acid,PCA)基因的引物见表1[19],由深圳华大基因科技有限公司合成。
基因和功能基因鉴定的PCR反应体系均采用50 μL总体系,其中2×EsTaq Master Mix 25 µL,基因组DNA 2 µL,27F和1492R引物(10 µmol/L)各1 µL,用ddH2O补足至50 µL。基因的PCR反应条件:95℃变性5 min;95℃ 30 s,55℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min。PCR产物经纯化后测序。功能基因反应条件:95℃变性5 min;95℃ 30 s,58℃退火30 s,72℃复性1 min,35个循环;72℃延伸8 min。扩增产物送往深圳华大基因科技有限公司进行测序
系统发育学特征:将测序结果与GenBank数据库中的BLASTn程序进行比对,运用MEGA 6.0软件的Neighbor-Joining法构建系统发育树,Bootstrap设为1000。

表1 本研究所用引物
1.2.5 拮抗细菌挥发性产物对多主棒孢菌的作用 参照梁艳琼等[20]的双皿对扣法,将拮抗细菌接种于50 mL的LB液体培养基中,37℃、180 r/min培养12 h后,取已培养好的发酵液50 μL,均匀涂布于含LB培养基的培养皿皿底,并将多主棒孢菌块(直径为5 mm)接种在含PDA培养基的培养皿盖中间,将后者与前者对扣,两皿接触处用封口膜密封,以空白的LB平板和接种有病原菌的PDA皿盖对扣为对照,重复3次。28℃黑暗培养4~5 d,十字交叉法测定处理组和对照组的多主棒孢菌落直径,并计算抑制率。
1.2.6 外源营养对拮抗细菌挥发性物质抑菌活性的影响 采用LB、NA、高氏、金氏B和PDA 5种不同培养基为营养来源,检测外源营养对拮抗细菌挥发性物质抑菌活性的影响。以抑制率评定不同营养条件下拮抗细菌所产挥发物作用活性的强弱,筛选产抑菌挥发物质的最优培养基。指示菌为多主棒孢菌,将拮抗菌接种于50 mL LB液体培养基中,37℃、180 r/min过夜培养,取100 μL培养好的发酵液,分别涂布至上述5种培养基中。双皿对扣法和测定方法同1.2.5。
1.2.7 挥发性物质的HS-SPME-GC-MS鉴定 参照梁艳琼等[20]的方法,在灭菌的顶空瓶(20 mL)中制作LB培养基,取拮抗菌株种子液50 µL接种在含LB培养基的顶空瓶中,将瓶盖密封后再用封口膜密封瓶盖外层,置于28℃生化培养箱中培养48 h,重复3次,以不接种拮抗菌株的培养基为对照。
萃取顶空瓶中的挥发物采用顶空固相微萃取方法。色谱柱为DB-5MS(30 m×250 μm× 0.25 μm),萃取头采用50/30 µm DVB/CAR/ PDMS,升温程序、载气、质谱条件、电离方式、电子能量、扫描质量范围均参照梁艳琼等[20]的方法。将所得气体成分采用国际标准数据库(Library of the National Institute of Standardsand Technology,NIST)鉴定挥发性物质成分,再去掉对照和实验中同时存在的化合物成分,最终确定挥发性物质的组分。
2 结果与分析
2.1 拮抗菌株的分离和筛选
以多主棒孢菌作为指示菌,从西双版纳橡胶树根际土壤中分离得到16株具有抑制作用的菌株,其中对多主棒孢菌抑菌带最宽的菌株编号为BACYitc8-7(图1),其抑菌直径为57.68 mm。
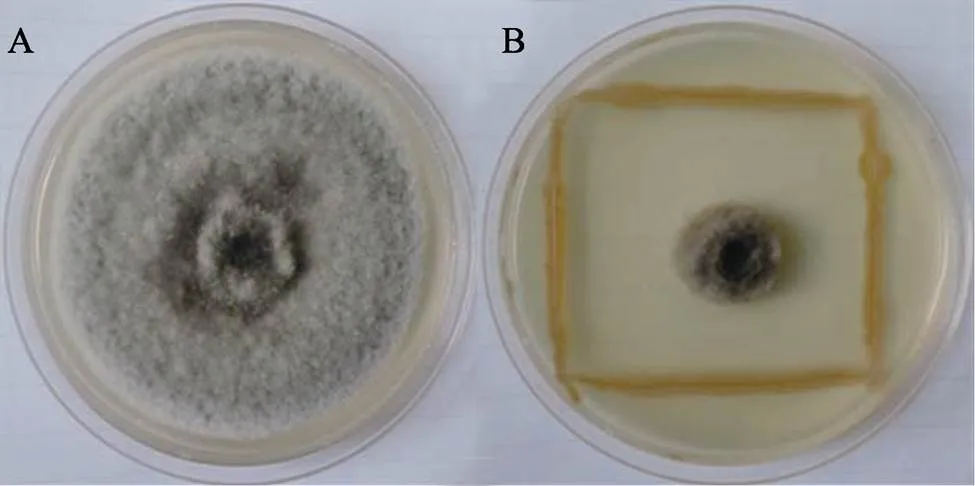
A:多主棒孢菌;B:菌株BACYitc8-7的拮抗作用。
2.2 拮抗菌株BACYitc8-7的鉴定
2.2.1 菌落形态特征 BACYitc8-7革兰氏染色阴性,有鞭毛,无芽胞,菌体呈球杆状。在LB、NA、PDA、高氏、金氏B不同培养基上的菌落形态详见表2。

表2 菌株BACYitc8-7的培养特征
2.2.2 生理生化特征 生理生化结果显示,菌株BACYitc8-7能利用D-木糖、甘露糖、D-葡萄糖、柠檬酸盐、甲基红、甘油,可使明胶液化、脂肪分解、氧化酶阳性、过氧化氢酶阳性、脓青素阳性、硝酸盐还原、接触酶阳性,但不能利用乳糖、D果糖、L-阿拉伯糖、蔗糖、麦芽糖、L-鼠李糖、半乳糖、肌醇,不产生硫化氢、氨气、吲哚,不能利用淀粉,可在42℃下生长,但不能在4℃下生长,耐盐浓度最高为5%。
2.3 拮抗菌株抗菌谱研究
菌株BACYitc8-7对尖孢炭疽菌MLZZP3、DFMP1、胶孢炭疽菌、多主棒孢菌、橡胶树褐根菌、小孢拟盘多毛孢、橡胶疫霉菌、五隔大无性孢丽赤壳菌和茄类镰刀菌均有抑制作用(表3),其中对多主棒孢菌和小孢拟盘多毛孢抑制作用最好(图1和图2),抑菌直径分别达(57.68±0.66)mm、(66.25±2.03)mm,其次对五隔大无性孢丽赤壳菌和橡胶树褐根菌2种病原菌的抑菌能力较强,对尖孢炭疽菌MLZZP3和DFMP1的抑制作用最弱。抗菌谱试验结果表明,菌株BACYitc8-7具有广谱抗菌活性,尤其对半知菌类病原菌的抑制作用显著,推测BACYitc8-7在半知菌类病原菌生防领域具有良好的应用前景。
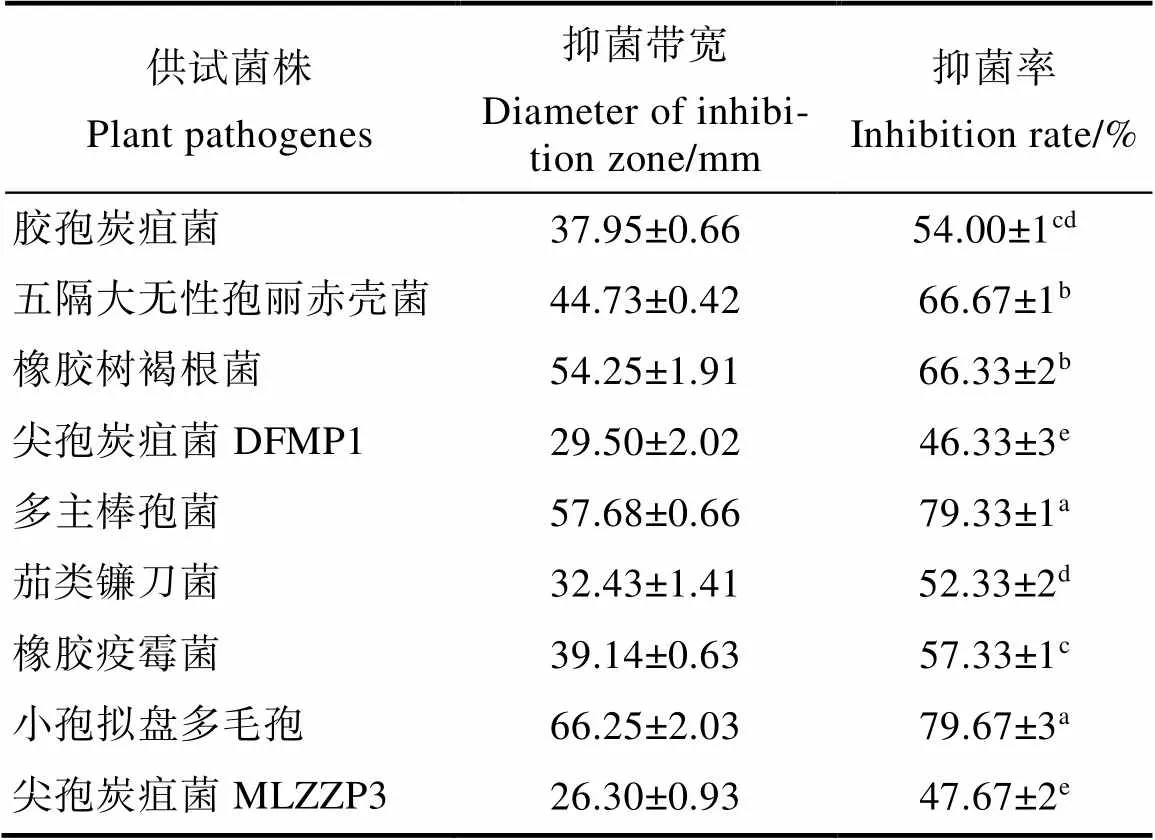
表3 菌株BACYitc8-7对不同病原真菌的抑制作用
注:同列数据后不同小写字母表示差异显著(<0.05)。
Note: Different lowercase letters after the same column of data indicate significant difference (<0.05).
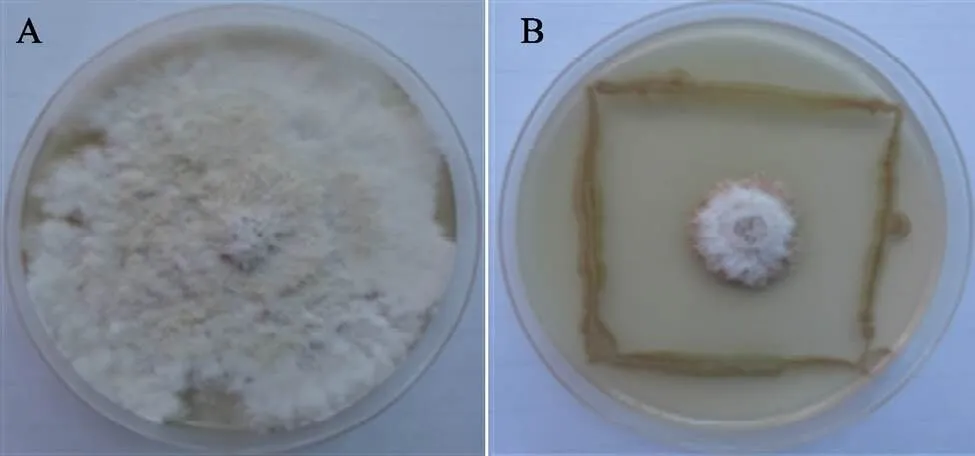
A;小孢拟盘多毛孢;B:菌株BACYitc8-7的拮抗作用。
2.4 BACYitc8-7菌株的16S rRNA基因和PCA基因鉴定
2.4.1基因聚类分析 采用基因通用引物对其进行PCR扩增,得到1500 bp条带,将得到的序列于NCBI上BLAST比对,发现菌株BACYitc8-7与strain DSM 50071(NR 117678.1)、strain NBRC 12689(NR 113599. 1)和strain ATCC 10145(NR 114471.1)的同源性最高,均为99.93%。序列提交到GenBank,获得登录号为MW320450。采用MEGA 6.0软件构建系统发育树,结果显示,菌株BACYitc8-7与聚在一支上,说明其亲缘关系很近(图3)。因此,在结合形态学及生理生化性质分析结果的基础上鉴定菌株BACYitc8-7为铜绿假单胞菌。
2.4.2 PCA鉴定 以菌株BACYitc8-7的基因组DNA为模板,用引物PCA2a/PCA3b进行PCR扩增,发现菌株中扩增到目的片段大小与预期相符,对扩增产物进行纯化并测序。将核苷酸序列在NCBI上进行BLAST比对,发现扩增产物与来源的phenazine biosynthesis protein PhzC(MBH9480114.1)的相似性最高,达98%;与来源的PhzC(ABN80405.1)有97%的相似性。表明菌株BACYitc8-7含有吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA)抗菌物质的合成相关基因。

图3 基于16S rRNA基因序列的菌株BACYitc8-7及GenBank数据库中相关菌株的系统发育分析
2.5 菌株BACYitc8-7挥发性产物对多主棒孢菌的抑制作用
当对照多主棒孢菌平均菌落直径达67.34 mm时,实验组多主棒孢菌平均菌落直径为36.98 mm,平均抑制率达48.70%(表4),表明菌株BACYitc8-7能够产生挥发性物质,且该物质对多主棒孢菌有良好的拮抗作用。
2.6 外源营养对菌株BACYitc8-7挥发性物质抑菌活性的影响
菌株BACYitc8-7能够在金氏B、LB、NA、高氏和PDA培养基上生长,不能在查氏培养基上生长;以多主棒孢菌为指示菌时,BACYitc8-7在金氏B、LB、NA、高氏和PDA培养基上均能产生挥发性物质抑制多主棒孢菌的生长,其抑菌率分别达43.47%±1.0%、48.69%±2.0%、16.02%±0.5%、11.95%±2.0%、25.89%±2.0%(表4)。表明菌株BACYitc8-7在金氏B和LB培养基上的产生抑菌挥发物最强,抑菌率达43.47%~48.69%。因此,选择LB为BACYitc8-7产挥发性物质的最优培养基。
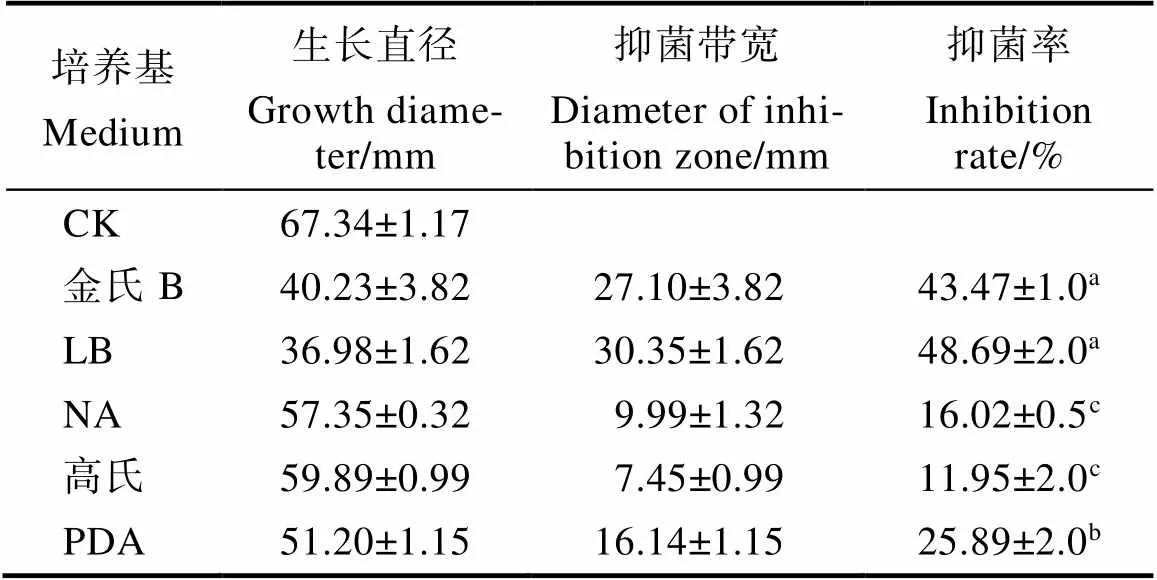
表4 不同培养基中菌株BACYitc8-7所产挥发性物质的抑菌活性
注:同列数据后不同小写字母表示差异显著(<0.05)。
Note: Different lowercase letters after the same column indicate significant difference (<0.05).
2.7 菌株BACYitc8-7挥发性物质的HS-SPME- GC-MS鉴定
依据NIST标准谱库将顶空瓶中的挥发物进行匹配分析,排除LB培养基处理及菌株BACYitc8-7+LB培养基处理中共有的物质,获得35种挥发性物质,包括胺类、醇类、烯类、酚类、酯类、吡嗪类等;将所获物质按峰面积降序排列,获得含量前10排名为胺、硼烷二甲硫醚络合物、异戊醇、1-十三烯、2-甲基-3-甲硫基呋喃、2-壬基醇、1,4-戊二烯、2-丙基-1-戊醇、异丙醇、苄基甲基硫醚;说明醇类物质为菌株BACYitc8-7的主要挥发性物质(表5)。
3 讨论
本研究采用稀释涂布、平板对峙法从橡胶树根际土壤中获得拮抗橡胶树多主棒孢菌的生防细菌BACYitc8-7。通过形态观察、生理生化检测及基因序列分析确定菌株BACYitc8-7为铜绿假单胞菌。
GE等[21]报道铜绿假单胞菌M18可防治瓜类枯萎病、辣椒疫病和水稻纹枯病。任小平等[16]报道铜绿假单胞菌粗提液对水稻纹枯病菌的抑制效果显著。然而,铜绿假单胞菌抑制多主棒孢菌,国内仅有陈旭玉等[14]报道过,其分离的铜绿假单胞菌CC1能抑制广藿香多主棒孢菌,抑菌带宽为10 mm;本研究获得的菌株BACYitc8-7能抑制橡胶树多主棒孢菌,抑菌带宽达57.68 mm,说明本研究获取的铜绿假单胞菌抑制多主棒孢菌的能力优于CC1。此外,菌株BACYitc8-7还对小孢拟盘多毛孢具有很好的抑制作用,抑菌带宽高达66.25 mm。小孢拟盘多毛孢为重要的植物病原体,能引起橄榄果实腐烂、闽楠叶枯病、麻疯树叶枯病等[22]。在澳洲坚果种植基地,经常发现有小孢拟盘多毛孢引起的澳洲坚果叶枯、落叶等病害[23]。此外菌株BACYitc8-7对尖孢炭疽菌MLZZP3、尖孢炭疽菌DFMP1、胶孢炭疽菌、橡胶树褐根菌、橡胶疫霉、五隔大无性孢丽赤壳菌、茄类镰刀菌均有抑制作用,由此可见,BACYitc8-7是一株具有广谱抗菌活性的生防菌株。
假单胞菌(spp)的作用机制主要是产生次生代谢产物包括抗生素吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA)、2,4-二乙酰基间苯三酚(2,4-diacetylphloroglucinol,PHL)、硝吡咯菌素(pyrrolnitrin,PRN)、藤黄绿脓菌素(pyoluterorin,PLT)、假单胞菌酸(pseudomonic acid)、氢氰酸和植物生长素吲哚乙酸(indole-3- acetic acid,IAA)[24-25],能防治青枯菌()、丝核菌()、疫霉菌()、黑曲霉()、辣椒炭疽病菌()[26-30]等多种病原菌。为研究菌株BACYitc8-7中是否含有PCA、PHL、PLT、PRN这4类次生代谢产物的基因,本研究参考张清霞等[19]的研究方法进行实验,最终仅有次生代谢产物基因成功获取,说明产生PCA来发挥抑菌作用是菌株BACYitc8-7可能的抑菌途径之一。
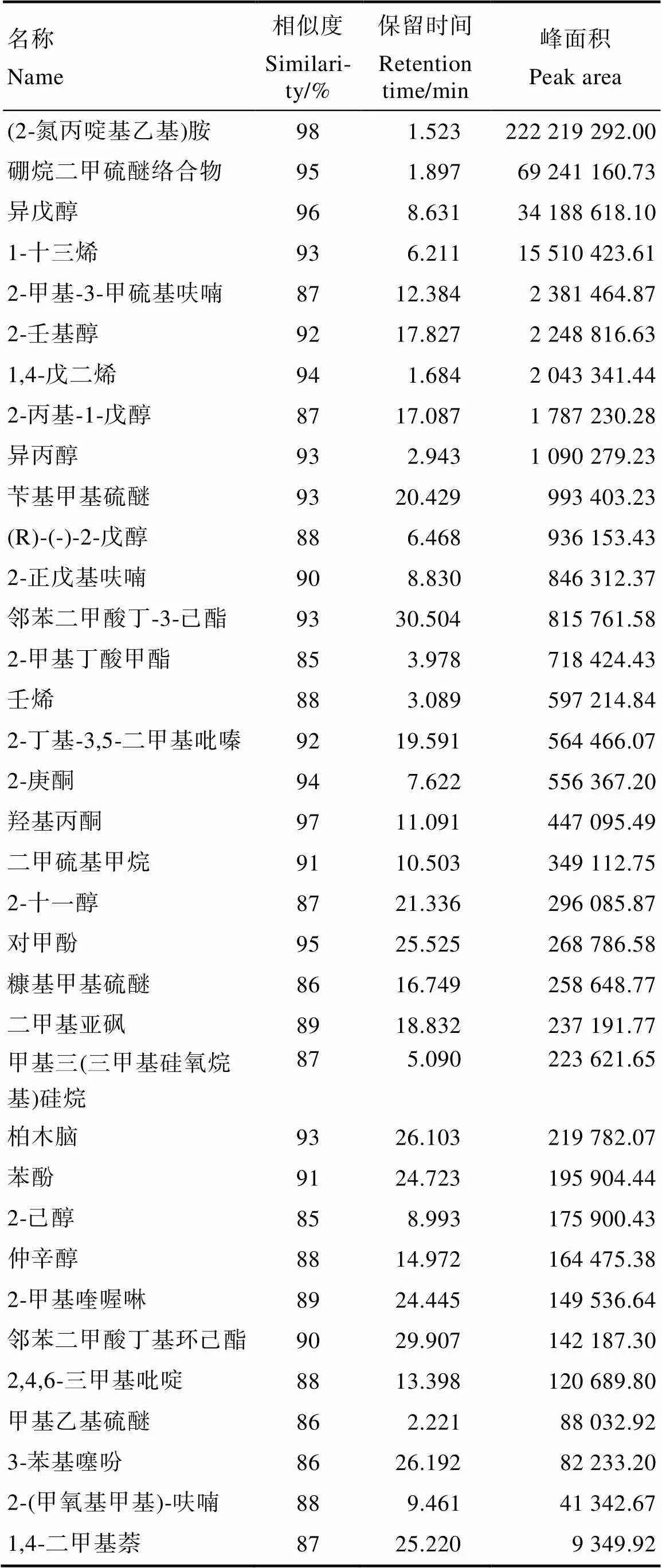
表5 菌株BACYitc8-7挥发性物质组分
与抗菌物质或脂肽类物质相比,挥发性物质中的抑菌物质更易在土壤、空气中扩散和渗透[31],FERNANDO等[32]从细菌中分离鉴定到包括醛类、醇类、酮类、硫化物等23种挥发性物质,其中有6种物质能够抑制核盘菌菌丝的生长和菌核的生成。GOTOR等[33]报道解淀粉芽孢杆菌CPA-8产生的挥发性物质3-羟基-2-丁酮、1,3-戊二烯、噻吩对、、均具有较好抑制作用。李宝庆等[34]从枯草芽孢杆菌BAB-1的挥发性物质中明确了甲酸、正丙胺、二甲胺、丙酸4种挥发性物质对番茄灰霉菌具有极强的抑菌作用。细菌产生的挥发性物质除具有抑菌作用外,还有促生长等作用,RYU等[35-36]报道乙酰甲基原醇(acetoin)、2,3-丁二醇(2,3-butanediol)能促进拟南芥的生长;TAHIR等[37]报道解淀粉芽孢杆菌产生的挥发性物质1,2-苯并异噻唑-3-酮、苯甲醛和1,3-丁二烯可抑制青枯雷尔氏菌()的运动性。
张清霞等[19]报道假单胞菌产生的挥发性有机化合物如3-羟基-2-丁酮及2R,3R-丁二醇等对植物病原菌有抑制作用。本研究用双皿对扣法探究假单胞菌BACYitc8-7的挥发性物质对橡胶树多主棒孢菌的抑菌效果,发现菌株挥发性物质能抑制病原菌的生长。采用HS-SPME-GC-MS对菌株BACYitc8-7挥发性物质进行检测,发现其挥发性有机化合物包括胺类、醇类、烯类、酚类、酯类、吡嗪类等35种,其中戊二烯和噻吩这2种化合物与GOTOR等[33]报道相同,初步推断戊二烯和噻吩在菌株BACYitc8-7抑制多主棒孢菌中起重要作用。
梁艳琼等[20]利用双皿对扣法和菌丝生长速率法评定LB、TSB-YE、TSB、NB和PDA不同营养条件下枯草芽孢杆菌Czk1产抑菌挥发性物质的最优培养基为LB。本研究测定金氏B、LB、NA、高氏和PDA不同营养条下菌株BACYitc8-7产抑菌挥发性物质的最优培养基为LB,结果与梁艳琼等[20]的报道相似。
本课题组通过表型鉴定和基因序列分析,从西双版纳橡胶树根部土壤中筛选了一株铜绿假单胞菌BACYitc8-7。抑菌谱研究表明,菌株BACYitc8-7比已报道的拮抗多主棒孢菌的铜绿假单胞CC1具有更好的抑菌能力,且对植物病原体——小孢拟盘多毛孢也具有很好的抑菌能力。此外,发现菌株BACYitc8-7的挥发性物质对橡胶树多主棒孢菌具有抑菌效果;LB为产挥发性物质的最优培养基;菌株BACYitc8-7挥发性物质包括胺类、醇类、烯类、酚类、酯类、吡嗪类等35种,其中戊二烯和噻吩在菌株BACYitc8-7抑制多主棒孢菌中可能起重要作用。
假单胞菌在环境修复和生物防治等方面具有很大的应用潜力,但是假单胞菌属中的铜绿假单胞菌属是动、植物和人类条件致病菌,对免疫力弱的病人具有一定的威胁性,虽然BACYitc8-7来源于橡胶根际,但其对人类的致病性还未知。本课题组后续将针对BACYitc8-7的致病性、抑菌代谢产物定性、挥发性物质中的主要抑菌组分进行研究,为开发新型绿色农药奠定基础。
[1] 蔡志英. 橡胶树常见病害诊断及其防治[M]. 北京: 中国农业科学技术出版社, 2017.
CAI Z Y. Diagnosis and control of common diseases of rubber trees[M]. Beijing: China Agricultural Science and Technology Press, 2017. (in Chinese)
[2] 李博勋, 冯艳丽, 刘先宝, 蔡吉苗, 陆翠梅, 郑肖兰, 黄贵修. 我国热带作物多主棒孢种群多样性及致病力分化分析[J]. 热带作物学报, 2019, 40(12): 2456-2465.
LI B X, FENG Y L, LIU X B, CAI J M, LU C M, ZHENG X L, HANG G X. Genetic diversity and pathogenic variability among isolates offrom tropical crops in China[J]. Chinese Journal of Tropical Crops, 2019, 40(12): 2456-2465. (in Chinese)
[3] 李宝聚, 高 苇, 石延霞, 谢学文. 多主棒孢和棒孢叶斑病的研究进展[J]. 植物保护学报, 2012, 39(2): 171-176.
LI B J, GAO W, SHI Y X, XIE X W. Progress in researches onleaf spot[J]. Acta Phytophylacica Sinica, 2012, 39(2): 171-176. (in Chinese)
[4] 李 晗, 冉 茂, 陈海涛, 吴 杰, 张 帅, 徐 宸, 杨 超, 汪代斌, 孙现超. 植物棒孢霉叶斑病的发生及防治研究进展[J]. 植物医生, 2020, 33(1): 15-20.
LI H, RAN M, CHEN H T, WU J, ZHANG S, XU C, YANG C, WANG D B, SUN X C. Progress in researches ofleaf spot[J]. Plant Doctor, 2020, 33(1): 15-20. (in Chinese)
[5] 王进强, 何明霞, 张春霞, 周 明. 橡胶树棒孢霉落叶病苗圃防治初报[J]. 中国农学通报, 2011, 27(22): 51-54.
WANG J Q, HE M X, ZHANG C X, ZHOU M. Preliminary report of chemical controlleaf fall disease of hevea rubber in rubber nursery[J]. Chinese Agricultural Science Bulletin, 2011, 27(22): 51-54. (in Chinese)
[6] 林运萍, 蒋菊生, 白先权, 易杰祥. 橡胶树棒孢霉落叶病的发生及防治[J]. 中国热带农业, 2008(1): 54-55.
LIN Y P, JIANG J S, BAI X Q, YI J X. The occurrence and prevention ofleaf fall disease of hevea rubber[J]. China Tropical Agriculture, 2008(1): 54-55. (in Chinese)
[7] 王 静, 郑永华. 拮抗菌在果蔬采后病害生物防治中的应用[J]. 生物技术进展, 2013, 3(6): 393-398.
WANG J, ZHENG Y H. Application of microbial antagonists as biocontrol agents against postharvest diseases of fruits and vegetables[J]. Current Biotechnology, 2013, 3(6): 393-398. (in Chinese)
[8] 赵昱榕, 李 磊, 谢学文, 石延霞, 柴阿丽, 孙广玉, 李宝聚. 贝莱斯芽胞杆菌ZF2对多主棒孢病菌防治效果[J]. 中国生物防治学报, 2019, 35(2): 62-70.
ZHAO Y R, LI L, XIE X W, SHI Y X, CHAI A L, SUN G Y, LI B J. Biocontrol effect ofstrain ZF2 against[J]. Chinese Journal of Biological Control, 2019, 35(2): 62-70. (in Chinese)
[9] 时 涛, 彭建华, 刘先宝, 戴英葵, 黄贵修. 橡胶树内生细菌多样性初探及拮抗菌株的筛选[J]. 中国森林病虫, 2011, 3(2): 5-9.
SHI T, PENG J H, LIU X B, DAI Y K, HUANG G X. Rubber endophytic bacteria population diversity and screening of antagonistic strains[J]. Forest Pest and Disease, 2011, 3(2): 5-9. (in Chinese)
[10] 李岚岚, 戴利铭, 蒋桂芝, 刘一贤, 施玉萍, 蔡志英. 橡胶树炭疽病生防内生菌的分离鉴定及抑菌作用研究[J]. 热带作物学报, 2021, 42(10): 2958-2965.
LI L L, DAI L M, JIANG G Z, LIU Y X, SHI Y P, CAI Z Y. Isolation, identification and bacteriostasis study of endophytic bacteria to controlleaf disease on rubber tree[J]. Chinese Journal of Tropical Crops, 2021, 42(10): 2958-2965. (in Chinese)
[11] 桑建伟. 香蕉枯萎病拮抗内生芽孢杆菌BEB17的分离鉴定及生防潜力分析[D]. 海口: 海南大学, 2018.
SANG J W. Isolation, identification and biocontrol potential analysis of endophyticBEB17 antagonistic banana fusarium wilt[D]. Haikou: Hainan University, 2018. (in Chinese)
[12] 吴利民, 陆宁海, 高扬帆, 田雪亮, 郎剑锋, 徐瑞富. 哈茨木霉TR-12对多主棒孢霉菌的拮抗作用[J]. 湖北农业科学, 2006, 45(6): 749-750.
WU L M, LU N H, GAO Y F, TIAN X L, LANG J F, XU R F. Antagonism ofstrain TR-12 againstWei[J]. Hubei Agricultural Sciences, 2006, 45(6): 749-750. (in Chinese)
[13] 刘一贤, 施玉萍, 戴利铭, 李岚岚, 蔡志英. 橡胶褐根病拮抗放线菌17-7的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2020, 47(1): 118-129.
LIU Y X, SHI Y P, DAI L M, LI L L, CAI Z Y. Screening, identification and fermentation optimization of an antimicrobial actinomycete strain 17-7 to[J]. Microbiology China, 2020, 47(1): 118-129. (in Chinese)
[14] 陈旭玉, 何其光, 甘炳春. 广藿香棒孢霉叶斑病拮抗菌的分离鉴定及生物农药的筛选[J]. 江西农业学报, 2012, 24(6): 64-66.
CHEN X Y, HE Q G, GAN B C. Isolation and identification of antagonistic bacterium against leaf spot pathogen () inand screening of biological medicaments[J]. Acta Agriculturae Jiangxi, 2012, 24(6): 64-66. (in Chinese)
[15] 张力群, 张俊威. 假单胞菌产生的抗生素[J]. 中国生物防治学报, 2015, 31(5): 750-756.
ZHANG L Q, ZHANG J W. Antibiotics produced byspp.[J]. Chinese Journal of Biological Control, 2015, 31(5): 750-756. (in Chinese)
[16] 任小平, 谢关林, 王 笑. 铜绿假单胞菌ZJ1999对水稻纹枯病的防治及其在水稻上的定殖[J]. 中国生物防治, 2006, 2(1): 54-57.
REN X P, XIE G L, WANG X. Application and colonization ofZJ1999 for biocontrol of, pathogen of rice sheath blight[J]. Chinese Journal of Biological Control, 2006, 2(1): 54-57. (in Chinese).
[17] 申顺善, 张莹莹, 张维娜, 吕雅悠, 朱卓琳, 朴凤植. 绿针假单胞菌HL5-4对番茄灰霉菌的抑制活性及其定殖能力[J]. 园艺学报, 2016, 43(6): 1195-1202.
SHEN S S, ZHANG Y Y, ZHANG W N, LV Y Y, ZHU Z L, PIAO F Z. Antifungal activity ofHL5-4 against tomato gray mold and its colonization ability[J]. Acta Horticulturae Sinica, 2016, 43(6): 1195-1202. (in Chinese)
[18] 宁 爽. 内生假单胞菌BTa14、Bar25促生抗病作用及机理的研究[D]. 烟台: 烟台大学, 2019.
NING S. Study on the growth-promoting, disease-resistance effects and mechanisms of endophyticBTa14 and Bar25[D]. Yantai: Yantai University, 2019. (in Chinese)
[19] 张清霞, 张 迎, 何玲玲, 陈夕军, 童蕴慧, 纪兆林. 水稻纹枯病拮抗细菌7-5的鉴定及其生防机制初步研究[J]. 中国水稻科学. 2018, 32(3): 277-284.
ZHANG Q X, ZHANG Y, HE L L, CHEN X J, TONG W H, JI Z L. Identification of strain 7-5, antagonistic to rice sheath blight, and preliminary study of its biocontrol mechanism[J]. Chinese Journal of Rice Science, 2018, 32(3): 277-284. (in Chinese)
[20] 梁艳琼, 唐 文, 董文敏, 吴伟怀, 李 锐, 习金根, 谭施北, 郑金龙, 黄 兴, 陆 英, 贺春萍, 易克贤. 枯草芽孢杆菌菌株Czk1挥发性物质的抑菌活性及其组分分析[J]. 南方农业学报, 2019, 50(11): 2465-2474.
LIANG Y Q, TANG W, DONG W M, WU W H, LI R, XI J G, TAN S B, ZHENG J L, HUANG X, LU Y, HE C P, YI K X. Antifugal effect and components analysis of volatile organic compounds fromCzk1[J]. Journal of Southern Agriculture, 2019, 50(11): 2465-2474. (in Chinese)
[21] GE Y H, HUANG X Q, WANG S L, ZHANG X, XU Y. Phenazine-1-carboxylic acid is negatively regulated and pyoluteorin positively regulated by gacA insp. M18[J]. FEMS Microbiology Letters, 2004, 237(1): 41-47.
[22] 蒋桂芝, 何双凌, 陶 亮, 岳 海, 贺熙勇. 澳洲坚果叶枯病病原鉴定及其防治药剂筛选[J]. 中国植保导刊, 2018, 38(7): 20-24.
JIANG G Z, HE S L, TAO L, YUE H, HE X Y. Identification of pathogen of macadamia leaf blight and selection of controlling pesticide[J]. China Plant Protection, 2018, 38(7): 20-24. (in Chinese)
[23] 柳 凤, 杨顺锦, 詹儒林, 赵艳龙. 澳洲坚果叶斑病病原鉴定及其生物学特性[J]. 植物保护学报, 2011, 38(5): 437-442.
LIU F, YANG S J, ZHAN R L, ZHAO Y L. Identification and biological characteristics of macadamia leaf spot caused by[J]. Acta Phytophylacica Sinica, 2011, 38(5): 437-442. (in Chinese)
[24] 周 莲, 蒋海霞, 金凯明, 孙 爽, 张 薇, 张雪洪, 何亚文. 高产申嗪霉素和吩嗪-1-酰胺的水稻根际铜绿假单胞菌PA1201分离、鉴定与应用潜力[J]. 微生物学报, 2015(4): 401-411.
ZHOU L, JIANG H X, JIN K M, SUN S, ZHANG W, ZHANG X H, HE Y W. Isolation, identification and characterization of rice rhizobacteriumpa1201 producing high level of biopesticide “shenqinmycin” and phenazine-1-carboxamide[J]. Acta Microbiologica Sinica, 2015(4): 401-411. (in Chinese)
[25] 蒋海霞, 周 莲, 何亚文. 铜绿假单胞菌生防菌株抑菌代谢产物及其生防应用研究进展[J]. 微生物学通报, 2015, 42(7): 1338-1349.
JIANG H X, ZHOU L, HE Y W. Research progress in biocontrol strain: antifungal metabolites and their applications in biocontrol[J]. Microbiology China, 2015, 42(7): 1338-1349. (in Chinese)
[26] 胡军华, 周泽扬, 张伏军, 蓝希钳, 林立鹏, 唐 婧, 马淑华, 谢 洁, 肖 杰, 潘国庆. 烟草根际细菌铜绿假单胞菌swu31-2的定殖能力及其对烟草青枯病的防治作用[J]. 植物保护, 2009, 35(5): 89-94.
HU J H, ZHOU Z Y, ZHANG F J, LAN X Q, LIN L P, TANG J, MA S H, XIE J, XIAO J, PAN G Q. Analysis of the colonization of tabacco rhizosphere bacterium swu31-2 and its control effect on tabacco bacterial wilt[J]. Plant Protection, 2009, 35(5): 89-94. (in Chinese)
[27] WU D Q, YE J, OU H Y, WEI X, XU Y. Genomic analysis and temperature-dependent transcriptome profiles of the rhizosphere originating strainM18[J]. BMC Genomics, 2011, 12(1): 438-455.
[28] LEE J Y, MOON S S, HWANG B K. Isolation andandactivity againstandof phenazine-1-carboxylic acid fromstrain GC-B26[J]. Pest Management Science, 2003, 59(8): 872-882.
[29] RANE M R, SARODE P D, CHAUDHARI B L, CHINCHOLKAR S B. Exploring antagonistic metabolites of established biocontrol agent of marine origin[J]. Applied Biochemistry and Biotechnology, 2008, 151(2/3): 665-675.
[30] 肖咪云, 孙孟龙, 阮楚晋, 陈寿昆, 刘裕华, 陆祖军. 生防细菌2016NX1对病原真菌的抑制及发酵条件优化[J]. 广西师范大学学报(自然科学版), 2019, 37(2): 172-182.
XIAO M Y, SUN M L, RUAN C J, CHEN S K, LIU Y H, LU Z J. Inhibitory effect of biocontrol bacterium 2016NX1 on plant pathogenic fungi and optimization of fermentation conditions[J]. Journal of Guangxi Normal University (Natural Science Edition), 2019, 37(2): 172-182. (in Chinese)
[31] LI Q, PING N, LU Z, HUANG J, LI G, HSIANG T. Effects of volatile substances ofJK-1 on control ofon tomato fruit[J]. Biological Control, 2012, 61(2): 113-120.
[32] FERNANDO W G D, RAMARATHNAM R, KRISHNAMOORTHY A S, SAVCHUK S C. Identification and use of potential bacterial organic antifungal volatiles in biocontrol[J]. Soil Biology and Biochemistry, 2005, 37(5): 955- 964.
[33] GOTOR V A, TEIXID N, FRANCESCO A D, USALL J, UGOLINI L, TORRES R, MARI M. Antifungal effect of volatile organic compounds produced byCPA-8 against fruit pathogen decays of cherry[J]. Food Microbiology, 2017, 64: 219-225.
[34] 李宝庆, 鹿秀云, 郭庆港, 钱常娣, 李社增, 马 平. 枯草芽孢杆菌 BAB-1产脂肽类及挥发性物质的分离和鉴定[J]. 中国农业科学, 2010, 43(17): 3547-3554.
LI B Q, LU X Y, GUO Q G, QIAN C D, LI S Z, MA P. Isolation and identification of lipopeptides and volatile compounds produced bystrain BAB-1[J]. Scientia Agricultura Sinica, 2010, 43(17): 3547-3554. (in Chinese)
[35] RYU C M, FARAG M A, HU C H, REDDY M S, KLOEPPER J W, PAEE P W. Bacterial volatiles induce systemic resistance in[J]. Plant Physiology, 2004, 134(3): 1017-1026.
[36] RYU C M, FARAG M A, HU C H, REDDY M S, WEI H X, PARE PW, KLOEPPER J W. Bacterial volatiles promote growth in[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(8): 4927-4932.
[37] TAHIR H A S, GU Q, WU H J, NIU Y D, HUO R, GAO X W.volatiles adversely affect the physiology and ultra-structure ofand induce systemic resistance in tobacco against bacterial wilt[J]. Scientific Reports, 2017, 7(1): 40481-40496.
Isolation and Identification of Antagonistic Bacteria BACYitc8-7 Against Deciduous Disease Pathogen () and Analysis of Antibacterial Components of Volatile Organic Compounds from Rubber Tree
DAI Liming, LI Lanlan, SHI Yuping, LIU Yixian, DENG Yueye, WU Zhonghua, CAI Zhiying*
Yunnan Institute of Tropical Crops, Jinghong, Yunnan 666100, China
is an important pathogen causingleaf fall disease of rubber trees. Chemical fungicides are widely used to prevent and control the disease at present, which brings severe ecological environmental issues in rubber planting areas. Isolating and screening bacteria strains with inhibitory activity againstfrom rhizosphere soil of rubber trees would provide theoretical foundation for researches and development of biological control agents onleaf fall disease. Bacteria with high antagonistic activity was obtained from the rhizosphere soil of rubber trees with leaf fall disease by using dilution plate coating and plate-confrontation, its bacteriostatic diameter was (57.68±0.66)mm.It was observed that nine important plant pathogenic fungi could be inhibited by the strain as well. Based on morphological, physiological, biochemical characteristics and 16S rRNA gene sequence, the strain was basically consistent with,and was named BACYitc8-7. The activity of the volatile compounds of BACYitc8-7 againstwas evaluated when LB, NA, Gause, Kim B and PDA were used as nutrition sources. The strongest antagonistic effects were found in Kim B and LB mediums, and the inhibition rate was43.47%‒48.69%. 35 substances, including amines, alcohols, alkenes, phenols, esters and pyrazines were obtained from the antimicrobial components of BACYitc8-7 collected and detected by headspace solid phase micro extraction-gas chromatography-mass spectrometry (HS-SPME-GC-MS), and the top five contents were amine, borane dimethyl sulfide complex, isoamyl alcohol, 1-triene and 2-methyl-3-methylthiofuran, respectively.
; antagonistic bacteria; isolation and identification; volatile substances; antibacterial components
S794.1
A
10.3969/j.issn.1000-2561.2022.08.013
2022-01-27;
2022-03-11
云南省热带作物科学研究所青年项目(No. QNCZ2020-8);农业基础性长期性科技项目(No. ZX04S270200);云南省应用基础研究计划青年项目(No. 2018FD156)。
戴利铭(1990—),女,硕士,助理研究员,研究方向:植物保护与微生物利用。*通信作者(Corresponding author):蔡志英(CAI Zhiying),E-mail:caizhiyingyn@sina.com。

