燃料电池高活性Pt/C电催化剂的制备
许友, 徐辉, 梁燕, 王光应, 赵羽
燃料电池高活性Pt/C电催化剂的制备
许友, 徐辉, 梁燕, 王光应, 赵羽*
(安徽元琛环保科技股份有限公司,安徽 合肥 230000)
实现低铂(Pt)载量高催化活性碳载铂(Pt/C)催化剂的制备,是达到降本增效的有效手段.实验研究了乙二醇溶液(EG)、甲醛溶液(HCHO)以及碱液(NaOH溶液)三者用量比例和后续热处理对水热法制备Pt/C催化剂电催化性能的影响.采用极化曲线(LSV)和循环伏安曲线(CV)表征催化剂的电催化性能,以及计算了Pt的电化学活性面积(ECA).通过X射线衍射(XRD)、透射电子显微镜(TEM)以及热重分析(TG)对催化剂进行物化性能表征.实验发现:在一定范围内适当提高HCHO占比可有效提升催化剂电催化性能,当(EG)∶(HCHO)∶(NaOH)溶液体积比为1∶2∶1时,所制备的Pt/C催化剂经过250 ℃的后续热处理后,电催化性能最优.以该方法制备的低载量Pt/C催化剂的ECA大于高载量的商业Pt/C催化剂的ECA.
Pt/C催化剂; 水热法; 热处理; 极化曲线(LSV); 循环伏安曲线(CV)
0 引 言
全球气候变暖以及传统化石能源的使用带来系列环境问题且愈演愈烈,能源转型已迫不及待[1].燃料电池区别于传统的燃料燃烧系统,是一种将燃料中的化学能转化成电能的装置,以燃料作为阳极,这里的燃料可以是氢气(H2)、甲醇(CH3OH)等有机燃料[2],也可以是锌(Zn)、铝(Al)等无机金属[3].当燃料为H2时,通过自身氧化消耗,失去的电子经过外电路被氧气(O2)捕获,在催化剂的作用下发生氧还原(ORR)反应,生成无污染的水.而同阳极反应相比,阴极反应的发生更加困难,因此关于阴极反应即ORR反应催化剂的研究一直影响着整个燃料电池的研究进展[4].
铂(Pt)是一种优秀的燃料电池催化剂,然而Pt价格昂贵,地球储量非常少,Pt单质制备困难.为实现提高Pt利用率的同时保证其高催化活性,碳载铂(Pt/C)催化剂得到广泛应用[5-8].目前关于Pt/C催化剂的制备方法很多,如:液相还原法[9-11]、浸渍法[12]、微波加热法[13-15]和溶剂热解法[16]等,这些方法的主要差异是分散剂、还原剂、加热或热处理方式以及反应气氛等[17-18].上述方法多数涉及H2或氮气(N2)氛围,或者是利用强还原剂如硼氢化钠(NaBH4)等易制爆试剂[19-20],综合考虑制备工艺以及环境友好性等因素,这些方法的产业化前景有限.
水热法是一种纳米材料制备的常用方法,其合成材料结晶程度较高,纳米颗粒大小均匀,制备工艺简单,容易产业化.Pt/C催化剂的制备研究重点仍然在于活性中心颗粒大小、均一性和分散性[21],具体方法包括调控溶液中分散剂和还原剂的用量、碱液(NaOH溶液)的用量以及反应温度等.水热法制备催化剂一般是将碳载体分散于分散剂中,在其中加入一定量的氯铂酸(H2PtCl6·6H2O)溶液,再加入还原剂,超声分散,然后加入一定量的酸碱液调控溶液的pH.加入过量的还原剂在一定程度上能够提高所得Pt/C催化剂的电催化性能,但也会明显影响催化剂的分散性.在还原剂量不够的情况下,尽管所得产物的分散性很好,但其电催化活性明显偏低.因此,分散剂和还原剂用量的控制对催化剂的分散性和电催化性能起着至关重要的作用.
针对以上问题,本文作者研究了乙二醇(EG)、甲醛溶液(HCHO)和NaOH混合体系不同用量对所得Pt/C催化剂的电催化性能的影响.另一方面,通过对所得催化剂进行高温热处理,可进一步提升催化剂的电催化性能.
1 实验
1.1 主要试剂
主要试剂包括:H2PtCl6·6H2O,EG,HCHO,无水乙醇和NaOH(片状固体)均为分析纯,氢氧化钾(KOH,电子级),卡博特导电碳黑(XC-72),自制纯水,Nafion 117溶液(质量分数为5%).
1.2 主要仪器
主要仪器包括:电子分析天平(华方计量)、电化学工作站(辰华CHI 660E)、旋转圆盘电极(德仪)、超声波清洗器(GT SONIC)、离心机(湖南湘仪)、移液枪(TOPAID)、可调微量移液枪(SMART)、透射电子显微镜(TEM,Talos F200X)和X射线衍射(XRD)仪(Smartlab TM).
1.3 催化剂的制备
水热法制备高效Pt/C催化剂步骤如下:称取20 mg经筛分的XC-72碳粉,置于烧杯中作为碳载体;将H2PtCl6·6H2O分散于纯水中配置成0.02 mol·L-1溶液待用,配置1 mol·L-1的NaOH溶液待用;向XC-72碳粉中加入一定体积的EG和HCHO,超声搅拌20 min,再加入H2PtCl6·6H2O稀释液2 mL,继续超声搅拌10 min;加入NaOH溶液调控pH值到10左右,超声搅拌置于水热反应釜中,180 ℃反应30 min,自然冷却后取出;黑色粉末样品通过离心洗涤并干燥后,再将样品置于250 ℃烘箱中热处理30 min,即得到Pt/C催化剂.
根据添加EG和HCHO体积不同命名催化剂为30EG,20EG10HCHO,10EG20HCHO和5EG25HCHO(标号举例:10EG20HCHO即EG和HCHO的加入量分别为10 mL和20 mL);根据NaOH溶液或水的用量不同命名催化剂为10NaOH,12NaOH和14H2O(标号举例:10NaOH即10 mL NaOH溶液);自制Pt/C催化剂标记为SM Pt/C,购买的商业Pt/C催化剂标记为AF Pt/C.
1.4 电催化性能测试
采用电化学工作站和旋转圆盘电极对催化剂电催化性能进行测试.三电极中以银/氯化银(Ag/AgCl)或汞/氯化汞(Hg/Hg2Cl2)作为参比电极,Pt丝作为对电极,工作电极为滴涂有催化剂的玻碳电极.称取5 mg所得Pt/C催化剂,置于3 mL的离心管中,向其中加入1 mL乙醇和Nafion(质量分数5%)混合溶液,超声振荡30 min,分散均匀后用微量移液管移取10 μL分散液,均匀滴涂到玻碳电极表面(直径为4 mm),自然风干后备用.测量循环伏安曲线(CV)时,电解液为含饱和N2的硫酸(H2SO4,0.5 mol·L-1)溶液,圆盘转速为1 600 r·min-1,扫描范围为(-0.25~1.1 V)vs.Hg/Hg2Cl2饱和KCl溶液,扫描速率为20 mV·s-1;测试极化曲线(LSV)时,电解液为含饱和O2的KOH(0.1 mol·L-1)溶液,圆盘转速为1 600 r·min-1,扫描范围为(-0.6~0.4 V)vs.Ag/AgCl饱和KCl溶液,扫描速率为10 mV·s-1.
2 结果与讨论
2.1 EG和HCHO不同用量对所得催化剂电催化性能的影响
为了调控催化剂的分散性和电催化活性,研究了EG和HCHO液相混合体系中各组分用量比例(EG和HCHO体积比分别为30∶0,20∶10,10∶20和5∶25)对制备催化剂的电催化活性及形貌大小的影响,如图1所示.
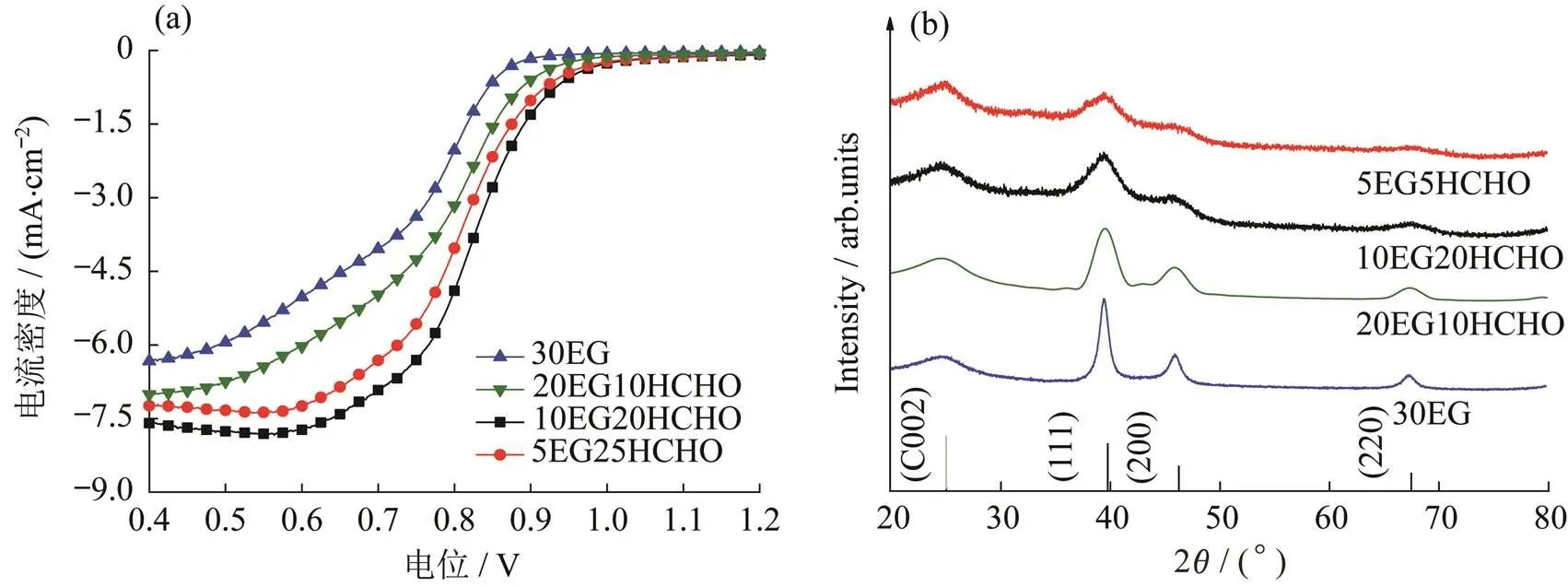
图1 不同EG和HCHO用量所得产物的(a) LSV和(b) XRD图
从不同体积用量EG和HCHO所对应产物的LSV图可以看出,当EG和HCHO体积比为10∶20时,所得产物电催化性能最佳.对比纯EG组的LSV,不难看出,HCHO的加入使起始电位明显正移,极限电流密度达8.2 mA·cm-2.主要原因在于具有较强还原性的HCHO的加入,使氯铂酸的还原反应过程更快,成核更迅速,制备的纳米颗粒更小.XRD图也说明了这一点,有HCHO加入制得的催化剂XRD衍射峰明显宽化,呈现向非晶体过渡趋势,畸变过程中其表面原子呈现无序排列的不饱和状态,使催化剂表面能增大,进而表现出更优的电催化性能.同时拍摄了4种不同体系下所得催化剂的TEM照片,如图2所示.
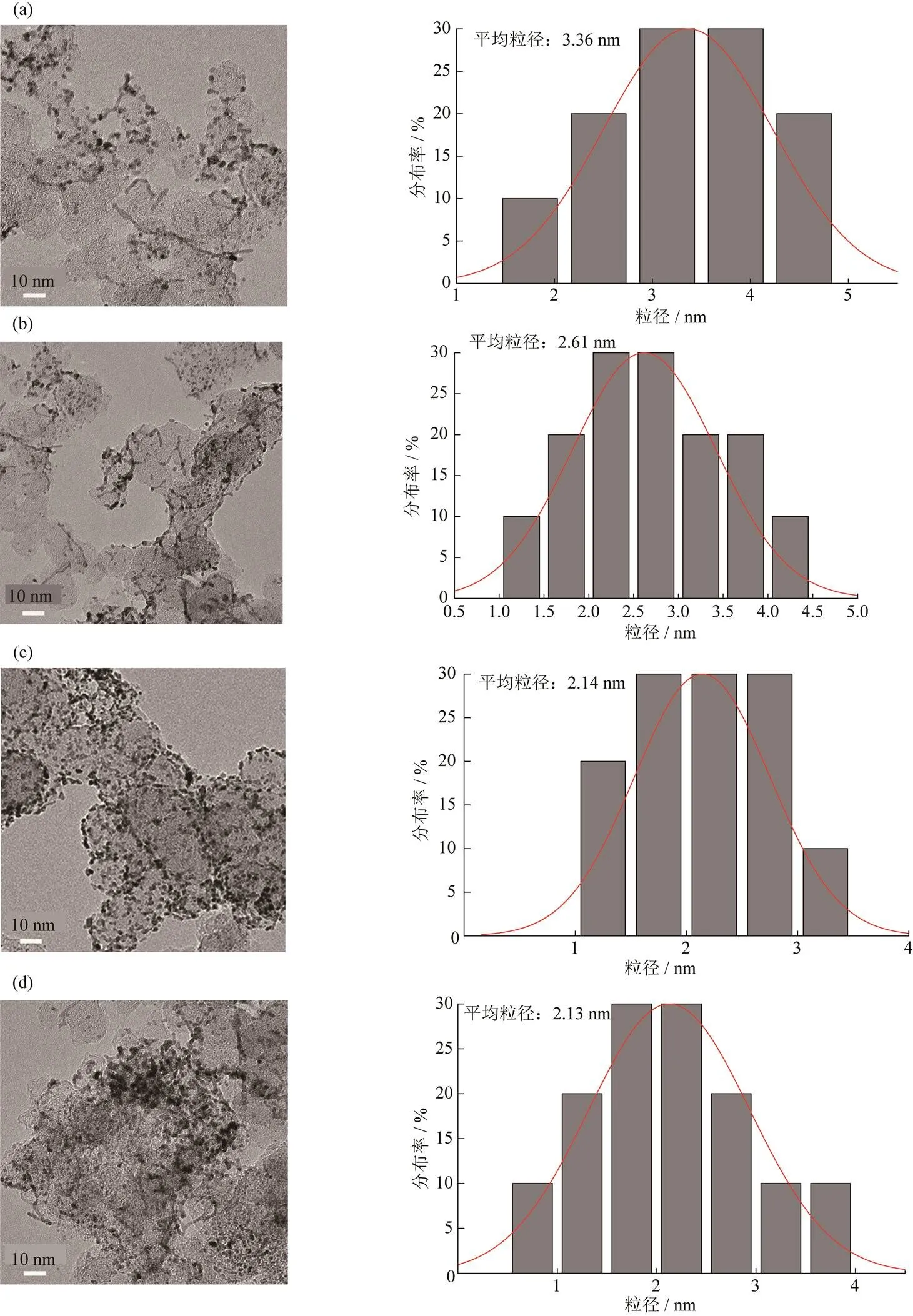
图2 不同EG和HCHO用量所得催化剂的TEM图(左)和Pt粒子的粒径分布图(右).
(a) 30∶0;(b) 20∶10;(c) 10∶20;(d) 5∶25
从各反应体系所得催化剂的TEM图和Pt粒子的粒径分布图(图2)可以直观看出,有HCHO加入的反应体系所得催化剂中Pt纳米粒子的平均粒径在在2.1 nm左右,而未加入HCHO的反应体系所得催化剂中Pt纳米粒子的平均粒径在3.3 nm左右.且随着HCHO用量增多,所得催化剂中Pt纳米粒子分散不均,出现局部团聚现象.即在EG和HCHO用量比为10∶20反应体系下,所得催化剂电催化性能最好.
2.2 碱液用量对所得催化剂电催化性能的影响
EG和HCHO还原制备Pt/C催化剂的反应原理如下[22]:
Pt4++4HO-+CH2OH-CH2OHPt+CH2OH-COOH+3H2O.
Pt4++4HO-+HCHOPt+CO2+3H2O.
从该反应的反应原理可以看出,适当提高溶液的pH值有利于Pt转化的进行.通过对碱液用量的调控,以一定体积的纯水为对照组进行探究,所得催化剂的相关性能测试结果如图3和图4所示.
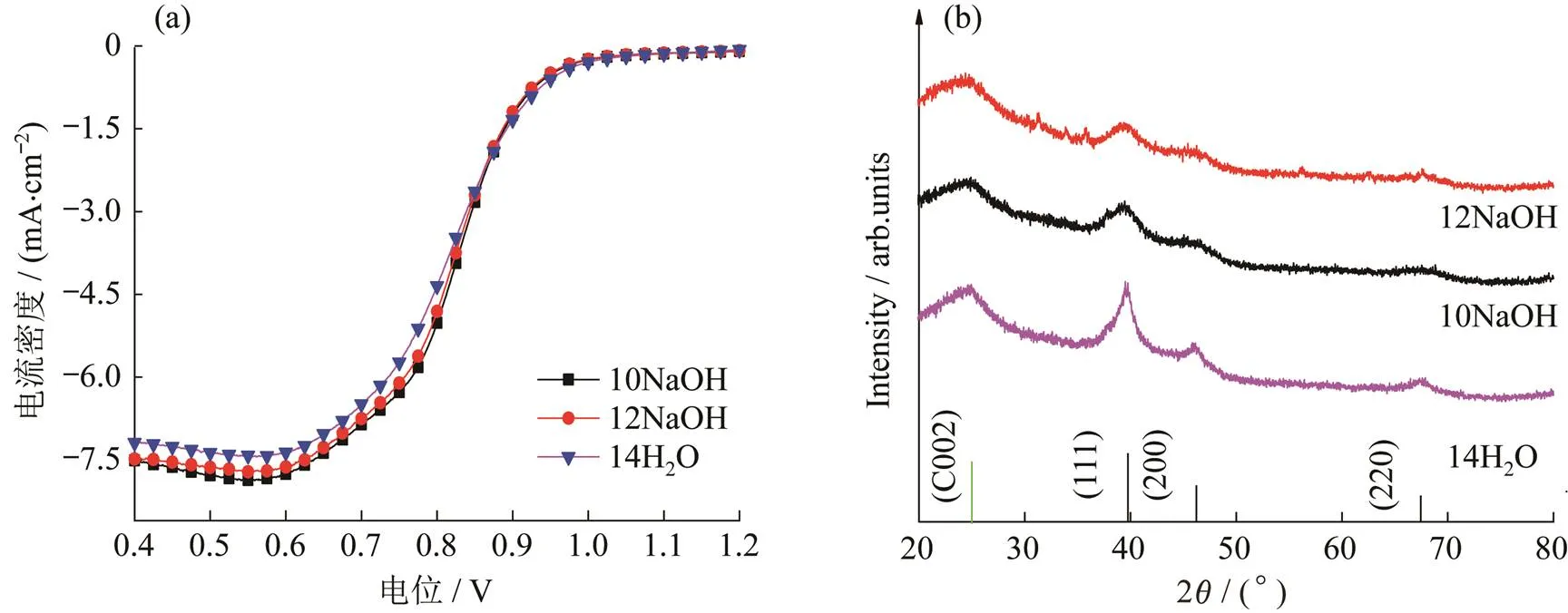
图3 不同NaOH溶液和水的用量所得催化剂的(a) LSV和(b) XRD谱图
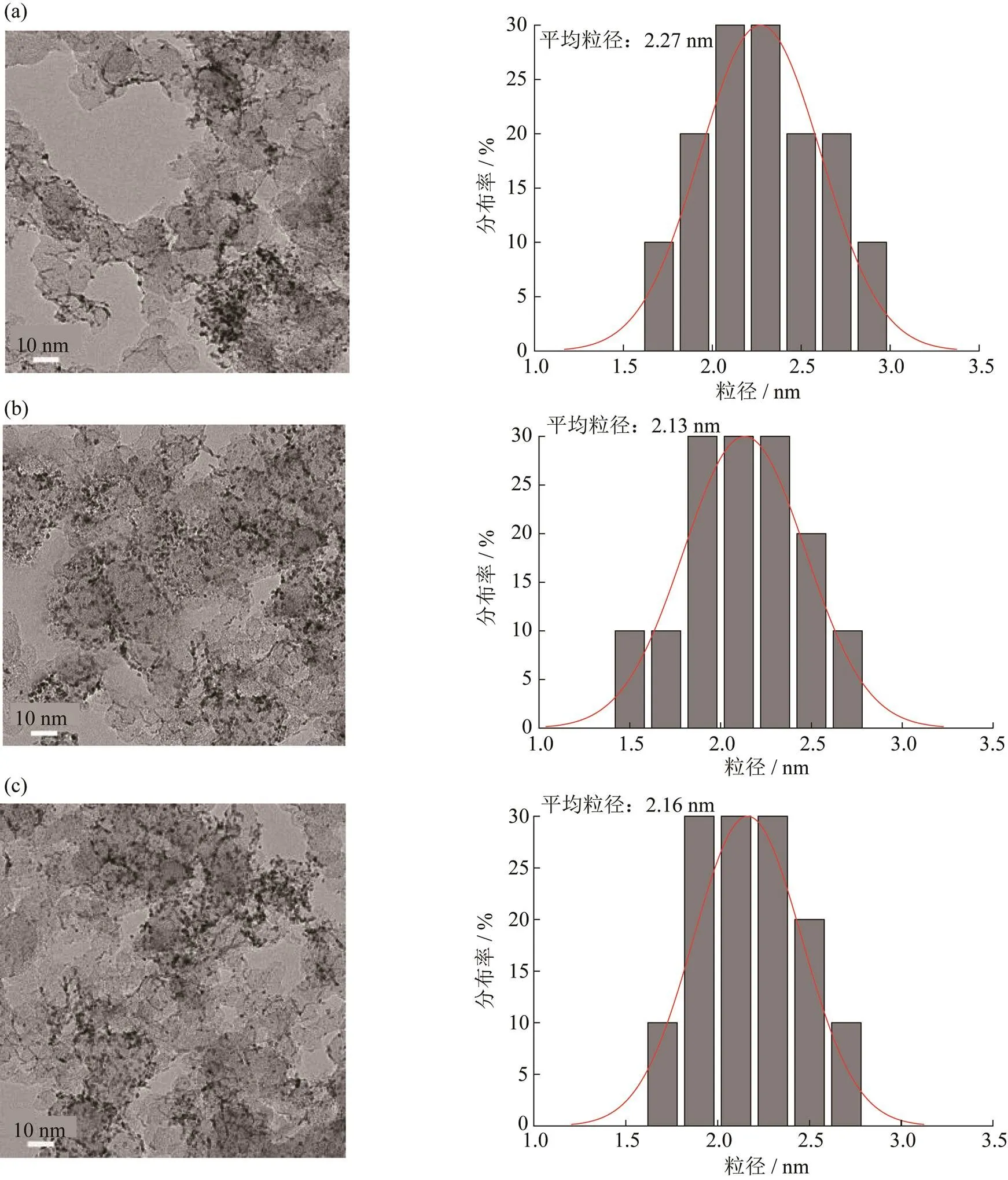
图4 不同NaOH溶液和水的用量所得催化剂的TEM图(左)和Pt粒子的粒径分布图(右).
(a) 14H2O;(b) 10NaOH;(c) 12NaOH
从纯水和不同体积的NaOH溶液所得催化剂的LSV图可以看出,NaOH溶液的加入有利于电催化性能的提升,但在一定的范围内,NaOH溶液的加入量对所得产物的电催化性能影响微小;相比对照组,实验组半波电位提升20 mV左右.从XRD测试结果可以看出:随着碱液的加入,Pt(220)衍射峰半峰宽较对照组呈现一定程度的宽化,碱液的加入促进了反应的快速进行,纳米粒子成核迅速,制备得到的Pt纳米粒子更小.其XRD衍射峰呈现向非晶态过渡趋势,更多的表面缺陷使催化剂具有更高的表面能,活性得到进一步提升.同时拍摄了上述不同NaOH溶液和水的用量所得催化剂的TEM图.
从不同NaOH和水的用量所得到催化剂的TEM图和Pt粒子的粒径分布图(图4)可以直观看出,NaOH体系所得催化剂Pt纳米粒子平均粒径在2.1 nm左右,略低于水体系所得催化剂(平均粒径在2.2 nm左右),且水体系呈现一定程度的团聚现象.即选取NaOH用量为10 mL时,所得催化剂电催化性能最好.
2.3 热处理对催化剂电催化性能的影响
在250 ℃下对所得到的催化剂进行热处理,对比了热处理前后催化剂的电催化性能,如图5所示.
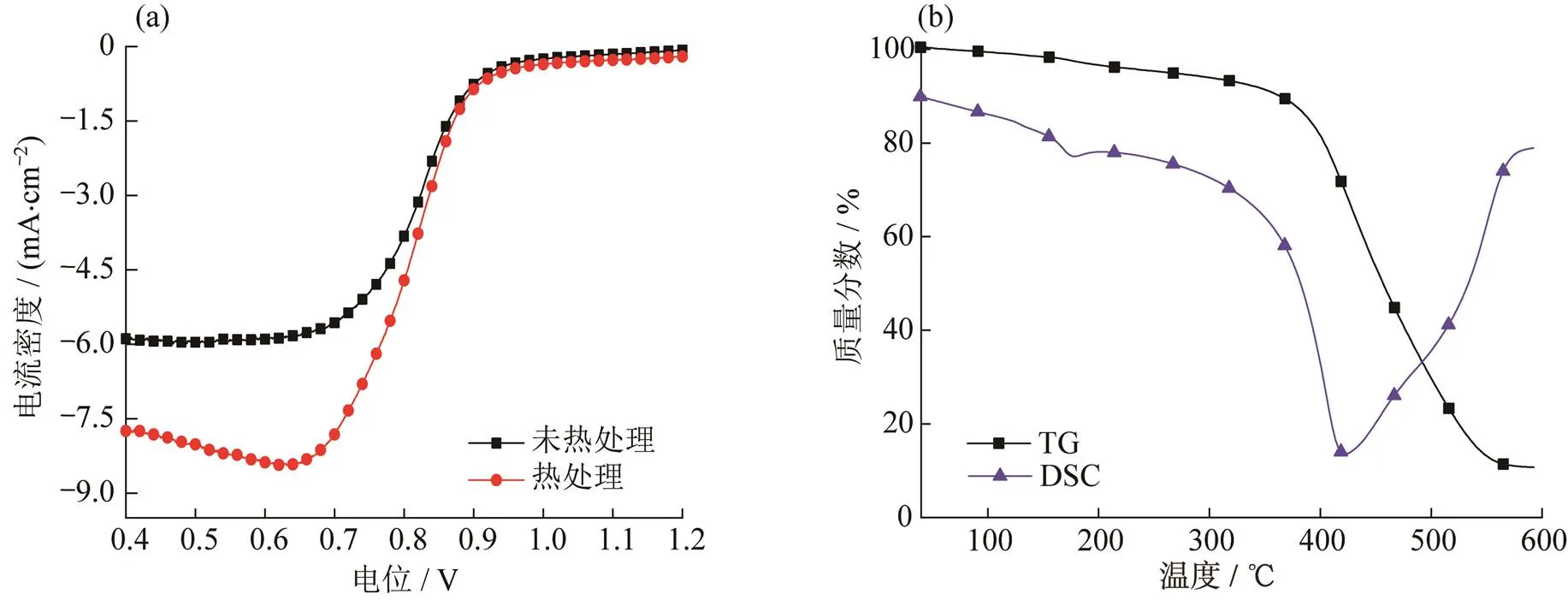
图5 催化剂的LSV和TG曲线.
(a) 热处理和未处理催化剂的LSV;(b) 未热处理催化剂的TG
在催化剂经过热处理和未热处理所对应的LSV中,经过热处理后,催化剂的极限电流密度为6.7 mA·cm-2,是未经过热处理的催化剂极限电流密度(4.7 mA·cm-2)的1.4倍,因为液相反应所得副产物和有机物等易吸附在催化剂表面,通过单纯的离心洗涤无法完全去除,而通过热处理后,表面吸附的杂质被氧化分解,使催化剂导电性增强,因而极限电流密度得到明显提升,如图5(a)所示.从催化剂在空气氛围下的热重分析(TG)曲线可以发现:在200 ℃附近出现一个明显的放热峰,为表面杂质氧化放热峰.即通过热处理,表面杂质被氧化分解,进一步提升催化剂的电催化性能,如图5(b)所示.
最后,选取EG,HCHO和NaOH溶液体积比为10∶20∶10条件下所得产物,在250 ℃热处理30 min,得到最佳条件下的Pt/C催化剂,拍摄其TEM图,如图6所示.
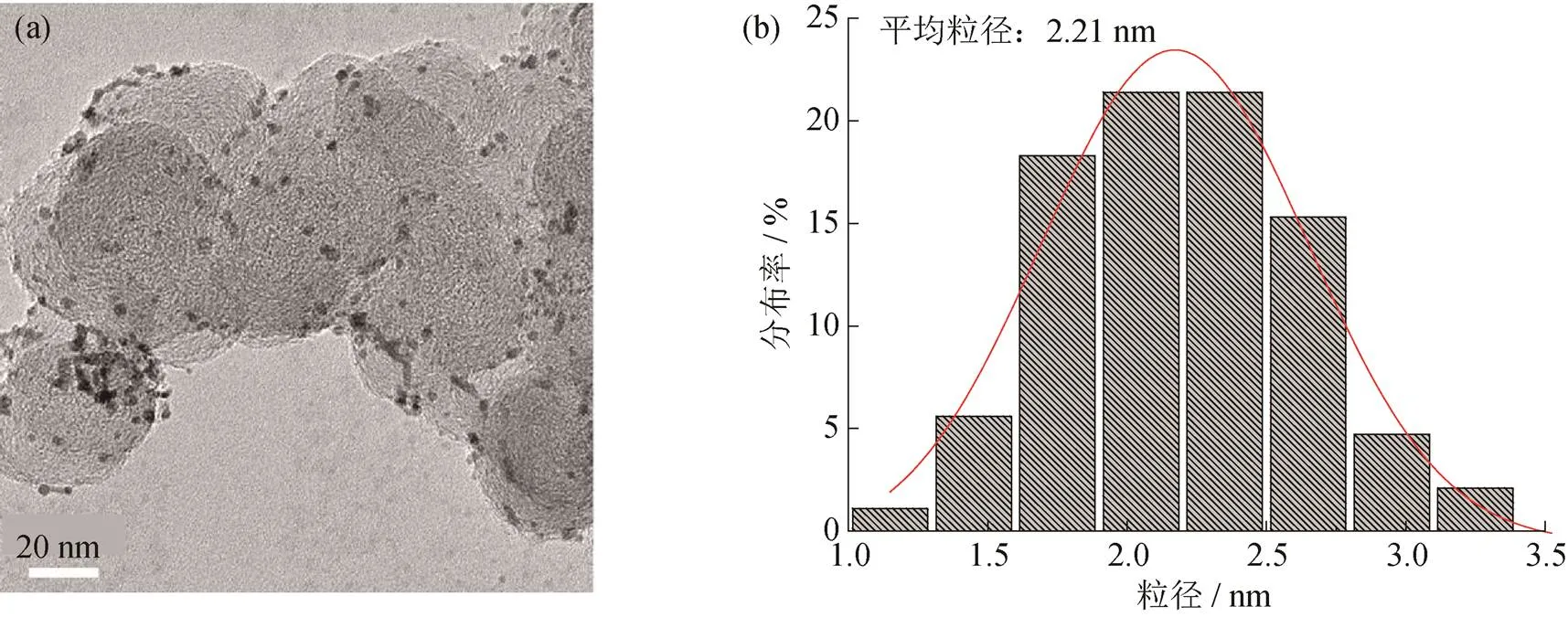
图6 最优条件所得催化剂的(a) TEM图及(b) Pt粒子的粒径分布图
从TEM和粒径分布图(图6)中可以看出,Pt粒子平均粒径为2.21 nm,整体分散均匀.对样品高温灰化后进行消解,通过电感耦合等离子光谱发生仪(ICP)测试其Pt负载量,测得自制Pt/C催化剂Pt负载量(16.01%)仅商业Pt/C催化剂铂负载量(51.49%)的0.31倍.同时测试自制Pt/C催化剂和商业Pt/C催化剂的LSV和CV图,如图7所示.
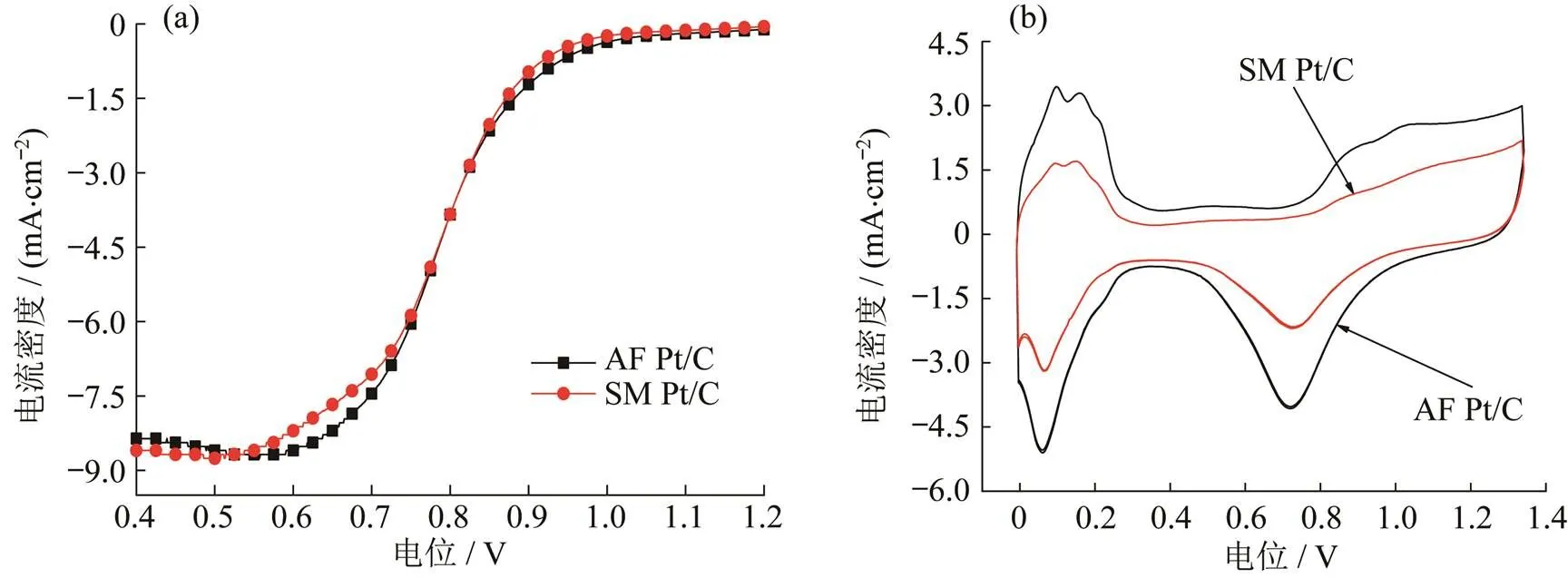
图7 自制Pt/C催化剂和商业Pt/C催化剂的(a) LSV和(b) CV图
自制Pt/C催化剂和商业Pt/C催化剂的LSV对比可以说明,所制备的低Pt载量的Pt/C催化剂电催化性能可与高载量的商业Pt/C催化剂相媲美.通过对CV氢脱附峰面进行积分,根据电化学活性面积(ECA)国标(GB/T 20042.4—2009)求解公式:
100), (1)
式中:表示电化学活性面积,单位为m2·g-1;为氢脱附峰的积分面积,单位为A·V;为光滑Pt表面吸附氢氧化吸附电量常数,即0.21 mC·cm-2;为扫描速度,单位为mV·s-1;为电极上Pt的质量,单位为g.求得对应ECA结果如表1所示.
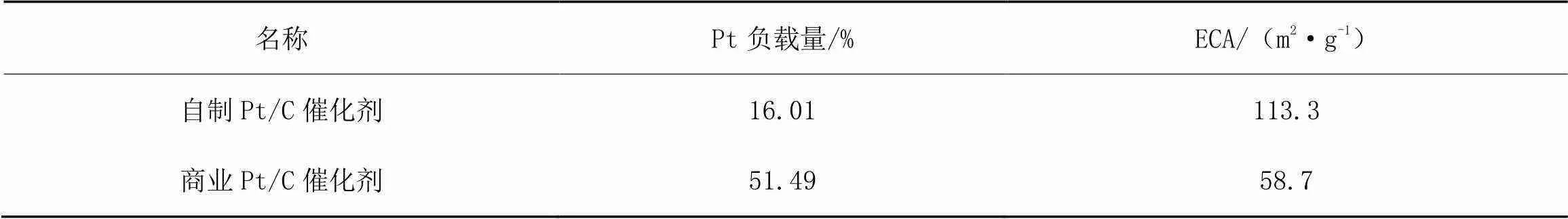
表1 自制Pt/C与商业Pt/C催化剂的Pt负载量和ECA
表1表明:自制Pt/C催化剂尽管Pt载量较低,但其ECA可达113.3 m2·g-1,是商业Pt/C催化剂(58.7 m2·g-1)的1.93倍,高的反应活性面积使催化剂在较低载量下仍具有高的电催化性能.
3 结 论
采用水热法,在EG和HCHO混合体系下,通过控制EG,HCHO和NaOH溶液体积比(10∶20∶10)以及将所得产物在250 ℃热处理进行双重优化,所制备得到的催化剂中Pt纳米粒子平均粒径为2.21 nm,且分散性好,Pt载量为商业Pt/C的0.31倍,ECA是商业Pt/C的1.93倍,电催化性能优异.而且通过一定的助剂和温度调控,上述方法同样适用于制备其他碳载金属催化剂.
[1]SEH Z W, KIBSGAARD J, DICKENS C F, et al. Combining theory and experiment in electrocatalysis: insights into materials design [J]. Science, 2017,355(6321):4998.
[2]DRILLET J F, EE A, FRIEDEMANN J, et al. Oxygen reduction at Pt and Pt70Ni30in H2SO4/CH3OH solution [J]. Electrochimica Acta, 2002,47(12):1983-1988.
[3]SUN W, WANG F, ZHANG B, et al. A rechargeable zinc-air battery based on zinc peroxide chemistry [J]. Science, 2021,371(6524):46-51.
[4]WU D, CHENG D. Core/shell AgNi/PtAgNi nanoparticles as methanol-tolerant oxygen reduction elect-rocatalysts [J]. Electrochimica Acta, 2015,180:316-322.
[5]HORNG W W. A review of recent development: transport and performance modeling of PEM fuel cells [J]. Applied Energy, 2016,165(1):81-106.
[6]CHEN A, HOLT-HINDLE P. Platinum-based nanostructured materials: synthesis, properties, and applic-ations [J]. Chemical Reviews, 2010,110(6):3767-3804.
[7] TAO A W, JIAN B H, ZHANG P C, et al. Preparation and durability of polypyrrole-carbon supported Pt electrocatalysts [J]. Journal of Nanjing University of Technology (Natural Science Edition), 2019,41(6):731-735.
[8] LIU S, GAO Y, MA J, et al. Catalytic electrode with carbon aerogel supported Pt for proton exchange membrane fuel cell [J]. Journal of Nanjing University of Technology (Natural Science Edition), 2016,38(2):60-63.
[9]OH H S, OH J G, HONG Y G, et al. Investigation of carbon-supported Pt nanocatalyst preparation by the polyol process for fuel cell applications [J]. Electrochimica Acta, 2007,52(25):7278-7285.
[10]LI W, LIANG C, ZHOU W, et al. Preparation and characterization of multiwalled carbon nanotube sup-ported platinum for cathode catalysts of direct methanol fuel cells [J]. The Journal of Physical Chemistry B, 2003,107(26):149-154.
[11] XU X F, SU Q Y, XU Y F, et al. Synthesis and electrochemical property of high-dispersed Pt/C catalysts [J]. Journal of Zhejiang Sci-Tech University, 2012,29(6):804-807.
[12]STONEHART K K L. Hydrogen adsorption on high surface area platinum crystallites [J]. Journal of Catalysis, 1973,31(3):325-334.
[13]LIU Z, GAN L M, HONG L, et al. Carbon-supported Pt nanoparticles as catalysts for proton exchange membrane fuel cells [J]. Journal of Power Sources, 2005,139(1/2):73-78.
[14]TIAN Z Q, JIANG S P, LIANG Y M, et al. Synthesis and characterization of platinum catalysts on muldwalled carbon nanotubes by intermittent microwave irradiation for fuel cell applications [J]. Journal of Physical Chemistry B, 2006,110(11):5343-5350.
[15]SONG S, WANG Y, SHEN P K. Pulse-microwave assisted polyol synthesis of highly dispersed high loading Pt/C electrocatalyst for oxygen reduction reaction [J]. Journal of Power Sources, 2007,170(1):46-49.
[16]ZHANG J, WANG X, WU C, et al. Preparation and characterization of Pt/C catalysts for PEMFC cathode: EFFECT of different reduction methods [J]. Reaction Kinetics and Catalysis Letters, 2004,83(2):229-236.
[17]REN X, WANG Y, LIU A, et al. Current progress and performance improvement of Pt/C catalysts for fuel cells [J]. Journal of Materials Chemistry A, 2020,8(46):24284-24306.
[18]MEIER J C, GALEANO C, KATSOUNAROS I, et al. Degradation mechanisms of Pt/C fuel cell catalysts under simulated start-stop conditions [J]. Acs Catalysis, 2012,2(5):832-843.
[19] WU F, LIU Y H, WU C. Preparation and characterization of Pt/C catalysts stabilized by ethylene glycol [J]. The Chinese Journal of Process Engineering, 2009,9(6):1198-1203.
[20]DEMIRCI U B, MIELE P. Reaction mechanisms of the hydrolysis of sodium borohydride: a discussion focusing on cobalt-based catalysts [J]. Comptes Rendus Chimie, 2014,17(7/8):707-716.
[21] WEN H, QIN Y H, LI W L. Pt/C catalyst prepared by hydrothermal method for PEMFC [J]. Power Source Technology, 2010,34(2):157-159.
[22] ZHOU W J. Development of anode catalyst for low-temperature direct alcohol fuel cell [D]. Dalian: Dalian Institute of Chemical Physics, Chinese Academy of Sciences, 2003.
Preparation of highly active Pt/C electrocatalyst for fuel cells
XUYou, XUHui, LIANGYan, WANGGuangying, ZHAOYu*
(Anhui Yuanchen Environmental Protection Technology Co., Ltd., Hefei 230000, Anhui, China)
Prepare of highly active carbon supported platinum(Pt/C) catalyst with low Pt loading is an effective means to reduce cost and increase efficiency. The effects of the ratio of ethylene glycol(EG),formaldehyde(HCHO) and alkaline solution(NaOH) and subsequent heat treatment on the electrocatalytic performance of Pt/C catalyst prepared by hydrothermal method were studied. The electrocatalytic performance of the catalyst was characterized by means of polarization curve(LSV) and the electrochemical active area(ECA) of platinum was calculated by cyclic voltammetry curve(CV). The physical and chemical properties of the catalyst were characterized by X-ray diffraction(XRD),transmission electron microscopy(TEM) and thermogravimetric analysis(TG). The results showed that the electrocatalytic performance of the catalyst could be improved effectively by properly increasing the HCHO ratio in a certain range. When the volume ratio of(EG)∶(HCHO)∶(NaOH) solution is 1∶2∶1,the Pt/C catalyst prepared after the subsequent heat treatment at 250 ℃ has the best electrocatalytic performance. The ECA of Pt/C catalyst with low loading prepared by the present method is higher than that of commercial Pt/C catalyst with high loading.
Pt/C catalyst; hydrothermal method; heat treatment; polarization curve(LSV); cyclic voltammetry curve(CV)
10.3969/J.ISSN.1000-5137.2022.04.012
2021-03-08
许 友(1990—), 男, 助理工程师, 主要从事可再生能源等方面的研究.E-mail:13122269439@163.com
赵 羽(1991—), 男, 工程师, 主要从事新能源和环保材料等方面的研究. E-mail:313769727@qq.com
许友, 徐辉, 梁燕, 等. 燃料电池高活性Pt/C电催化剂的制备 [J]. 上海师范大学学报(自然科学版),2022,51(4):474‒482.
XU Y, XU H, LIANG Y, et al. Preparation of highly active Pt/C electrocatalyst for fuel cells [J]. Journal of Shanghai Normal University(Natural Sciences), 2022,51(4):474‒482.
TM 911.4
A
1000-5137(2022)04-0474-09
(责任编辑:郁慧,冯珍珍)

