耐盐异养硝化-好氧反硝化菌Bacillus megatherium N07的分离及脱氮特性
高宇轩 靳静晨 徐利杉 高雅娟 张闻天 李晨晨 张国伟 靳永胜,3
(1.北京农学院生物与资源环境学院,北京 102206;2.北京环氧环保科技发展有限公司,北京 100000;3.农业农村部华北都市农业重点实验室,北京 102206)
化工生产、石油采集和沿海地区水产养殖等各行业所排放的总含盐量大于1%的废水为高盐废水[1],废水中的氮素严重威胁水生生态系统的平衡和稳定。高盐废水中的无机氮主要包括氨氮、硝态氮和亚硝态氮[2]。氨氮易导致地表水富营养化;硝态氮可还原为亚硝酸盐后可导致高铁血红蛋白的形成,阻碍氧气正常运输,已被证明危害人体健康[3]。生物处理因二次污染少、处理效率高而被广泛应用于污水脱氮。传统的生物脱氮工艺至少包括好氧硝化与厌氧反硝化两个独立的步骤,但因抗高氨氮冲击负荷能力弱、基建成本高等问题增加运行的复杂性[4]。此外,盐分过高的含氮废水易导致细胞内外渗透压失衡,酶活性降低而使微生物丧失代谢功能,增加了废水处理的难度。
近年来,如粪产碱杆菌 Alcaligenes faecalis[5]、芽孢杆菌 Bacillus[6]、不动杆菌 Acinetobacter sp.[4]等异养硝化-好氧反硝化菌株能够在好氧条件下同时完成硝化和反硝化过程,将氨氮、硝态氮和亚硝态氮转变成气态氮,能够简化处理工艺的同时因其繁殖速度快、抗逆性强等优良脱氮性能而受到广泛关注。已有报道部分异养硝化-好氧反硝化菌为轻度耐盐菌,在3%-5%低盐度条件下维持正常代谢活动,如赵坤等[6]从养殖废水中分离获得 Bacillus subtilis H1,氯化钠浓度30 g/L 时是其最佳生长和脱氮条件,且氨氮去除率达到 87.2%;Yu等[7]从腌制废水中筛选的蜡样芽孢杆菌Bacillus cereus X7,在4%盐度下最高去除52.1%的总氮。本实验从河北农药化工污水中筛选到一株巨大芽孢杆菌Bacillus megatherium N07,研究该菌在不同盐度(1%、4%、8%)、不同溶氧条件(有氧、微厌氧)下的脱氮特性;探究单因素环境因子对菌株氮素去除率的影响,以期为高盐废水的生物脱氮奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种样品 含菌样品取自河北某农药化工厂中的钠盐废水。水质情况:COD浓度107 200 mg/L、氨氮378 mg/L、pH值5.87、总盐度14.18%。
1.1.2 培养基 富集培养基(g/L):蛋白胨5,酵母提取物5,氯化钠10。
BTB(溴百里酚蓝)培养基(g/L):硝酸钾1,天冬酰胺1,柠檬酸三钠1,七水合硫酸镁1,氯化钙0.2,氯化铁0.05,1%溴百里酚蓝溶液5 mL,pH 7.0。
硝化培养基(g/L):硫酸铵0.71,蔗糖3.78,磷酸二氢钾 3,磷酸氢二钾8,七水合硫酸镁 0.05,微量元素溶液2 mL/L。
反硝化培养基1(g/L):硝酸钠0.91,蔗糖3.78,磷酸二氢钾 3,磷酸氢二钾8,七水合硫酸镁 0.05,微量元素溶液2 mL/L。
反硝化培养基2(g/L):亚硝酸钠0.72,蔗糖3.78,磷酸二氢钾 3,磷酸氢二钾8,七水合硫酸镁0.05,微量元素溶液2 mL/L。
微量元素溶液(g/L):EDTA 35,FeSO4·7H2O 5,H3BO40.014,MnCl2·4H2O 0.99,CuSO4·5H2O 0.25,ZnSO4·7H2O 0.43,无水 CaCl20.19,NaMoO4·2H2O 0.22,CoCl2·6H2O 0.24。
1.2 方法
1.2.1 菌株筛选 富集:取化工污水样品按5%(V/V)比例加入100 mL富集培养基中,28℃,120 r/min恒温培养。每隔72 h转接至新的富集培养基中,连续富集3次。
初筛:将分离纯化后得到的菌株,划线于溴百里酚蓝(BTB)培养基中28℃恒温培养,于24 h、36 h观察培养基颜色变化筛选反硝化型菌株;再将以上菌株在反硝化培养基2中培养,于0 h、18 h后取样检测,采用格里斯试剂法进一步验证具有反硝化能力的菌株。
复筛:将上述筛选到的具备反硝化能力的菌株接种于硝化培养基中,28℃,120 r/min恒温培养12 h测定氨氮以及总氮降解率,将降解效果最佳的菌株选定为本实验目标菌株。
1.2.2 菌株鉴定 形态学鉴定:纯化目标菌株并划线于LB固体培养基中,28℃恒温培养2 d,观察菌落生长形态;挑取固体菌落,采用革兰氏染色法镜检观察菌体形态特征;取培养24 h的新鲜菌液,分别经过2.5%戊二醛、乙醇、叔丁醇前处理,冷冻干燥4 h。喷金后用扫描电镜观察菌体大小与形态特征。
分子生物学鉴定:取培养48 h的菌液,稀释后对其16S rRNA进行菌液PCR 扩增。PCR反应体系共 25 μL:模板 DNA 2.5 μL ;引物27F 0.5 μL;引物1492R 0.5μL ;Taq酶 Mix 10 μL ;超纯水 11.5 μL。反应条件:预变性解旋95℃ 5 min;变性过程94℃ 1 min;退火过程55℃ 1 min;延伸过程72℃ 1 min;重复第二步30个循环;最终延伸72℃10 min。PCR产物用1%的琼脂糖凝胶电脉检测,电泳仪180 V,25 min。PCR扩增产物由生工生物工程(上海)股份有限公司进行序列测定。将测序结果的序列在NCBI 官网上进行 Blast比对分析,采用MEGA7.0邻接法构建系统发育树,完成菌株同源性分析。
1.2.3 耐盐脱氮能力研究 硝化培养基中以添加1%、4%、8%(m/V)的氯化钠作为不同梯度盐度。取新鲜菌液按2%(V/V)比例分别接种于硝化培养基1和反硝化培养基2中,于28℃,120 r/min恒温培养,每隔24 h取样测定OD600值以及氮去除率。
1.2.4 好氧反硝化特性探究 取对数生长期菌液,按2%(V/V)比例分别接种于反硝化培养基1和反硝化培养基2中。设定28℃,120 r/min摇瓶培养作为好氧培养实验组;在28℃,静置培养下作为微厌氧实验组。每隔2 h取样测定OD600值、硝态氮以及亚硝态氮含量,探究不同溶氧对菌株反硝化能力的影响。
1.2.5 环境因子对异养硝化性能探索 取对数生长期的菌液,以2%(V/V)比例接种于硝化培养基中,设定不同碳源、C/N、pH、转速和温度为单因素变量,培养至12 h取样检测OD600、氨氮和总氮浓度,研究环境因子对菌株生长情况和脱氮性能的影响。其中碳源:选取柠檬酸三钠、葡萄糖、蔗糖、丙酮酸钠和琥珀酸钠;C/N分别为5、10、15、20、25;设定培养基的初始pH分别为5、6、7、8、9;不同转速设定为100、120、140、160和180 r/min;温度调节为8、18、28、38℃。
1.2.6 分析方法 以上试验均设置3组平行。氨氮测定方法:纳氏试剂分光光度法[8];总氮测定方法:过硫酸钾双波长分光光度法[9];亚硝态氮测定方法:N-(1-萘基)-乙二胺分光光度法[9];硝态氮测定方法:双波长紫外分光光度法[9]。OD600为菌液在波长为600 nm时的吸光值。并计算降解率:
降解率(%) =(CK平均值-样品平均值)/CK平均值×100%
采用 Excel2010软件对实验数据进行绘图,SPSS 23.0软件进行统计学分析。
2 结果
2.1 菌株筛选
初筛:经过连续富集后,共分离纯化出7株形态不同的菌株,编号为N01-N07。将7株菌于BTB培养基中恒温培养,观察培养基的变色情况。微生物在反硝化过程的每一步都需要氢离子的参与,因此pH值由中性向碱性偏移,溴百里酚蓝作为酸碱指示剂在酸性、中性和碱性环境下分别呈现黄色、绿色和蓝色。结果表明菌株N01、N04、N07培养基在24 h局部产碱变蓝,于 36 h观察到固体平板完全由绿变蓝,初步推测这3株为反硝化功能菌株。
以亚硝态氮为氮源,将菌株N01-N07单独摇瓶培养,定期取样后采用格里斯试剂法,以试剂颜色变化探究菌株对于亚硝态氮的降解效果。18 h时菌株N01、N04、N07使试剂颜色变为无色,说明这3株菌降解亚硝态氮效果显著。
复筛:将上述3株具有反硝化能力的菌株单独摇瓶培养,测定其硝化性能。结果如表1,由检测结果可知,培养至12 h菌株N07总氮、氨氮去除率分别达到63.84%和70.95%,降解效果最佳,故选为本试验目标菌株。

表1 三株反硝化菌脱氮性能比较Table 1 Comparison of nitrogen removal performance of three denitrification strains
2.2 菌株鉴定
2.2.1 形态学观察 菌株 N07 的形态学观察如图1。在固体培养基上形成乳白色、边缘整齐且表面光滑的菌落;经革兰氏染色鉴定为革兰氏阳性菌(G+);SEM扫描电镜结果表明菌体呈直杆状,大小为5 μm×(10-15)μm。
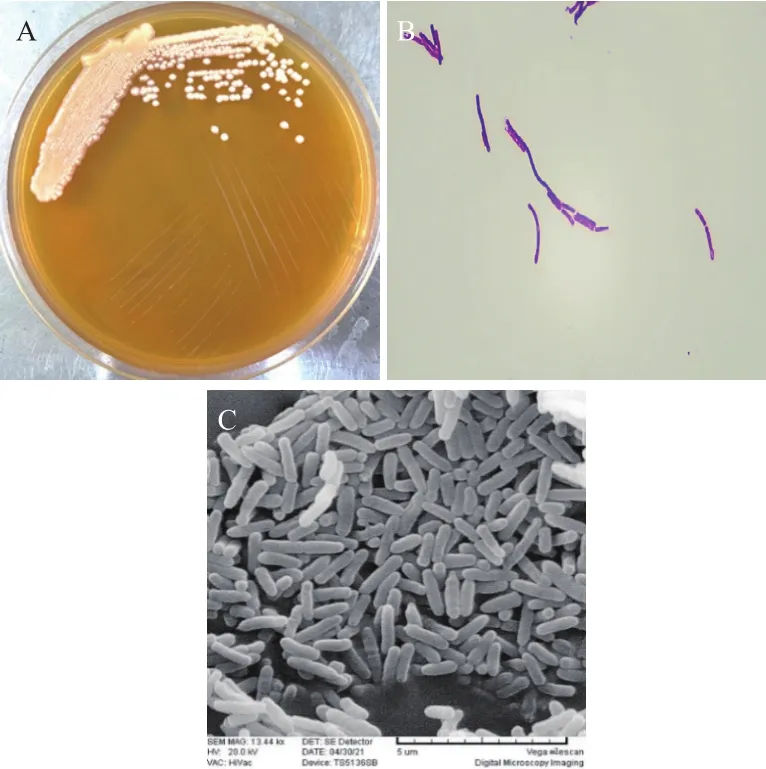
图1 菌株N07的形态学鉴定Fig.1 Morphological identification of strain N07
2.2.2 分子生物学鉴定 PCR扩增菌株N07的16Sr-RNA片段。将该序列通过NCBI的 Blast比对分析,采用MEGA7.0邻接法构建系统发育树。图2结果表明菌株N07的16S rRNA片段和Bacillus megatherium基因序列相似性达99.8%以上,与Bacillus megatheriumCS55基因片段的亲缘性最高,确定N07为巨大芽孢杆菌。

图2 菌株N07的系统发育树Fig.2 Phylogenetic tree of strain N07
2.3 耐盐脱氮能力
为了解菌株N07在高盐环境下的生长特性,设定培养基盐度为1%、4%、8%(W/V),测定菌株在1-4 d培养期内的OD600。图3-A为菌株在氨氮培养基中的生长情况,结果显示在不同盐浓度下N07菌株的OD600总体处于上升趋势,最高值达到2.055;而在图3-B中可知,以亚硝态氮为氮源的培养基中N07的OD600随培养时间延长略有下降,在盐度为4%条件下OD600从1.198降至0.838,可能是由于发酵后期培养基中营养成分匮乏,菌体无法维持正常活性所致。适量盐度有益于维持微生物体内与环境中渗透压一致,稳定胞内相关酶活性,而过量盐度则破坏细胞质成分,活性衰退[10]。总体来看,菌株N07在盐度为4%时菌株生长旺盛;当盐度增加至8%时,菌体生长缓慢,1 d时无繁殖迹象;培养后期2-4 d生长速度加快,最高OD600值上升至2.014。
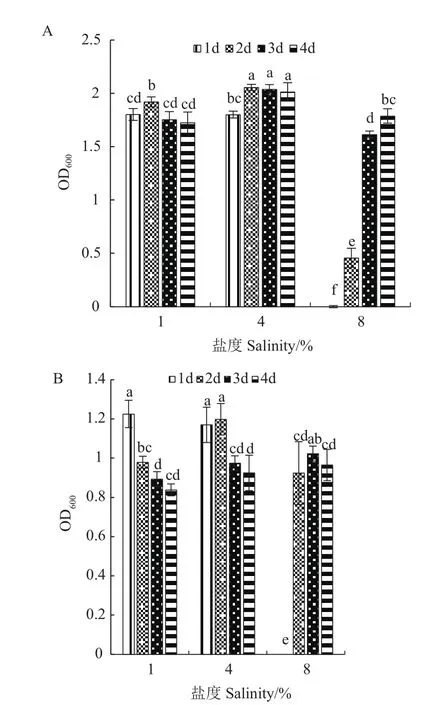
图3 不同盐度下菌株N07的生长情况Fig.3 Growth of strain N07 under different salinities
为探究菌株N07在高盐环境下的脱氮能力,在培养基盐度分别为1%、4%、8%(m/V)时测定菌株在1-4 d培养期内的氨氮以及亚硝态氮降解率。图4结果显示,1%和4%组的氮去除率在培养初期迅速上升,在培养至2 d氨氮和亚硝态氮去除率分别为70.01%和89.39%。盐度4%时的氮去除率在2 d后达到平台期,降解率无明显波动。培养至4 d,氨氮降解率达到73.61%。在8%盐度环境下菌株脱氮能力前期稍弱,菌株生长受到抑制。在1-2 d含盐量≤4%时,氨氮转化率不足50%。但随着培养时间延长至3 d和4 d,氨氮及亚硝态氮降解率呈上升趋势,最终分别达到73.61%和83.56%。
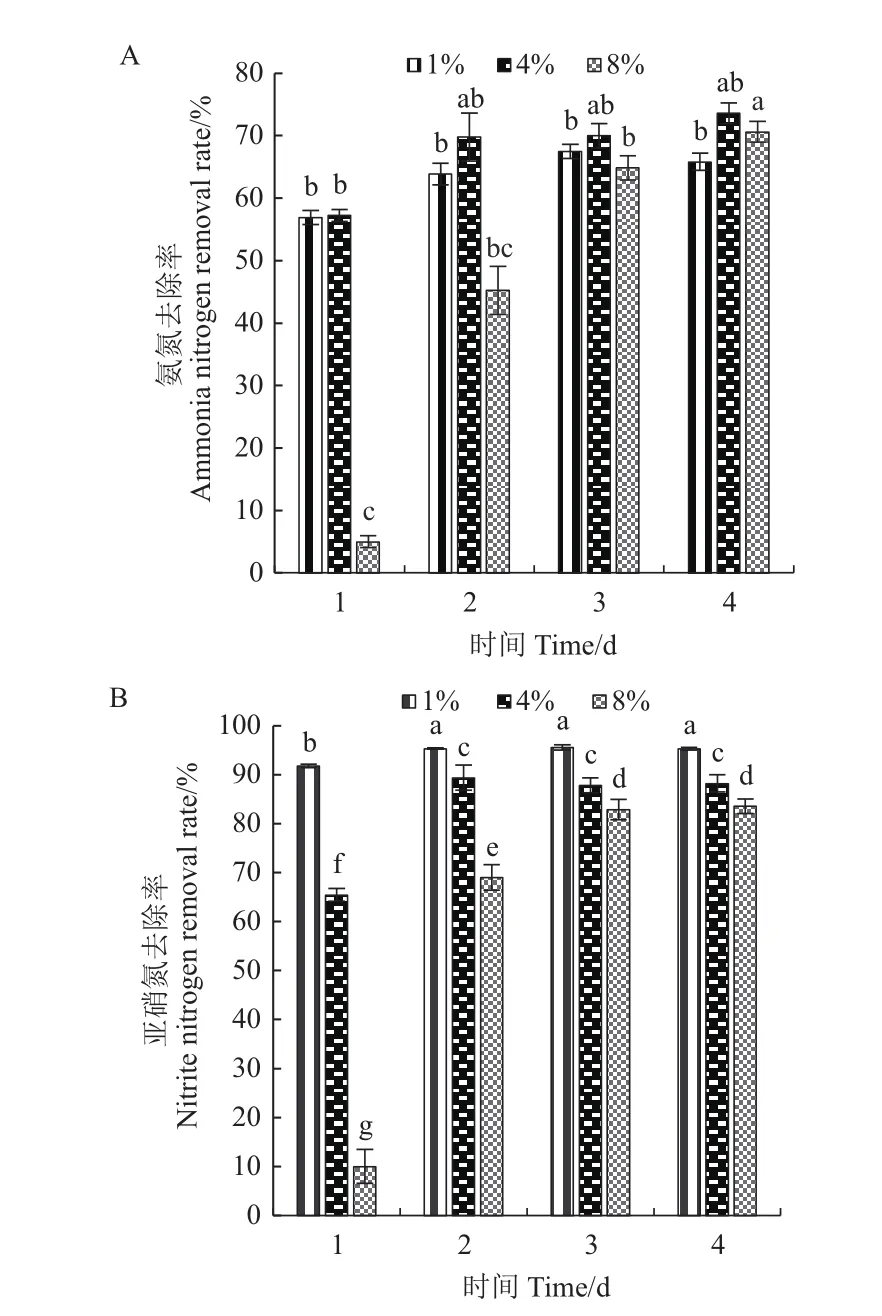
图4 不同盐度下菌株N07的脱氮效果Fig.4 Nitrogen removal effect of strain N07 at different salinities
2.4 好氧反硝化特性
为探究溶氧条件对菌株N07反硝化作用的影响,以硝态氮作为唯一氮源,初始氮浓度为150 mg/L,菌株N07的生长以及反硝化脱氮情况如图5。图5-A结果表明,好氧条件下菌株在4 h内进入对数生长期,0-6 h菌体迅速生长,OD600从0.676升至1.091;而微厌氧条件最高OD600仅为0.375,菌体未大量增殖。亚硝态氮积累量主要由硝态氮的转化速率和亚硝态氮的消耗速率决定。好氧组在4-6 h硝态氮浓度显著下降,去除速率最高达到35.25 mg/(L· h),随着硝态氮的减少亚硝态氮浓度升高,最大积累量为31.25 mg/L,这一现象表明亚硝酸盐取代硝酸盐作为电子受体。好氧条件下6 h后菌体生长进入平稳期,硝态氮与亚硝态氮浓度同时下降,其中硝态氮最高去除率达到94.94%,相应的反硝化速率为14.24 mg/(L· h)。而从图5-B可知微厌氧组在整个反应过程中,硝态氮浓度始终高于120 mg/L,亚硝态氮迅速积累,直到培养结束仍保持在75.34 mg/L,氮素并未得到降解。结果表明:硝态氮为唯一氮源时,菌株在氧气充足条件下生长状况较好,能将部分硝态氮转化为亚硝态氮,同步去除硝态氮与亚硝态氮效果显著。
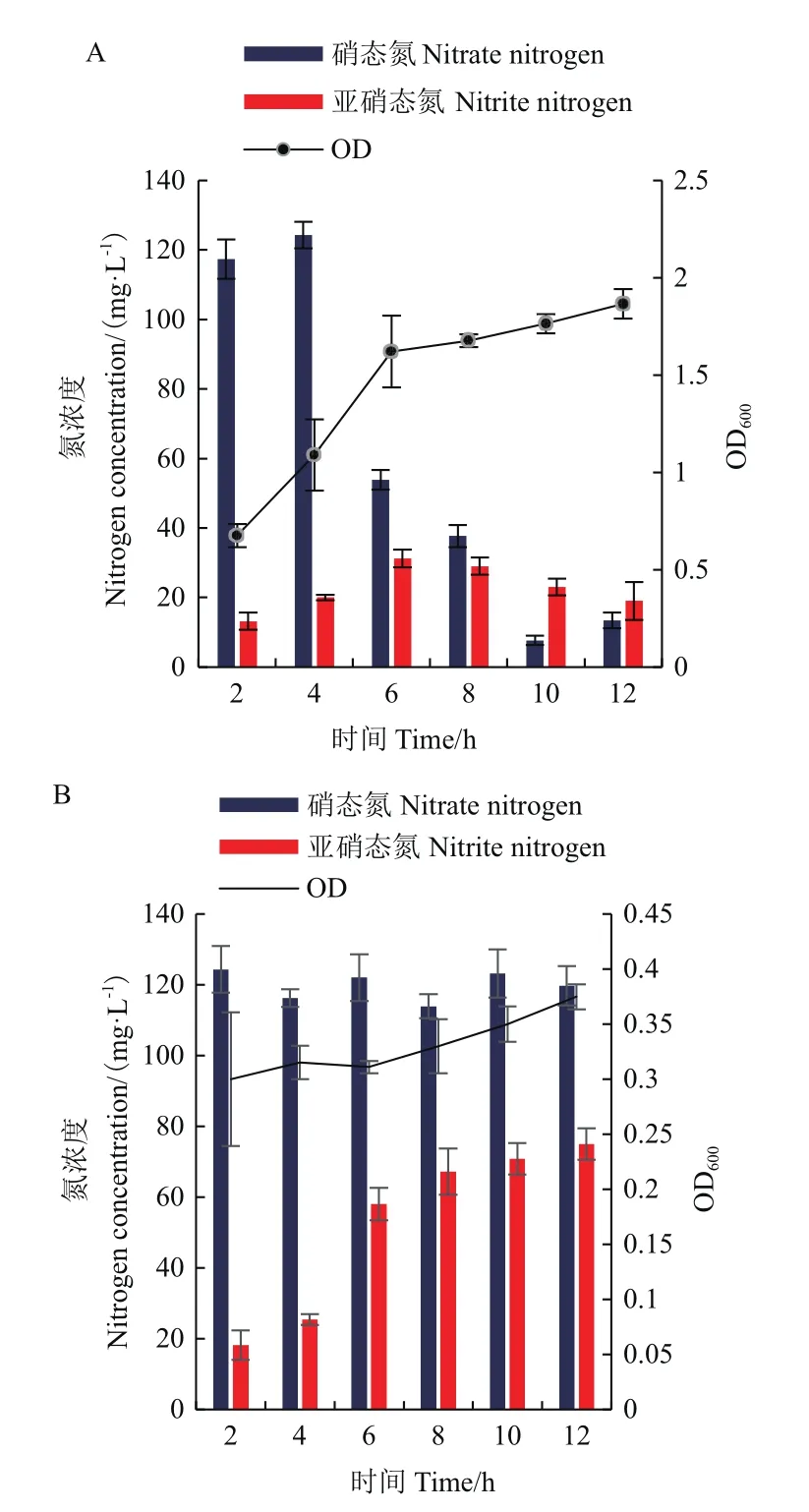
图5 不同溶氧条件下菌株N07降解硝态氮的性能Fig.5 Degradation performance of strain N07 under different DO
以亚硝态氮作为唯一氮源,初始氮浓度为75 mg/L,菌株N07的生长以及脱氮情况如图6。如图6-A可知,在好氧条件下,前4 h菌体生长处于迟缓期,这种现象可能是由于菌株需要一定时间适应有毒环境。4-8 h随着菌体大量增殖,亚硝态氮浓度从115.67 mg/L降至62.63 mg/L,降解速率为13.26 mg/L,并在10 h内亚硝态氮去除率达到100%。由于亚硝态氮发生氧化,不同溶氧条件的硝态氮浓度分别增加到22.01 mg/L 和30.79 mg/L,均存在部分由亚硝态氮向硝态氮转化现象。然而图6-B中,在微厌氧条件下OD600最高值仅为0.342,亚硝态氮浓度始终保持在110 mg/L以上,未有效降解。可能由于菌株生长受到抑制,导致反硝化性能无法发挥到最佳状态。
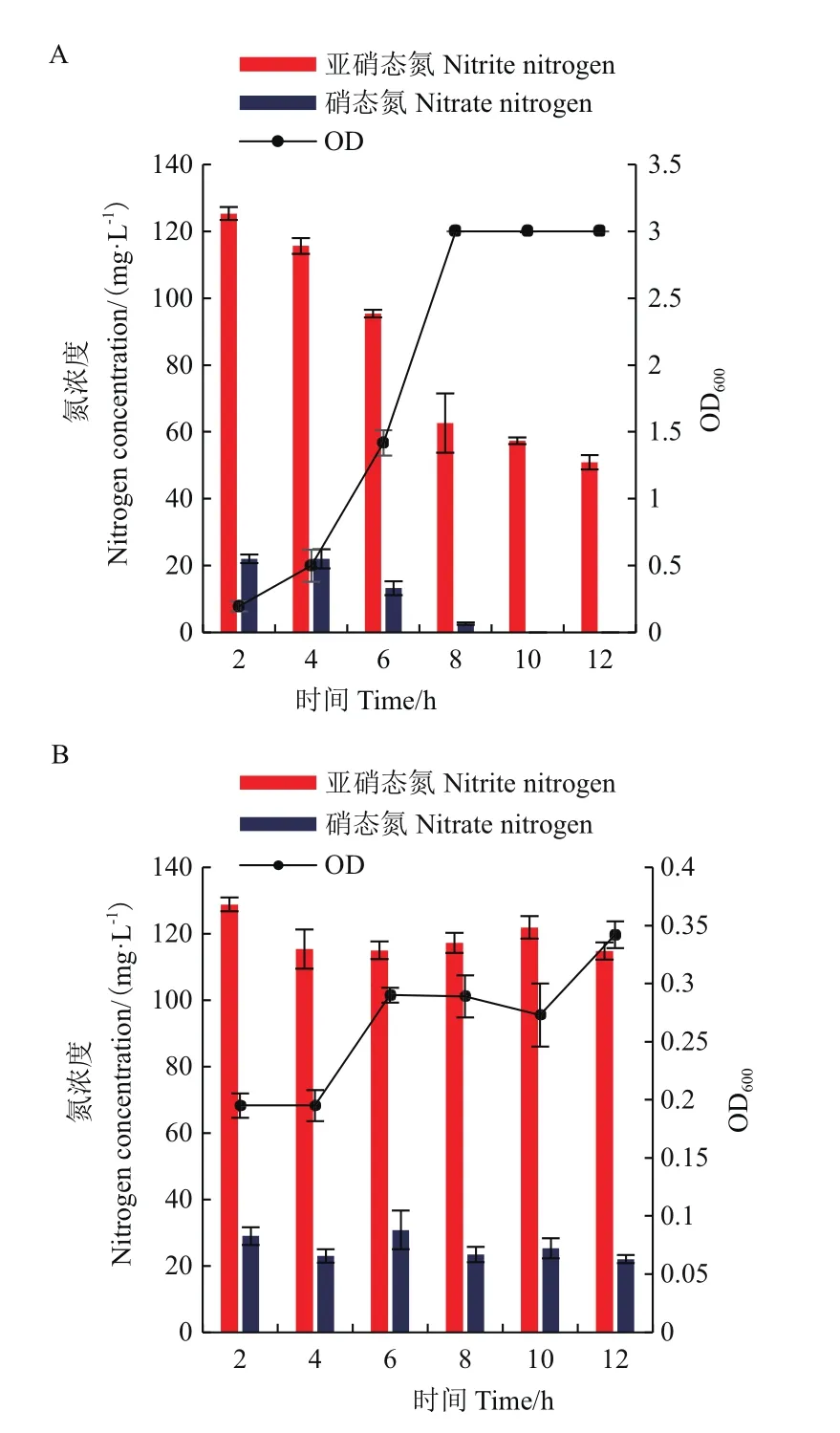
图6 不同溶氧条件下菌株N07降解亚硝态氮的性能Fig.6 Degradation of nitrite nitrogen by strain N07 under different DO
2.5 单因素环境因子对脱氮性能的影响
2.5.1 碳源 有机碳源的类型会影响细菌的生长和代谢速度。分别以柠檬酸钠(SC)、葡萄糖(GLU)、蔗糖(SUC)、丙酮酸钠(SP)和丁二酸钠(SS)作为唯一碳源,研究碳源种类对菌株N07脱氮性能的影响。图7结果表明,菌株N07可以利用多种有机碳源,在以柠檬酸钠、葡萄糖、蔗糖和丙酮酸钠为唯一碳源时均有较好长势,最高OD600值达到1.86。但以丁二酸钠作为碳源时,菌体生长以及硝化功能明显受阻,氨氮去除率仅为15.59%。其中以蔗糖作为唯一碳源时菌株具有最高的氮去除能力,总氮和氨氮降解效率分别达到90.11%和91.78%。
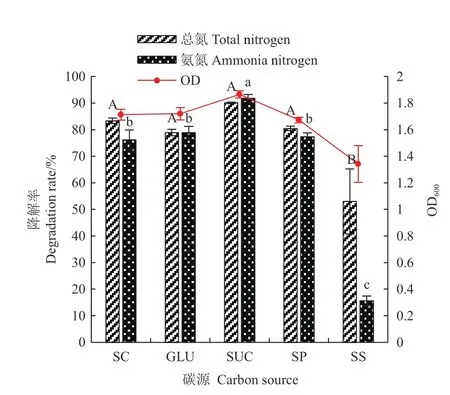
图7 碳源对菌株N07脱氮能力的影响Fig.7 Effect of carbon source on the nitrification capacity of strain N07
2.5.2 碳氮比(C/N) 在振荡培养中通过改变蔗糖添加量,研究了不同C/N对菌株N07细胞生长和脱氮性能的影响。如图8所示,经过12 h培养,菌体密度随碳源浓度增加而上升,C/N为20时生长状况最好,OD600为1.77。高C/N会加速细胞的合成和氮素降解,当C/N从5增加至25,氨氮去除率从82.98%提高到100%,而总氮的去除率最高为65.26%,可能由于培养时间过短,亚硝态氮未能完全还原。然而C/N为5时总氮去除速率仅为5.69 mg/(L· h),可能由于碳源不足使细胞处于贫营养状态,硝化反应受到抑制。

图8 碳氮比对菌株N07脱氮能力的影响Fig.8 Effects of C/N ratio on the denitrification capacity of strain N07
2.5.3 pH 设置培养基初始pH值为5、6、7、8、9,恒温培养12 h后如图9所示,菌株在pH=7时总氮和氨氮去除率最高,分别达到81.97%和100%。但在pH=5的酸性环境中,观察到N07的生长和脱氮能力明显受阻遏,OD600仅为0.725,总氮去除率不足20%,极端的酸性条件抑制细菌的代谢并损坏细胞,导致菌株丧失脱氮能力。在初始pH值为7-9的中性和弱碱性条件下,氨氮去除率始终稳定在峰值90%-100%,表示菌株N07能够在相对较宽的pH范围内生长良好并具有高效的硝化性能。

图9 初始pH值对菌株N07脱氮能力的影响Fig.9 Effect of initial pH value on the denitrification capacity of strain N07
2.5.4 转速 溶解氧是异养硝化过程中的关键参数之一,本研究通过调节摇床转速为100、120、140、160和180 r/min来控制培养基中的溶解氧。从图10可以看出,当转速从100 r/min升高至160 r/min,总氮和氨氮去除率随之增加,最高降解速率分别为7.97 mg/(L· h)和 6.67 mg/(L· h)。较高的溶氧量促进了菌株N07的生长,在转速达到180 r/min时的OD600攀升至2.1,但相应氨氮和总氮去除率略有下降,仅为56.8%和47.51%,表明过高的溶氧量也会抑制菌株的脱氮性能。
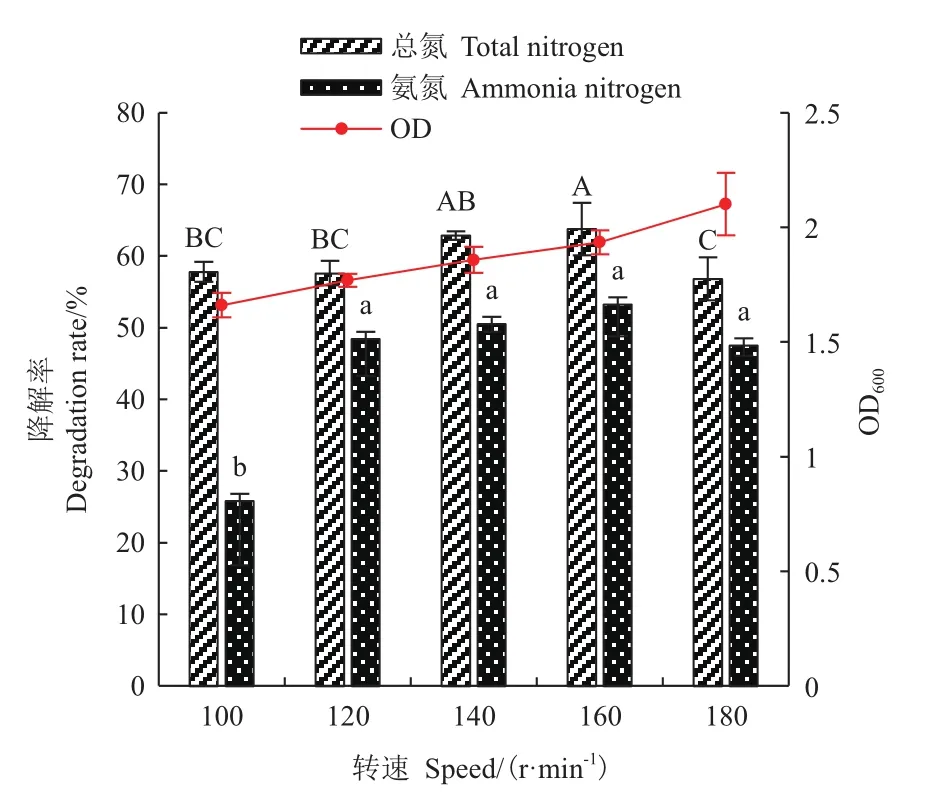
图10 转速对菌株N07脱氮能力的影响Fig.10 Effect of rotation speed on the denitrification capacity of strain N07
2.5.5 温度 大多数好氧反硝化菌对环境温度较为敏感。研究了菌株N07在8、18、28和38℃时的生长状况和氮去除率。由图11观察到,外界温度从8℃升高至28℃,菌体生长和代谢速度加快,总氮去除率从0.44%增加到62.91%。在温度为28℃时菌体密度和脱氮性能最高,总氮和氨氮去除速率为6.72 mg/(L· h)和 7.86 mg/(L· h),OD600为 1.733。然而菌株在8℃低温时生长缓慢,当温度上升至38℃时,总氮去除率也明显下降至14.97%,表明N07菌株不能适应极端低温和高温环境。
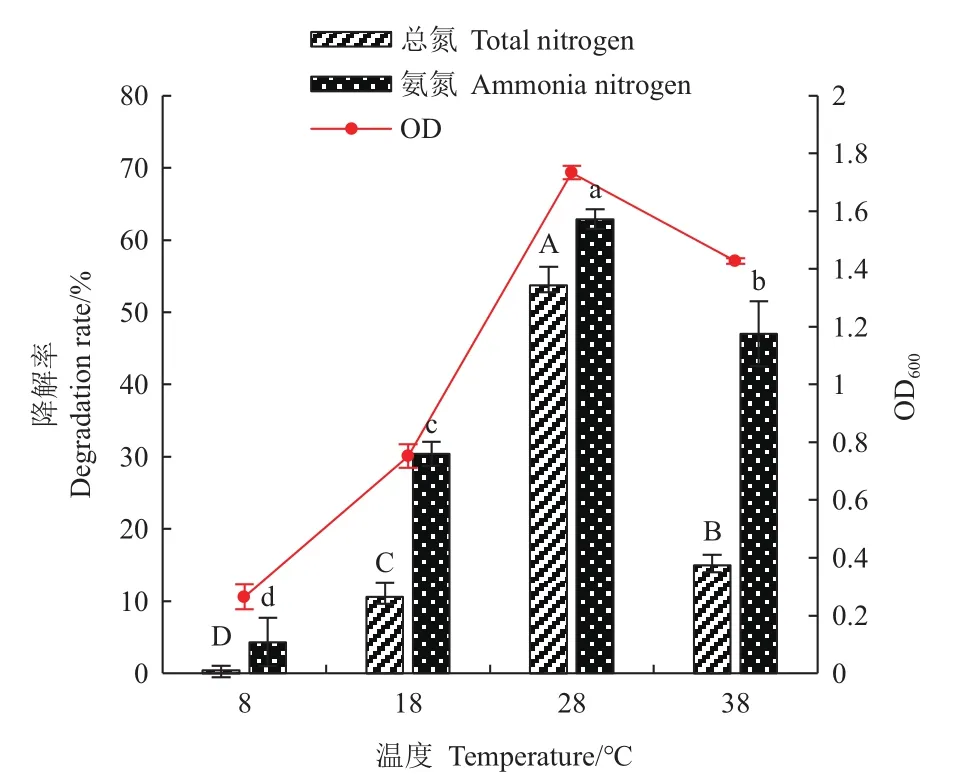
图11 温度对菌株N07脱氮能力的影响Fig.11 Effect of temperature on the denitrification capacity of strain N07
3 讨论
在处理高盐(盐度>1%)含氮废水过程中,常见微生物不能抵抗较高盐度的冲击,导致这类废水生物脱氮效率低下[11]。近年来已发现能进行异养硝化好氧反硝化功能的嗜盐菌属有盐单胞菌Halomonas sp.[12],但耐受盐度>5%的脱氮菌株鲜有报道。因此,筛选嗜盐菌有望解决含盐废水难脱氮的问题。本研究从河北农药化工污水中筛选到一株异养硝化-好氧反硝化型细菌,结合形态学与16S rRNA序列比对鉴定为Bacillus megatherium,命名为N07。
不同种属微生物的耐盐程度差异较大,依据最高耐受盐度分类,能在3%-5%盐度下生存的细菌称之为耐盐菌;耐受盐度5%-15%为中度嗜盐菌;大于15%为极端嗜盐菌[1]。较高盐分引发胞外渗透压偏高,而绝大部分耐盐菌株能在高渗透压胁迫下分泌渗透压补偿溶质,如甜菜碱(betaine)、四氢嘧啶(ectoine)、海藻糖(trehalose)等来增强细胞的抗逆协助作用,从而抵御外界极端环境对细胞活性的影响[10]。菌株N07能够在8%盐度下正常生长,维持生命代谢活动并高效脱氮,属于中度嗜盐菌,推测其为渗透压补偿溶质分泌型菌株。目前已报道的H.campisalis.sp.nov[13]能在8.8%的盐度下生长,但仅在厌氧条件下去除硝态氮;而袁建华等[1]从生活污水中筛到甲养芽孢杆菌 Bacillus methylotrophicus L7 最高耐盐度仅为 3.5%。综合比较,本试验菌株Bacillus megatherium N07在高盐分环境中具备更强的抗胁迫性和脱氮能力,这一特点为处理高盐废水奠定基础。
研究了不同溶氧条件下菌株的反硝化性能差异。该菌在好氧条件下硝态氮最高反硝化速率为14.24 mg/(L·h),显著高于黏质沙雷氏菌[14]CL1502(4.6 mg/(L·h))和门多辛假单胞菌 TJPU04[3](4.69 mg/(L· h))。氮转化和细菌同化作用是脱氮过程中去除亚硝态氮的主要途径,亚硝酸盐的存在对细胞具有毒性[15]。菌株 N07 相比于假单胞菌 yy7[16](去除速率为0.76 mg/(L· h))和甲基营养型芽孢杆菌L7[11](去除速率为 0.24 mg/(L·h)),具有更强的反硝化能力且能够同步硝化反硝化。陈均利等[17]研究表明,大多数异养硝化-好氧反硝化菌在好氧条件下会积累亚硝态氮,而厌氧条件会抑制亚硝态氮的积累,然而菌株N07脱氮趋势与之相反。反硝化菌主要通过表达周质硝酸还原酶Nap和膜结合硝酸还原酶Nar来催化硝酸盐的转化,并在有氧条件优先表达Nap,厌氧条件会优先表达Nar[18],它们对氧分子的敏感程度不同。根据结果推测菌株N07的反硝化过程主要由周质硝酸还原酶Nap介导。
单因素环境因子对菌株硝化性能结果表明:(1)Bacillus megatheriumN07菌株的最适碳源为蔗糖,该结果与多数具有脱氮性能的细菌不同[19],大多好氧反硝化菌更偏好以丙酮酸钠、柠檬酸钠、琥珀酸钠等有机酸作为其最适碳源,而菌株在以琥珀酸钠为碳源时氨氮去除率仅为15.59%,可能由于在菌株N07的异养硝化过程中,大分子多糖的氧化还原电位相比于有机酸具有更大优势[20],与菌株N07同属的Bacillus subtilisZF2-3[21]也观察到类似情况。(2)菌株N07最佳 C/N为25,在低C/N下氮去除效率低,可能是碳源的匮乏使微生物硝化过程的电子供体供应不足所致。在反硝化菌如Vibrio diabolicus SF16[11]、Diutina rugosa DW-1[22]等也观察到类似情况,贫营养条件导致使细胞在内源周期发生裂解。结果进一步证实,有效的异养硝化过程可能与高有机负荷条件密切相关[23]。(3)在pH探究实验中,与Ren等[24]、Guo等[11]报道的硝化细菌相似,菌株N07更倾向于中性或弱碱性的脱氮条件。这可能是因为在碱性介质中,由于氨氮的氧化作用释放氢离子生成NH3,pH值趋于中性,更有利于氨单加氧酶催化反应[25];菌株N07不能适应酸性环境,可能由于在强酸条件下细胞损坏导致菌株丧失脱氮能力[26]。(4)不同转速对菌株的生长和氮去除率影响不显著(P>0.05)。菌体密度随转速提高而增加,但当转速增加至180 r/min时的氮去除率反而下降,可能归因于溶氧过高抑制了菌株N07关键硝化酶基因的表达,从而降低了氮去除效率[19]。Qin等[27]筛选的Paracoccus denitrificans的最大耐受氧浓度为2.20 mg/L;Ren等[24]分离的 Marino bacter,在转速为150 r/min(溶氧6.08 mg/L)时可去除100%的总氮。结果证明,不同种属微生物的溶氧水平有较大差异,通过调控溶氧量能有效提高脱氮性能。(5)在温度为28℃时菌株N07具有最佳硝化性能,然而随环境温度降低,菌株生长与脱氮功能受到削弱。该现象在冯叶[28]发现的Pseudomonas mandelli也被检测到,其在 10℃下生长时,负责同步硝化-反硝化的基因会延迟表达。向书迪等[13]在研究表明,温度过低或过高会阻遏细菌的代谢和蛋白质合成途径,导致硝化过程关键酶活性减弱。在低温条件,菌株N07可能是冷休克蛋白酶和抗氧化酶分泌不足[28],机体受到损伤致使脱氮效率低下。
4 结论
从河北化工污水分离到一株异养硝化-好氧反硝化菌株N07,根据16S rRNA序列比对结果,鉴定为Bacillus megatherium,革兰氏 G+,扫描电镜菌体呈直杆状,大小为5 μm×(10-15)μm。Bacillus megatheriumN07在8%盐度下繁殖生长并高效脱氮,最高氨氮及亚硝态氮降解率分别达到73.61%和83.56%。该菌在好氧条件下可同步去除硝态氮与亚硝态氮,最高去除速率分别为35.25 mg/(L· h)和13.26 mg/L。菌株N07在以蔗糖为碳源、C/N为25、pH为7、转速160 r/min、温度为28℃时具有最佳脱氮性能。

