自发性蛛网膜下腔出血后并发脑血管痉挛的影响因素研究*
宋启星 朱飚 郑建桥 刘保国 张心佟 张龙 田硕
自发性蛛网膜下腔出血(SAH)是神经外科常见的急重症疾病之一,具有较高的致死致残率,颅内动脉瘤破裂是主要的诱发病因[1]。有资料显示,颅内动脉瘤破裂引发的SAH 发病率约为9/(10 万),其中致死致残率高达65%[2]。近年来,随着临床医疗技术的快速发展,血管内微创手术治疗的临床优势逐渐凸显,可有效改善SAH 患者预后,但临床并发症的发生率仍然高达10%[3]。脑血管痉挛(CVS)是自发性SAH 最常发的并发症之一,不仅可能导致自发性SAH 发生不可逆的神经功能损伤,也是导致自发性SAH 患者死亡的主要因素。因此,明确自发性SAH 后并发CVS 的相关因素对指导临床防治CVS 具有重要的意义。既往有研究指出,SAH患者年龄、术中出血量、基础疾病、动脉瘤位置等均与CVS 的发生有关,可作为SAH 后并发CVS 的预测指标[4]。除此之外,也有报道指出,血钾、血钙、血糖、血镁等生化指标以及白细胞计数的变化与CVS 的发生发展可能具有相关性[5]。基于此,本研究采用回顾性研究方法,评估自发性SAH 后患者并发CVS 的危险因素,为实际工作提供临床诊疗依据。现报道如下。
1 资料与方法
1.1 一般资料 选取2021 年1 月-2022 年4 月粤北人民医院收治的120 例自发性SAH 患者为研究对象。纳入标准:符合文献[6]中的自发性SAH 诊断标准,并经临床诊断、影像学检查确诊为自发性SAH;临床资料完整;依从性良好。排除标准:存在颅内肿瘤、颅内感染或血液疾病;合并自身免疫性疾病;全身重要器官存在器质性病变;Hunt-Hess分级为5 级;入院时已处于濒死状态;近期或正在参与其他临床研究。其中男51 例,女69 例;年龄41~79 岁,平均(55.94±8.21)岁。患者或家属对治疗方式、检测项目等知情同意,并签署知情同意书。本研究已经医院伦理委员会批准。
1.2 方法
1.2.1 临床资料收集 采用本院自制的《SAH 患者临床资料调查表》收集所有患者临床资料,包括性别、年龄、基础疾病、动脉瘤位置、Fisher 分级、Hunt-Hess 分级、动脉瘤破裂史、吸烟史、饮酒史及实验室指标(血糖、低密度脂蛋白、血钙、血钠、血镁、外周血白细胞计数及中性粒细胞百分比),收集完成后妥善保管,确保患者个人信息及隐私不外泄。Fisher 分级:根据CT 诊断结果,未见颅内出血为0 级,仅基底池出血为1 级,仅侧裂池或周边脑池出血为2 级,广泛蛛网膜下腔出血且伴有脑实质内血肿为3 级,基底池、周边脑池、侧裂池明显积血为4 级[7]。Hunt-Hess 分级:患者无明显不适症状,或仅存在轻微头痛、颈项强直症状为1 级,出现颈部强直、头痛明显、动眼神经等症状为2 级,存在轻度嗜睡、躁动或意识障碍为3 级,出现肢体偏瘫、昏迷或自主神经障碍为4 级,出现深度昏迷、去脑强直,濒死状态为5 级[8]。
1.2.2 CVS 标准及分组 CVS 诊断标准:(1)治疗后,自发性SAH 患者症状明显缓解后又进行性加重,并且伴有高热、血象高等症状;(2)意识障碍进行性加重;(3)出现神经系统功能缺损,如肢体功能障碍、感觉障碍等;(4)出现颅内高压增加症状,如头痛、呕吐及视乳头水肿等;(5)经DSA 检查显示存在CVS;(6)经颅脑多普勒超声检查显示血流速度、动脉参数变化,可见血流杂音。排除二次出血、出血导致的血肿、脑积水等病因后,自发性SAH 患者上述任意两项或以上,即可诊断为CVS[9]。根据患者是否并发CVS 将入组的120 例自发 性SAH 患者分为CVS 组(n=38)和 无CVS 组(n=82),分析自发性SAH 合并CVS 的影响因素。
1.3 统计学处理 将两组患者基本信息及临床资料以双录入校对的方式录入Epidata 3.0 软件,整理成最终的电子数据库,并导入SPSS 21.0 统计学软件进行数据处理。计量资料用()表示,比较采用独立样本t检验;计数资料以率(%)表示,比较采用χ2检验;多因素分析采用logistic 回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组基本临床资料比较 两组年龄、高血压、动脉瘤位置、动脉瘤破裂史、Fisher 分级、Hunt-Hess 分级比较,差异均有统计学意义(P<0.05),见表1。
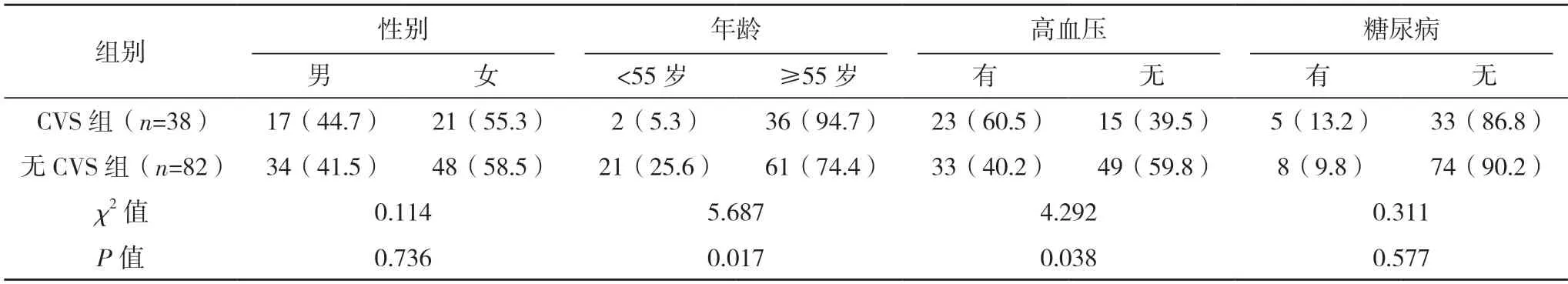
表1 两组基本临床资料比较[例(%)]

表1(续)
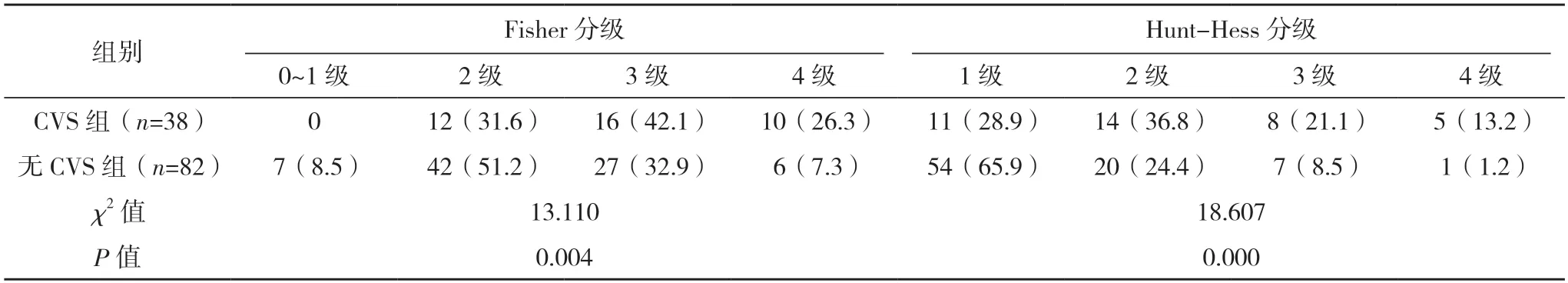
表1(续)
2.2 两组实验室指标比较 两组低密度脂蛋白比较,差异无统计学意义(P>0.05);CVS 组血糖、白细胞计数、中性粒细胞百分比均高于无CVS 组,血钙、血钠、血镁均低于无CVS 组,差异均有统计学意义(P<0.05)。见表2。
表2 两组实验室指标比较()

表2 两组实验室指标比较()
2.3 多因素分析 以是否合并CVS 为应变量,以单因素分析结果中有统计学差异的因子为自变量并进行赋值(年龄<55 岁=0,≥55 岁=1;无高血压=0,有高血压=1;动脉瘤位置:大脑后动脉=0,中动脉=1,前动脉=2;无动脉瘤破裂史=0,有动脉 瘤破裂史=1;Fisher分级:0~1 级=0,2 级=1,3 级=2,4 级=3;Hunt-Hess分级:1 级=0,2 级=1,3 级=2,4 级=3),血糖、血钙、血钠、血镁、白细胞计数、中性粒细胞百分比均以原始数据进入方程,建立logistic 回归模型进行分析。结果显示,年龄、血钙、血钠、Fisher 分级、白细胞计数、Hunt-Hess 分级、动脉瘤破裂史均为自发性SAH 患者合并发CVS 的影响因素(P<0.05)。见表3。

表3 自发性SAH患者合并CVS影响因素的logistic回归分析
3 讨论
颅内动脉瘤破裂是导致SAH 的主要诱因,血管破裂后,血液直接进入到蛛网膜下腔而引发一系列临床综合征。CVS 作为SAH 最常见的并发症之一,其发生率约为20%~40%,可进一步引发严重的局部脑缺血、迟发性缺血性脑损伤、脑梗死等继发病症,导致患者神经功能损伤[10]。目前,CVS 被认为是SAH 患者主要的致死致残因素之一,也成为临床治疗SAH 的重点关注问题。通常而言,CVS 可分为急性期和慢性痉挛期,其中急性CVS 患者颅内压明显升高、脑血流量和脑灌注降低,具有较高的死亡率,进入慢性CVS 后,由于微循环已受损明显,这一阶段可能造成神经功能损害,导致预后不良[11]。由于CVS 的发生机制复杂,现阶段尚无研究明确报道SAH 后并发CVS 的具体发生机制,这在一定程度上增加了临床防治CVS 的难度。因此,分析SAH患者并发CVS 的影响因素对指导临床制定防治干预措施具有重要的意义。
在国内的一项研究中,郭文才等[12]学者选取了514 例SAH 患者为研究对象,回顾性分析了SAH 患者并发CVS 的影响因素指出,高龄、颅内动脉瘤破裂史、Hunt-Hess 分级为4 级、Fisher 分级为3 级是导致SAH 患者并发CVS 的独立危险影响(P<0.05),这与本研究结果相似。在本研究入组的120 例自发性SAH 患者中,一共有38 例患者并发CVS,发生率为31.7%。通过分析基本临床信息显示,年龄、Fisher 分级、Hunt-Hess 分级、动脉瘤破裂史是自发性SAH 患者合并发CVS 的独立危险因素(OR>1,P<0.05)。临床认为,高龄SAH 患者由于机体各个器官功能减弱,血管反应性明显降低,当脑组织发生缺氧缺血后,代偿能力下降,受到刺激后更容易引发脑血管痉挛。Fisher 分级是基于CT检查积血程度的一种分级方式,已被证实Fisher 分级越高,SAH 患者并发CVS 的风险越大[13]。Hunt-Hess 分级是临床广泛应用的动脉瘤分级方法,与SAH 患者预后密切相关,Hunt-Hess 分级越高表示患者病情越严重,预后越差。从本研究结果中也可以看出,不同Hunt-Hess 分级的自发性SAH 患者并发CVS 的发生率存在显著性差异,Hunt-Hess 分级越高,越容易发生CVS。
有研究指出,与血管痉挛有关的蛋白质、胺类物质都是通过血管平滑肌细胞的Ca2+内流和细胞内钙库中的Ca2+释放而发挥作用[14]。在SAH 发病时,脑血管内皮细胞、平滑肌细胞内Ca2+分布遭到破坏,细胞内的Ca2+与钙调节蛋白结合后激活蛋白激酶C,从而导致肌球蛋白结合收缩。本研究结果显示,CVS 组血钙水平低于无CVS 组,且低血钙是导致自发性SAH 患者并发CVS 的危险因素(P<0.05),可见血钙降低可能与CVS 的发生发展有关,这在张峰等[15]研究中也得以体现。除此之外,低钠血症可导致脑水肿,甚至引发脑组织缺血性损伤。有资料显示,SAH 患者中约有45%左右的患者存在低血钠症,而其中84%的患者存在CVS 高风险[16]。本研究结果也显示,低血钠是自发性SAH患者并发CVS 的独立危险因素(P<0.05),提示血钠降低,自发性SAH 患者并发CVS 的风险越高,这可能与脑耗盐、抗利尿激素分泌失调有关。俞学斌等[17]研究指出,白细胞计数增高会影响血管物质的活性和免疫反应,诱导血管痉挛的发生,并指出白细胞计数可作为CVS 的独立预测因子。本研究结果显示,CVS 组的白细胞计数高于无CVS 组,且白细胞计数是自发性SAH 患者合并发CVS 的影响因素(P<0.05)。由此可见,通过监测白细胞计数的变化有助于评估自发性SAH 并发CVS 的风险,可以指导临床早期预防和治疗。
综上所述,自发性SAH 患者并发CVS 的因素较多,包括高龄、低血钠、低血钾、白细胞计数升高、动脉瘤破裂史、Fisher 分级以及Hunt-Hess 分级等,临床应当针对危险因素及时给予针对性干预,降低CVS 风险。

