太赫兹技术在胶质瘤诊疗中的应用:从组织分级到分子分型*
穆宁 杨川艳 马康 全玉莲 王诗 赖颖 李飞 王与烨 陈图南† 徐德刚 冯华
1) (陆军军医大学(第三军医大学)第一附属医院神经外科,重庆 400038)
2) (天津大学精密仪器与光电子工程学院,天津 300072)
太赫兹波(terahertz,THz)是位于微波和红外之间介观尺度波长的电磁波,因其低电离性和指纹性的特点,在生物医学领域有着巨大的应用潜力,尤其是在肿瘤的术中定位定性诊断方面.而对于定位定性诊断需求最迫切的肿瘤为胶质瘤,因其侵袭性和异质性,切除后极易复发且对临近脑区神经功能有显著影响,快速确定瘤体边界以及肿瘤病理学特征,是开展胶质瘤精准诊疗和临床研究的重要前提.本文总结了胶质瘤诊断的生物物理技术,梳理了太赫兹波这一新兴技术在胶质瘤诊断方面所取得的研究成果.进一步,基于胶质瘤组织病理和分子病理整合诊断研究进展,提出不同分子分型肿瘤组织在太赫兹波段可能具有不同 “特异性蛋白组成”的太赫兹肿瘤亚型识别机制假说,结合脑组织生物学特点与体液中胶质瘤标志物检测潜力,全面设想了未来太赫兹波在胶质瘤临床诊疗中的应用模式和发展前景.
1 引言
胶质瘤是中枢神经系统最常见的原发性实体瘤,恶性胶质瘤具有高度的侵袭性和异质性,在神经功能丰富而重要结构密集的大脑中可不断生长,而被破坏的中枢神经系统又难以实现结构再生和功能重建,其后果是恶性胶质瘤患者的身心残疾率高、生存期短且生存质量差[1].与绝大多数实体瘤治疗策略类似,尽可能精准地切除瘤体是胶质瘤目前得到有效控制的基础,而精准手术的前提是精准的识别[2].目前,尽管现有的神经肿瘤检测技术和仪器较好地解决了术前肿瘤的定位问题,但对于术中诊断与病灶识别,特别是面对浸润型神经肿瘤的深度、边界与分子分型精准识别,始终缺乏快捷而有效的技术手段.因此,发展快速定位和定性诊断技术为目前肿瘤研究的热点之一.为了实现胶质瘤的精准识别,多个领域专家均将太赫兹波谱与成像列为了重要的候选方案.
太赫兹(terahertz,THz)波因其低电离、无标记、指纹性等特性广泛应用于生物医学研究[3,4].太赫兹时域光谱(terahertz time-domain spectroscopy,THz-TDS)可反映生物样品的分子集体的非对称性振动/转动和极性基团振动/转动引起的偶极矩的变化,获得特异性介电参数;同时在复杂生物组织检测中,由于太赫兹波的单光子能量较低且对水吸收敏感,其光谱成像可以安全有效地反映不同生物组织成分结构的宏观整体差异.因此,近几年太赫兹技术在肿瘤病灶区域定位及病理学定性快速检测方面得到了大量应用研究[5-14].
本综述主要围绕太赫兹技术在胶质瘤诊断的研究进展和展望,分为以下几个部分: 1) 总结当前胶质瘤诊断的生物物理技术及其局限性;2) 简要回顾应用于生物医学的太赫兹探测技术,以及基于太赫兹光谱成像技术在胶质瘤诊断方面所取得的研究成果,进而提出不同分子分型肿瘤组织在太赫兹波段可能具有不同“特异性蛋白组成”的太赫兹肿瘤亚型识别机制假说;3) 结合胶质瘤脑组织生物学特点和体液中胶质瘤标志物,探讨太赫兹波在胶质瘤检测中的临床应用模式和前景.
2 胶质瘤客观诊断技术需求与现实局限
2.1 胶质瘤疾病特性决定了其对“同步定位定性”的高度精准诊断需求
胶质瘤是颅内最常见的原发肿瘤,其发病率大约占中枢神经系统肿瘤的80%[15].即使采用标准化的治疗,胶质瘤患者的预后仍不容乐观[1].由于脑胶质瘤呈浸润性生长,当肿瘤毗邻或累及神经功能结构时,即便应用手术显微技术,也不能达到既安全切除肿瘤、又不损伤神经结构的理想状态.因此,实现胶质瘤精准切除是当前神经外科诊治最基本的目标.这就要求术中实现胶质瘤的“定位”及“定性”: 定位需要实现的是变肿瘤边界的不可见为可见,定性需要实现肿瘤病理性质的不可见为可见;实现了肿瘤位置和性质的“可见”,就有可能以手术为起点,开展包括手术策略、综合诊疗策略上的精准诊疗.
当前临床肿瘤定性主要依赖于病理学方法.根据肿瘤组织的形态学特征(细胞性质、核分裂、核异型、微血管增殖和坏死等)可将神经胶质瘤分为1—4 级[15,16];这种组织学分级是判断和区分不同神经胶质瘤预后的传统手段,也是确定治疗方案的重要依据.但在长期使用过程中,这种组织病理分型的不足也逐渐显现,首先这种分型主要依据胶质瘤在传统光学显微镜下的形态学表现基础上再辅以免疫组化技术,更多的是依靠病理科医师的主观观察,然而组织学观察者的判读可能存在差异[17];其次,胶质瘤细胞存在多样性,导致组织病理学诊断结果可能囊括不同的细胞亚群,而不同亚型的肿瘤细胞可能带来显著差异的疾病预后,仅仅依赖组织分型无法做到尽可能细致的判断[2,15,18-20].2016 年,世界卫生组织中枢神经系统(World Health Organization-Central Nervous System,WHO-CNS)纳入了异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)、地中海贫血/智力低下基因(Alpha Thalassemia/mental Retardation syndrome X-linked gene,ATRX)、染色体1p 和19q 杂合性缺失(lp/19q loss of heterozygosity,lp/19q LOH)等分子标志物,在肿瘤分类中结合肿瘤组织病理及其分子病理信息,使相关诊断水平有所提高.这标志着中枢神经系统肿瘤诊断进入“整合”诊断时代[20,21](图1).因此,快速提取肿瘤分子病理特征是胶质瘤准确诊断和临床研究的重要依据,也是提高临床治疗效果的重要前提[16,22].
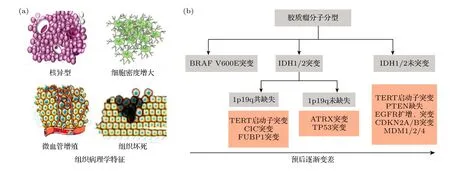
图1 基于“组织病理”和“分子病理”联合诊断标准 (a) 肿瘤细胞形态学特征;(b) 胶质瘤分子分型Fig.1.Based on a combination of histopathology and molecular pathology: (a) Morphological characteristics of tumor cells;(b) molecular typing of gliomas.
肿瘤的定位主要依赖影像学方法.由于影像学“定位”和病理学“定性”无法完美结合,当前临床上主要依赖影像学技术行手术前规划,依靠可见光波段显微镜进行手术,当手术中肿瘤边界区域难以抉择时,往往根据术者经验判断,先行切除少量临界组织进行快速(15—60 min)术中病理检测来获得初步定性提示,再根据提示判断是否已经到达肿瘤边界.即便如此“粗略”,由于缺乏“定性同时定位”的技术,该模式已然成为当前医学领域最优的选择和应用最广的方法.
在临床治疗和研究过程中,快速获取胶质瘤定位及定性信息,是开展胶质瘤精准诊疗和临床研究的重要前提.尽可能早地获取肿瘤分子分型信息,将带来一系列重要的临床进展.1) 弥补术中快速病理检测的局限: 在手术中,部分患者组织病理学未见某种特定肿瘤大体特征,但依据其分子特点,仍可做出诊断,辅助手术决策(如存在IDH 突变、1p/19q 共缺失,则高度提示少突胶质细胞瘤的诊断结果);2) 辅助手术策略的制定: 例如,IDH 突变型胶质瘤术后预后良好,在手术实行全切方案最佳,若术中快速获取的这一结果,可供主刀医师进行术中决策;3) 术中精准划定肿瘤边界: 胶质瘤具有极强的侵袭性和异质性,依据视觉判断和影像导航难以实现精准的边界识别,多切造成残疾、少切极易复发,术中快速病理,可以实现神经医生“定位同时定性”的术中病理学边界划定追求;4) 为术后综合治疗方案的制定提供更早、更全面的分子病理学依据.
2.2 现有定位定性技术及其局限性
当前主流的胶质瘤“定位定性”技术如图2 所示,主要分为影像学技术与病理学技术、分子生物学技术等,表1 重点阐述这些技术的优缺点.
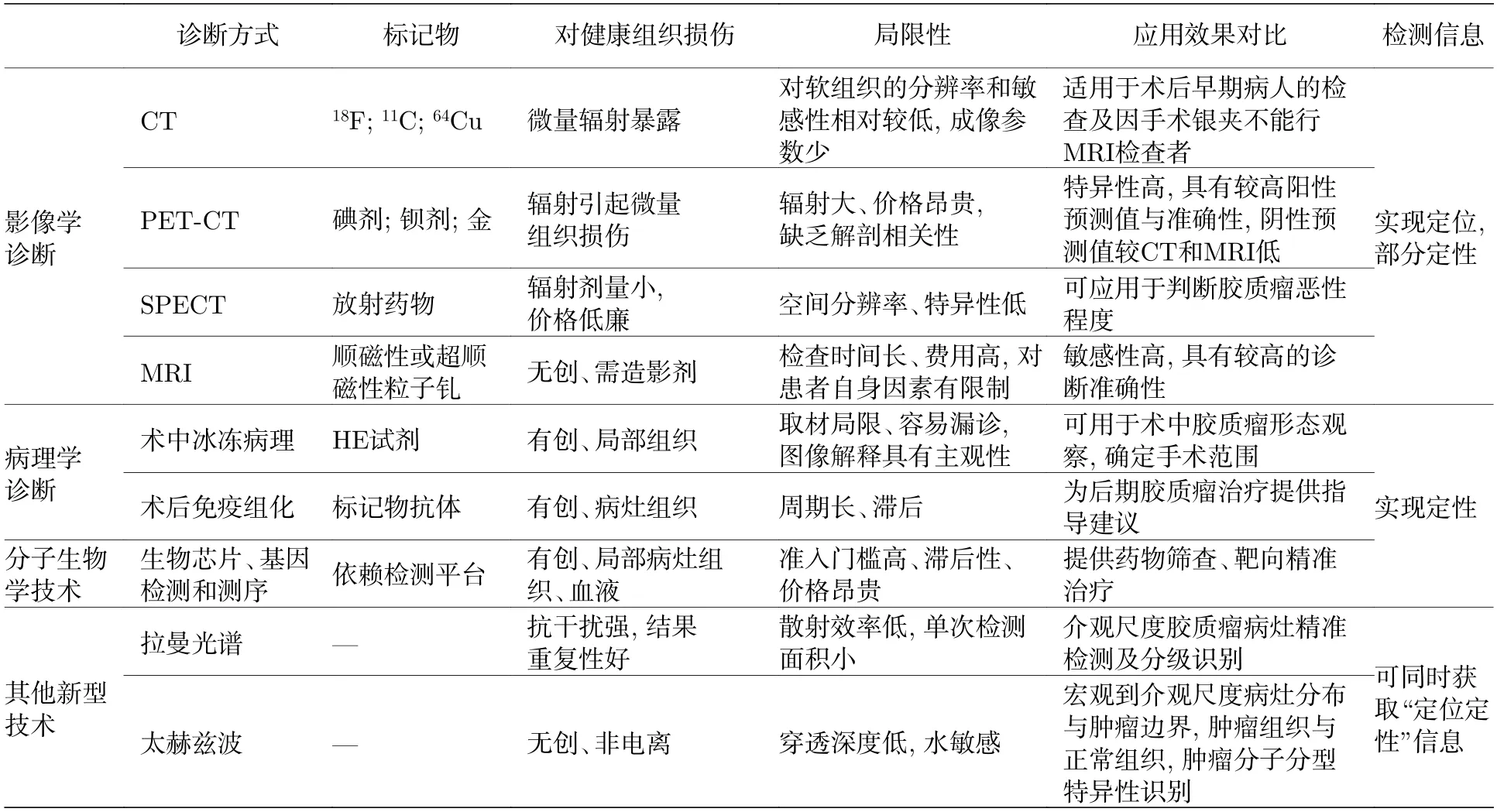
表1 当前胶质瘤临床诊断方法Table 1. Current clinical diagnosis of glioma.
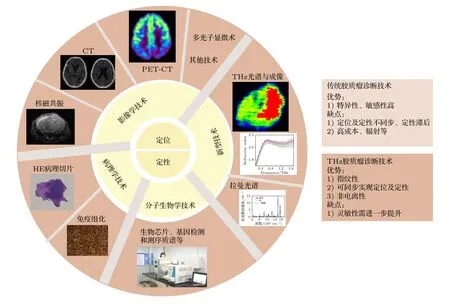
图2 胶质瘤诊断方法Fig.2.Diagnostic methods for glioma.
2.2.1 影像学技术
电子计算机断层扫描(computed tomography,CT)[23,24]又称X 射线电子计算机断层扫描仪,分为平扫和增强扫描,具有高分辨率、无前后重叠、病灶细节清晰、分期准确、扫描时间短等诸多优点.CT 可显示颅内占位性病变,能较清楚的对比分析术后渗血或积血,因此该技术可减少积血对胶质瘤术后影像学诊断所受的干扰;可有效检测脑组织血流动力学改变及肿瘤内部微血管改变,对鉴别良恶性肿瘤及对肿瘤分级有较重要的意义;但是相较于磁共振(magnetic resonance imaging,MRI),其对软组织分辨率低,同时成像参数少,可获得的诊断信息有限,因此单独应用CT 发生误诊或漏诊的风险较大;CT 增强则需要注射造影剂,但部分患者对造影剂过敏;另外,CT 也具有一定的放射性损害,可能引起医源性伤害.
正电子发射断层成像—X 线计算机断层成像仪(positron emission tomography-computed tomography,PET-CT)[25]是一种将PET 和CT 拼接在一起的诊断技术,CT 主要显示病灶的形态结构信息,PET 具有测定肿瘤代谢水平的能力,PETCT 扫描将两者结合,提高了诊断的准确性.PETCT 在判断胶质瘤良恶性、残留情况、以及鉴别肿瘤复发和放射性坏死具有一定的意义,其缺点主要有: 1) PET-CT 辐射较大(10—15 mSv/次),一部分是CT 检查出现的X 射线,另一部分则是氟代脱氧葡萄糖(fludeoxyglucose,FDG)等示踪剂造成的伽马射线;2) 价格昂贵.
单光子排放计算断层扫描(single photon emission computed tomography,SPECT)实际上是一种由CT 与核医学示踪原理相结合的影像技术.对判断胶质瘤恶性程度可提供一定的帮助,价格较便宜,辐射剂量也较少,但其空间分辨率及特异性不及PET-CT.
磁共振成像(magnetic resonance imaging,MRI)[26,27]是胶质瘤影像学诊断的金标准.以其优良的软组织分辨率在脑肿瘤检查中发挥了十分重要的作用.在生物组织发生病变时,其含水量会发生相应的改变,磁共振可灵敏地探测出这种差异[28];相较于CT,MRI 具有较高的图像分辨率,且MRI为多参数、多角度成像,清晰度和对比度高,伪影影响小,可实现肿瘤冠状面、矢状面、横断面等多方位成像,显示肿瘤病灶及周围组织、血管的关系,提高胶质瘤检出率及定位定性准确性.但是术区脑组织在术后会伴随有水肿及积血等情况;受此干扰,MRI 影像较为混杂.同时MRI 诊断也存在一定客观局限性: 1) 组织移动性;2) 如果患者存在金属心脏瓣膜、金属物体、迷走神经刺激器、子弹弹片等,则无法进行MRI 检查;3) 补牙使用的填充物和支撑物会影响头颅MRI 成像的质量;4) 幽闭恐惧症、儿童等患者无法忍受密闭性MRI,须在镇定剂作用下进行MRI 检查.
除此之外,术中影像学诊断还发展了多光子显微术[29,30]、以及基于5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)诱导的原卟啉IX (protoporphyrin IX)荧光光谱诊断成像技术[31,32].这些技术价格相对低廉,且可以有效识别高级别胶质瘤,但是对低级别胶质瘤不敏感.科学家们尝试开发更多的新兴技术,如从紫外到近红外光谱范围的光谱学[33-35]、拉曼光谱和成像[36]以及光声成像[14]、太赫兹光谱成像等.
2.2.2 病理学技术
组织病理学诊断是最理想、最可靠的诊断依据,是肿瘤定性诊断的金标准.通过病理检测对疾病进行判定,为临床治疗提供可靠的科学依据.目前常用方法主要有术中快速苏木素-伊红染色(hematoxylin and eosin staining,HE)切片和术后免疫组化.1) 术中冰冻病理HE: 由于胶质瘤的异质性,在术中病理检查时需要考虑尽可能多的部位,进行快速HE 切片,根据细胞形态等特征进行判断.尽管术中病理检查可以快速(大约30 min)确定有无癌组织残留,但也存在一定的局限: 冰冻病理切片的质量与常规石蜡切片有一定差距,准确率只有90%,存在误诊和漏诊的可能性,且只有经验丰富的病理医生才能够进行冰冻病理诊断;冰冻切片取材十分局限,局部组织难以代表整个肿瘤的全貌,且胶质瘤的侵袭性强,术中组织运动难以准确跟踪[14],须考虑较多的检查部位,不仅费时,而且加大了病理医师的工作量,从而难以准确地选择病理检查部位;术中诊断没有免疫组化等辅助手段,部分病变仅凭形态学特征并不能明确作出诊断.2) 免疫组化诊断: 通过对活检或手术切除的肿瘤组织切片,结合相关抗体进行染色观察;对于胶质瘤而言,术后的免疫组化可进一步确定分子分型等信息,为临床提供治疗方案的选择;但免疫组化技术具有抗体特异性及稳定性不足、工作量大、病理结果滞后等局限性.
2.2.3 分子生物学技术
目前,实验室分子生物学技术则主要有聚合酶链反应(polymerase chain reaction,PCR)、荧光原位杂交(fluorescencein situhybridization,FISH)、生物芯片、基因检测及测序等.
1) 聚合酶链反应.实时荧光定量PCR 是现在最普遍的检测技术,其操作简单,结果可靠,在生物实验中得到了广泛应用.其原理是在目的基因区域设计引物和探针,当探针和序列结合时,DNA聚合酶将荧光淬灭基团切断从而发出荧光,其假阳性低,成本也低.
2) 原位荧光杂交.该方法是最常用的原位检测方式,能够检测如细胞、组织和小型生物体等不同水平样本的单核苷酸多态性(single nucleotide polymorphism,SNP).
3) 生物芯片.属于微型生物化学分析系统,能检测不同时空条件下的基因变化;能显示反应特征性的组织类型、发育阶段和环境应答等.
4) 基因检测及测序.近十年来,基因组学及基因测序技术被广泛应用于临床,并在个体化医疗中优势明显.应用高通量测序技术(next generation sequencing,NGS)对肿瘤细胞基因组测序,并通过数据库比对关联肿瘤与特定基因,不仅有助于诊断分类,更有助于进一步深刻地理解各类型胶质瘤的生物学信息,为研发新的抗肿瘤药物、指导治疗方案并对预后判断提供强有力的依据,最终为胶质瘤患者制定最佳的个体化治疗方案.Sanger 法测序是目前检测肿瘤基因突变的金标准,灵敏度仅有20%左右,且基因检测、焦磷酸测序检测平台准入成本高、经验及人才缺乏,对于大多数病患而言高昂的自费检查难以承担.
定位定性存在时空差异性也是上述诊断技术最大的术中应用缺陷.近年来,以太赫兹光谱成像、拉曼光谱成像为代表的无标记分子光谱检测技术将电磁波作为激发媒介,光散射能量谱作为表征手段,通过对样品中固有生物大分子的振动/转动能级信息进行直接测量,实现特异性“指纹识别”表征;适用于肿瘤组织诊断.太赫兹波因其高空间分辨率和水敏感等特性,广泛应用于胶质瘤组织、细胞、特征性分子等的识别,实现胶质瘤诊断影像学“定位”和病理学“定性”同步.同时,太赫兹技术在胶质瘤术中诊断中还具有以下优势: 1) 太赫兹技术可解决术中组织移位问题,传统的术中导航即基于定位系统引导下将探针引入脑内,可能会造成组织移位,而太赫兹技术有望突破这一限制;2) 太赫兹波具有无损、无标记等特征,因此它不受造影剂、光透明剂、时间窗口、荧光素酶的限制,可快速检测不清楚的肿瘤边界,为疾病预后提供完整的肿瘤切除.由此可见,太赫兹波有望成为以神经肿瘤为代表的实体肿瘤术中“定位同时定性”识别的新型、快速、无标记诊断方法.
3 太赫兹探测技术在胶质瘤诊断中的应用研究
太赫兹波因其安全、水敏感、指纹性、无标记等特点,广泛应用于肿瘤诊断[3,4,7].拟通过以下两个方面系统梳理太赫兹技术在胶质瘤检测中的应用: 一是检测技术方面,分析当前最常应用于肿瘤检测的太赫兹检测模式,并对目前应用于肿瘤的相关研究进行了整理;二是检测效果方面,将重点阐述太赫兹光谱成像在胶质瘤诊断中的研究进展.
3.1 太赫兹光谱技术及其在肿瘤检测中的应用
根据太赫兹源产生方式的不同,太赫兹光谱系统主要分为太赫兹时域光谱和太赫兹频域光谱.其中太赫兹时域光谱系统在生物医学领域应用最为广泛,该系统主要由飞秒激光器、光电导探测器、测量模块(透射式、反射式、衰减全反射)等装置组成.其中最核心部分为飞秒激光器,它很大程度上决定了THz-TDS 的信噪比和动态范围.根据太赫兹波与样本作用机理的不同,太赫兹时域光谱系统可以分为透射、反射、衰减全反射三大类(图3),具体特点描述见3.1.1 节和3.1.2 节.在该系统中,飞秒激光器产生的激光脉冲经过分束分成两路,一路作为信号用于产生太赫兹波进而进行样品探测,另一路作为参考用于信号光的探测.信号路的飞秒激光被聚焦到光电导天线产生太赫兹脉冲,太赫兹脉冲在光路中通过样品并携带样品的信息;参考路的飞秒激光经过延迟线与携带样品信息的太赫兹脉冲一起到达电光探测晶体碲化锌(ZnTe),从而实现太赫兹波的探测.THz-TDS 技术相对于传统的傅里叶变换红外光谱(Fourier transform infrared,FTIR)技术有以下优势: 1) 基于相干探测技术,可以同时测得物质的相位信息和强度信息,并得到样品在太赫兹波段的介电响应信息;2) 太赫兹源的功率较高,可以在常温下工作,信噪比和稳定性高,同时其光谱的动态范围较大,频率分辨率高;3) 太赫兹波对水、蛋白质等生物大分子十分敏感,且太赫兹波对许多生物大分子具有指纹谱特性.基于上述优点,可以利用THz-TDS 技术实现对生物病变组织和细胞的检测,该方法受到研究学者的广泛关注.表2 整理了近10 年太赫兹光谱技术在肿瘤诊断中的应用.
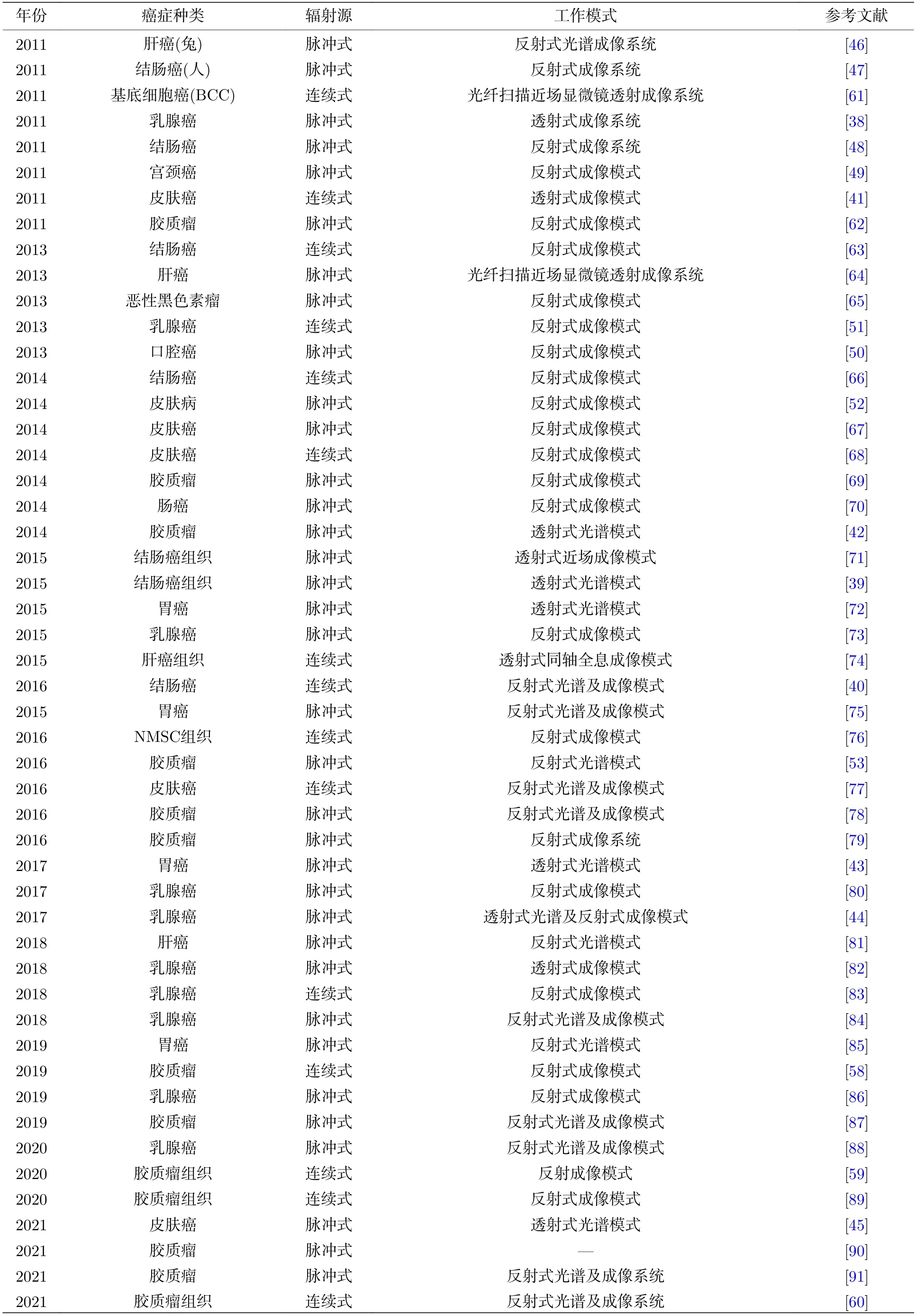
表2 近10 年太赫兹技术在肿瘤诊断中的工作模式Table 2. Patterns of THz technique in tumor diagnosis over the last 10 years.
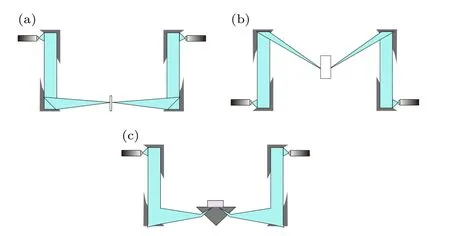
图3 太赫兹光谱检测技术 (a) 透射式太赫兹光谱系统;(b) 反射式太赫兹光谱系统;(c)衰减全反射太赫兹光谱系统Fig.3.Terahertz spectral detection technology: (a) Transmitted THz spectral system;(b) reflected THz spectral system;(c) attenuated total reflection THz spectral system.
3.1.1 透射式太赫兹光谱系统
对于低吸收的材料如高透明的固体等,太赫兹波穿透这些物质后衰减很小,一般采用透射式的探测方法对其进行检测[37].典型的透射式太赫兹时域系统的原理是: 激光器发出脉宽飞秒量级的激光脉冲经过分光镜后被分成两束,分别为泵浦光和探测光;其中泵浦光用于产生太赫兹脉冲,然后经过抛物面镜及透镜的作用聚焦到样品表面,透过样品的太赫兹波束被探测器收集,在光学延迟平移台的调控下,和相干的探测光束一起聚焦在探测器上进行光电导探测,经过锁相放大器后读出携带样品信息的太赫兹时域波形.近10 年来,学者们先后用该系统对基底细胞癌、乳腺癌、结肠癌、胃癌等组织进行检测[38-45].
3.1.2 反射式和衰减全反射式太赫兹时域光谱
对于反射式太赫兹时域光谱,其检测样品主要为高吸收的材料如厚的固体材料和溶液等,由于太赫兹系统的功率和动态范围有限,透射式方法检测得到的结果很不理想,这种情况下可使用反射式的探测方法.反射式与透射式太赫兹系统的区别在于太赫兹波束传播的光路不同.除此之外,当太赫兹波从光密介质入射到光疏介质,且入射到样品中的入射角大于临界角时,也会发生衰减全反射,系统则变为衰减全反射测量.衰减全反射系统探测原理是: 当太赫兹波进入棱镜内,在棱镜-样品面上发生全内反射而产生倏逝波,界面上的倏逝波与样品相互作用,反射到棱镜出射面的光波携带了样品信息,经棱镜-空气界面折射后,水平射出到检测器上;
此时,出射的太赫兹波束主要携带了样品的相关信息,通过分析太赫兹波信号,可以获得样品的太赫兹物理化学性质.近10 年来,学者们先后通过优化太赫兹反射系统,检测了肝癌、结肠癌、宫颈癌、恶性黑色素瘤、乳腺癌、皮肤病、胶质瘤等[46-53],证明了该检测系统在肿瘤诊断的应用价值及优势.
3.2 太赫兹波成像技术及其在肿瘤研究中的应用
随着太赫兹波谱检测技术的不断发展,出现了各种原理和结构的太赫兹成像装置.根据太赫兹源的不同,太赫兹成像可以分为连续波成像[54]和脉冲成像[55];根据成像模式的不同,太赫兹成像可以分为透射式[56]、反射式、衰减全反射[57]等.
连续波太赫兹成像根据物体内部缺陷或损伤边缘对太赫兹光的散射效应,从而影响太赫兹波电磁场的强度分布.在检测过程中,样品放在太赫兹源的焦点处,将太赫兹源或样品固定在X-Y二维平移台上,通过计算机控制平移台,实现太赫兹源相对样品的移动.计算机采集样品表面或金属底板透射或反射回的强度信息,实现对样品不同点的成像,获得样品的二维图像.
脉冲式太赫兹成像则是在THz-TDS 的基础上利用二维移动平台控制样品的移动,在每个位置得到的时域波形即为脉冲式太赫兹成像的像素信息.后期可以将时域波形或计算得到的折射率、吸收系数等参数作为像素信息对图像进行重构.表2总结了近10 年太赫兹成像技术在肿瘤研究中的应用,实验证明太赫兹成像能够区分生物组织中的水分分布,有望于应用于肿瘤诊断成像[58-60].
在上述系列研究中,研究者主要从以下角度解释太赫兹波识别肿瘤的内在机理.1) 含水量差异:基于太赫兹波水敏感性特征,由于肿瘤代谢旺盛、生长迅速且具有较强的免疫原性,肿瘤区域往往伴有大量的血管生成和炎症反应,使得肿瘤区域的含水量较高,水的折射率和吸收系数高于正常组织,可据此区分肿瘤与正常组织[92-94];2) 宏观结构差异[95]: 低级别的肿瘤新生毛细血管较少、代谢相对较慢,局部呈现相对较低的血流灌注状态;而高级别肿瘤新生血管较为丰富,且生长速度较快,易发生组织坏死与囊变,呈现不均匀灌注,太赫兹技术可以反映组织微循环状态,据此进一步区分不同恶性程度肿瘤;3) 介观尺度差异: 癌细胞侵袭性生长,肿瘤区域的细胞核数量大于正常区域,从而导致更多的细胞,其细胞密度、结构以及对应生物大分子含量与正常组织差异明显[95];4) 微观结构差异: 即分子构成差异,从物理表征来看,太赫兹波对肿瘤的表征,实际上是对其内所含生物分子(主要是蛋白)集体振动、转动模式差异的检测,太赫兹波对肿瘤特征分子蛋白构象、蛋白与蛋白相互作用及突变等敏感,证明了利用太赫兹光谱诊断肿瘤的可行性[96].
3.3 太赫兹光谱和成像技术在胶质瘤诊断中的应用
研究者为了探索太赫兹技术在胶质瘤诊断中的应用价值,大多数都是采用太赫兹光谱及成像技术对胶质瘤组织进行检测.随着研究的进一步深入,也出现了利用太赫兹技术检测胶质瘤细胞和胶质瘤特征性分子的研究,进一步拓展了太赫兹技术的应用范围.我们总结了太赫兹技术在胶质瘤不同物理尺度样本检测中的研究现状,主要包括组织、细胞和特征性分子的检测研究,图4 展示了近10 年来太赫兹技术在胶质瘤诊断研究领域的发文情况(图4).当前基于太赫兹技术研究胶质瘤的结果如表3 所示.
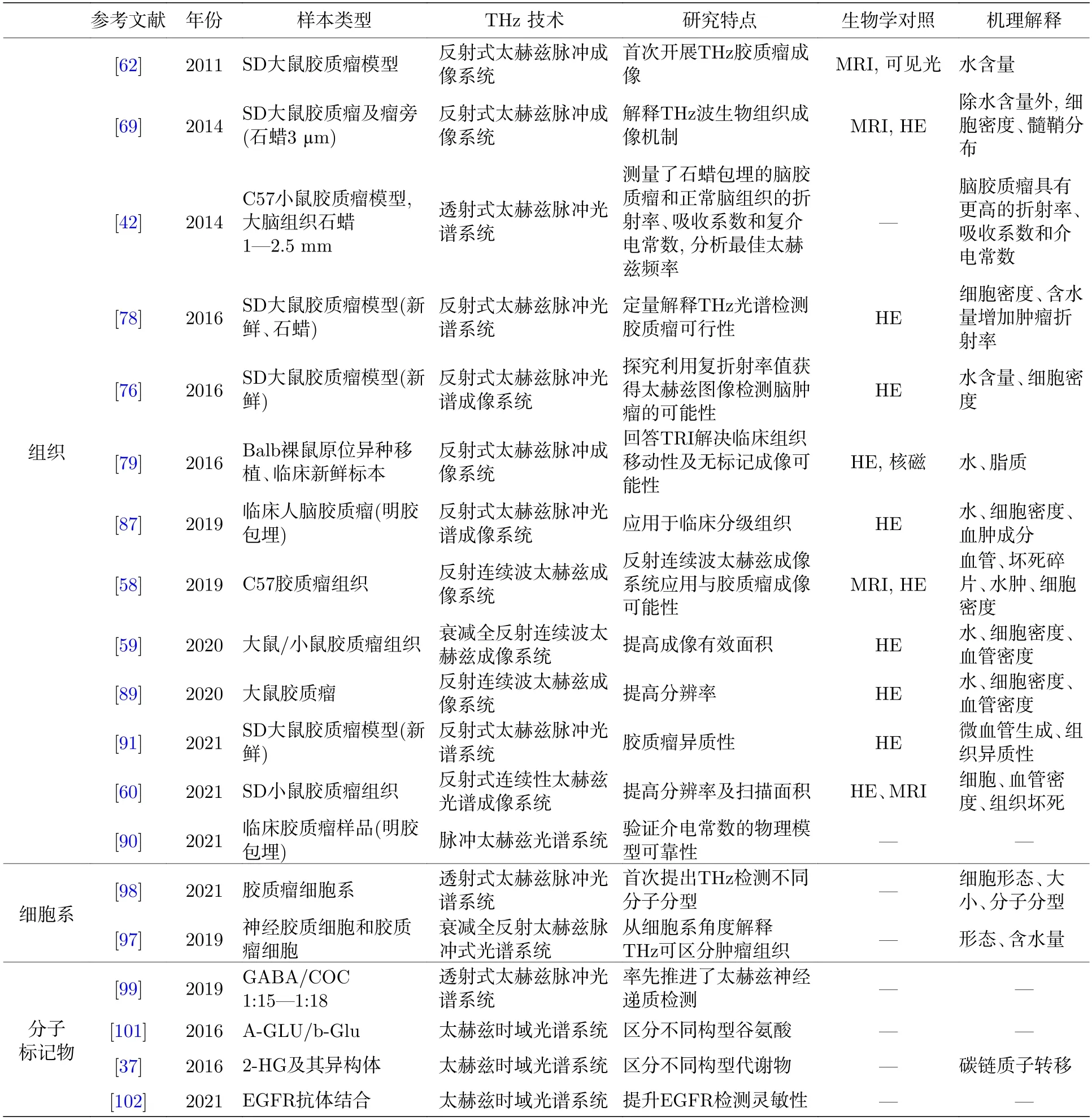
表3 当前基于太赫兹技术研究胶质瘤的结果Table 3. Current results of glioma studies using the terahertz techniques.
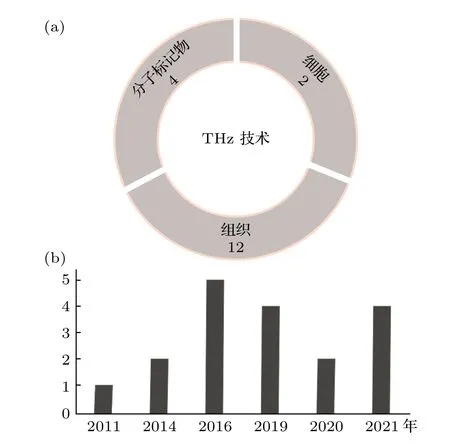
图4 近10 年太赫兹技术在胶质瘤诊断研究中的发文情况Fig.4.Publication of THz technology in glioma diagnosis in recent 10 years.
3.3.1 胶质瘤组织的太赫兹检测
太赫兹技术作为一种“图谱合一”的检测方法,可在获取样本光谱信号的同时进行成像研究.典型的太赫兹成像系统产生的辐射波长范围为30 µm—3 mm,所以太赫兹波不太容易在生物组织内散射,且太赫兹波具有水敏感性,而胶质瘤组织比周围组织水浓度高,所以太赫兹技术在胶质瘤诊断方面具有良好的前景.2011 年,韩国延世大学Oh 等[62]首次将太赫兹技术应用于胶质瘤组织的检测研究,他们采用反射式太赫兹脉冲成像系统(THz pulsed imaging,TPI)研究了新鲜离体大鼠脑胶质瘤模型.结果显示太赫兹波成像显示的肿瘤区域与核磁检测区域相吻合.进一步,他们发现大鼠脑灰质和白质的太赫兹反射参数存在差异,并推测这可能源于灰质中髓鞘的含量较低.这项研究初步证明了太赫兹波对脑胶质瘤识别的潜力,为后续脑胶质瘤检测研究奠定了基础.为了进一步解释太赫兹波生物组织成像机制,2014 年,Oh 等[69]再次利用TPI 技术进行脑胶质瘤组织识别研究,结果验证了太赫兹波技术可实现新鲜离体脑组织肿瘤边界的清晰划分,且可识别脑组织中的灰质和白质区域.另外,他们还实现了石蜡包埋脑组织中肿瘤区域的识别,通过与HE 染色结果对比,推测TPI 技术识别肿瘤主要源于该区域的高密度细胞.同年,Meng 等[42]利用太赫兹时域光谱系统检测石蜡包埋脑胶质瘤和正常脑组织.结果显示,与正常组织相比,石蜡包埋脑胶质瘤具有更高的折射率、吸收系数和介电常数;进一步分析了石蜡包埋脑胶质瘤成像的最佳太赫兹参数.
以往基于太赫兹技术进行的脑胶质瘤研究证明正常和肿瘤组织的差异主要来源于含水量和细胞密度的差异,但是尚未进行定量的解释.为了回答这一问题,2016 年,Yamaguchi 等[53]获得了新鲜和石蜡大鼠脑组织的太赫兹波反射率光谱.通过定量分析,计算得出新鲜脑胶质瘤组织中的含水量比正常组织增加了大约5%,脑胶质瘤组织单位面积的细胞核密度比正常组织增加15%以上,这两者的共同作用导致肿瘤区域的折射率高于正常组织.基于此结果,Yamaguchi 等[78]尝试采用复折射率获得鼠脑太赫兹图像,探索使用太赫兹波检测脑肿瘤的内在机理.结果显示,利用太赫兹检测区域的复折射率结合主成分分析,可进行新鲜离体大鼠脑组织的肿瘤区域可视化.他们发现太赫兹成像中显示的肿瘤区域大于染色图像中,这主要与肿瘤病灶周围存在的水肿区域有关.通常,为了改善缺氧和营养物质的微环境,肿瘤组织的新生血管增加,进一步导致了该区域含水量增大.另外,细胞代谢的病理变化也将导致肿瘤区域周围出现水肿,此变化仅影响水肿组织区域的含水量,对细胞密度没有影响.Kucheryavenko 等[91]研究了脑组织区域结构及胶质瘤异质特性的太赫兹光学特性.发现正常组织和肿瘤组织间存在差异,且脑组织中有异质特征,这可能源于白质和灰质的不同反应、不同神经血管结构的存在以及坏死碎片和出血等.在术中诊断过程中,这种异质性可能会导致神经肿瘤边缘描绘的复杂化.
为了分析太赫兹技术在术中神经诊断方面的潜在价值,韩国延世大学Ji 等[79]在2016 年尝试进行原位移植瘤及不同级别(WHO 2—4 级)离体人脑胶质瘤组织的太赫兹成像研究.结果表明,太赫兹波识别肿瘤区域与组织病理显示区域基本吻合,证实了太赫兹技术可用于神经肿瘤宏观区域识别和边界检测,且可有效地解决组织移位和标记等问题.随后,Gavdush 等[87]采用太赫兹脉冲光谱技术研究了26 例不同WHO 级别明胶包埋的人脑胶质瘤组织的太赫兹光学特征,结果显示,不同病理级别组织间与瘤旁组织的太赫兹波折射率和吸收系数等参数具有显著差异,且瘤周水肿区域与肿瘤具有类似的太赫兹响应.这客观地揭示了太赫兹技术在不同WHO 级别人脑胶质瘤手术诊断中的优势.基于太赫兹波肿瘤诊断的迅速发展,太赫兹波与肿瘤组织相互作用的物理模型也逐渐得到关注.基于此,Gavdush 等[90]用双德拜(double Debye,DD)模型和双过阻尼振子(double overdamped oscillator,DO)分析不同分级胶质瘤组织和瘤旁的太赫兹介电响应常数.这两个模型均可以准确地再现太赫兹范围内的神经胶质瘤响应,证实DD 模型和DO 模型可被用于参数化脑组织在太赫兹频率下介电响应分析.2019 年,Wu 等[58]基于反射式连续太赫兹波成像系统,研究了新鲜离体和在体小鼠脑胶质瘤模型.结果显示,采用频率为2.52 THz的太赫兹波反射成像系统可实现在体和新鲜离体脑组织的肿瘤区域识别,且太赫兹波成像与磁共振、HE 图像中显示的肿瘤区域具有良好的相关性;通过太赫兹时域光谱仪检测发现,在0.6—2.8 THz范围内,脑胶质瘤与正常脑组织的太赫兹光谱差异较大,其中脑胶质瘤的折射率和吸收系数较正常组织高,且在高频范围内差异较大.这些结果表明,太赫兹成像技术作为术中无标记诊断脑胶质瘤的替代方法具有巨大的潜力.并且解释了小鼠正常和肿瘤脑组织的区别在于肿瘤组织中水分含量的增加,主要是由于新血管、坏死碎片的体液和细胞密度变化引起的.证实了单点扫描太赫兹成像技术可通过检测胶质瘤细胞特征识别肿瘤边界,为临床应用检测脑胶质瘤疾病提供了一种新的肿瘤检测方法.为了提高太赫兹波在胶质瘤成像中的分辨率,Wu等[59]在2020 年报道了水平扫描连续波太赫兹ATR成像系统.通过优化ATR 棱镜,使得成像面积达到与棱镜成像面一样大,其不仅可避免二次反射的影响,且系统在水平和垂直方向上的成像分辨率可分别达400 µm 和450 µm.通过采用高折射率材料的全反射棱镜和较大的太赫兹波入射角,有助于更小尺寸肿瘤组织的识别.此外,通过该成像系统可以清晰区分大小不同的胶质瘤区域.且太赫兹图像显示的肿瘤区域的体积、位置与肉眼及HE 染色图像的宏观显示相似.同年,该团队Wang 等[89]针对连续波太赫兹图像提出了一种混合ROI 分割方法.该方法结合了块匹配3D 去噪、模糊c-means聚类、形态学操作和canny 边缘检测,实现连续太赫兹图像的ROI 高效识别.结果显示使用这种混合ROI 分割方法能够精确分割肿瘤区域,准确度、灵敏度和特异性分别为95.6%,84.5% 和97.7%.
3.3.2 胶质瘤细胞的太赫兹波检测
与胶质瘤组织波谱成像研究相比,太赫兹技术检测胶质瘤细胞研究起步较晚.2019 年,Wang 等[97]对胶质瘤细胞及神经细胞进行了太赫兹光谱检测,提出了一种在细胞厚度未知情况下,结合单层和双层ATR 模型来确定活细胞介电响应的方法.实验结果表明,太赫兹介电响应特性与细胞数量、细胞内液体和细胞结构显著相关.此外,胶质瘤细胞(C6 和U87)与正常胶质细胞相比具有不同的介电特性,这可能是太赫兹波识别胶质瘤组织的原因之一.随着胶质瘤分子分型的提出,Zhang 等[98]提出了由切割线和裂环谐振器组成的超材料生物传感器,在生物传感器表面培养了两种类型的胶质瘤细胞(IDH 突变型和野生型).测量结果表明,在没有抗体引入的情况下,通过观察任何细胞浓度下EIT 共振频率和幅度的变化,可以直接区分突变型和野生型胶质瘤细胞.这为太赫兹波识别胶质瘤分子分型开辟了新途径.
3.3.3 胶质瘤特征性分子的太赫兹波检测
除此之外,研究者还对胶质瘤特征性分子等进行了检测.γ-氨基丁酸(GABA)是中枢神经系统中主要的抑制性神经递质,其构象对选择生物功能和信号传递过程至关重要.虽然这种神经活性分子已经被广泛研究,但是其在太赫兹波段的构象和分子间相互作用有关的振动特性尚未在实验中确定.Cheng 等[99]应用0.5—18.0 THz 的宽带THz-TDS系统来表征GABA 独特的指纹信息.研究结果表明,GABA 在1.15 和1.39 THz 有明显的集体振动.太赫兹波高频下的吸收携带部分集体振动,但更多地反映了特定的局部振动信息,包括骨架变形和官能团的摇摆,这些与GABA 的构象和灵活性密切相关.这项研究可能有助于理解神经递质分子的构象转变和与太赫兹波的共振反应.L-谷氨酸(L-Glu)在胶质瘤细胞中迅速积累,然后转化为谷氨酰胺[100].Ruggiero 等[101]测量了左旋谷氨酸的多晶型.结果表明,太赫兹光谱可以区分左旋谷氨酸构象形式.IDH1 突变在胶质瘤中很常见,可产生s2-羟基戊二酸二钠盐(2-hydroxyglutarate,2HG),其作为胶质瘤的标志物,可用于研究肿瘤的发展阶段,以及识别正常组织与癌组织的边界.尽管磁共振波谱法(magnetic resonance spectroscopy,MRS)可对2HG 进行有效地检测,但是检测时间至少为20 min,且2HG(连续合成和分解)存在变异性,将导致2HG 的图像检测结果无法作为医疗外科诊断时的实时图像.Chen 等[94]利用太赫兹时域光谱系统研究了2HG 同分异构体的振动光谱,并利用密度泛函理论进一步区分了它们的物理性质.研究发现同分异构体L-2HGDS 和D-2HGDS 具有不同的特征吸收峰(L-2HGDS: 0.769,1.337,1.456 和1.933 THz;D-2HGDS: 0.760,1.200,1.695 和2.217 THz).但是2-HG 和2HGDS 还是有区别的,酸基在二钠盐状态下可能有不同的振动模式.异构体之间的差异主要归因于碳链内的质子转移.这些结果表明,太赫兹技术能够准确、快速地识别2HG 的异构体,对胶质瘤的进一步研究和临床手术具有重要意义.表皮生长因子受体 (epidermal growth factor receptor,EGFR)在胶质瘤增殖中起重要作用,胶质瘤组织中EGFR 的表达水平可为诊断和预后提供依据.改进EGFR 检测技术,实现更高的灵敏度和更快的速度,将有利于多种肿瘤的诊断.Liu 等[102]2021 年尝试基于太赫兹技术结合金纳米粒子(gold nanoparticles,GNPs)和EGFR 抗体修饰,实现了对EGFR 的增敏.该超材料生物传感器还可以实现微小体积的EGFR 溶液检测.因此,该技术可能应用于实现EGFR 相关肿瘤的快速准确检测.
除此之外,研究者还先后对NAA、肌醇、肌酸等进行了检测.肿瘤引起的神经元丢失导致NAA浓度降低[103].且NAA 在1.466,1.695,1.979 和2.879 THz 处发现了4 个特征峰.肌醇/肌酸在星形胶质细胞病相关的脑疾病具有显著差异[104]: 例如,高级别间变性星形细胞瘤和胶质母细胞瘤中,肌醇/肌酸比值较低,具体为(0.39±0.11),(0.025±0.06);反之,低级别星形细胞瘤患者的肌醇/肌酸较高,数值为(2.14±1.4)[105].Yang 等[106]测量了肌醇的太赫兹光谱,发现在1.00,1.46,1.58,1.85 和2.05 THz有五个特征峰.King 等[107]测量了肌酸的太赫兹光谱,发现在1.23 和1.97 THz 有两个特征峰.
十年间,基于太赫兹技术的脑胶质瘤研究不断涌现,主要包括: 1) 从正常与病灶组织鉴别,到不同恶性程度组织的识别;2) 从离体样品检测,到动物在体样本检测;3) 胶质瘤细胞自身具有的或外来添加的特征性分子识别.这三方面的研究为太赫兹波肿瘤检测的应用发展奠定了基础,但是从检测机制、结果一致性、生物对照单一及临床价值等方面,太赫兹技术仍然难以达到辅助手术医师或病理医师进行诊断的效果,更鲜有关于参考分子病理学知识进行脑胶质瘤研究的报道.
不同的胶质瘤分子分型,意味着各型肿瘤细胞具有截然不同分子生物学特征,由于它们蛋白表达的差异性,从而发生不一样的生化反应过程、显现不同的疾病进展或复发特性、对同一治疗手段产生不同的响应模式,最终产生了截然不同的治疗方法.聚类具有“近似分子特征”的肿瘤细胞亚群,这些细胞亚群,才最有可能产生较为稳定的太赫兹波物理表征结果,从而实现胶质瘤合理精细的分子分型.
从物理表征原理上看,包括胶质瘤在内的肿瘤细胞,其尺寸一般介于亚微米到数个微米之间,在太赫兹光谱中一般不会表现出特征光谱结构.由多种细胞及其间质构成的肿瘤组织,更难以在太赫兹波谱中出现“吸收峰”等典型特征.太赫兹波对肿瘤的表征,实质上是对其内所含生物分子(主要是蛋白)集体振动、转动模式差异的检测.如果一类肿瘤细胞或者组织,具有某种相对稳定的“特异性分子集合”,那么,这类肿瘤就有可能被太赫兹技术检测出来.因此,我们提出不同分子分型肿瘤组织可能在太赫兹波段具有不同“特异性蛋白组成”的太赫兹肿瘤亚型识别机制假说.
在我国太赫兹波胶质瘤研究进展中,最早由天津大学姚建铨院士团队发起,带动了多家研究机构的跨学科团队参与研究,该研究团队的胶质瘤系列研究是目前国际上最为丰富和前沿的[58-60,89,97].2021 年初,上海理工大学专家和俄罗斯科学院联合发表了针对胶质瘤分子标记物进行胶质瘤检测的研究综述,总结和展望了针对胶质瘤内分子标记物进行特异性识别的太赫兹波谱识别方法,这代表了研究胶质瘤病理分类的一个实用策略[108].近年来,常超研究员领导的跨学科研究团队不断推进太赫兹生物学领域研究深度[99,109-114],其创新研究成果对肿瘤诊断领域也具有重要理论启发和技术借鉴价值.
4 太赫兹技术在胶质瘤诊断应用模式展望
基于上述研究进展可知,研究人员利用太赫兹波谱差异性可初步实现胶质瘤组织、细胞、特征性分子等样本的识别.为促进太赫兹诊断技术的临床应用,推进临床诊疗技术水平的提高,结合太赫兹技术特点,进一步提出太赫兹技术在胶质瘤整个诊疗过程中的潜在应用方式.
4.1 太赫兹技术在胶质瘤术前诊治中的应用
快速准确地检测体液(血液及脑脊液等)中分离的循环肿瘤细胞(circulating tumor cell,CTCs)、细胞外囊泡(extracellular vesicles,EVs)、分子标志物、代谢物、循环肿瘤DNA(circulating tumor DNA,ctDNA)和微小RNA(microRNAs,miRNA)等遗传肿瘤材料[115-118],可实现胶质瘤早期病理诊断.Kumar 等[119]提出了一种高灵敏度、低约束损耗的SC-PCF 传感器,可基于太赫兹技术高效检测血细胞.CTCs 是肿瘤细胞从原发性肿瘤中脱散并进入人外周血循环,可用于诊断癌症和监测癌症的状态[120,121].目前通过FDA 认证的CTCs 检测方法为细胞搜索系统.但该方法的阳性率低,而且现有的所有CTCs 检测方法都无法判定检测到的细胞是存活还是凋亡的,而只有功能细胞才能够促成转移灶的形成.Zhu 等[122]提出了三维超材料设计将其集成到微流体芯片中,利用这种相似性与具有物理结构的红细胞(red blood cell,RBC)分离CTC,并用太赫兹光谱检测CTCs,实现了CSCs 的分离和鉴定.肿瘤细胞释放也会释放ctDNA,miRNA等到体液中,并在体液中表达稳定.目前这两种遗传资料主要基于PCR 技术进行跟踪肿瘤突变模式的变化[116,118,123].杨柯等[124]构建并优化了一种集成超材料技术、纳米材料技术和SDA 技术的太赫兹超材料纳米芯片,获取了其检测microRNA-21的灵敏度、特异性和重复性等一系列重要方法学指标并进行了临床样本检测.除了体液中的分离物,体液中一些蛋白质同样也参与了胶质瘤发生发展,可作为胶质瘤的诊断指标之一[115,125-129].在这些蛋白质中,最具代表性的是血管内皮生长因子和血管生成相关蛋白(FGF-B,IGFBP-2,EGF),细胞外基质蛋白(TSP12,TNC,Cyr61,CCN1,OPN等),基质金属蛋白酶(MMP-2,MMP-9,AEG-1),胶质纤维酸性蛋白,巨噬细胞迁移抑制因子和功能相关的蛋白质(DD-T,CD74,CD44,CXCR2,CXCR4)[130,131]、髓鞘碱性蛋白(MBP)[132]等,均为脑脊液或胶质瘤的血液生物标志物.目前,胶质瘤体液蛋白的检测手段主要为质谱等,曹灿等[133]基于太赫兹光谱技术实现了蛋白质构象识别及分子间的相互作用,研究发现太赫兹波可识别体液中的标志蛋白物.代谢产物谱与肿瘤中特定代谢途径的激活密切相关,目前胶质瘤血浆样品筛选出224 种代谢产物[134],特别在高级别和低级别胶质瘤,有五种代谢物(尿嘧啶、精氨酸、乳酸、胱胺酸和鸟氨酸)具有显著差异,而且已经观察到与核苷酸(例如,嘧啶),氨基酸(例如,精氨酸、谷胱甘肽、丙氨酸)和碳水化合物(例如,糖酵解和丙酮酸)代谢有关途径的显著变化,这与肿瘤的特征发展一致[135].另外,燕芳等[136]通过对氨基酸官能团太赫兹振动模式研究,为太赫兹代谢物的诊断提供了可能.
除此之外,神经胶质瘤可通过细胞外囊泡、外泌体等与邻近细胞进行信息交流,几乎可以从所有体液中提取[116,137-140].据文献报道,胶质母细胞瘤EVs中MicroRNA-301a[141-143],核酸变化[144],miRNA-21[145],miRNA-1587[146]和Epha2[147]等显著增加.太赫兹波可通过检测EVS 中物质成分进行胶质瘤诊断.然而由于水敏感问题的存在,既往研究多局限在固相或干燥状态下分子、细胞、组织等,为了降低水溶液对太赫兹波的强烈吸收,增强太赫兹信号,提高检测的精度和灵敏度,因此可针对液相环境的传感器芯片方向设计,或者采用分子动力学等构建生物分子溶液检测模型[148].Zhang 等[149]设计了一种新型的微流体多通道超材料生物传感器(multi-microfluidic-channel metamaterial biosensor,MMCMMB).多通道主要设置在超材料强电场增强区域,大大减少了液量,增强了传感目标与太赫兹波的相互作用,从而提高了灵敏度.通过异丙醇-水混合物和牛血清白蛋白溶液的传感结果证明了该设计的有效性和在THz 生物传感方面的巨大潜力.此设计具有灵敏度高、无标签、成本低、操作方便、液体量的优点,可为液体基物质的太赫兹无标记生物传感提供了一条可靠的途径[149].Zhou等[150]通过太赫兹石墨烯-超表面微流控平台增强生物分子与太赫兹波的相互作用,从而提高灵敏度.为了验证这一概念,采用了纯微流控单元、超表面微流控单元和石墨烯微流控单元进行对比实验,探索并验证了微流控单元的传感机理.证明了基于石墨烯-超表面THz 杂化微流控器件的精密传感的高灵敏度[149].此外,研究者也采用分子动力学实现水溶液样品检测.例如: Sebastiani 等[151]基于对甘氨酸等氨基酸溶液进行THz 测量,通过abinitio 分子动力学模拟证实在315 cm 处的N-C-CO 开/关模式可作为敏感的、无标记的酰胺基局部质子化探针.实验证实了,由于质子化引起的强度变化可以通过THz 时域(0—50 cm)和精确的THzft 光谱(50—400 cm)探测到,实现了太赫兹光谱在无标记方式下探测天然氨基酸在水中的电荷状态[151].
4.2 太赫兹波谱与成像技术在胶质瘤手术中的应用前景
除了术前的体液诊断,太赫兹波技术对于术中组织、细胞的诊断研究也是可靠的.术中实现胶质瘤边界从不可见变为可见,以及快速实时获得肿瘤分子分型信息,有效指导术中肿瘤切除.
与正常细胞相比,癌细胞中有更多的自由水和较少的结合水.更重要的是,细胞水化程度随着癌细胞的恶性程度而增加,表明细胞内水合可能是致癌物中的主要因素,例如,增加水化可以促进细胞内的呼吸,一定程度上可以增强用于使用营养素的癌细胞的竞争优势.Zhang 等[152]提供了一种非免疫生物传感技术,即基于太赫兹范围内各向异性共振分裂环谐振器的等离子体生物传感器成功地实现了癌细胞的无抗体识别,证明了太赫兹光谱检测肿瘤细胞的可能性.组织的定位及定性对于胶质瘤术中的精准切除同样至关重要.太赫兹技术可以实现胶质瘤术中定位,克服胶质瘤组织移位、无标记等,从而有效地区分肿瘤边缘及脑组织成分[42,58,59].太赫兹技术实现胶质瘤定性,可根据分子分型结果决定手术切除程度,从而指导手术策略的制定.尽管如此,由于太赫兹光谱成像系统的高成本和人体工程学低,临床实践目前还很遥远.另外,考虑到太赫兹光学的功能材料和器件,将太赫兹反射或光谱学集成到传统的神经外科工作流程和神经探针中非常具有挑战性.
4.3 太赫兹技术在胶质瘤术后病理诊断及预后监测中的应用前景
病理信息进一步明确有助于患者治疗方案制定.目前已证实胶质瘤组织新鲜切片及石蜡切片的太赫兹波谱成像[42].然而辅助组织学的太赫兹波检测技术需要优化组织固定程序,目前已经考虑了在太赫兹光谱范围内使用的多种固定组织的方法,其中包括福尔马林[153]、明胶[154],及各种浸渍剂的组织脱水,以使太赫兹波穿透组织的深度增加,并突出正常和病理组织的非水因素的相关差异[155-157].石蜡包埋[7,42,158],组织冻结等可以增加组织探测深度并揭示组织的非水相关特征,包括癌症DNA 中的准共振反应DNA 甲基化[50,159].除此之外,术后监测对于胶质瘤诊疗和预后同样重要,术后监测主要是体液检测,基于4.1 节的描述,太赫兹技术也有望实现胶质瘤术后定期监测.
图5 给出了THz 技术在临床胶质瘤诊断方面的新模式.总之,太赫兹因其独特性质在肿瘤诊断方面取得了很多前瞻性的进展,并且在胶质瘤整个诊疗过程中具有潜在应用价值,有望实现“定位同时定性”的外科目标.

图5 THz 技术在临床胶质瘤诊断方面的新模式Fig.5.New models of THz technology in clinical glioma diagnosis.

