不同水分处理下双接种丛枝菌根真菌和根瘤菌对疏叶骆驼刺生长及氮素转移的影响
高文礼,陈晓楠,伊力努尔·艾力,马晓东
新疆师范大学生命科学学院 新疆特殊环境物种保护与调控生物学实验室,乌鲁木齐 830054
疏叶骆驼刺(Alhagisparsifolia)是豆科骆驼刺属的多年生草本植物,生长于干旱、半干旱荒漠地区,凭借自身极强的抗干旱、抗盐碱、适应性强等特点,在塔里木盆地南缘的绿洲—荒漠过渡带上大面积分布[1]。成年骆驼刺的根系可达地下数十米吸收水分和养分[2],因此可在蒸发强烈的塔里木河流域自然生长,对于防风固沙及涵养水源等方面具有非常重要的作用;同时,疏叶骆驼刺含有丰富的蛋白质,是一种优良的饲料,在畜牧生产中占有一定的地位[3];另外,疏叶骆驼刺与根瘤菌共生形成根瘤,使疏叶骆驼刺可以直接将大气中游离的氮固定下来,是干旱区生态系统中氮素循环的关键环节。所以,疏叶骆驼刺具有极高的经济价值和生态价值。
土壤微生物是植物生长过程中重要的影响因子。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)可以与陆地绝大多数的维管植物形成互利共生的丛枝菌根共生体[4—5],其根外菌丝能扩大根系吸收范围,促进寄主植物对水分、养分的吸收,增加寄主植物的抗逆性[6]。丛枝菌根真菌的根外菌丝可以同时侵染不同植物,在土壤生态群落中形成庞大的地下菌根网络,通过丛枝菌根网络的介导,不同植物之间可以进行氮、磷等养分以及水分的交流,调节植物之间的营养流动[7]。根瘤菌(Rhizobium)是土壤中普遍存在的一种革兰氏阴性细菌,可与豆科植物根系形成互利共生结构—根瘤,帮助植物将空气中游离的氮转化为可以吸收利用的铵态氮[8],对于植物初期定植以及整个生态系统的氮素循环来说,都具有重要的意义。
疏叶骆驼刺可同时被丛枝菌根真菌和根瘤菌侵染,形成AMF-疏叶骆驼刺-根瘤的三重共生体。三重共生体结构中,三者相互作用又相互影响。AMF的根外菌丝,可以深入根系到达不了的土壤缝隙,帮助植物扩大养分及水分的吸收范围,从而提高植物的抗逆性;根瘤的固氮效应,减少氮营养对疏叶骆驼刺生长的限制作用;作为寄主植物的疏叶骆驼刺,其发达的根系,为AMF和根瘤菌提供了生长的立地条件,同时作为回报,将光合作用产生的碳传递给AMF和根瘤,以供AMF和根瘤的生长。有研究发现,同时双接种AMF和根瘤菌时,可以增加AMF的侵染率以及根瘤的数量,促进植物的生长发育,提高植物的抗逆性[9]。但是双接种的正效应具有一定的局限性,受到AMF、根瘤菌以及植物之间不同种类组合的匹配关系以及土壤条件的影响[10]。以往关于AMF和根瘤菌双接种的研究多在农业生态系统中,系统内营养条件相对丰富,而关于双接种在荒漠生态系统这样资源匮乏地区的研究鲜有报道。因此,本研究在塔里木河实施间歇性生态输水的大背景下,以恢复生态学的理论为指导,着重探讨塔河下游优势物种疏叶骆驼刺在幼苗期双接种AMF和根瘤菌处理下对干旱胁迫及复水之后的生长、生理响应以及双接种处理下基于丛枝菌根网络介导的氮素转移情况,为塔里木河流域的生态恢复提供科学的理论支撑。
1 材料与方法
1.1 实验材料
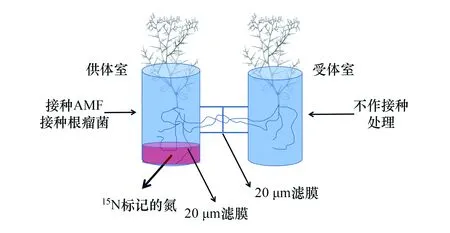
图1 实验装置模式图Fig.1 Schematic diagram of experimental equipment AMF:丛枝菌根真菌 Arbuscular mycorrhizal fungi
供试植物疏叶骆驼刺种子及实验用土均采集于塔里木河下游骆驼刺群落分布区,沙土过2 mm筛去除杂质后经流水冲洗2次,然后在110℃、0.14 MPa下连续湿热灭菌1 h备用,育苗期在每个分室内添加500 mL的1/8 MS营养液,以求每个实验装置内的土壤初始理化性质一致。控制实验开始前测得供试沙土土壤的田间持水量为22.75%,平均全磷含量为0.69 g/kg,有效磷含量为17.2 mg/kg,全钾含量为22 g/kg,全氮含量为0.64 g/kg,有效氮含量为13.2 mg/kg,pH为7.7。供试丛枝菌根真菌采用比例为1∶1幼套球囊霉(Glomusetunicatum)和摩西球囊霉(Glomusmosseae)的混合菌种,来源于新疆农科院微生物研究所,菌剂孢子密度25个/mL;根瘤菌为天山中慢生根瘤菌(Mesorhizobiumtianshanense),购于中国微生物菌种查询网,网址为https://www.biobw.org/,菌种编号为bio-03285。
1.2 实验装置
实验装置如图1所示,将两个高30 cm,直径15 cm的PVC三通管中间用PVC管道相连,连接部分由两层20 μm滤膜(20 μm滤膜允许根外菌丝通过,阻止根系通过)分隔成两分室,左面为供体室,作接种处理及同位素注射处理。供体室底部内嵌高5 cm的同位素注射室,注射室顶部用20 μm滤膜封盖,允许AMF根外菌丝进入,阻挡植物根系进入。供体室与受体室之间为双层20 μm滤膜阻挡,中间有2 mm的空隙,此空气隔层可阻挡根系的通过。因水分流动所产生的氮素转移误差,后续菌丝氮素转移量均通过差减法(减去无菌丝网络装置受体室内15N含量)计算获得,尽量将误差减至最小。
1.3 实验方法
选取颗粒饱满、大小基本一致的疏叶骆驼刺种子分别播种于供体室、受体室。实验共设4种接种处理,分别为单接种AMF(A)、单接种根瘤菌(R)、双接种AMF+根瘤菌(双接种)以及不接种(CK);3个水分处理,分别为正常水分处理(土壤相对含水量(70±5)%,D0),干旱胁迫处理(土壤相对含水量(20±5%),D1)以及复水处理(干旱胁迫60 d后复水至正常水分,5 d后收获,D2),用WET水分测定仪测定土壤水分,并用称重法控制水分。每组实验装置内装入8 kg经过湿热灭菌的沙土,每个分室(供体室、受体室)各有4 kg土样;接种AMF的方法为在供体室土壤表层均匀接种40 g AMF菌剂(菌剂为包含孢子和菌丝的土壤混合物),对照组加入等量的灭活菌土;接种根瘤菌的方法为将根瘤菌剂在YMA培养基上25℃活化培养3 d,然后转入盛有1000 mL YMA培养液的三角瓶中震荡培养30 h后,配成根瘤菌悬液104CFU/mL,每盆接种100 mL,对照组添加100 mL的蒸馏水。育苗1个月后,进行齐苗和间苗,留下两株健康生长、长势一样的幼苗进行室内控制实验。待植株收获的前5 d,在同位素注射室内进行同位素的注射。将自然丰度为99.01%的15NH4Cl配置成0.1 mol/L的溶液,每盆以环形等位选取10个位点,在土壤中均匀注射10 mL,让同位素在同位素注射室的土壤中充分扩散,5 d后收获植株进行指标检测。将每个处理的供体、受体植株分别剪成细碎小块,置于研钵中,在干燥箱中105℃杀青15 min,然后80℃烘干至恒重,将烘干的样品研磨粉碎后,称取不少于0.5 g样品,装进离心管中,用封口膜密封,用于测定全氮含量和氮转移率,样品测定由北京中科院植物所同位素分析测试中心完成。
1.4 指标测定
1.4.1共生体生长指标
(1)AMF侵染率测定:干旱胁迫培养60 d后,收获疏叶骆驼刺,将根系洗净后剪成1—2 cm,进行固定、碱解离、酸化、染色的步骤,具体如下:①固定:按70%乙醇:6 mol/L乙酸= 6∶1的比例配置成固定液,将剪好的根段放入固定液中固定12 h。②碱解离:用蒸馏水冲洗掉固定液,加入1 mol/L KOH溶液,没过根系,解离15 min。③酸化:用蒸馏水冲洗掉碱液,加入0.1 mol/L HCl溶液,没过根系,3—5 min后,蒸馏水洗去酸液。④染色:将水洗后的根样置于试管中,加入0.25 g台盼蓝+250 mL甘油+250 mL乳酸配制而成的染色液,没过样品,室温下染色1 h。水洗一遍后,将样品放入塑料小瓶中,加入等量甘油和乳酸混合的贮存液,没过样品,室温下放置,于光学显微镜下观察。将染好色的根样平辅在载玻片上,轻轻盖上盖玻片,制成装片,先用4×物镜观察,发现可疑现象后,再用10×物镜观察。观察根系内是否有菌丝、丛枝和泡囊等典型菌根结构。
侵染率的计算:根据网格交叉法,先统计AMF侵染根段数,将染色后的根系置于直径9 cm带有网格的培养皿中,10×10倍镜下观察根系与网格交叉部位是否有菌根结构[11—12]。AMF侵染率的计算公式如下:
AMF侵染率(%)=侵染根段数/全部根段数×100%
(2)根瘤数量:在解剖镜下进行形态学观察,记录每株的根瘤数量及生长部位。
1.4.2骆驼刺生长及生理指标
(1)生物量测定:将植株从基径处分为地上、地下两部分,105℃杀青15 min,然后置于80℃的恒温干燥箱中烘干至恒重,称其干重,计算根冠比。
根冠比=地下部分干重/地上部分干重
(2)叶绿素荧光相关指标:于干旱胁迫后第10天、15天和20天以及复水后的第5天分别测定荧光参数。选取晴朗天气,使用Junior-Pam便携式调制叶绿素荧光仪,于10:00—18:00之间,每隔2 h测定一次光适应状态下植物的叶绿素荧光反应,测定植株叶片的初始荧光(Fo)、最大荧光(Fm)和最大光化学效率(Fv/Fm),测定时选取同一植株不同的叶片和不同的位点进行,每个处理重复6次。
1.4.3氮素吸收转移指标
总氮量(mg/g)= 干物质质量(g)×全氮百分含量%;
N 转移(%)= [15N受体/(15N供体 +15N受体)]×100
1.5 数据处理
采用SPSS 21.0软件进行多因素方差分析,用Duncan法在0.05水平进行多重比较,用Origin 9.0作图。
2 结果与分析
2.1 不同水分及接种处理对共生体的影响
2.1.1不同水分及接种处理下AMF侵染率的变化
R处理和不接种的对照组的疏叶骆驼刺根系均未发现泡囊和丛枝等典型的丛枝菌根真菌结构,而A处理和双接种处理的疏叶骆驼刺根系发现大量泡囊、根外菌丝和丛枝等,且侵染率较高(图2),说明土壤、种子灭菌效果以及AMF接种效果良好,符合预期。不同水分及接种条件下丛枝菌根真菌的侵染率如表1所示,不同接种处理对疏叶骆驼刺AMF侵染率产生不同的影响。在D0水分条件下,双接种疏叶骆驼刺的AMF侵染率要比A处理的高9.20%,且差异性显著(P<0.05),而D1和D2水分条件下双接种疏叶骆驼刺的AMF侵染率显著低于A处理,分别比AMF处理的低32.86%和29.14%。A处理和双接种处理的疏叶骆驼刺在D1水分条件下均显著降低了AMF的侵染率(P<0.05),D2水分条件下的AMF侵染率与D1水分条件下无显著性差异(P>0.05),表明干旱降低了疏叶骆驼刺AMF的侵染率且复水对AMF侵染率无明显的补偿效应。

图2 不同接种处理下AMF侵染及根瘤生长的变化Fig.2 Changes of AMF infection and nodule growth under different inoculation treatments

表1 不同水分及接种处理对疏叶骆驼刺AMF侵染率的影响
2.1.2不同水分及接种处理下根瘤数量的变化
单接种A和不接种的对照组均未发现根瘤,而在单接种根瘤菌与双接种处理中均有根瘤的生长,说明土壤、种子灭菌处理以及根瘤菌的接种效果良好,与预期结果一致。水分对根瘤数量无显著性的影响(P>0.05)。不同水分及接种处理下根瘤数量变化如表2所示,接种条件对根瘤数量无显著性的影响,三组水分条件下(D0、D1、D2)的R处理的骆驼刺和双接种处理的骆驼刺的根瘤数量均无显著性差别(P>0.05)。干旱胁迫处理时两组接种处理的根瘤数无显著差异(P>0.05),但在复水处理后,R处理的疏叶骆驼刺的根瘤数要显著低于双接种处理的骆驼刺的根瘤数(P<0.05)
2.2 不同水分及接种处理对疏叶骆驼刺生长的影响
2.2.1不同水分及接种处理对疏叶骆驼刺生物量的影响
如表3所示,三组接种(A、R、双接种)处理与不接种相比均显著提高了疏叶骆驼刺的生物量(地上、地下、总生物量)(P<0.05)。D0水分条件下,双接种A和R处理的疏叶骆驼刺的地上生物量分别比不接种的对照组高143.59%、76.92%、84.62%,对于地上生物量的促进作用,双接种显著优于两组单接种(A、R);D1水分条件下,双接种、A和R处理的疏叶骆驼刺的地上生物量分别比不接种的对照组高191.30%、191.30%和169.57%,双接种与两组单接种之间无显著性差异(P>0.05);D2水分条件下的疏叶骆驼刺的地上生物量与D0水分条件下的疏叶骆驼刺地上生物量变化趋势一致,双接种优于两组单接种处理。地下生物量与总生物量的变化特点与地上生物量变化趋势一致,均为D0和D2水分处理时,双接种优于单接种,而D1水分条件下,单接种优于双接种。
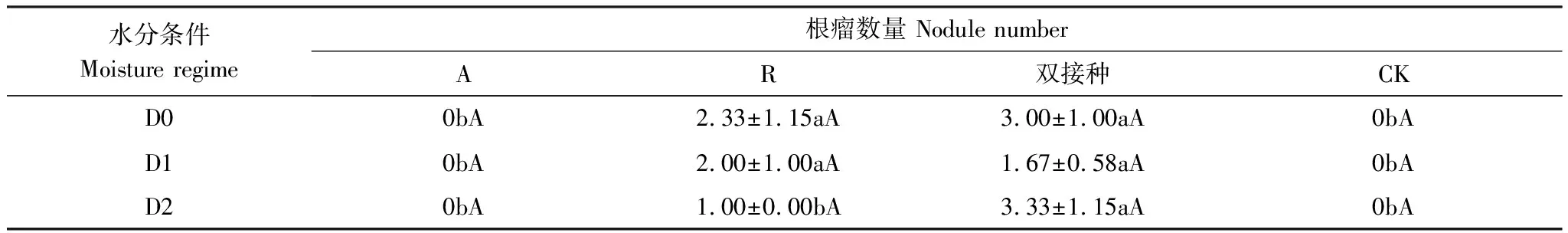
表2 不同水分及接种处理下根瘤数量的变化
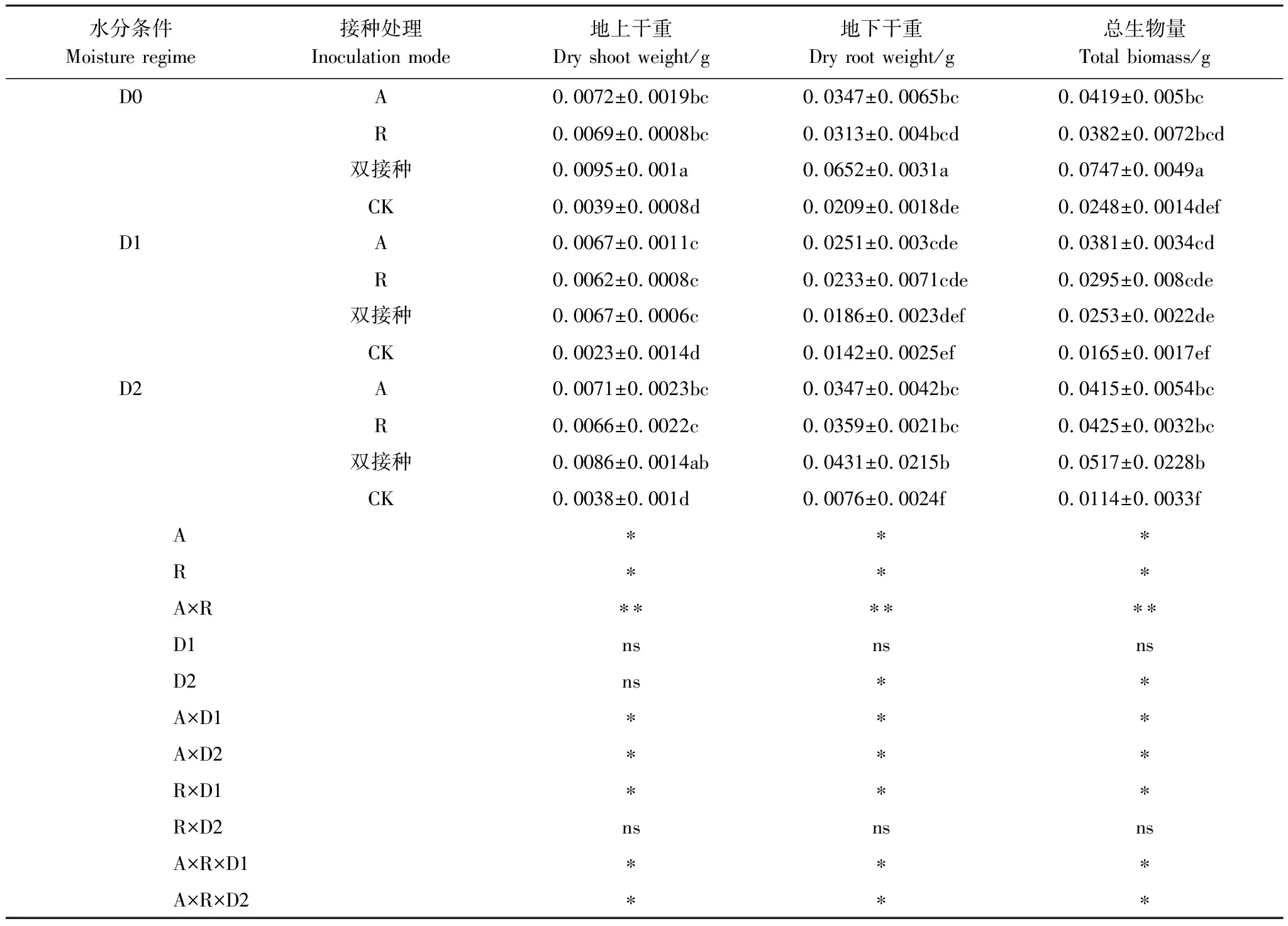
表3 不同水分及接种处理下生物量的变化
相同接种处理,不同水分条件下的疏叶骆驼刺生物量(地上、地下和总生物量)比较,随着D0—D1—D2的水分变化,三组接种处理与对照组均呈现先下降再上升的生长趋势。两组单接种处理的疏叶骆驼刺在D1水分条件下的地上、地下和总生物量均低于D0水分条件下的疏叶骆驼刺,D2条件下虽有一定的补偿效应,但地上、地下和总生物量仍低于D0水分条件,且差异性不显著(P>0.05);双接种疏叶骆驼刺的地上、地下和总生物量在D1水分条件下显著降低,分别比D0水分条件低41.79%、250.54%、195.25%,D2水分条件对双接种疏叶骆驼刺的地上、地下和总生物量有一定的补偿作用,但仍然低于D0水分条件,分别比D0水分条件低10.47%、51.27%、44.49%。结果说明,无论是否接种,水分胁迫仍是降低疏叶骆驼刺生物量积累的主要原因,而三种接种处理均可以显著增加疏叶骆驼刺生物量的积累,在正常水分和复水条件下,双接种对于疏叶骆驼刺生物量积累的促进作用要优于单接种,但干旱胁迫条件下双接种的促生作用低于单接种处理。
2.2.2不同水分及接种处理对疏叶骆驼刺叶绿素荧光的影响
如表4所示,在相同水分条件下,不同接种处理间比较,三种水分(D0、D1、D2)条件下A和双接种处理虽然提高了疏叶骆驼刺的最大荧光产量(Fm),但与不接种的对照组无显著差异(P>0.05),而R处理的疏叶骆驼刺Fm在D1水分条件下比对照组低23.81%,差异性显著(P<0.05)。三组接种(A、R、双接种)处理的疏叶骆驼刺Fo均小于对照组,但在D0水分条件下,差异性不显著(P>0.05);在D1水分条件下,两组单接种处理的疏叶骆驼刺Fo分别比对照组小22.73%、28.26%,差异性显著(P<0.05),双接种处理的疏叶骆驼刺Fo比对照组小7.91%,未达到显著性差异;在D2水分条件下,三组接种(A、R、双接种)处理的疏叶骆驼刺Fo分别比对照组小21.41%、14.35%、29.98%,但单接种R处理下Fo与对照组差异性不显著。
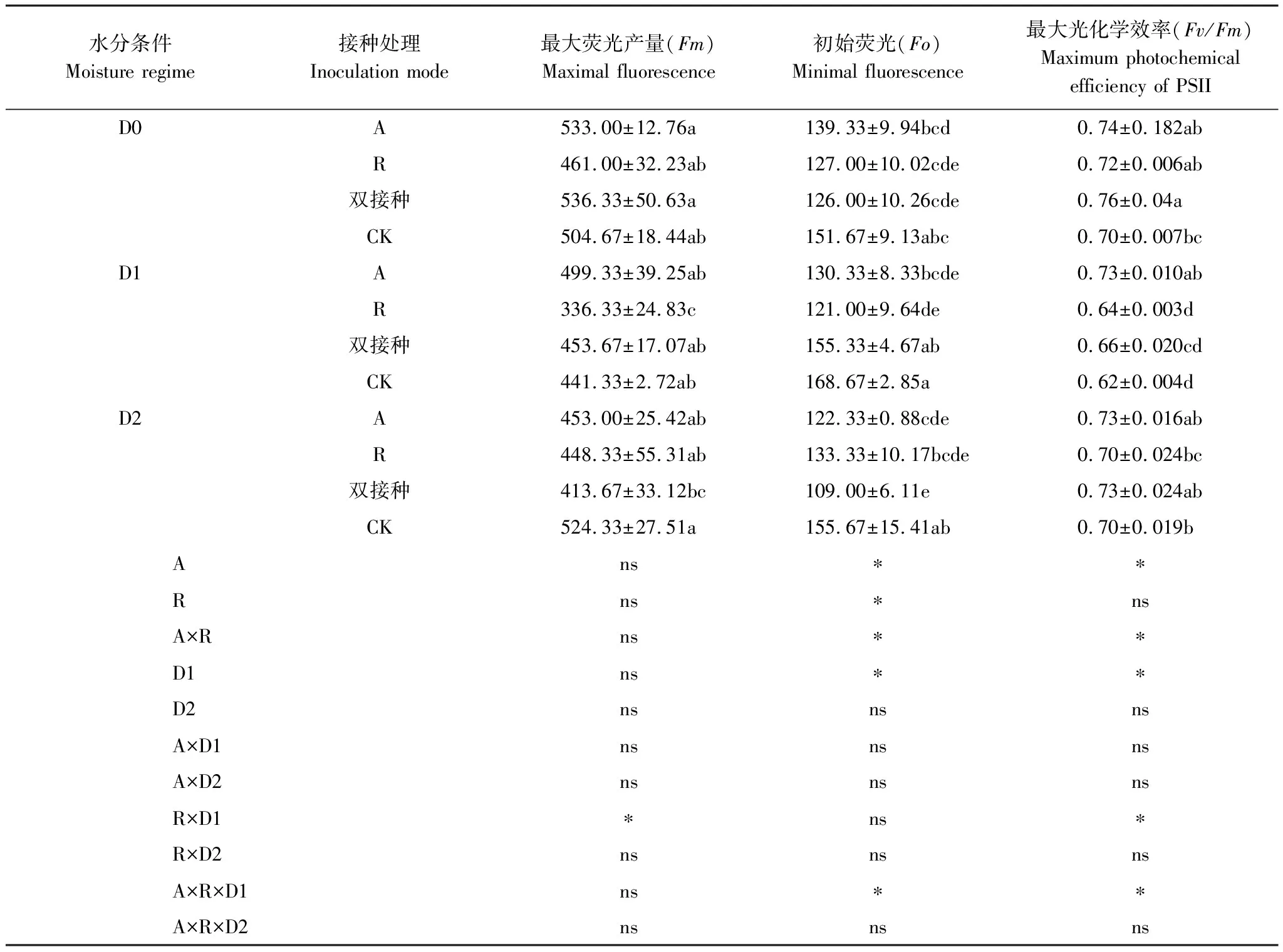
表4 不同水分及接种处理对疏叶骆驼刺叶绿素荧光的影响
最大光化学量子产量Fv/Fm表示PSII原初光能转化效率,在D0水分条件下,三组接种(A、R、双接种)处理均能提高疏叶骆驼刺的Fv/Fm,分别比对照组高5.71%、2.86%、8.57%,但仅双接种的差异性显著(P<0.05);D1水分条件下,仅A处理的Fv/Fm显著高出对照组17.74%,R和双接种处理的Fv/Fm均与对照组无显著性差异(P>0.05);D2水分条件下,三组接种处理的Fv/Fm虽比对照组高,但是均未达到显著性差异。
相同接种处理,不同水分条件下比较:A、双接种和不接种的对照组的最大荧光产量Fm在三种水分(D0、D1、D2)条件下均无显著性的差异,仅R处理的疏叶骆驼刺Fm在D1水分条件下显低于D0水分时(P<0.05),复水(D2)后又恢复至D0水分时大小。两组单接种与对照组处理的疏叶骆驼刺的初始荧光Fo在三种水分(D0、D1、D2)条件之间均无显著性的差异,仅双接种处理时,随着D0→D1→D2的水分变化,Fo值呈先上升后下降的趋势,且差异性显著(P<0.05)。A处理的疏叶骆驼刺的Fv/Fm在三种水分条件下无显著性差异(P>0.05),而R、双接种和对照组的Fv/Fm随着D0→D1→D2的水分变化,均为先下降再上升,且差异性显著(P<0.05)。
2.3 不同水分及接种处理对疏叶骆驼刺氮素吸收传递的影响
2.3.1不同水分及接种处理下供、受体骆驼刺全氮含量的变化
三组接种处理在不同水分条件时均能提高疏叶骆驼刺氮素的积累。如表5所示,在D0水分时,A、R和双接种处理的疏叶骆驼刺氮含量分别比不接种的对照组高48.06%、52.66%、61.60%,双接种显著优于A和R两组单接种处理(P<0.05);在D1水分条件下,双接种与A和R两组单接种之间氮含量的无显著性的差异(P>0.05);D1水分条件下,A、R和双接种处理的疏叶骆驼刺氮含量分别比不接种的对照组高30.03%、35.94%、43.27%,三组接种处理之间无显著性差异;D2水分条件下,A、R和双接种处理的疏叶骆驼刺氮含量分别比不接种的对照组高61.43%、51.73%、44.78%,双接种处理与两组单接种之间无差异。三组接种处理及不接种对照组的疏叶骆驼刺氮含量在D1水分条件下均要小于D0,且差异性显著(P<0.05);A和R两组单接种处理的疏叶骆驼刺氮含量在D2水分条件下显著高于D1,而双接种和对照组的氮含量在D2水分条件下与D1之间无显著差异(P>0.05)。说明,说明干旱导致了氮含量的降低,复水对两组单接种具有一定的补偿作用,而对于双接种而言,复水后仍然不能缓解干旱对氮含量所带来的负效应。
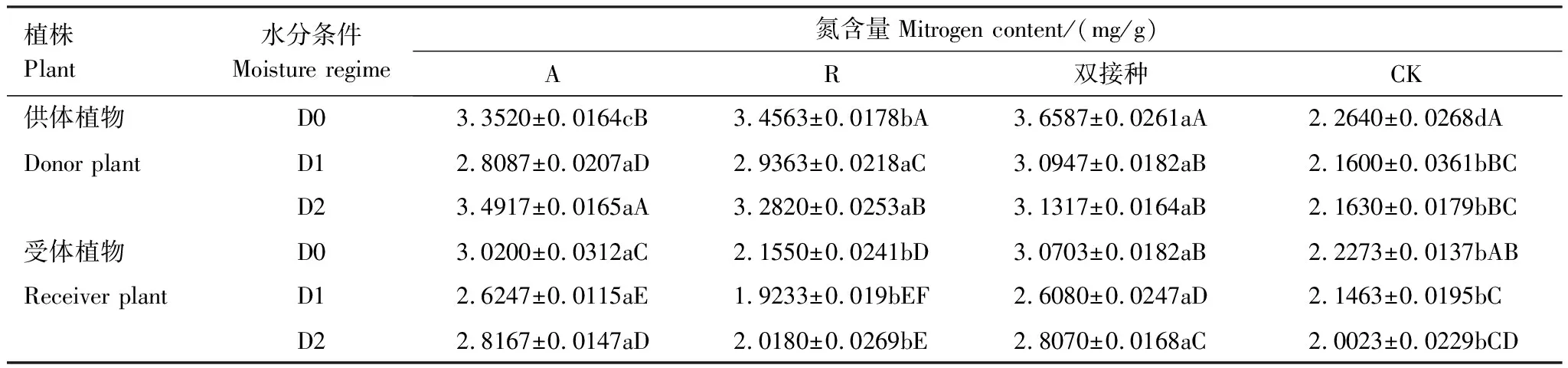
表5 不同水分及接种处理对疏叶骆驼刺氮含量的影响
R处理的受体骆驼刺无丛枝菌根网络介导,且无根瘤菌侵染,因此与对照组的受体骆驼刺的处理相同,表5中R处理的受体骆驼刺与对照组的受体骆驼刺之间氮含量无显著性的差异(P<0.05),也符合实验预期。受体骆驼刺氮含量如表5所示,A与双接种处理的受体疏叶骆驼刺的氮含量均显著高于对照组,分别比对照组高35.59%、37.85%(D0),22.29%%、21.51%(D1),39.64%、40.19%(D2),A与双接种处理之间氮含量无显著性差异。水分对于疏叶骆驼刺氮含量影响显著(P<0.05,R处理与不接种的对照组的受体疏叶骆驼刺在D1水分条件下的氮含量显著低于D0水分条件下,D1与D2水分条件之间无显著性差别(P>0.05)。A处理和双接种处理的受体疏叶骆驼刺在D0水分条件下氮含量最大,D1水分条件下最低,D2水分条件下的氮含量虽然高于D1,但是低于D0,且差异性显著(P<0.05)。
2.3.2不同水分及接种处理对微系统中氮素转移的影响
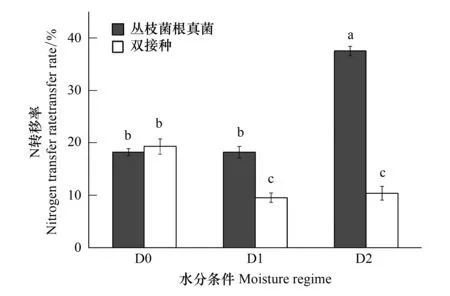
图3 不同水分及接种条件下氮素转移率的变化Fig.3 Changes of nitrogen transfer rate under different water and inoculation conditions 不同小写字母表示不同处理间差异显著(P<0.05)
在无丛枝菌根网络介导的疏叶骆驼刺受体(R处理及对照组处理)中检测到15N的含量平均值为0.77%,此值减去15N自然丰度0.368%,得出的0.402%为水分流动所带来的氮转移率误差,图中所得氮转移率,均为减去误差后的值。丛枝菌根真菌网络介导的微生态系统中,对于氮素转移率的影响如图3所示,D0水分条件下,双接种与A处理之间氮转移率无显著差异(P>0.05),而在D1和D2水分条件下,A处理的氮转移率均要优于双接种处理,分别比双接种高91.19%(D1)和261.75%(D2),且差异性显著(P<0.05)。A处理和双接种处理的疏叶骆驼刺通过丛枝菌根网络进行的氮素传递对水分有不同的响应。A处理的疏叶骆驼刺的氮素转移率在D1水分条件下与D0无显著差异,在D2水分条件下的氮转移率显著高于D0与D1;而双接种处理与A处理的氮转移率正好相反,D1与D2两种水分条件之间氮转移率无显著差异,但D0水分条件下氮转移率要显著高于D1和D2。
3 讨论
3.1 双接种对共生体的影响
有研究表明,双接种AMF和根瘤菌时,根瘤菌促使寄主植物根系类黄酮的排出,同时为AMF提供一部分的氮营养,有利于AMF孢子的萌发以及根外菌丝的生长,从而提高AMF的侵染[13];AMF的存在,又可以为根瘤的生长提供磷营养,并且AMF可以刺激结瘤因子(Nod)的表达[14],促进根瘤的生长,因此同时接种AMF和根瘤菌产生协同促生效应。本研究结果中,正常水分情况下,双接种的疏叶骆驼刺AMF侵染率显著高于单接种AMF,与前人研究结果一致[15],但是在干旱胁迫以及复水条件下,双接种疏叶骆驼刺的AMF侵染率却显著低于单接种AMF,AMF和根瘤菌之间表现出拮抗效应,初步分析原因是水分条件的改变,致使AMF和根瘤菌之间的关系发生转变。疏叶骆驼刺遭遇干旱胁迫时,生长受到抑制[2],降低了对共生体的碳投资,而AMF和根瘤菌共同着生在疏叶骆驼刺的根系,生态位重叠,当根系营养贫乏时,二者表现出竞争关系[16—17]。
生物量是植物生长的主要参数,反映了植物碳固定的能力[18]。在遭遇干旱胁迫时,植物的各种生化反应降低,导致生物量积累缓慢,而双接种AMF和根瘤菌能提高植物生物量的积累,缓解干旱胁迫带来的负效应[19],本研究也发现,双接种疏叶骆驼刺的生物量(地上、地下生物量)显著高于未接种的对照组,但是AMF和根瘤菌对疏叶骆驼刺生物量的协同促生作用,随着水分的变化而变化。在正常水分条件下双接种的促生作用显著优于两组单接种,但在遭遇干旱胁迫时双接种与两组单接种处理之间的生物量无差异,复水后双接种的促生优势又得到恢复,因此分析干旱胁迫是造成AMF和根瘤菌协同促进作用受到限制的主要原因[20]。
叶绿素荧光技术具有反应光合作用“内在性”的特点,对于植物光合作用的测定具有快速、准确、无损伤的优势,近年来这一技术被广泛应用于监测植物对于各种环境胁迫的响应。植物的Fv/Fm值一般在0.7—0.8之间,正常环境下基本稳定[21],植物受到干旱胁迫常常会导致PSⅡ光能捕获效率降低,最大荧光Fm降低,而初始荧光Fo升高,从而导致原初光能转化效率Fv/Fm降低[22]。本研究表明,水分与接种处理对疏叶骆驼刺的Fm无显著影响,但疏叶骆驼刺在遭遇干旱胁迫时,Fo显著升高,从而导致Fv/Fm降低。单接种根瘤菌对于疏叶骆驼刺光能捕获效率无影响,而接种AMF可以缓解因干旱胁迫导致的Fv/Fm降低[23—24],还发现双接种的疏叶骆驼刺在正常水分时提高了其光能捕获效率,但在干旱胁迫下不仅没有协同促进的效果,反而比单接种时还要低,复水后可恢复至正常水分处理的水平,表明复水对双接种疏叶骆驼刺的光能捕获效率具有明显的补偿效应[25]。
综合以上研究结果,发现双接种AMF和根瘤菌可以促进疏叶骆驼刺生物量以及光合作用的提高,但水分是二者是否表现出促生效果的限制因素。初步分析原因为水分是土壤营养流动的载体[26],干旱时,土壤中营养流动性较差[27],尤其是氮磷元素,导致根系营养贫乏,且疏叶骆驼刺遭受干旱胁迫的影响,生物量降低[28],对共生体的碳投资减少[29],从而在双接种AMF和根瘤菌时,二者因生态位的重叠,共同竞争根系营养,导致双接种的促生效果降低,甚至不如单接种,复水后水分条件得到一定的改善,AMF和根瘤菌又表现出协同促生作用,表明复水对双接种疏叶骆驼刺的生物量及光合作用具有明显的补偿效应。
3.2 双接种对氮素吸收转移的影响
氮素是植物生长发育必不可少的关键营养物质,受干旱胁迫的影响,氮有效性降低,难以被植物吸收利用,从而导致植物含氮量降低,致使植物生长迟缓[30]。前人研究表明,在贫瘠土壤中,限制豆科固氮能力的主要为磷的吸收,双接种AMF和根瘤菌时,AMF为根瘤提供固氮所需的磷,提高豆科植物的固氮能力,进而植物提供良好的氮营养供AMF生长,AMF和根瘤菌表现出协同促进的作用[31—32]。本研究结果也表明,在正常水分条件下,双接种疏叶骆驼刺显著提高了氮含量,且优于两组单接种处理,但是当遭遇干旱胁迫时,双接种对于氮素吸收的促进作用与两组单接种处理无差异,AMF和根瘤菌并没有表现出协同促进的作用,在复水后,双接种处理的疏叶骆驼刺的氮含量与单接种仍无差异,这与Tsimilli-Michael等[33]提出的资源匮乏的荒地上AMF和根瘤菌存在不同程度的拮抗性的结论一致。分析原因是AMF和根瘤菌共同生长在植物根系,同时竞争植物提供的碳水化合物及其他光合产物,当植物向共生体提供充足碳源时,AMF和根瘤菌能够同时生长,表现为协同促进作用,当植物遭遇干旱胁迫时,光合作用降低,且根系营养条件较差,植物的碳固定能力较弱,因此对共生体的碳投资减少,AMF和根瘤菌开始竞争根系的碳源,进而由正常水分时的协同促生作用,改变成干旱胁迫时的竞争作用。复水后,双接种疏叶骆驼刺的根瘤数量增多,但是AMF侵染率显著降低,因此即使复水恢复了一定的水分条件,但双接种疏叶骆驼刺的氮含量仍与单接种无差异。
AMF侵染植物之后与植物形成丛枝菌根共生体,其根外菌丝不断扩展延伸,又可侵染其他植物,从而形成庞大的地下网络[34]。桑钰等[30]利用三分室培养箱种植柽柳和骆驼刺时研究发现,受体植物均有来自于供体植物的15N,说明通过丛枝菌根网络的介导,氮素可以在供体植物与受体植物之间进行传递。本研究同样在受体中发现了15N的存在,但是由于实验装置中间未设置较宽的空气隔层,因此供、受体室之间仍存在非菌丝间的氮素交流产生的误差,经无菌根网络介导的对照组计算得出,水分流动等非菌丝间的氮素交流仅为0.402%,这与实验所得丛枝菌根网络介导的9.537%—37.550%氮素转移率相比,对结果未形成显著性的影响,因此研究结果证明了丛枝菌根网络可以介导两株植物之间的氮素转移,与前人研究结果一致。研究还发现干旱胁迫时,单接种AMF的疏叶骆驼刺氮素转移率与正常水分时无显著性的差异,表明丛枝菌根网络介导的氮传递具有一定的耐旱性,但是双接种疏叶骆驼刺在遭遇干旱胁迫时,氮转移率显著降低,即使复水后,仍得不到恢复。在干旱胁迫时,对于供体而言,双接种的骆驼刺氮含量与单接种AMF的氮含量无差异(表5),而AMF侵染率却显著降低(表1),在排除供体骆驼刺氮含量不足导致氮转移率降低的情况下,初步推测干旱胁迫导致的AMF侵染率降低是氮转移率降低的主要原因[35]。
综上所述,三组接种处理(A、R和双接种)均能促进疏叶骆驼刺的生长发育,正常水分条件下,AMF和根瘤菌表现出协同促进的作用,促生优势明显高于两组单接种;在遭遇干旱胁迫时,虽然双接种与不接种的对照组相比也能促进疏叶骆驼刺的生长,但是与两组单接种的促生效果无差异,复水后,双接种的促生优势又得到恢复。可见,水分条件是导致AMF与根瘤菌协同还是竞争关系的关键因素,复水对双接种疏叶骆驼刺的生长发育具有明显的补偿作用。
4 结论
(1)正常水分条件(D0)下,双接种疏叶骆驼刺的AMF侵染率、地上生物量、地下生物量、总生物量以及氮含量均要高于单接种处理;根瘤数量、Fm、Fo、Fv/Fm与单接种处理之间无差异。
(2)在干旱胁迫条件下(D1),双接种疏叶骆驼刺的AMF侵染率、总生物量、Fv/Fm均小于单接种处理;地上生物量、地下生物量、根瘤数、Fm、Fo以及氮含量与单接种之间无差异。
(3)复水(D2)后,双接种疏叶骆驼刺的地上生物量、地下生物量、总生物量、根瘤数均优于单接种;AMF侵染率、氮含量低于单接种;Fm、Fo、Fv/Fm均与单接种根瘤菌之间无差异,但要小于单接种AMF处理。
(4)在氮素转移方面,正常水分(D0)时,双接种处理与单接种处理的疏叶骆驼刺氮素转移率无差异,而干旱胁迫水分条件(D1)时,双接种疏叶骆驼刺的氮素转移率显著降低,即使复水(D2)后,仍得不到恢复。

