终末期肾病高通量血液透析患者全因死亡的影响因素*
胡文杰 张晓玲 李培芳 周辉 王殿尹
终末期肾病(ESRD)为多种慢性肾脏疾病终末阶段,早期多无明显症状,但随着疾病进展,肾功能可进行性降低,导致肾脏代谢功能障碍,大量毒素蓄积于体内,从而诱发恶心、呕吐、水肿等症状,甚至威胁患者生命[1-2]。血液透析为当前治疗ESRD的主要手段,可替代肾脏功能,清除体内代谢废物及肾脏毒素,并加快多余水分排出,以减轻肾脏负担,维持机体水电解质平衡。而高通量血液透析(HFHD)较常规血液透析效果更佳,可进一步提高透析充分性[3-4]。但临床随访发现,长期HFHD 患者易合并感染、心血管疾病等多种并发症,增加患者死亡风险[5-6]。若能尽早找出可能影响HFHD 患者死亡相关因素,则有利于尽早干预,以提高患者生存率。但临床对影响HFHD 患者死亡的具体因素尚无统一定论,仍有较多影响因素尚未明确,还需进一步研究[7-8]。鉴于此,本研究旨在分析ESRD HFHD 患者全因死亡的影响因素,为临床早期干预方案制定提供重要参考。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018 年1 月-2019 年2 月于南昌市第三医院接受HFHD 治疗的110 例ESRD 患者临床资料。纳入标准:均接受HFHD 治疗,且透析时间≥3 个月;免疫、凝血功能正常;均接受2 年随访;精神状态正常;临床资料完整。排除标准:伴有先天性心脏病;存在恶性肿瘤;透析前有心肌梗死等疾病;透析前存在严重感染性疾病。本研究已经医院伦理委员会批准。
1.2 方法 所有患者均进行HFHD 治疗,使用意大利贝尔克公司生产的BLS814 高通量血液透析器,超滤系数61 mL/(h·mmHg),有效膜面积1.4 m2,3 次/周,4 h/次,采用德国费森尤斯4008S 透析机,普通肝素抗凝,以碳酸氢盐及动静脉内瘘血液透析,维持血流量200~250 mL/min,透析流量500 mL/min。所有患者均进行2 年的随访,记录透析期间死亡情况,并依据是否死亡分为存活组与死亡组。设计基线资料表格,统计两组性别、年龄、体重指数、合并心脑血管疾病、首次血管通路、实验室指标[甘油三酯(TG)、血肌酐(Scr)、尿素氮(BUN)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、C 反应蛋白(CRP)、碱性磷酸酶(ALP)]及透析前低蛋白血症等情况,其中实验室指标均于首次透析前采集5 mL 空腹肘静脉血,离心处理后,以全自动分析仪检测。
1.3 观察指标(1)记录随访期间HFHD 治疗患者全因死亡情况。(2)分析ESRD HFHD 患者全因死亡的影响因素。
1.4 统计学处理 采用SPSS 21.0 软件对所得数据进行统计分析,符合正态分布的计量资料用()表示,组间比较采用独立样本t 检验;计数资料以率(%)表示,比较采用χ2检验;先进行单因素分析,之后将差异有统计学意义的变量纳入多因素Cox 回归模型,采用逐步回归筛选变量,获取HFHD 患者全因死亡的独立影响因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 HFHD 患者全因死亡情况 随访2 年,110 例患者,死亡21 例,死亡率为19.09%(21/110)。
2.2 影响HFHD 患者全因死亡的相关因素分析 两组年龄、低蛋白血症、首次血管通路、合并心脑血管疾病及HDL、CRP、ALP 水平相比,差异均有统计学意义(P<0.05);两组体重指数、性别、原发疾病及TG、Scr、BUN、LDL 水平比较,差异均无统计学意义(P>0.05)。见表1。
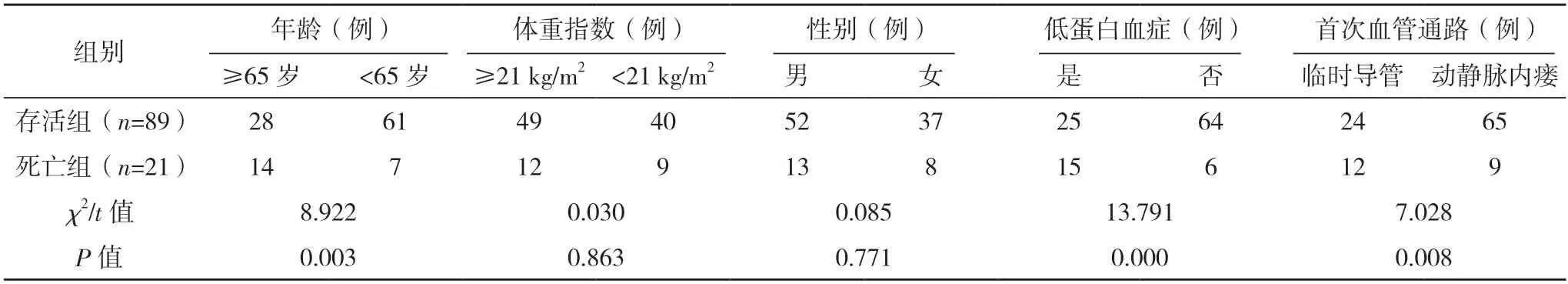
表1 影响HFHD患者全因死亡的相关因素分析
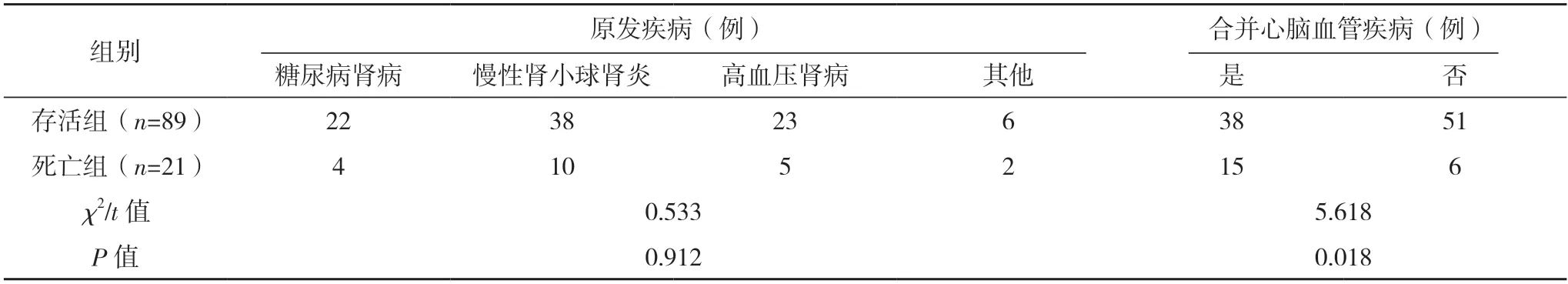
表1(续)
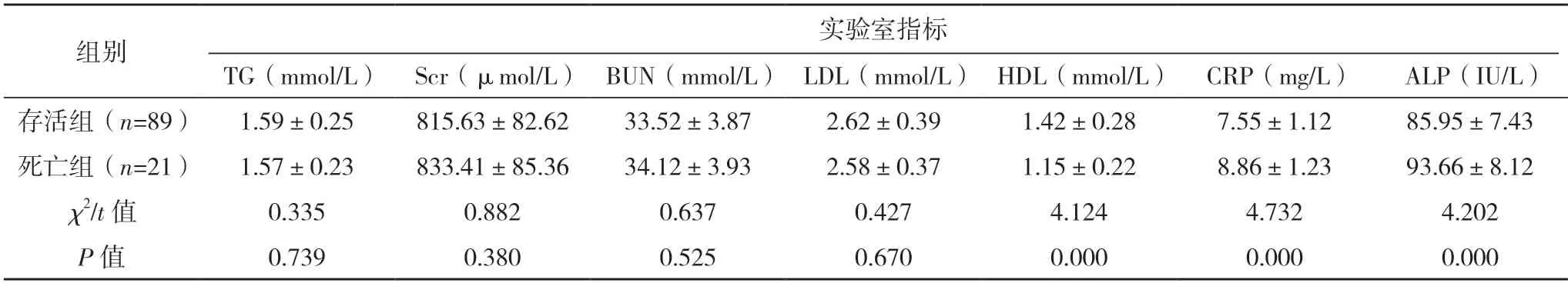
表1(续)
2.3 影响HFHD 患者全因死亡的多因素分析 HFHD 患者全因死亡的影响因素赋值:年龄,<65 岁=1,≥65 岁=2;低蛋白血症,否=1,是=2;首次血管通路,动静脉内瘘=1,临时导管=2;合并心脑血管疾病,否=1,是=2;HDL,≥1.25 mmol/L=1,<1.25 mmol/L=2;CRP,<8.0 mg/L=1,≥8.0 mg/L=2;ALP,<89.5 IU/L=1,≥89.5 IU/L=2;生存结局,存活=1,死亡=2。多因素分析显示,年龄≥65 岁、低蛋白血症、首次血管通路(临时导管)、合并心脑血管疾病、低HDL、高CRP 及高ALP 水平均为影响HFHD 患者全因死亡的高危因素(P<0.05),见表2。

表2 影响HFHD患者全因死亡的多因素分析
3 讨论
ESRD 病因复杂,该类患者多伴有原发性肾脏疾病,在多种肾脏疾病长期损害下,可促使肾功能进行性、不可逆性破坏,致使残存肾功能难以满足机体正常代谢废物需求,故而出现毒素、废物蓄积于体内现象,诱发水电解质、酸碱平衡等紊乱[9-10]。HFHD 为治疗ESRD 重要方案,相较于常规血液透析,其透析充分性更高,可更好地减轻肾脏负担,加快体内毒素排出,以延长患者生存时间[11-12]。但长期随访发现,HFHD 患者透析过程中受多种因素影响存在较高死亡风险。本研究结果显示,随访2 年,110 例患者死亡21 例,死亡率为19.09%(21/110)。提示HFHD 患者全因死亡风险较高。而临床对该类患者全因死亡的影响因素尚未完全明确,还需深入研究,以便于早期干预方案制订[13-14]。
多因素分析显示,年龄≥65 岁、低蛋白血症、首次血管通路(临时导管)、合并心脑血管疾病及低HDL、高CRP 及高ALP 水平均为影响HFHD 患者全因死亡的高危因素。分析原因:(1)年龄是影响HFHD 患者死亡的重要危险因素,临床认为透析患者多为中老年群体,该类患者机体脏器功能、代偿能力及免疫力已出现不同程度下降,在长期血液透析影响下,可进一步加重机体损耗,增加多种危险因素风险,且年龄越大机体细胞、骨骼等老化越严重,死亡风险越高[15-16]。(2)低蛋白血症提示机体营养不良,一旦营养不良可促使机体防御功能减退,易发生感染性疾病,且营养不良与微炎症反应存在因果关系,炎症又可加快蛋白分解,进一步加重营养不良状态[17-18]。(3)首次血管通路。正常情况下,对于首次或非计划透析患者,临床在血管通路的选取方面多以临时导管为主,待后续完善透析计划后更换为动静脉内瘘等[19]。而临时导管反复操作不仅增加患者痛苦,还可增加感染风险,加重疾病负担。(4)心脑血管疾病是引起HFHD 患者死亡的重要因素,在长期血液透析过程中,可引起血液调节功能异常,使得患者血管容量超负荷,增加多种心脑血管疾病风险,且易急性发作,导致患者死亡。(5)HDL 为冠心病保护因子,可加快体内脂质代谢,改善血管内皮功能,且利于阻止动脉粥样硬化进程。一旦体内HDL 表达下降,则会增大不良心血管事件风险,影响患者预后。(6)CRP 属于炎症标志物,当机体感染后可由肝脏大量合成并释放入血,一旦其水平异常升高则提示机体存在感染性疾病。而感染可加重病情进展,影响透析进程及透析充分性,且机体处于炎症活跃状态下也会对心血管造成损害,故死亡风险高。(7)ALP 属于同型二聚体,当其水平异常升高是会增加血管钙化风险,促进血管内皮功能紊乱,从而增大心肌梗死等风险[20]。
综上所述,行HFHD 的ESRD 患者全因死亡风险较高,死亡与年龄、低蛋白血症、首次血管通路、合并心脑血管疾病等多因素关系密切,临床应高度重视,多方面进行干预,以改善患者预后,减少死亡发生。

