宽筋藤氯仿和正丁醇部位化学成分研究
高艳艳,郭凤霞,郭少波,梁 燕,张 薇,刘 斌
北京中医药大学中药学院,北京 102488
宽筋藤为防己科青牛胆属植物中华青牛胆Tinosporaesinenisis(Lour.)Merr.的干燥藤茎,主要分布于广东、广西、云南等地,尤以两广分布广,产量大,民间应用历史悠久[1]。《全国中草药汇编》记载,宽筋藤味微苦、性凉,具有祛风止痛,舒筋活络的功效[2]。宽筋藤在藏药中又名“勒哲”,是藏药常用药材,善祛风除湿、舒筋活络,疗效显著,《晶珠本草》中记载宽筋藤“治疗隆,赤巴合并症;培根病、风湿病、隆热病”[3]。临床上,宽筋藤主要用于治疗风湿痹痛、腰肌劳损、跌打损伤等骨伤科疾病[4,5],可见其具有较大的研究价值和开发潜力。现代药理研究表明,青牛胆属植物具有抗炎、抗辐射、抗肿瘤、抗病毒、免疫抑制等多种药理活性,但目前对该属植物的化学成分研究主要集中在海南青牛胆以及心叶青牛胆两个种上[5,6]。宽筋藤作为青牛胆属植物中华青牛胆的藤茎,民间应用历史悠久,疗效确切可靠。但目前对宽筋藤的开发利用度依然较低,国内外学者对其药效物质基础的研究还比较薄弱,且多集中在乙酸乙酯部位化学成分分离,药理作用研究多集中在宽筋藤水煎液或提取物层面,其药效物质基础尚未完全阐明。为进一步丰富宽筋藤的化学成分,本实验采用多种色谱分离技术对宽筋藤的氯仿和正丁醇萃取部位进行化学成分研究,并对分离得到的化合物进行了抑制脂多糖诱导RAW 264.7细胞释放NO活性的测定,以期为从宽筋藤中寻找和发现活性成分,对进一步开发利用打下基础。
1 材料与方法
1.1 仪器与材料
Bruker Avance Ⅲ-500型超导核磁共振仪(美国Bruker公司);VARIAN INOVA-600型超导核磁共振仪(美国Varian公司);VG-ZAB-HS型质谱仪(英国VG Instruments公司);Bruker ESQUIRE-LC型质谱仪(美国Bruker公司);LTQ-Orbitrap XL质谱仪(美国赛默飞世尔科技公司);CO2细胞培养箱(美国Thermo公司);荧光倒置显微镜(日本Nikon公司);酶标仪(德国BMG Labtech公司)。
柱色谱用硅胶(60~100目、200~300目,青岛海洋化工厂);硅胶G预制薄层板(20 cm × 20 cm,青岛海洋化工厂);Sephadex LH-20(美国Pharmacia公司);ODS色谱柱材料(50 μm,日本Yamaha Motor Company,YMC公司);AB-8型大孔吸附树脂(天津南开大学化工厂);MCI-GEL CHP20P(日本三菱化学公司)。其他试剂均为分析纯。
小鼠巨噬细胞RAW 264.7(北京协和细胞资源中心);地塞米松(大连美伦生物科技有限公司);DMEM培养基(美国Gibco公司);PBS磷酸缓冲液(美国Gibco公司);双抗(10 000 U青霉素和链霉素混合液)(美国Gibco公司);FBS胎牛血清(浙江天杭生物科技有限公司);DMSO(阿拉丁公司);甲基噻唑蓝(美国Sigma公司);脂多糖(大连美伦生物科技有限公司);NO试剂盒(北京百瑞极生物科技有限公司)。
宽筋藤药材购自安国市万联中药饮片有限公司,产地广西,批号140101,经鉴定为防己科青牛胆属植物中华青牛胆Tinosporasinenisis(Lour)Merr.的干燥藤茎。
1.2 提取与分离
干燥宽筋藤药材(10 kg)经粉碎后加入70%乙醇回流提取3次,每次2 h,合并提取液,减压回收溶剂得宽筋藤提取物1.3 kg。将总提取物加水分散,依次用氯仿、乙酸乙酯、水饱和的正丁醇萃取,萃取液减压回收溶剂,分别得到氯仿、乙酸乙酯、正丁醇萃取部位。
氯仿萃取部位经硅胶柱色谱,二氯甲烷∶甲醇(20∶1→0∶1,V/V)梯度洗脱,得Fr.1~Fr.4四个流分。Fr.3通过硅胶柱色谱分离,以二氯甲烷∶甲醇(150∶1→0∶1,V/V)洗脱,经薄层检识合并得Fr.3-1~Fr.3-4。Fr.3-1、Fr.3-3和Fr.3-4先后经Sephadex LH-20(氯仿∶甲醇 = 1∶2)洗脱、甲醇重结晶,得到化合物1(3.6 mg)、化合物2(5.4 mg)和化合物3(4.3 mg)。Fr.4先后经硅胶柱色谱(二氯甲烷∶甲醇,100∶1→0∶1,V/V),Sephadex LH-20柱色谱(氯仿∶甲醇 = 1∶2)和制备薄层色谱(二氯甲烷∶甲醇 = 9∶1)分离纯化,得到化合物4(4.2 mg)。
正丁醇萃取部位经AB-8型大孔吸附树脂,水、30%乙醇、50%乙醇、70%乙醇、95%乙醇梯度洗脱,得到Fr.1~Fr.5五个流分。Fr.2经硅胶柱色谱(氯仿∶甲醇,15∶1→0∶1,V/V)洗脱,得到Fr.2-1~Fr.2-4。Fr.2-1经硅胶柱色谱,氯仿∶甲醇(18∶1→0∶1,V/V)洗脱,得到Fr.2-1-1和Fr.2-1-2。Fr.2-1-1经硅胶柱色谱,氯仿-甲醇(15∶1→0∶1,V/V)梯度洗脱,得到化合物5(21.5 mg)。Fr.2-1-2经MCI柱色谱,水∶甲醇(9∶1→0∶1,V/V)梯度洗脱和硅胶柱色谱分离(氯仿∶甲醇∶水 = 15∶1∶0.05,V/V/V),得到化合物6(4.1 mg)。Fr.2-2经硅胶柱色谱,氯仿∶甲醇(15∶1→0∶1,V/V)洗脱,得到Fr.2-2-1~Fr.2-2-3。Fr.2-2-1经Sephadex LH-20,甲醇洗脱,再经硅胶柱色谱(氯仿∶甲醇∶水 = 15∶1∶0.05,V/V/V)分离,得到化合物7(3.2 mg)。Fr.2-2-3经硅胶柱色谱,氯仿∶甲醇∶水(12∶1∶0.05,V/V/V)分离,得到化合物8(2.7 mg)。Fr.2-3经硅胶柱色谱,氯仿∶甲醇(12∶1→0∶1,V/V)梯度洗脱,得到Fr.2-3-1和Fr.2-3-2。Fr.2-3-1经Sephadex LH-20,甲醇洗脱,得到Fr.2-3-1-1~Fr.2-3-1-3。Fr.2-3-1-1和Fr.2-3-1-2分别过硅胶柱色谱,氯仿∶甲醇∶水(12∶1∶0.05,V/V/V)洗脱,得到化合物9(3.3 mg)和化合物10(5.3 mg)。Fr.2-3-1-3经硅胶柱色谱分离,氯仿∶甲醇(30∶1→0∶1,V/V)、氯仿∶甲醇(20∶1→0∶1,V/V)、氯仿∶甲醇∶水(12∶1∶0.05,V/V/V)洗脱,得到化合物11(2.9 mg)。Fr.2-3-2经Sephadex LH-20柱色谱,甲醇洗脱,再经硅胶柱色谱,氯仿∶甲醇∶水(12∶1∶0.05,V/V/V)洗脱,得到化合物12(3.2 mg)。Fr.2-4过硅胶柱色谱,先后以氯仿∶甲醇∶水(20∶1∶0.05→0∶1∶0,V/V/V)、氯仿∶甲醇∶水(18∶1∶0.05→0∶1∶0,V/V/V)、氯仿∶甲醇∶水(9∶1∶0.05,V/V/V)洗脱,得到化合物13(15 mg)。
1.3 抗炎活性筛选
采用脂多糖(LPS)诱导的小鼠巨噬细胞RAW 264.7释放一氧化氮(NO)炎症细胞模型,通过Griess法测定NO的含量[7],对宽筋藤中分离得到的化合物1~13进行了体外抗炎活性初步筛选。
1.3.1 RAW 264.7细胞的培养
RAW 264.7细胞用含10% FBS的DMEM培养液于37 ℃,5% CO2培养箱中静置培养。待RAW 264.7细胞处于对数生长期时,按3×105个/mL的细胞密度,每孔100 μL,接种于96孔板中于37 ℃、5% CO2继续培养24 h,进行后续试验。
1.3.2 不同化合物对NO释放量的影响
实验设置空白对照组、模型组、阳性药组和给药组。空白对照组加入完全培养基;模型组加入10 μg/L LPS溶液;阳性药组加入20 μmol/L地塞米松和10 μg/L LPS混合液;药物组加入10 μg/L LPS溶液和20 μmol/L各单体化合物的混合液,刺激细胞共孵育24 h。24 h后,每孔取50 μL上清液,加入至新的96孔培养板中,根据一氧化氮试剂盒说明书进行操作。将96孔培养板置于摇床上摇晃10 min,在酶标仪540 nm处读取各孔OD值,计算化合物NO的抑制率,实验重复3次。
抑制率 =(OD模型-OD药物)/
(OD模型-OD对照)× 100%
1.3.3 统计学方法

2 实验结果
2.1 结构鉴定
化合物1白色粉末(氯仿);ESI-MS:m/z684.6[M+H]+,m/z706.6[M+Na]+,分子式C42H85O5N;1H NMR(600 MHz,C5D5N)δ:8.59(1H,d,J=8.9 Hz,NH),6.72(2H,br s,3-OH,4-OH),6.23(1H,br s,1-OH),5.13(1H,m,H-2),4.63(1H,br s,H-2′),4.53(1H,dd,J=9.6,5.3 Hz,H-1a),4.44(1H,dd,J=9.6,5.3 Hz,H-1b),4.37(1H,br s,H-3),4.29(1H,br s,H-4),2.24(2H,m,H-3′),2.04(1H,m,H-5a),1.95(2H,m,H-5b,H-6a),0.86(6H,t,H-18,H-24′);13C NMR(150 MHz,C5D5N,)δ:61.8(C-1),52.7(C-2),76.5(C-3),72.8(C-4),35.5(C-5),26.4(C-6),175.0(C-1′),72.2(C-2′),33.9(C-3′),25.6(C-4′)。以上数据经与文献[8]对照,鉴定化合物1为2-(2′-羟基二十四碳酰氨基)十八碳-1,3,4-三醇。
化合物2白色结晶(吡啶);ESI-MS:m/z753.5[M+Na]+,分子式C41H78O10;1H NMR(500 MHz,C5D5N)δ:5.67(1H,m,H-2),4.69(1H,dd,J=11.9,4.2 Hz,H-3a),4.53(1H,dd,J=11.9,4.2 Hz,H-3b),4.37(1H,dd,J=10.8,3.2 Hz,H-1a),4.16(1H,dd,J=10.8,5.3 Hz,H-1b),4.14(1H,d,J=7.5 Hz,H-1′),0.85(6H,t,J=6.8 Hz,CH3);13C NMR(125 MHz,C5D5N)δ:63.3(C-1),71.0(C-2),68.1(C-3),105.8(C-1′),72.4(C-2′),75.3(C-3′),70.2(C-4′),77.3(C-5′),62.3(C-6′),173.3(C-1′′),173.2(C-1′′′),34.5(C-2′′),34.3(C-2′′′),25.3(C-3′′,3′′′),23.0~34.5(C-4′′~15′′,4′′′~15′′′),14.3(C-16′′,16′′′)。以上数据经与文献对照[9,10],鉴定化合物2为1,2-di-O-palmitoyl-3-O-β-D-galactopyranosyl glycerol。
化合物3白色结晶(吡啶);ESI-MS:m/z714.5[M+H]+,m/z736.5[M+Na]+(分子式C40H75NO9,分子量713);1H NMR(500 MHz,C5D5N)δ:5.49(2H,m,H-8,9),4.23(1H,m,H-1′′),0.87(6H,t,-CH3);13C NMR(125 MHz,C5D5N)δ:70.1(C-1),54.7(C-2),72.4(C-3),132.0(C-4),132.1(C-5),33.0(C-6),32.1/27.6(C-7),130.0/129.4(C-8),131.1/130.6(C-9),32.9/27.4(C-10),175.6(C-1′),72.5(C-2′),14.3(CH3),105.6(C-1′′),75.1(C-2′′),78.5(C-3′′),71.6(C-4′′),78.4(C-5′′),62.7(C-6′′)。以上数据经与文献对照[11,12],鉴定化合物3为由soyacerebroside Ⅰ和soyacerebroside Ⅱ组成的一组顺反异构混合物,通过分析13C NMR放大谱的丰度,表明soyacerebroside I(反式异构体)与soyacerebroside II(顺式异构体)二者比例约为5∶4。
化合物4白色无定性粉末(甲醇);ESI-MS:m/z419.2[M+Na]+,m/z815.4[2M+Na]+,分子式C21H32O7;1H NMR(600 MHz,DMSO-d6)δ:5.61(1H,s,H-3),2.90(1H,m,H-6),4.26(1H,d,J=7.8 Hz,H-1′),2.54(1H,d,J=6.7 Hz,H-1),2.00(1H,m,H-9),1.94(3H,s,H-14),1.93(1H,m,H-5),1.69(1H,m,H-7),1.18(1H,m,H-8),1.06(3H,s,H-15),0.97(3H,s,H-12),0.86(3H,s,H-13);13C NMR(150 MHz,DMSO-d6)δ:56.7(C-1),202.9(C-2),120.8(C-3),170.7(C-4),54.5(C-5),53.1(C-6),49.0(C-7),20.6(C-8),36.5(C-9),55.9(C-10),79.6(C-11),20.4(C-12),22.2(C-13),23.7(C-14),23.9(C-15),97.1(C-1′),70.6(C-2′),77.5(C-3′),74.0(C-4′),76.9(C-5′),61.5(C-6′)。以上数据经与文献对照[13],鉴定化合物4为tinocordiside。
化合物5白色针状结晶(甲醇);ESI-MS:m/z395.1[M+Na]+,m/z767.3[2M+Na]+,分子式C17H24O9;1H NMR(600 MHz,CD3OD)δ:6.77(2H,s,H-2,H-6),6.57(1H,d,J=15.9 Hz,H-7),6.35(1H,dt,J=15.8,5.6 Hz,H-8),4.89(1H,d,J=7.6 Hz,H-1′),4.25(2H,d,J=5.6 Hz,H-9),3.88(6H,s,3,5-OCH3),3.81(1H,dd,J=12.0,2.2 Hz,H-6′b),3.69(1H,dd,J=12.0,5.2 Hz,H-6′a),3.50(1H,m,H-2′),3.44(2H,m,H-3′,H-4′),3.24(1H,m,H-5′);13C NMR(150 MHz,CD3OD)δ:135.2(C-1),105.5(C-2,6),154.3(C-3,5),135.9(C-4),130.0(C-7),131.3(C-8),63.6(C-9),57.0(3,5-OCH3),105.3(C-1′),75.7(C-2′),78.4(C-3′),71.3(C-4′),77.8(C-5′),62.6(C-6′)。以上数据经与文献对照[14,15],鉴定化合物5为反式丁香苷。
化合物6白色结晶(甲醇);ESI-MS:m/z317.1[M+H]+,分子式C14H20O8。1H NMR(600 MHz,DMSO-d6)δ:6.82(1H,d,J=8.8 Hz,H-5),6.70(1H,d,J=2.7 Hz,H-2),6.55(1H,dd,J=2.7,8.7 Hz,H-6),4.71(1H,d,J=7.7 Hz,H-1′),4.04(1H,dd,J=12.0,2.2 Hz,H-6′a),3.92(1H,dd,J=12.0,5.2 Hz,H-6′b),3.71(3H,s,3-OCH3),3.68(3H,s,4-OCH3),3.17~3.44(4H,m,H-2′~H-5′);13C NMR(150 MHz,DMSO-d6)δ:143.9(C-1),102.4(C-2),152.0(C-3),149.4(C-4),107.2(C-5),112.6(C-6),55.4(3-OCH3),56.1(4-OCH3),101.5(C-1′),73.4(C-2′),76.8(C-3′),70.0(C-4′),77.2(C-5′),60.9(C-6′)。以上数据经与文献对照[16],鉴定化合物6为3,4-二甲氧基苯基-β-D-葡萄糖苷。
化合物7白色无定型粉末(甲醇);ESI-MS:m/z527.2[M+Na]+,m/z543.1[M+K]+,分子式C22H32O13;1H NMR(600 MHz,CD3OD)δ:6.74(2H,s,H-3,H-5),6.53(1H,d,J=15.9 Hz,H-7),6.31(1H,dt,J=15.9,5.6 Hz,H-8),5.30(1H,d,J=2.7 Hz,H-1′′),4.89(1H,d,J=7.7 Hz,H-1′),4.21(2H,d,J=5.6 Hz,H-9),4.11(1H,d,J=9.3 Hz,H-4′′b),4.00(1H,d,J=2.7 Hz,H-2′′),3.84(6H,s,3,5-OCH3),3.78(1H,m,H-6′b),3.77(1H,m,H-4′′a),3.65(1H,dd,J=12.1,5.0 Hz,H-6′a),3.60(2H,s,H-5′′),3.59(1H,dd,J=8.9,7.7 Hz,H-2′),3.51(1H,dd,J=8.9,8.8 Hz,H-3′),3.44(1H,dd,J=8.8,9.5 Hz,H-4′),3.22(1H,m,H-5′);13C NMR(150 MHz,CD3OD)δ:135.3(C-1),154.3(C-2,6),105.4(C-3,5),135.8(C-4),131.3(C-7),130.1(C-8),63.6(C-9),57.0(3,5-OCH3),105.1(C-1′),75.4(C-2′),85.2(C-3′),69.8(C-4′),78.1(C-5′),62.5(C-6′),111.4(C-1′′),77.9(C-2′′),80.6(C-3′′),75.0(C-4′′),65.2(C-5′′)。以上数据经与文献对照[13,17],鉴定化合物7为tinosinen。
化合物8白色无定型粉末(甲醇);ESI-MS:m/z167.0[M-H]-,m/z123.0[M-COOH]-,分子式C8H8O4;1H NMR(600 MHz,CD3OD)δ:7.38(1H,q,J=15.7 Hz,H-7),6.67(1H,d,J=3.3 Hz,H-3),6.41(1H,d,J=3.3 Hz,H-4),6.23(1H,q,J=15.7 Hz,H-6),4.53(2H,s,H-1′);13C NMR(150 MHz,CD3OD)δ:151.9(C-2),116.7(C-3),111.0(C-4),158.9(C-5),132.5(C-6),117.0(C-7),170.7(C-8),57.5(C-1′)。以上数据经与文献对照[18],鉴定化合物8为5-羟甲基-2-呋喃丙烯酸,是合成5-取代-2-羟甲基(羧基)呋喃的中间产物。
化合物9白色无定型粉末(甲醇);ESI-MS:m/z601.2[M-H+HCOOH]-,分子式C26H36O13;1H NMR(CD3OD,500 MHz)δ:7.64(1H,br s,H-16),7.52(1H,m,H-15),6.54(1H,d,J=1.0 Hz,H-14),5.79(1H,dd,J=12.6,3.4 Hz,H-12),4.93(1H,dd,J=11.0,2.4 Hz,H-1),4.39(1H,d,J=7.8 Hz,H-1′),4.08(1H,br d,J=2.4 Hz,H-2),3.94(1H,br s,H-4),3.86(1H,dd,J=11.7,1.6 Hz,H-6′b),3.66(1H,dd,J=11.7,7.5 Hz,H-6′a),3.35(1H,dd,J=8.3,5.6 Hz,H-3′),3.28(1H,dd,J=5.6,8.6 Hz,H-4′),3.24(1H,m,H-5′),3.21(1H,dd,J=8.3,7.8 Hz,H-2′),2.62(1H,dd,J=14.4,12.6 Hz,H-11b),2.50(1H,dd,J=11.0,11.1 Hz,H-10),2.33(1H,m,H-3b),2.33(1H,m,H-7b),2.01(3H,s,COCH3),1.95(1H,dd,J=14.4,3.4 Hz,H-11a),1.77(1H,m,H-5),1.77(1H,m,H-6b),1.66(1H,m,H-3a),1.66(1H,m,H-7a),1.60(1H,s,H-6a),1.07(3H,s,H-20);13C NMR(125 MHz,CD3OD)δ:77.2(C-1),69.1(C-2),32.6(C-3),76.7(C-4),39.5(C-5),26.5(C-6),30.2(C-7),76.6(C-8),40.5(C-9),35.2(C-10),37.0(C-11),73.1(C-12),126.7(C-13),109.6(C-14),145.1(C-15),141.3(C-16),174.8(C-17),15.5(C-20),172.0(COCH3),21.8(COCH3),100.9(C-1′),74.9(C-2′),78.0(C-3′),71.6(C-4′),77.8(C-5′),62.8(C-6′)。以上数据经与文献对照[13],鉴定化合物9为tinosineside A。
化合物10白色无定型粉末(甲醇);ESI-MS:m/z561.2[M+Na]+,分子式C27H38O11;1H NMR(600 MHz,CD3OD)δ:6.99(1H,d,J=8.2 Hz,H-5′),6.79(1H,d,J=8.0 Hz,H-5),6.66(1H,d,J=1.5 Hz,H-2′),6.63(1H,d,J=1.5 Hz,H-2),6.62(1H,dd,J=8.2,1.5 Hz,H-6′),6.62(1H,dd,J=8.0,1.5 Hz,H-6),4.82(1H,d,J=7.3 Hz,H-1′′),3.86(1H,dd,J=12.0,5.2 Hz,H-6′′b),3.78(3H,s,4-OCH3),3.73(3H,s,3′-OCH3),3.70(3H,s,3-OCH3),3.67(1H,dd,J=12.0,5.2 Hz,H-6′′a),3.58(2H,m,H-9),3.58(2H,m,H-9′),3.48(1H,dd,J=6.6,7.3 Hz,H-2′′),3.46(1H,d,J=6.6 Hz,H-3′′),3.39(1H,m,H-4′′),3.39(1H,m,H-5′′),2.68(1H,dd,J=13.7,8.9 Hz,H-7b),2.68(1H,dd,J=13.7,8.9 Hz,H-7′b),2.56(1H,dd,J=13.7,8.9 Hz,H-7a),2.56(1H,dd,J=13.7,8.9 Hz,H-7′a),1.90(1H,m,H-8),1.90(1H,m,H-8′);13C NMR(150 MHz,CD3OD)δ:135.4(C-1),113.9(C-2),150.4(C-3),148.7(C-4),112.9(C-5),122.7(C-6),36.2(C-7),44.2(C-8),62.2(C-9),137.5(C-1′),114.4(C-2′),150.6(C-3′),146.2(C-4′),117.8(C-5′),122.9(C-6′),36.2(C-7′),44.2(C-8′),62.3(C-9′),56.5(3-OCH3),56.7(4-OCH3),56.7(3′-OCH3),103.2(C-1′′),75.1(C-2′′),77.9(C-3′′),71.5(C-4′′),78.3(C-5′′),62.7(C-6′′)。以上数据经与文献对照[13,17],鉴定化合物10为tinosposide A。
化合物11白色无定型粉末(甲醇);ESI-MS:m/z547.2[M+Na]+,分子式C26H36O11;1H NMR(600 MHz,CD3OD)δ:6.67(1H,d,J=3.6 Hz,H-5′),6.65(1H,d,J=3.6 Hz,H-5),6.64(1H,d,J=1.3 Hz,H-2′),6.62(1H,d,J=1.1 Hz,H-2),6.56(1H,m,H-6),6.56(1H,m,H-6′),4.19(1H,d,J=7.8 Hz,H-1′′),3.87(1H,m,H-6′′b),3.86(1H,m,H-9′b),3.75(6H,s,3-OCH3,3′-OCH3),3.67(1H,m,H-6′′a),3.67(1H,m,H-9b),3.56(1H,m,H-9a),3.56(1H,m,H-9′a),3.35(1H,m,H-4′′),3.35(1H,m,H-5′′),3.30(1H,m,H-3′′),3.21(1H,m,H-2′′),2.65(2H,m,H-7′),2.56(2H,m,H-7),2.06(1H,m,H-8′),2.04(1H,m,H-8);13C NMR(150 MHz,CD3OD)δ:134.0(C-1),113.4(C-2),148.8(C-3),145.4(C-4),115.7(C-5),122.8(C-6),35.5(C-7),44.0(C-8),62.8(C-9),133.9(C-1′),113.5(C-2′),148.8(C-3′),145.4(C-4′),115.7(C-5′),122.7(C-6′),35.5(C-7′),41.6(C-8′),70.4(C-9′),56.3(3-OCH3),56.2(3′-OCH3),104.6(C-1′′),75.2(C-2′′),78.0(C-3′′),71.7(C-4′′),78.2(C-5′′),62.8(C-6′′)。以上数据经与文献对照[19],鉴定化合物11为开环异落叶松脂素-9-O-β-D-葡萄糖苷。
化合物12白色无定型粉末(甲醇);ESI-MS:m/z545.2[M+Na]+,分子式C26H34O11;1H NMR(600 MHz,CD3OD)δ:6.74(1H,dd,J=8.0,1.7 Hz,H-6),6.69(1H,d,J=1.7 Hz,H-2),6.65(1H,d,J=8.0 Hz,H-5),6.64(1H,s,H-5′),6.18(1H,s,H-2′),4.04(1H,d,J=7.8 Hz,H-1′′),3.85~3.64(10H,m,H-9,9′,2′′,3′′,4′′,5′′,6′′),3.81(3H,s,3-OCH3),3.78(3H,s,3′-OCH3),3.15(1H,m,H-7′a),2.87(1H,m,H-7′b),2.75(1H,m,H-7),1.96(2H,m,H-8,8′);13C NMR(150 MHz,CD3OD)δ:138.7(C-1),114.0(C-2),149.0(C-3),145.3(C-4),116.0(C-5),123.5(C-6),48.6(C-7),45.3(C-8),70.7(C-9),129.3(C-1′),112.3(C-2′),147.3(C-3′),146.0(C-4′),117.4(C-5′),133.7(C-6′),33.7(C-7′),41.2(C-8′),65.5(C-9′),56.5(3-OCH3),56.4(3′-OCH3),103.8(C-1),75.0(C-2′′),78.2(C-3′′),71.4(C-4′′),77.9(C-5′′),62.5(C-6′′)。以上数据经与文献对照[20],鉴定化合物12为异落叶松脂素-9-O-β-D-葡萄糖苷。
化合物13白色针状结晶(甲醇);ESI-MS:m/z128.0[M-H]-,分子式C5H7NO3;1H NMR(500 MHz,CD3OD)δ:4.25(1H,dd,J=9.1,4.6 Hz,H-2),2.49(1H,m,H-3a),2.33(2H,m,H-4),2.16(1H,m,H-3b);13C NMR(125 MHz,CD3OD)δ:57.0(C-2),30.4(C-3),26.1(C-4),175.8(C-5),181.1(C-6)。以上数据经与文献对照[21],鉴定化合物13为L-焦谷氨酸。
化合物1~13结构见图1。
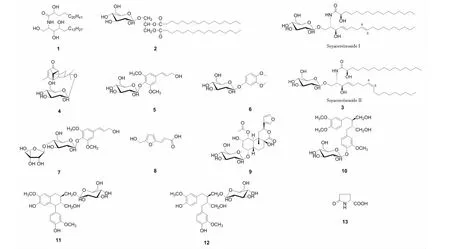
图1 化合物1~13的化学结构
2.2 抗炎活性结果
本实验采用脂多糖(LPS)诱导的RAW 264.7细胞炎症筛选模型,以地塞米松为阳性对照,对宽筋藤中分离得到13个化合物(化合物1~13)进行了抗炎活性筛选(见表1)。结果显示,当浓度为20 μmol/L,化合物2、3、4具有一定的NO生成抑制作用。

表1 化合物1~13的抗炎活性
3 结论
本实验采用多种分离技术,从宽筋藤氯仿部位和正丁醇部位共分离鉴定了13个化合物,包括3个脑苷脂类化合物(1、3)、5个苯丙素类化合物(5、7、10、11、12)、2个萜类化合物(4、9)、1个氨基酸类化合物(13)和3个其他类化合物(2、6、8)。其中,化合物8作为天然产物首次被报道,化合物1、2、3、6、11为首次从防己科植物中分离得到,化合物13为首次从宽筋藤中分离得到。有研究报道化合物4对人口腔表皮样癌KB细胞、子宫颈鳞癌SiHa细胞表现出一定的抑制活性;化合物3可通过减少MCP-1表达、抑制单核细胞/巨噬细胞浸润滑膜细胞而达到减轻滑膜炎症、预防关节损伤的作用[22,23]。本文在化学成分研究的基础上,对分离得到的13个化合物以LPS诱导RAW 264.7细胞为体外炎症模型,通过抑制NO生成实验评价化合物的抗炎活性,结果显示化合物2、3、4具有一定的抗炎活性。本研究不仅丰富了宽筋藤的化学结构类型和化学成分库,也为进一步阐明其药效物质基础、促进宽筋藤的资源开发提供了科学依据。

