紫苏籽粕抗氧化肽的纯化、鉴定及降血脂功效研究
白宝清,贾槐旺,张锦华,李兰,范三红
(山西大学生命科学学院1,太原 030006) (特色植物资源研究与利用山西重点实验室;山西大学2,太原 030006)
高脂血症是一种由于脂肪转运或代谢异常导致血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白-胆固醇(LDL-C)过高,高密度脂蛋白-胆固醇(HDL-C)降低的全身性代谢慢性疾病[1],是诱发肥胖、高血压、动脉粥样硬化、冠心病、糖尿病等常见代谢疾病的重要因素[2]。心血管疾病是由高脂血症引发的一种疾病,致死率高,预计到2030年全球因心血管疾病死亡的人数将由2008年的1 730万人飙升至2 330万人[3]。目前,因其引发的并发症而死亡的人数占到全球死亡率的一半,且这一比例还在逐年增加[3]。临床上主要使用他汀类、胆酸螫合剂、贝特类、烟酸类等药物治疗高脂血症,它们虽然具有清晰的作用机制和靶点,但使用这些药物治疗的同时会产生诸多副作用,例如容易引起胃肠等脏器损伤、产生皮肤过敏、肝脏毒性、肾功能受损等[4]。植物蛋白中含有具有生理活性的多肽物质,目前已从多种植物蛋白中发现抗氧化肽、抗菌肽、降胆固醇肽、降血压肽、免疫活性肽以及神经活性肽。近年来动植物蛋白多肽的降脂疗效及其抗氧化活性取得了一定的进展。魏连会等[3]通过动物实验对火麻籽进行降血脂功能性研究,结果显示火麻籽多肽能够抑制高脂饮食喂养大鼠的体质量增长、降低肝脏指数、血清中TC、TG、LDL-C、AST、ALT水平降低,升高HDL-C水平,降低动脉硬化指数(AI)值;改善大鼠血流变学指标,降低大鼠的全血粘度和血浆黏度,表明火麻籽多肽具有良好的降血脂功效。贺东亮[5]通过检测经紫苏籽肽PSP3c灌胃后小鼠血液和肝脏组织中MDA含量、GSH-Px和SOD活力了解PSP3c对小鼠抗氧化能力的影响,结果显示紫苏籽多肽PSP3c能够保护机体免受自由基的攻击,提高小鼠抗氧化能力。
紫苏(Perillafrutescens(L.)Britt. ),为唇形科塔花族紫苏属一年生直立草本植物,属我国卫生部首批颁布的药食同源的60种中药之一[6,7],紫苏籽、根茎、叶富含的多种活性物质具有抗过敏、抑菌、消炎、降血脂、抗氧化、预防细胞衰老癌变等作用[8]。紫苏籽粕是紫苏籽榨油后的残留物,紫苏籽粕蛋白质量分数为28%~45%[9]。紫苏籽粕蛋白富含有紫苏籽特有的各种营养成分,气味优良,适口性好,不存在对人体有害的成分;紫苏籽粕蛋氨基酸组成丰富,共含有18种氨基酸,其中包含8种人体必需氨基酸,是氨基酸种类齐全的完全蛋白质[10]。紫苏籽粕不仅含有紫苏蛋白和紫苏油所具有的营养物质和保健功能,还含有大量的膳食纤维,对多种球菌、杆菌具有抑制作用,还可以预防多种肠道疾病发生[11,12]。目前已有学者对紫苏籽蛋白的理化性质、功能性质及其纯化肽的抗氧化、抗肿瘤进行了研究[5],但关于紫苏籽多肽在降血脂方面的研究很少有相关报道。
本研究采用前期已优化蛋白提取工艺和蛋白酶酶解工艺制备紫苏籽粕蛋白及紫苏籽粕蛋白酶解物,通过超滤法、DEAE-32离子交换层析以及Sephadex G-25凝胶层析对酶解物进行分离纯化,并研究分离纯化后紫苏籽粕活性肽的降血脂及抗氧化功效,为紫苏籽粕蛋白的深加工提供参考。
1 材料与方法
1.1 材料与试剂
紫苏籽粕、碱性蛋白酶(2.0×104U/g)、邻苯三酚、DPPH、ABTS、DEAE-32、Sephadex G-25、乙腈、胰酶、甲酸、碳酸氢铵、尿素、辛伐他汀等试剂均为分析纯。
SPF级昆明小鼠54只,体重(24±2) g,由北京市昌扬西养殖场提供,许可证号:SCXK(京)2019-0010;基础饲料由中国辐射防护研究院提供;高脂饲料、血脂四项试剂盒(TC、TG、HDL-C、LDL-C)、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-PX)试剂盒。
1.2 仪器与设备
SK-1030超声波清洗仪,868 pH测试仪,SP-2000UV紫外可见分光光度计,SCIENTZ-12N冷冻干燥机,BS-100A自动部分收集器,HD-21-1核酸蛋白检测仪,TH-100梯度混合器,BT-100数显蠕动泵,Dionex Ultimate 3000 RSLCnano-Q Exactive 液质联用仪,MR23i低温冷冻离心机,JXFSTPRP-CL高通量多样品组织研磨机,Spectra MaxM5酶标仪。
1.3 实验方法
1.3.1 紫苏籽粕蛋白的制备
紫苏籽粕→去杂、粉碎、脱脂、过筛→蒸馏水配制成一定料液比(1∶20)→调节pH(10)→超声提取20 min→离心机去渣→取上清液调节pH为等电点(4.2)→离心→蛋白质沉淀→真空冷冻干燥→密封低温保存。
1.3.2 紫苏籽粕蛋白酶解产物的制备
以超声提取制备的紫苏籽粕分离蛋白为原料,参考贺东亮[5]的方法并做适当调整。选用碱性蛋白酶进行酶解,酶解工艺条件为:底物质量分数3%、pH9.5、酶解温度60 ℃、酶质量分数7%、酶解时间4 h。酶解结束后经沸水浴10 min灭活,4 500 r/min离心10 min,取上清液即为紫苏籽粕分离蛋白酶解产物。
1.3.3 超滤法分离抗氧化活性肽
使用装有截留分子质量为3、5、10 ku的聚醚砜超滤膜,在二氧化碳压力为2.5×104Pa下依次对紫苏籽粕分离蛋白酶解液进行超滤,得到分子质量分别为<3 ku、3~5 ku、5~10 ku以及>10 ku的4种不同分子质量段的超滤组分,真空冷冻干燥以测定抗氧化活性,获得抗氧化活性最强的紫苏籽粕多肽超滤组分[12]。
1.3.4 DEAE纤维素DE-32离子交换层析分离抗氧化活性肽
将抗氧化活性最强的多肽超滤组分,利用DEAE纤维素DE-32离子交换层析继续分离纯化,选用20 mm×400 mm规格层析柱,用50 mmol/L Tris-HCl(pH 8)的缓冲液平衡柱床,上样量3 mL,用0~1 mol/L NaCl平衡缓冲液进行梯度洗脱,流速为1.5 mL/min,紫外检测波长220 nm。将所得分离组分冷冻干燥以测定抗氧化活性,筛选出抗氧化活性最好的组分用于后续凝胶色谱的分离纯化。
1.3.5 凝胶色谱Sephadex G-25分离抗氧化活性肽
使用凝胶色谱Sephadex G-25继续分离纯化经离子交换层析分离获得的抗氧化活性最好的多肽组分,选用16 mm×300 mm规格层析柱,洗脱条件为:用100 mmol/L Tris-HCl(pH 7.5)的平衡缓冲溶液,上样量3 mL,洗脱流速0.5 mL/min,紫外检测波长220 nm。分离纯化后的组分冷冻干燥以测定其抗氧化活性,将抗氧化能力最强的组分进行结构鉴定。
1.3.6 紫苏籽粕抗氧化肽氨基酸序列质谱分析1.3.6.1 蛋白酶切
蛋白液加4 μL 0.05 mol/L TCEP 溶液,60 ℃反应1 h;还原后,加入2 μL 55 mmol/L MMTS溶液,室温避光45 min;将蛋白液加入10 ku 超滤管,12 000 g离心20 min;加入100 μL UA(8 mol/L尿素pH 8.5)溶液,12 000 g离心20 min,离心2次;加入100 μL 0.25 mol/L TEAB,12 000 g离心20 min,重复3次;加入50 μL 0.5 mol/L TEAB,加入2%胰酶(胰酶与蛋白质量比为1∶50),37 ℃孵育过夜(12 h);次日补加1%胰酶(胰酶与蛋白质量比为1∶100),37 ℃孵育4 h;更换新的收集管,离心收集滤液,低温真空抽干[13]。
1.3.6.2 质谱鉴定
肽段用样品溶解液(0.1%甲酸、2%乙腈)溶解,13 200 r/min,4 ℃离心20 min,取上清,进行质谱鉴定;液相参数:捕集柱:Acclaim PepMap RSLC C18(300 μm×5 mm, 5 μm, 10 nm);分析柱:Acclaim PepMap C18(75 μm×150 mm, 3 μm,10 nm);流动相A:0.1%甲酸、流动相B:0.1%甲酸,80%CAN、流速:300 nL/min;梯度分离:B相从5%上升至90%(0 min~5%、5 min~5%、45 min~50%、50 min~90%、55 min~90%、65 min~5%)。分离后的肽段直接进入质谱仪Thermo Scientific Q Exactive进行在线检测,具体参数如下:一级质谱参数,分辨率:70 000、AGC:目标3e6、最大喷射时间:40 ms、扫描范围:350~1 800m/z;二级质谱参数,分辨率:17 500、AGC 目标:1e5、最大喷射时间:60 ms、TopN :20、NCE/stepped NCE:27。
1.3.7 动物分组及给药处理
SPF级昆明种雄性小鼠54只,随机分配6个鼠盒,基础饲料饲养,自由饮食,环境温度 22~25 ℃,相对湿度40%~60%,适应性喂养1周后,将小鼠随机分为6组,每组9只,具体分组及给药方法见表1,连续饲养4周,每2天换1次垫料,小鼠的给药剂量由实验室前期药效学动物实验得出的灌胃剂量确定。
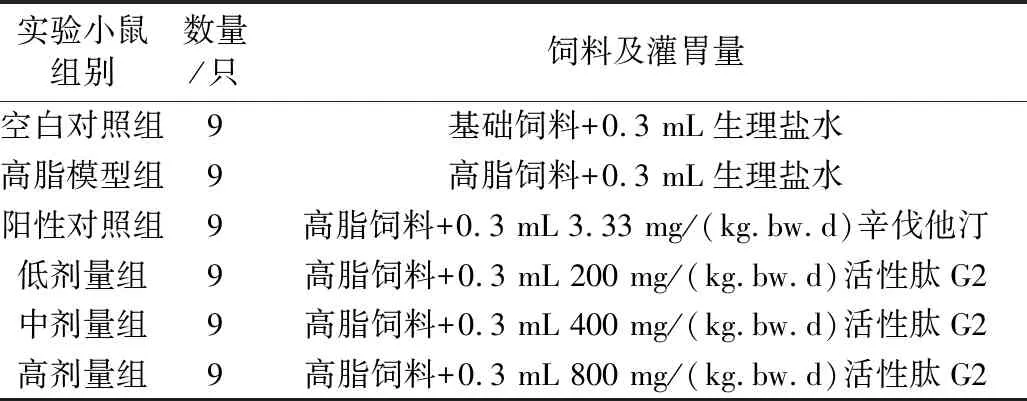
表1 动物分组及饲料、灌胃条件
1.3.8 血清和组织样品制备
实验最后1次给药后断食不断水12 h,用巴比妥钠将小鼠麻醉,眼底取血,低温冷冻离心机离心分离血清(15 min,4 500 r/min),取上清液,于-20 ℃下储存在EP试管中备用。取血后颈椎脱臼处死,解剖摘取肝脏组织,用生理盐水冲洗掉肝脏表面残留的血迹,用滤纸吸干多余生理盐水后称重、记录。精确称取1 g肝脏组织,加入9 mL生理盐水进行匀浆,低温冷冻离心机离心取上清液(15 min,4 500r/min),-20 ℃保存用于测定生理生化指标。
1.3.9 小鼠体重及肝脏指数测定
实验期间,每周定时记录小鼠体重。解剖前,称量并记录各小鼠体重,处死后取脏器并准确称重,并根据式(1)计算肝脏指数。

(1)
1.3.10 小鼠体内抗氧化及降血脂水平测定
取制备好的小鼠血清及肝脏组织匀浆上清,使用酶标仪和科研试剂盒测定肝组织匀浆中GSH-Px、SOD、CAT 活力和 MDA含量;测定小鼠血清中TG、TC、HDL-C 和 LDL-C 含量。
1.3.11 数据分析

2 结果与讨论
2.1 超滤分离组分的抗氧化性分析


注:以0.2 mg/mL的质量浓度测DPPH自由基清除活性,以1 mg/mL的质量浓度测自由基清除能力和还原力,余同。图1 紫苏籽粕蛋白酶解液和超滤分离级分的抗氧化活性
2.2 DEAE纤维素DE-32离子交换层析分离纯化紫苏籽粕抗氧化肽


图2 离子层析分离纯化分子质量<3 ku紫苏籽抗氧化肽

图3 离子层析分离纯化分子质量<3 ku紫苏籽抗氧化肽各组分的抗氧化活性
2.3 凝胶色谱Sephadex G-25分离纯化紫苏籽粕抗氧化肽


图4 凝胶层析分离纯化紫苏籽粕抗氧化肽D3

图5 凝胶层析分离纯化紫苏籽粕抗氧化肽D3后各组分抗氧化活性

表2 紫苏籽粕蛋白水解物中获得的抗氧化活性肽的纯化汇总
2.4 紫苏籽粕抗氧化肽分子质量及氨基酸序列测定
如图6所示,根据LC-MS-MS鉴定,分析并获得G2的准确MS数据,该肽段由7个氨基酸组成,分子质量为790.375 5 u,其氨基酸序列为AADCRAK,即丙氨酸(Ala)-丙氨酸(Ala)-天冬酰胺(Asp)-半胱氨酸(Cys)-精氨酸(Arg)-丙氨酸(Ala)-赖氨酸(Lys)。较短的肽(5~16个氨基酸)比较大的多肽表现出更强的抗氧化活性,这是因为它具有更好的穿过肠道屏障的能力,并且与自由基的相互作用更容易[19]。一些氨基酸对于肽的抗氧化活性至关重要,含有疏水性氨基酸的肽有助于其脂质溶解度的增加,从而有助于增加其抗氧化活性[20]。此外,疏水性氨基酸能够通过疏水性缔合促进肽进入靶器官,便于其发挥抗氧化特性。因此,本研究中经纯化获得的抗氧化活性肽G2组分中存在的疏水性氨基酸残基Ala,在抗氧化活性肽能够有效清除自由基的过程中起到重要的作用。

图6 抗氧化肽G2组分的质谱分析图
2.5 紫苏籽粕活性肽G2对小鼠平均摄食量的影响
紫苏籽粕活性肽G2对受试小鼠摄食量的影响如表3所示。在实验过程中,各实验组小鼠摄食量整体相当,无显著性变化(P>0.05),小鼠平均摄食量稳定在3~4 g。由此判定,实验过程中小鼠摄食量的变化并未对其体质量、血脂水平及抗氧化活性产生显著的影响。

表3 不同阶段小鼠平均摄食量
2.6 紫苏籽粕活性肽G2对小鼠体重及肝脏指数的影响
由表4可以看出,实验前各实验组小鼠体重比较均衡,各组小鼠体重无显著性差异(P>0.05)。实验结束后,高脂模型组小鼠体重极显著高于空白对照组(P<0.01);灌胃低剂量组及中剂量组小鼠体质量显著低于高脂模型组(P<0.05);灌胃高剂量组和阳性对照组小鼠体质量极显著低于高脂模型组(P<0.01)。结果表明,灌胃一定量的紫苏籽粕活性肽G2对高血脂症小鼠的体重增加具有显著的抑制作用;且一定范围内,活性肽的抑制作用与活性肽的剂量呈正相关。
肝脏是机体的重要功能器官,胆固醇的代谢是肝脏的主要功能之一,一般情况下肝脏系数(肝脏重与体重的比值)是相对恒定的一个数值,当胆固醇摄入过多或者代谢异常时,肝脏系数就会偏离恒定值[21]。由表4可知,与空白对照组相比,高脂模型组小鼠的肝脏指数增加极显著(P<0.01);与高脂模型组相比,中剂量组肝脏指数显著减小(P<0.05);阳性对照、高剂量组肝脏系数减小极显著(P<0.01)。说明高脂饮食可导致小鼠肝脏组织重量增加,肝脏胆固醇代谢异常,损害肝脏健康;灌胃紫苏籽粕活性肽G2可保护高脂血症小鼠的肝脏健康,维护肝脏系数的恒定,具有预防脂肪肝的潜在功效。
2.7 紫苏籽粕活性肽G2对小鼠抗氧化水平的影响
谷胱甘肽过氧化物酶(GSH-Px)是动物体内存在的一种重要的能够分解体内过氧化物的酶,它能催化体内有毒的过氧化物转变为无毒的羟基化合物,从而使机体细胞膜的结构和功能免受过氧化物的干扰和损害,然而在疾病和衰老的动物体内 GSH-Px活性明显降低[22]。高血脂症动物往往组织中的脂质过氧化物含量较高,GSH-Px是一种重要的还原脂质过氧化物的主要酶类,能催化过氧化氢分解,可防止细胞膜与其他生物组织免受过氧化损伤[23]。由图7a可知,模型组的GSH-Px活力显著低于空白组(P<0.05),表明模型组小鼠机体抗氧化能力降低。中、高剂量组紫苏籽粕活性肽G2灌胃4周后的小鼠,其GSH-Px活力相对于模型组显著或极显著升高(P<0.05或P<0.01)这表明,紫苏籽粕活性肽G2对具有氧化损伤小鼠GSH-Px活力的恢复有帮助,可以提高小鼠机体的抗氧化能力。超氧化物歧化酶(SOD)是生物体内存在的一种重要的抗氧化酶,能够使体内的超氧化物通过歧化反应转变为过氧化物和氧气,过氧化物再由相应的过氧化物分解酶清除[24]。如图7b所示,高脂模型组小鼠SOD活力下降,与空白对照组相比差异显著(P<0.05),表明长期饲喂高脂饲料能够使小鼠肝组织的抗氧化能力降低。紫苏籽粕抗氧化活性肽中剂量组SOD活力相较模型组显著升高(P<0.05)、高剂量组升高极显著(P<0.01),表明一定剂量的紫苏籽粕活性肽G2可以提高小鼠体内SOD活力,提高机体抗氧化的能力。

表4 紫苏籽粕活性肽G2对小鼠体重、肝脏指数的影响




图7 紫苏籽粕活性肽G2对小鼠体内抗氧化活性的影响
过氧化氢酶(CAT)在动物肝脏组织以高浓度存在,其酶活性为机体提供了抗氧化防御机制[25]。从图7c可以看出,模型组小鼠相对空白对照组CAT活力明显下降(P<0.05)。相对高脂模型组,紫苏籽粕抗氧化活性肽低、中、高剂量组CAT活力升高显著或极显著(P<0.05或P<0.01),其CAT活力分别增长了7.37%、24.64%、37.93%,表明紫苏籽粕活性肽G2各剂量组能显著提高小鼠肝脏组织CAT活力,而且CAT含量随着灌胃浓度的升高而升高,呈现一定的剂量效应关系。
丙二醛(MDA)是一种脂质过氧化的产物,机体中自由基浓度升高会导致脂质过氧化程度升高,过氧化产物丙二醛含量也会升高。因此,体内 MDA的含量能够间接地反映机体受自由基氧化损伤的程度[26]。从图7d可以得出,与空白组相比较,模型组小鼠肝脏组织中MDA 的含量升高具有极显著差异(P<0.01)。与模型组相比,紫苏籽粕活性肽G2低、中剂量组MDA含量分别降低了6.7%、23.21%(P<0.05);高剂量组降低极显著(P<0.01),说明紫苏籽粕活性肽G2各剂量组不同程度降低了小鼠体内的MDA含量,降低机体内脂质过氧化的程度,提高了小鼠机体抗氧化的水平。
2.8 紫苏籽粕活性肽G2对小鼠血脂水平的影响
高血脂症是血脂代谢异常所致,其主要表现为血清中TC、TG和LDL-C水平过高或HDL-C水平过低而引起的脂质水平异常[27]。紫苏籽粕活性肽G2对实验组小鼠血脂水平的影响如图8所示,与空白对照组相比,高脂模型组血清TC和LDL-C水平升高极显著(P<0.01)、HDL-C水平显著降低(P<0.05)、TG显著升高(P<0.05)。对照组在整个造模期间,TC和LDL-C水平基本维持在4.48、1.21 mmol/mL,而高脂模型组则上升至9.15、1.95mmol/mL; HDL-C水平基本维持在2.84 mmol/mL,而模型组HDL-C水平则下降至1.10 mmol/mL,表明高脂模型组小鼠出现明显的血脂代谢紊乱,高血脂小鼠模型造模成功。

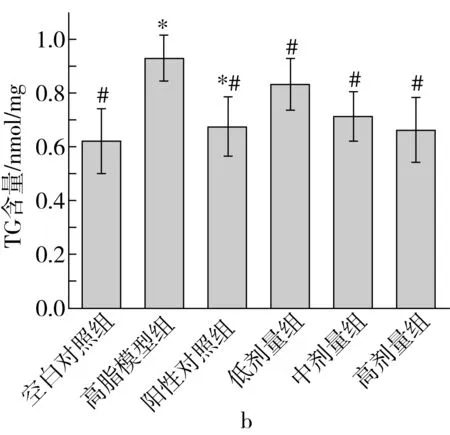


图8 紫苏籽粕活性肽G2对小鼠血脂水平的影响
由图8a可知,与高脂模型组相比,G2高剂量组小鼠血清中TC含量降低了11.93%(P<0.05)。从图8b可以看出,与模型组相比,G2各剂量组小鼠血清中TG含量降低显著(P<0.05),与空白组对比差异不显著(P>0.05),且小鼠血清中TG含量与活性肽G2的剂量呈负相关,即随着灌胃活性肽G2的剂量减少,小鼠血清中TG含量上升。由图8c所示,G2中剂量组小鼠与高脂模型组小鼠HDL-C含量相比有所升高(P<0.05),高剂量组小鼠HDL-C含量较模型组升高了29.28%,差异极显著(P<0.01)。从图8d可以得出G2各剂量组小鼠血清中LDL-C含量与高脂模型组相比均降低,紫苏籽粕活性肽G2中剂量组与模型组相比差异显著(P<0.05),高剂量组差异极显著(P<0.01) 。实验结果表明,灌胃紫苏籽粕活性肽G2能够降低高血脂小鼠血清中TC、TG、LDL-C含量,促进HDL-C升高,表明紫苏籽粕活性肽G2在调节脂代谢紊乱方面具有良好功效,具有调节高血脂小鼠胆固醇代谢的潜在作用。
3 结论


