高中化学“氢氧化铝的两性”项目式教学
——胃药“氢氧化铝”的工作原理
杨凤娇,王 娅,姜红波,王 艳,王冬梅,胡登卫,赵卫星,苏小龙
(1.宝鸡文理学院 化学化工学院,陕西 宝鸡 721013;2.乐陵民生教育高级中学,山东 德州 253600)
1 项目主题内容
在高中化学体系中,氢氧化铝是第一个需要学生详细学习的两性氢氧化物,其性质有至关重要的作用[1]。本项目对氢氧化铝性质的探究包含酸碱中和反应的相关知识、氨水的相关性质以及氢氧化物的制取方法等。学生通过平时生活中的观察发现,药品“氢氧化铝”对治疗胃酸过多有显著的效果,以文献查询、实验探究、小组讨论等形式对“氢氧化铝”药品的有效成分—氢氧化铝的性质进行探究,了解到氢氧化铝的性质不同于一般氢氧化物,应用所学知识和规律进行推理判断有一定难度[2]。本项目旨在引导学生发现生活中的问题,并能运用化学原理对其进行解释,培养学生发现问题、解决问题的能力,强化学生的探究能力、创新意识和小组合作能力[3]。
2 项目教学目标
(1)通过对药品“氢氧化铝”的实验探究,学生能掌握氢氧化铝的两性,培养科学探究与创新意识。
(2)以图表的形式分析药品“氢氧化铝”的作用并探究其工作原理,明确药品“氢氧化铝”中和胃酸的原理,探究其他药品能否同样达到中和胃酸且保护肠胃的效果,以此培养学生的证据推理能力。
(3)学生能从生活中发现问题并解决问题,将化学物质的性质应用于生活中,感受化学知识的重要作用,培养科学精神和社会责任感。
3 项目任务及教学流程
项目任务如表1所示。

表1 项目任务

续表1
4 项目教学设计实施过程
4.1 全方位认识药品“氢氧化铝”
“氢氧化铝”是典型的抗酸药,具有抗酸、吸着、局部止血和保护溃疡等作用[5]。“氢氧化铝”能对胃酸起到中和或缓冲的作用,抗酸作用缓慢而持久,但不会减少胃酸的分泌[6]。“氢氧化铝”与胃酸作用时,产生的氯化铝有收敛作用,能够起到局部止血的效果,同时也可能产生便秘的副作用。“氢氧化铝”与胃液混合形成凝胶,覆盖在溃疡表面形成一层保护膜,起机械保护作用。此外,铝离子在肠内与磷酸盐结合成不溶解的磷酸铝随粪便排出,因此,尿毒症患者服用大量“氢氧化铝”后可减少肠道磷酸盐的吸收,进而减轻酸血症。药品“氢氧化铝”的相关参数如表2所示。

表2 药品“氢氧化铝”的相关参数
4.2 “氢氧化铝”治疗胃病的原理探究
4.2.1 任务引导
【教师活动】学生通过对药品“氢氧化铝”的学习和了解,知道“氢氧化铝”药品属于原料药,以其作为研究对象是为了减少其他成分对实验的干扰。学生通过学习药品“氢氧化铝”的相关参数,明确其主要作用是治疗胃酸过多等,接下来需要了解其主要成分和治疗胃酸过多的原理[7]。
【学生活动】明确药品“氢氧化铝”的主要成分是氢氧化铝,查询资料得知胃酸的主要成分为HCl,设计实验进行探究。
4.2.2 探究实验假设
查询资料可知,胃酸的正常pH在0.9~1.8,饭后会被稀释,pH上升到3.5左右。首先,设计实验。使药品“氢氧化铝”与盐酸溶液反应(见图1),测量其反应前后的pH,记录实验数据。其次,设计对比实验进行探究。(1)准备两支试管并加入等量的药品“氢氧化钠”,然后分别滴加盐酸,通入二氧化碳,观察现象,记录并对比分析。(2)准备一支试管,向其中加入一定量的盐酸,用pH计测量其pH,将pH控制在0.9以下。(3)向试管中少量多次加入药品“氢氧化铝”粉末直到不再反应为止,测量反应结束时的pH,记录并讨论分析,找到选择氢氧化铝中和胃酸的原因。(4)设计对比实验,比较氢氧化铝分别与强酸、弱酸反应的结果。
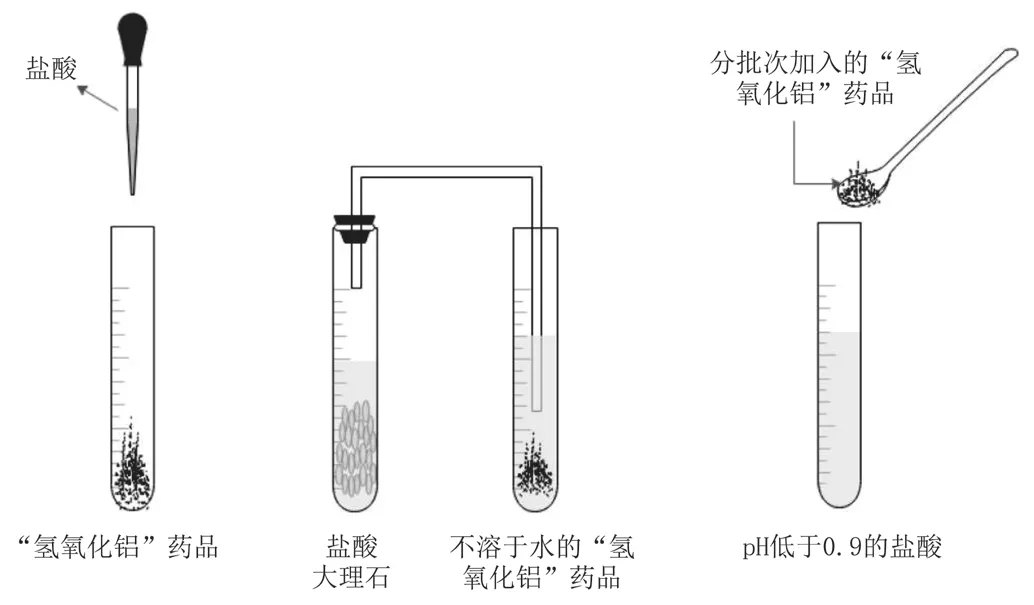
图1 “氢氧化铝”药品与酸反应
4.2.3 实验结果预测
(1)盐酸与“氢氧化铝”药品发生反应,药品白色粉末溶解;(2)“氢氧化铝”药品不溶于水,为白色沉淀,通入盐酸与大理石制取的二氧化碳,无明显反应;(3)向pH低于0.9的盐酸溶液中少量多次加入“氢氧化铝”药品直至不反应,出现少许白色沉淀时,溶液的pH在3.0~4.0。
4.2.4 知识小结
氢氧化铝能和强酸发生反应,但不和弱酸发生反应,中和胃酸时生成的氯化铝显酸性,对于胃里的酸性环境不会有太大影响且能中和过量胃酸,氯化铝具有收敛作用,可局部止血,用于治疗胃病很合适。
4.3 “氢氧化铝”主要成分是否与碱反应探究
4.3.1 任务引导
【教师活动】氢氧化铝治疗胃酸过多的原理是氢氧化铝能和胃酸中的主要成分盐酸发生反应,且为酸碱中和反应,提问:氢氧化铝能和碱发生反应吗?如若发生反应,生成什么物质?
【学生活动】收集资料并提出预想的结果,根据所查资料设计实验以验证假设。
4.3.2 探究实验假设
为了保证探究的完整性,准备“氢氧化铝”药品,分别与强碱、弱碱反应(见图2),观察、记录现象并进行对比。分别向两支试管中装入等量药品“氢氧化铝”,向一支试管中滴加氢氧化钠溶液,观察实验现象并记录;向另一支试管中滴加氨水,观察实验现象并记录[8]。

图2 “氢氧化铝”药品与碱反应
4.3.3 实验结果预测
(1)向“氢氧化铝”药品中滴加NaOH,白色粉末溶解;(2)向“氢氧化铝”药品中滴加氨水,白色粉末无明显变化,不溶解。
4.3.4 知识小结
氢氧化铝能和强碱发生反应,不能和弱碱发生反应。根据以上实验可知,氢氧化铝既能和酸反应,又能和碱反应,为两性氢氧化物。
4.4 “氢氧化铝”主要成分的制取
4.4.1 任务引导
【教师活动】通过分析“氢氧化铝”药品的参数可知,其主要成分为氢氧化铝,提问:结合上面两个探究实验以及参考资料,应如何制备氢氧化铝?其药品的选择有没有特殊要求?
【学生活动】明确药品“氢氧化铝”的主要成分是氢氧化铝,结合上面两个探究实验可知,氢氧化铝会和强酸、强碱反应,因此不能选用强酸、强碱制备氢氧化铝。查阅资料选择合适的制备方法。
4.4.2 探究实验假设
根据已学知识,氢氧化物可以通过离子与碱反应生成。由于氢氧化铝会和强碱反应,但是不与弱碱反应,可以使用氨水与铝离子反应制取氢氧化铝(见图3)。可设置对照实验,分别逐滴加入NaOH和氨水,观察现象并对比,收集生成的氢氧化铝[9]。
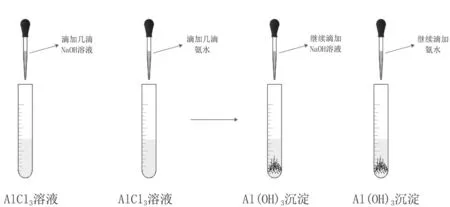
图3 氢氧化铝的制取
4.4.3 实验结果预测
(1)开始滴入NaOH时产生白色沉淀,继续滴加NaOH则白色沉淀消失;(2)开始滴入氨水时产生白色沉淀,继续滴加氨水,白色沉淀不消失。
4.4.4 知识小结
氢氧化铝会和强碱反应,因此,可用弱碱制取氢氧化铝。同理,可用弱酸与偏铝酸根反应制取氢氧化铝。
5 知识巩固与总结评价
5.1 知识巩固
明确胃药“氢氧化铝”的主要成分为氢氧化铝,通过查询资料以及实验探究可知,氢氧化铝既能和强酸反应,又能和强碱反应:
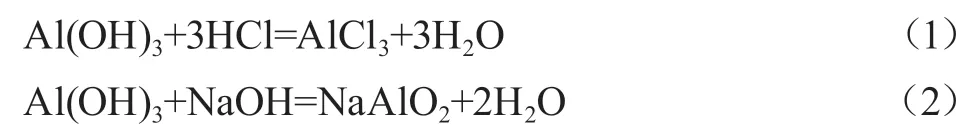
可见,氢氧化铝是两性氢氧化物,不与弱酸、弱碱反应,因此,可以使用弱酸、弱碱制备氢氧化铝:

氢氧化铝治疗胃病的工作原理为其能中和胃酸,且生成的物质对人体没有危害。
5.2 总结评价
在学生查阅资料时,教师要予以适当的指导并补充资料,对学生工作进行过程性评价。在学生设计实验和实施过程中,教师要对学生的实验设计方案进行指导并评价。实验结束后,教师要了解学生对实验结果的深层次认识,对学生的知识把握情况作出总结性评价,并及时对学生活动作出系统性评价。
6 项目教学设计反思
对氢氧化铝两性的探究以胃药“氢氧化铝”项目式教学设计展开,每个阶段的任务和培养目标清晰明确。在实验探究方面,学生作出了实验假设,但鉴于学生思维的发散性,假设并不完善,因此,在进行教学实践时,还要求教师有临场应变能力。学生查到的以及教师提供的设备和药品,对学生的探究行为起到了一定的限制作用,所以实验的探究性较弱,还有待改进。在评价方面,教师给予学生较多的是口头过程性评价以及对知识掌握情况的总结性评价,应设计多元化评价机制,通过多种途径反馈学生对知识的理解程度。

