乳酸菌发酵接骨木果汁降血糖与抗氧化活性机理
封 弦, 翁佩芳*, 吴祖芳, 李 杲
(1.宁波大学 食品与药学学院,浙江 宁波 315832;2.宁波市北仑玉健医药科技有限公司,浙江 宁波 315830)
接骨木(Sambucus nigra)为茜草目忍冬科接骨木属植物,目前多集中于研究其根茎和花,而对接骨木果实的研究较少,仅局限于对接骨木果油的营养和生物活性的研究。接骨木果(Elderberry)富含蛋白质[1]、脂肪酸[2-3]、碳水化合物[4-5]、有机酸和维生素[6]等营养成分以及多酚[7]、黄酮[8-9]、花青素[10-11]和酚酸[12]等生物活性物质,是一种良好的药食资源,可用于开发新的功能食品。
接骨木果中花青素含量较高,故具有显著的抗氧化能力。Olejnik[13]等使用接骨木果提取物在人结肠膜细胞中进行抗氧化实验,结果显示降低了细胞中活性氧水平和DNA的损伤,说明接骨木果对结肠细胞氧化应激具有保护作用。Wu[11]等研究了15个水果样品的抗氧化能力,结果显示接骨木果和草莓的抗氧化活性最强。Milbury[14]等研究表明,接骨木果中的花青素的抗氧化能力比维生素C和维生素E强。有研究表明,接骨木果花青素能避免血管上皮细胞的氧化损伤,进而防止血管病变[15]。Bratu[16]等研究表明接骨木果的提取物能显著清除氧自由基。其他研究也表明,接骨木果汁和果酒均具有抗氧化作用,并且接骨木果酒的抗氧化能力与生产过程中所用的糖和水的比例以及果实的细度有关[17-18]。乳酸菌发酵可以增加果蔬的营养和感官特性,延长货架期,同时乳酸菌发酵也可以促进食品中植物化学成分的转化[19],从而产生大量新的代谢产物,因此相应的营养功能等也会发生变化[20]。
H2O2是一种常用的刺激细胞氧化损伤的工具,它作为氧化应激诱导剂诱导的HepG2细胞氧化损伤模型可控性强,具有一定的模拟性[21],因此常应用于天然产物抗氧化研究中。
作者选用保加利亚乳杆菌BNCC336436和嗜热链球菌ABT-T发酵接骨木果汁,通过DPPH自由基、羟自由基和超氧阴离子清除率来判断接骨木果汁发酵过程抗氧化活性变化;以未发酵为对照,进行发酵接骨木果汁酚类化合物细胞抗氧化实验,比较发酵前后抗氧化活性变化并初步探究抗氧化机理,为接骨木果汁的发酵加工和果蔬发酵功能食品开发提供了理论依据。
1 材料与方法
1.1 材料与试剂
接骨木果粉:宁波市北仑玉健医药科技有限公司提供;保加利亚乳杆菌BNCC336436(Lactobacillus bulgaricus,B)、嗜 热 链 球 菌ABT-T(Streptococcus thermophilus,ST):均保存于宁波大学食品与药学学院食品生物技术实验室;蔗糖:购于超市;MRS肉汤培养基、吐温80、甘油:购于国药集团化学试剂有限公司;HepG2细胞、PBS缓冲溶液、细胞冻存液和质量分数0.25%胰酶缓冲液(EDTA缓冲液)、乳酸脱氢酶(LDH)测定试剂盒:购于北京索莱宝科技有限公司;DMEM高糖培养基、胎牛血清、链霉素、青霉素:购于美国Gibco公司;细胞培养瓶、6孔板、12孔板、96孔板:购于宁波航景生物有限公司;CCK-8试剂盒:购于美国Proteintech公司;细胞活性氧(ROS)检测试剂盒、总抗氧化能力(T-AOC)测定试剂盒、过氧化氢酶(CAT)测定试剂盒:购于南京建成生物有限公司;qPCR实验相关引物:购于生工生物工程(上海)股份有限公司;RNA提取试剂盒 (HiPure Bacterial RNA Kit,R4182):购于广州美基生物有限公司;反转录试剂盒(UEIrisⅡIRT-PCR Svstem for First-StrandcDNA Svnthesis,R2028):购于苏州宇恒生物科技有限公司;实时荧光定量检测试剂盒(PerfectStarrTM Green qPCR SuperMix):购于北京全式金生物技术有限公司。
1.2 仪器与设备
FA2004分析天平:上海舜宇恒平科学仪器有限公司;ZJ-HCB-1200洁净工作台:广州梓净净化设备有限公司;SPX智能生化培养箱:江南仪器厂;5418R低温超速离心机:德国Eppendorf公司;311型细胞CO2培养箱、1300系列A2型生物安全柜、MK3酶标仪:美国赛默飞世尔科技有限公司;XSP-63XDV荧光倒置显微镜:上海光学仪器厂;HWS-11恒温水浴锅:上海慧泰仪器制造有限公司;LDZX-40B I型立式蒸汽灭菌器:上海申安医疗器械厂;DM-40L262-40℃冰箱:青岛海尔特种电器有限公司;-80℃超低温冰箱:赛默飞科技(苏州)有限公司;qPCR仪:武汉俊杰电子有限公司;BD-252WY-20℃冰箱:容声冰箱有限公司;SCIENTZ-18N冷冻干燥机:宁波新芝仪器厂。
1.3 方法
1.3.1 菌种活化取新鲜保藏的B和ST试管斜面分别接种至MRS肉汤培养基中,于37℃恒温静置培养18 h得到菌种活化液,备用。
1.3.2 发酵接骨木果汁的制备按料液质量体积比1 g∶50 mL配制接骨木果汁,加入质量分数4%的蔗糖,经85℃水浴灭菌15 min后降至室温得到发酵基质。将B和ST按体积分数3%接入发酵基质中,于37℃恒温静置发酵36 h。
1.3.3 发酵接骨木果汁酚类化合物的提取与纯化分别取一定量的未发酵和发酵接骨木果汁与无水乙醇按体积比1∶1混合均匀,然后超声提取30 min(功率40 W,温度40℃)后过滤,得到的滤渣再按体积比1∶1的比例加入无水乙醇进行提取,重复提取3次,将收集到的提取液旋转蒸发至无醇味,即得到酚类化合物的粗提取物,于4℃保存待纯化。 采用AB-8大孔吸附树脂对接骨木果汁酚类化合物的粗提取物进行纯化。具体操作步骤为:1)AB-8大孔吸附树脂经无水乙醇浸泡24 h使其活化,用蒸馏水冲洗至无醇味;2)取适量烘干活化好的AB-8树脂倒入烧杯中备用;3)在烧杯中加入酚类物质粗提取物浓缩液、无水乙醇和AB-8大孔树脂,搅拌均匀放置磁力搅拌器搅拌过夜;4)收集乙醇洗脱液,将洗脱液旋转蒸发至无醇味,备用;5)经冷冻干燥后得到接骨木果汁的酚类化合物纯化物。
1.3.4 DPPH自由基、超氧阴离子、羟自由基清除能力的测定DPPH自由基清除能力的测定参照冯文娟[22]等的方法;超氧阴离子清除能力的测定参照文献[23]的方法;羟自由基清除能力的测定参考郑时莲[24]等的方法。
1.3.5 α-淀粉酶抑制实验α-淀粉酶抑制率用3,5-二硝基水杨酸试剂法测定[25]。称取α-淀粉酶粉末用pH 6.8的PBS溶液配制成质量浓度为0.04 mg/mL的α-淀粉酶溶液。取1 mL样品与1 mL α-淀粉酶溶液,摇匀,25℃静置反应10 min。随后加入1 mL体积分数1%可溶性淀粉(pH 6.8的PBS溶液溶解),再加入1 mL DNS溶液沸水浴5 min进行显色反应,冷却至室温。加入蒸馏水稀释至10 mL,540 nm处检测吸光值,空白组以蒸馏水做对照。

式中:Ac为空白组吸光值,As为样品组吸光值。
1.3.6 α-葡萄糖苷酶抑制实验α-葡萄糖苷酶抑制率参考Marilisa[26]的方法,稍做修改。具体操作为:分别取1 mL磷酸盐缓冲液、0.2 mL α-葡萄糖苷酶溶液、0.4 mL果汁发酵液加入试管中摇匀,37℃水浴10 min,加入0.5 mL pNPG溶液摇匀,再于37℃水浴10 min,最后加入8 mL Na2CO3溶液,于405 nm处测定其吸光值,结果记为A1。取2支试管做对照实验,其中不加底物pNPG的试管吸光值记为A2,另一支不加果汁的试管吸光值记为A3。
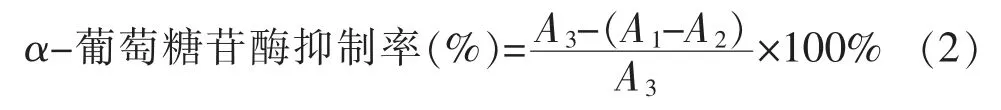
式中:A1为添加α-葡萄糖苷酶溶液、果汁和底物pNPG的吸光值,A2为添加α-葡萄糖苷酶溶液和果汁的吸光值,A3为添加α-葡萄糖苷酶溶液和底物pNPG的吸光值。
1.3.7 细胞复苏、培养和传代将HepG2细胞在培养瓶中培养至状态良好后灌满培养基并转移到生物安全柜中操作。如细胞生长至70%~80%,将瓶中的培养基移入无菌瓶中留作培养使用,保留5~8 mL培养基在培养箱(37℃、5% CO2)中继续培养。细胞培养至90%~100%后,按要求消化传代。弃去培养基,细胞用无菌PBS缓冲液清洗2次,加入适量胰蛋白酶消化,待细胞完全脱壁后加入培养基吹打均匀,分瓶培养,按需传代或铺板。
1.3.8 细胞冻存将培养至90%~100%的HepG2细胞于生物安全柜中弃掉旧培养基,用PBS缓冲液清洗2遍,然后加入适量0.25% EDTA溶液消化2~3 min后,加入新鲜培养基终止消化。最后将细胞收集至15 mL离心管中,于1 000 r/min离心5 min,弃掉培养基,将细胞冻存液(提前预冷)加入细胞中,吹打之后分装到2 mL细胞冻存管中,写好标签后,用封口膜封好,最后放至-80℃超低温冰箱中保存。
1.3.9 建立HepG2细胞氧化损伤模型以未经过样品和H2O2处理的细胞作为空白对照组,经过不同浓度的H2O2处理的细胞为模型组,经过样品处理再经过H2O2处理的细胞作为实验组。选择质量浓度0、125、250、500、1 000 μg/mL的H2O2溶液(DMEM培养基配制)作为本实验浓度,将生长至对数期的HepG2细胞接种于96孔板中,每个孔中加入200 μL细胞悬液后置于培养箱(37℃、5% CO2)中培养24 h,弃去旧培养基,用PBS缓冲液清洗1次,每个孔中加入不同质量浓度的200 μL H2O2溶液继续培养4 h后测定细胞存活率,获得HepG2细胞氧化损伤模型。
1.3.10 HepG2细胞毒性实验按照CCK-8试剂盒步骤进行测定。
1.3.11 ROS、LDH、T-AOC和CAT活力的测定取适量经过处理的细胞培养液,严格按照相应的测定试剂盒测定步骤进行。其中ROS以荧光强度计,LDH用相对释放率表示,T-AOC单位为U/mL,CAT其活力单位为U/mL。
1.3.12 RNA提取及反转录HepG2细胞培养结束后,分别收集各组细胞。总RNA的提取根据RNA提取试剂盒提供的方法执行,接着使用反转录试剂盒对提取的RNA进行反转录,具体操作步骤严格按照试剂盒说明书进行。GAPDH购自生工生物工程(上海)股份有限公司,货号B661104。

表1 qPCR引物序列Table 1 Sequence of qPCR primer
1.3.13 数据分析每组实验进行3次重复,结果以均值±标准偏差表示。利用SPSS软件对数据进行分析,使用Origin软件作图。
2 结果与分析
2.1 乳酸菌发酵接骨木果汁体外抗氧化活性变化
乳酸菌发酵接骨木果汁过程中抗氧化能力的变化见图1。可以看出,发酵接骨木果汁对DPPH自由基、羟自由基和超氧阴离子的清除能力呈现一致的趋势,随着发酵时间的增加对自由基的清除率提高,且发酵结束时接骨木果汁的抗氧化能力最大。经菌种B和ST发酵后,接骨木果汁对DPPH自由基的清除能力从44.67%提高到了60.76%,对羟自由基清除率达到了75.37%,较未发酵果汁提高了20.39%,对超氧阴离子的清除能力从43.27%增加到了57.45%,表明接骨木果汁经过乳酸菌发酵后提高了抗氧化能力。这可能是由于乳酸菌发酵过程中发酵基质中酚类和黄酮类化合物的释放以及乳酸菌分泌的抗氧化酶的抗氧化能力不同引起的。延莎[27]等使用乳酸菌发酵茶花粉后发现其总多酚和总黄酮含量都有明显的增加,发酵茶花粉提取物对DPPH自由基、ABTS自由基等自由基的清除能力均高于对照组。沙棘-苹果汁的复合果汁经不同种类乳酸菌发酵后,植物乳杆菌对其黄酮醇含量和抗氧化能力的提高更为明显[28]。乳清蛋白蓝莓汁混合物经保加利亚乳杆菌、嗜热链球菌单独发酵和混菌发酵后对DPPH自由基、超氧阴离子、羟自由基清除率和脂质过氧化能力与发酵前相比均有提高[29]。

图1 接骨木果汁发酵过程中DPPH自由基、羟自由基和超氧阴离子清除率的变化Fig.1 Changes in the scavenging rates of DPPH radicals,hydroxyl radicals and superoxide anions during the fermentation of elderberry juice
2.2 酶抑制实验
α-葡萄糖苷酶和α-淀粉酶可以分解碳水化合物,从而增加人体血糖水平,通过抑制这两种酶的活性可以有效地延缓糖类的水解从而起到降低血糖的作用。保加利亚乳杆菌和嗜热链球菌发酵接骨木果汁过程中对这2种酶抑制能力变化见图2。从图2可以看出,发酵接骨木果汁对α-葡萄糖苷酶的抑制率随发酵时间的延长而增加;经36 h的发酵,接骨木果汁对α-葡萄糖苷酶的抑制率从52.97%提高至72.39%,对α-淀粉酶的抑制率从48.75%增加到68.62%,表明乳酸菌发酵有效提高了接骨木果汁的酶抑制能力。有文献报道,Aronia果汁经发酵后具有较强的α-葡萄糖苷酶抑制活性[30]。李云姣[31]等发现,水果酵素在发酵120 d后对α-葡萄糖苷酶和α-淀粉酶的抑制率分别达到了99.57%和81.67%,证明水果酵素具有良好的降血糖作用。有研究表明,采用植物乳杆菌发酵黑葡萄汁后对α-葡萄糖苷酶和α-淀粉酶的抑制活性显著提高[32]。南瓜乳酸菌发酵饮料对α-葡萄糖苷酶的抑制率达到(95.89±0.03)%[33],证明南瓜经乳酸菌发酵可用于开发降糖饮料。
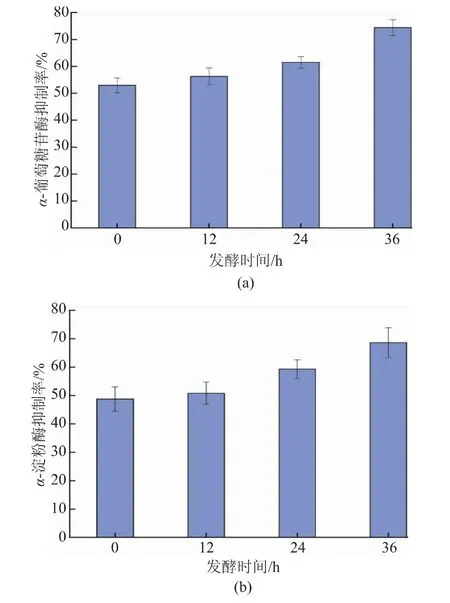
图2 接骨木果汁发酵过程中α-葡萄糖苷酶和α-淀粉酶抑制能力的变化Fig.2 Changes in the inhibitory capacity of α-glucosidase and α-amylase during the fermentation of elderberry juice
2.3 乳酸菌发酵接骨木果汁酚类化合物对HepG2细胞的毒性作用
不同质量浓度酚类物质作用下HepG2细胞存活率见图3。可以看出,发酵前后的接骨木果汁酚类化合物质量浓度在0~500 μg/mL范围内作用于HepG2细胞,细胞存活率均在85%以上,说明在该质量浓度范围内,酚类化合物对HepG2细胞无明显毒性作用。
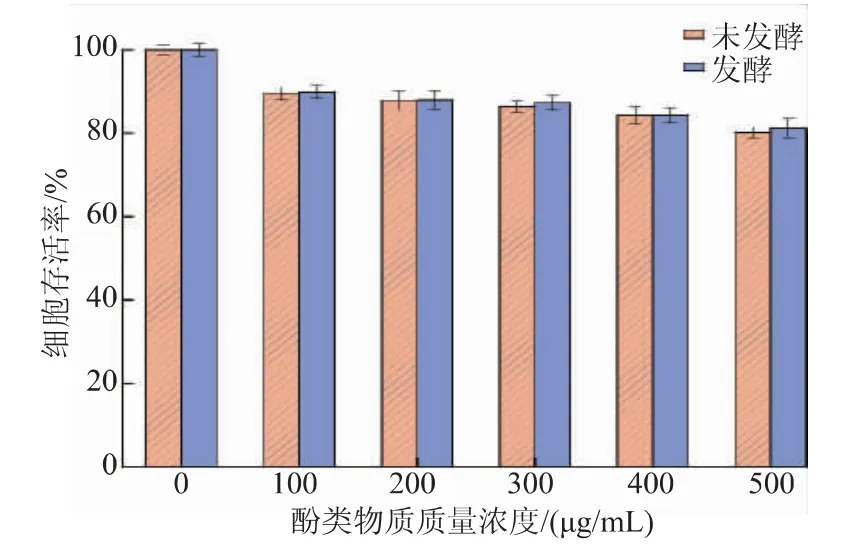
图3 不同质量浓度接骨木果汁酚类物质作用下的HepG2细胞存活率Fig.3 Survival of HepG2 cells under the different mass concentrations of phenolic substances of elderberry juice
2.4 H2O2诱导HepG2细胞氧化损伤质量浓度的确定
为了确定H2O2的刺激浓度,选取质量浓度0、125、250、500、1 000 μg/mL的H2O2对HepG2细胞进行氧化刺激,不同质量浓度作用下HepG2细胞存活率见图4。从图4可以看出,H2O2质量浓度在0、125、250 μg/mL下HepG2细胞存活率都在80%以上,说明该质量浓度范围内H2O2对HepG2细胞没有造成氧化损伤;而在500、1 000 μg/mL质量浓度刺激下,HepG2细胞存活率分别为47.31%和31.27%,如果细胞存活率太高或太低,那么样品对HepG2细胞的作用效果就会不明显,参考意义不大[34]。因此选择刺激条件下细胞存活率接近50%的H2O2质量浓度进行下一步分析。
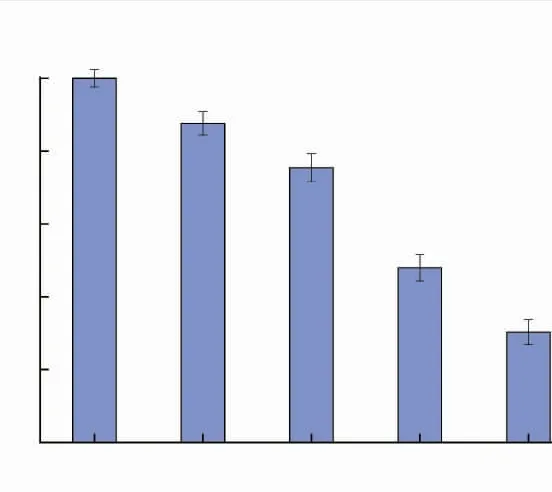
图4 不同质量浓度H2O2刺激下HepG2细胞存活率Fig.4 Survival rate of HepG2 cells under different mass concentrations of H2O2 stimulation
2.5 接骨木果汁酚类物质对HepG2细胞氧化损伤的保护作用
通过实验筛选了诱导HepG2细胞氧化损伤的H2O2质量浓度。从图5可以看出,在质量浓度为100、200、300、400、500 μg/mL未发酵和发酵接骨木果汁酚类物质质量浓度作用下,HepG2细胞的存活率都高于刺激组,说明酚类物质可有效降低H2O2对HepG2细胞的氧化损伤程度。而在200 μg/mL和300 μg/mL时,细胞存活率接近85%,有利于下一步实验的开展。为了确保下一步实验顺利进行,作者研究了200 μg/mL和300 μg/mL接骨木果汁酚类物质对HepG2细胞氧化损伤的保护作用。
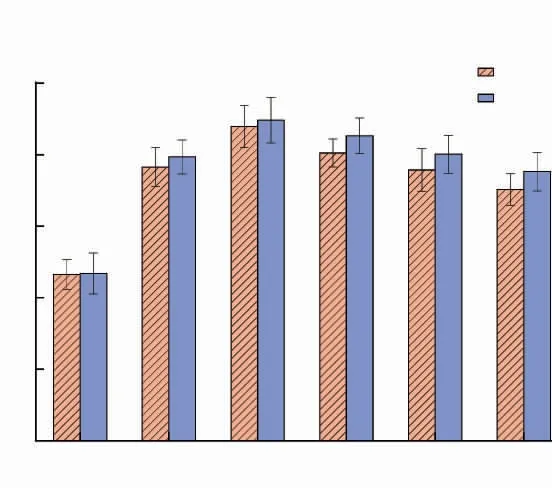
图5 不同质量浓度酚类物质作用下HepG2细胞的存活率Fig.5 Survival rate of HepG2 cells under the effect of different mass concentrations of phenolic substances
2.6 ROS、T-AOC、CAT、LDH的测定
不同处理条件下HepG2细胞中ROS水平的变化见图6。可以看出,与空白组相比,仅添加H2O2处理后提高了HepG2细胞中ROS的水平,说明促进了氧化应激的发生;而HepG2细胞经质量浓度200 μg/mL和300 μg/mL酚类物质预处理后明显减弱了氧化应激作用,抑制了ROS的积累,说明酚类物质在一定程度上起到了保护作用。为了探究接骨木果汁酚类物质对H2O2诱导的HepG2细胞氧化应激的保护作用,HepG2细胞先用酚类物质预处理24 h,然后测定HepG2细胞T-AOC、CAT和LDH相对释放率的变化,结果见图6。经质量浓度200 μg/mL和300 μg/mL酚类物质预处理的HepG2细胞总抗氧化能力显著提高,并且呈现一定的剂量依赖性,说明酚类物质的作用降低了HepG2细胞的氧化损伤程度。发酵接骨木果汁酚类物质的总抗氧化能力比未发酵酚类物质强。同时,用质量浓度200 μg/mL和300 μg/mL酚类物质预处理的HepG2细胞的过氧化氢酶活力显著高于对照组,说明酚类物质可以有效降低H2O2诱导的HepG2细胞氧化应激。乳酸脱氢酶的释放可能是因为在H2O2的刺激下细胞膜受到损伤,通透性增加,从而导致细胞中乳酸脱氢酶浓度的增加。如图6所示,用质量浓度200 μg/mL和300 μg/mL酚类物质预处理的HepG2细胞的乳酸脱氢酶相对释放率明显高于空白组,但远远低于对照组。这些都说明酚类物质在一定程度上降低了H2O2对HepG2细胞膜的破坏。
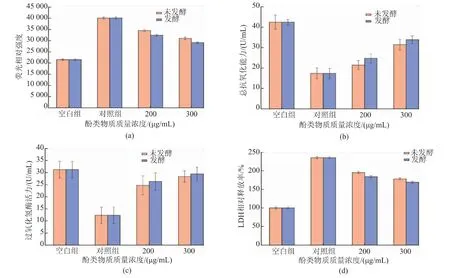
图6 不同质量浓度酚类物质作用下HepG2细胞ROS、T-AOC、CAT和LDH的变化Fig.6 Changes of ROS,T-AOC,CAT and LDH in HepG2 cells under the different mass concentrations of phenolic substances
2.7 抗氧化酶相关基因表达的变化
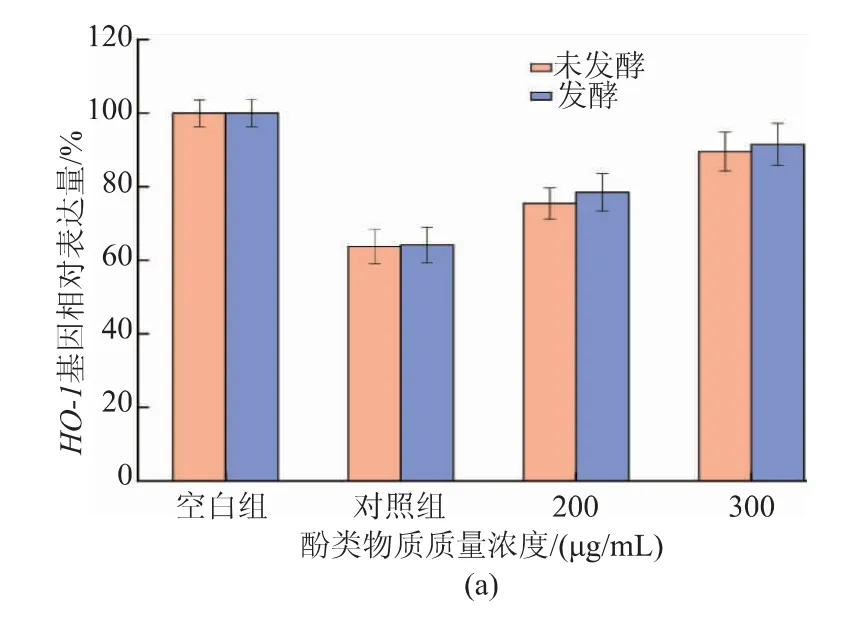
抗氧化酶可以保护细胞免受氧化应激的损害,抑制细胞中ROS的过量生成,以维持细胞氧化还原平衡。同时,抗氧化酶可以将过氧化物转化为毒性较小或无害的物质。通过测定HO-1、NQO1和GCLC基因相对表达量,证明酚类物质处理后是否提高了相关酶的抗氧化活性。HO-1可以催化血红素分解,生成的小分子产物具有抗氧化损伤的功能[35],是一种重要的抗氧化酶。如图7所示,HO-1的基因表达在经H2O2处理的HepG2细胞中明显降低,而在经200、300 μg/mL酚类物质预处理的HepG2细胞中明显提高。NQO1可以通过还原反应降低ROS的产生,因此NQO1能阻止外源性刺激条件对DNA造成氧化损伤,是重要的抗氧化酶之一。在H2O2刺激下HepG2细胞中的NQO1基因表达量减少,而采用质量浓度为200、300 μg/mL酚类物质预处理的HepG2细胞中NQO1基因表达量明显增加。同时,经H2O2刺激后HepG2细胞中GCLC表达量减少,使用质量浓度200 μg/mL和300 μg/mL酚类物质预处理的HepG2细胞中NQO1基因表达量上升。因此可以说明酚类物质可以加强HepG2细胞中抗氧化酶相关基因的表达量。
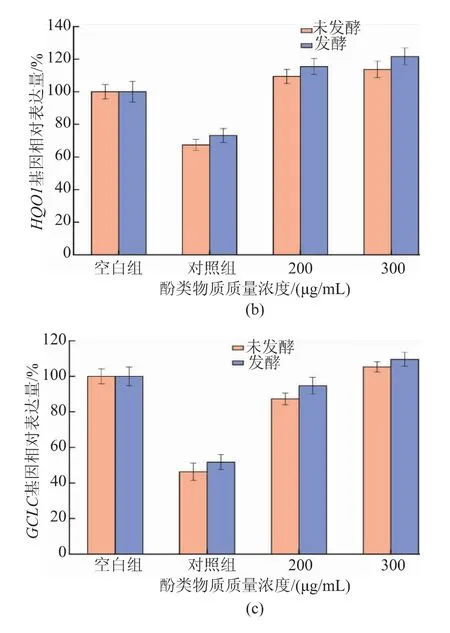
图7 不同质量浓度酚类物质作用下HepG2细胞氧化损伤模型中的抗氧化酶相关基因相对表达Fig.7 Relative expression of antioxidant enzyme-related genes in a model of oxidative damage in HepG2 cells under the different phenolic substance mass concentrations
3 结语
选用B和ST发酵接骨木果汁后,果汁的抗氧化活性提高,对α-葡萄糖苷酶和α-淀粉酶的抑制能力也提高。研究还表明,用酚类物质预处理HepG2细胞后,细胞T-AOC、CAT明显提高;LDH相对释放率明显增加并且降低了细胞中活性氧的积累;这说明酚类物质能使HepG2细胞免受H2O2氧化损伤,并且发酵后的酚类物质作用比发酵前强。细胞抗氧化实验证明,HO-1、NQO1和GCLC相关抗氧化酶的基因表达在经H2O2处理的HepG2细胞中明显降低,而经酚类物质预处理的HepG2细胞中明显提高。由此可见,发酵后果汁抗氧化能力提高的原因可能是在酚类物质的作用下提高了HepG2细胞中相关抗氧化酶的基因表达水平。

