紫山药多酚分离纯化及其对α-葡萄糖苷酶活性的抑制作用
朱延胜,魏明,钱森和,赵世光
(安徽工程大学 生物与食品工程学院,安徽 芜湖,241000)
紫山药(DioscroreaalataL.)是山药的一种,具有养胃润肺、益肾健脾等功效,是一种药食两用植物[1]。紫山药含有多糖、花青素、薯蓣皂苷、尿囊素、多酚等活性成分,具有抗氧化、延缓衰老、降血糖、降血脂等功能,这些功能与其生物活性物质密切相关[2-4]。
抑制α-葡萄糖苷酶的活性是防治糖尿病的有效手段,通过抑制α-葡萄糖苷酶的活性,可以防止餐后血糖水平升高[5]。KWON等[6]研究发现,从茄子里提取的酚类物质具有抑制糖代谢相关酶活性的作用。LES等[7]发现石榴汁中的酚类物质具有较强的α-葡萄糖苷酶抑制活性。GUO等[8]研究发现,紫山药乙醇提取物对α-葡萄糖苷酶活性具有一定的抑制作用。因此,分离纯化紫山药多酚,并研究其α-葡萄糖苷酶抑制活性,对明确紫山药多酚的降血糖作用具有重要意义。
大孔树脂具备较强的选择性和吸附性能,使用成本低,受杂质及酸碱的影响较小,性质稳定再生能力强,在天然活性成分的分离纯化方面得到了广泛应用[9]。不同的植物所含的酚类物质性质不同,不同树脂的极性、颗粒大小和比表面积均能影响其对酚类物质纯化的效果,所以,选择适宜的树脂至关重要[10]。近年来,大孔树脂在植物多酚分离纯化方面的研究已有大量文献报道,且取得了良好的效果[11-12]。ZHANG等[13]利用离子液体协同超声提取紫山药多酚,取得了良好的提取效率。大孔树脂分离纯化紫山药多酚尚未见报道。
本文探讨了大孔树脂对紫山药多酚的分离纯化效果,利用不同洗脱剂获得不同洗脱组分,比较不同洗脱组分的α-葡萄糖苷酶抑制活性,并分析多酚的组成,研究结果为阐明紫山药酚类物质的降血糖活性提供依据。
1 材料与方法
1.1 材料与试剂
紫山药产自广州增城县;D4006、AB-8、D101、ADS-7、NKA-9型大孔树脂,郑州和成新材料科技有限公司;α-葡萄糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,pNPG),分析纯,Amresco 公司;各种酚类物质标准品均为色谱纯,Sigma公司其余试剂均为分析纯。
1.2 仪器与设备
DHL-B型电脑恒流泵,上海青浦沪西仪器厂;BSZ-100型自动部分收集器,上海琪特分析仪器有限公司;RE52-AA型旋转蒸发器,上海亚荣生化仪器厂;JC-LDGZ-12S型冷冻干燥机,青岛聚创环保有限公司;LC-20A型高效液相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 紫山药粗多酚的制备
将紫山药洗涤后,切片冷冻干燥,研磨成粉末后过100目筛备用。取100 g紫山药粉于10 L提取罐中,加入7 L蒸馏水,60 ℃条件下浸提2.5 h,过滤去渣后将溶液浓缩至100 mL,加入400 mL无水乙醇,放入4 ℃冰箱内静置24 h后过滤除去絮状沉淀,收集滤液浓缩后,置于冷冻干燥机内干燥48 h,得到紫山药粗多酚备用。
1.3.2 大孔树脂的筛选
大孔树脂预处理和筛选参考杨希娟等[12]的方法略作修改,将一定量的大孔树脂预处理后风干备用,称取5种大孔树脂各1 g,置于5个250 mL的三角瓶中,分别加入200 mL、0.91 g/L的紫山药粗多酚溶液,在室温下于120 r/min振荡12 h后,测定多酚浓度,过滤取出吸附饱和的树脂,放入5个250 mL三角瓶中,分别加入50%的乙醇溶液200 mL,振荡解吸12 h后测定多酚浓度。根据公式(1)和公式(2)分别计算树脂的吸附率和解吸率[14]。

(1)

(2)
式中:C0,吸附前溶液中多酚质量浓度,g/L;C1,吸附平衡后溶液中剩余多酚的质量浓度,g/L;C2,解吸平衡后溶液中多酚的质量浓度,g/L。
1.3.3 AB-8树脂静态吸附-解吸试验
1.3.3.1 吸附时间确定
准确称取AB-8树脂1 g,放入5个250 mL的三角瓶中,分别加入200 mL、2.0 g/L的紫山药粗多酚溶液。在室温下于120 r/min下振荡,每隔1 h测定各三角瓶中溶液多酚浓度,计算吸附率。
1.3.3.2 多酚浓度对大孔树脂吸附率的影响
参考巫永华等[14]的方法略作修改,准确称取6份AB-8树脂各1 g,将其放入6个250 mL的三角瓶中,加入200 mL质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.0 g/L 的紫山药粗多酚溶液,在室温下于120 r/min下振荡4 h,测定各三角瓶中溶液多酚浓度,计算吸附率。
1.3.3.3 pH值对吸附率的影响
准确称取7份AB-8树脂各1 g,分别放入7个250 mL的三角瓶中,分别加入200 mL、2.0 g/L的不同pH值的紫山药粗多酚溶液(pH= 2.0、3.0、4.0、5.0、6.0、7.0、8.0),在室温下于120 r/min振荡4 h,测定各三角瓶中溶液多酚浓度,计算吸附率。
1.3.3.4 乙醇浓度对解吸率的影响
参考巫永华等[14]的方法略作修改,准确称取8份AB-8树脂各1 g,放入8个250 mL的三角瓶中,分别加入200 mL、2.0 g/L 的紫山药粗多酚溶液,在室温下于120 r/min下振荡4 h,测定各三角瓶中溶液多酚浓度,抽滤取出树脂后,再放入8个250 mL的三角瓶中,分别加入20%、30%、40%、50%、60%、70%、80%、90%的乙醇溶液200 mL,振荡解吸12 h后,测定各三角瓶中溶液多酚浓度,计算解吸率。
1.3.4 AB-8树脂动态吸附-解吸试验
1.3.4.1 上样流速对树脂吸附效果的影响
将适量的AB-8大孔树脂湿法填充入25 mm×300 mm的色谱柱中,用蒸馏水冲压至平衡无气泡。用质量浓度为2.0 g/L的紫山药粗多酚,分别以0.5、1.0、1.5 mL/min的流速进行上样,底部收集流出液,自动收集器设定每管5 mL,每管吸取0.1 mL溶液测定其多酚的浓度。
1.3.4.2 洗脱流速对解吸率的影响
大孔树脂吸附饱和后,以50%(体积分数)的乙醇为洗脱剂,分别以0.6、1.2、1.8 mL/min的流速洗脱,底部收集流出液,自动收集器设定每管5 mL,每管吸取0.1 mL溶液测定其多酚的浓度。
1.3.5 总酚含量的测定
参考LUENGO[15]的方法略作修改。配制质量浓度为0.10 g/L的没食子酸标准液,绘制标准曲线,其回归方程为y=0.792 6x+0.009 4,R2=0.999 4。测定样品中多酚含量时,按照作标准曲线的方法进行操作,根据回归方程计算样品中多酚浓度。
1.3.6 α-葡萄糖苷酶的抑制活性测定
参照GHANI等[16]的方法略作修改,具体如下:96微孔板反应体系中加入40 μL的α-葡萄糖苷酶溶液,然后加入不同待测样品40 μL,置于37 ℃的恒温水浴锅中反应10 min,再加入pNPG溶液40 μL,然后恒温孵育30 min,再加入120 μL 0.2 mol/L的碳酸钠溶液终止反应,于405 nm处检测吸光度值,计算其IC50。
(3)
式中:A0,酶与底物反应后的吸光值;A1,加入样品后酶与底物反应的吸光值;A2,样品自身吸光值。
1.3.7 不同洗脱剂洗脱组分的α-葡萄糖苷酶的抑制活性
分别用50%的乙醇、三氯甲烷和乙酸乙酯作为洗脱剂,洗脱饱和吸附紫山药粗多酚的树脂柱,收集不同的洗脱组分,分别测定不同洗脱组分的α-葡萄糖苷酶活性抑制率,以阿卡波糖为阳性对照,以粗多酚作为阴性对照。
1.3.8 高效液相色谱法分析紫山药多酚单酚成分
准确称取一定量的儿茶素、山奈酚、槲皮素、芦丁、没食子酸、表儿茶素、阿魏酸、绿原酸、咖啡酸标准品,用甲醇配制成质量浓度为0.4 g/L的单一标准液,各取200 μL混合,再用0.22 μm滤膜过滤后用于HPLC检测。
分析条件:依利特 C18色谱柱(100 mm×4.6 mm,5 μm);柱温:30 ℃,紫外检测波长280 nm,进样量:10 μL,流速:1.0 mL/min。流动相梯度洗脱程序:A:甲醇;B:0.1%冰乙酸;流动相梯度:0 min(85%B),10 min(75%B),25 min(65%B),35 min(55%B),60 min(5%B)。
1.4 数据处理
试验数据采用SPSS 21.0进行分析,采用Origin 2019b制图。做3次平行测定,结果以平均值±标准差(x±SD)表示。
2 结果与分析
2.1 最佳树脂的筛选
由图1可知,不同的树脂对紫山药多酚的吸附能力差异较大,NKA-9吸附率最高,为77.3%,而AB-8吸附率为72.2%,二者差异不明显(P>0.05),D101吸附率最低,仅为52.2%。从解吸效果上看,D101解吸率最高,为89.6%,AB-8的解吸率为87.7%,二者差异不明显(P>0.05),D4006解吸率最低,为69.3%。不同的大孔树脂由于其极性、比表面积和孔径等不同,对天然产物会表现出不同的吸附和解吸性能[14]。NKA-9具有较高的吸附率,但解吸率较低。D101解吸率高,但吸附率较低。综合比较考虑,AB-8树脂保持了较高的吸附率,同时又具有较高的解吸率。所以,选择AB-8树脂分离纯化紫山药多酚较为合适。

图1 五种大孔树脂的吸附-解吸效果比较Fig.1 Comparison of adsorption and desorption properties of five resins注:不同字母表示组间差异显著(P<0.05)(下同)
2.2 静态吸附、解吸试验结果
2.2.1 AB-8树脂的静态吸附曲线
由图2可知,在AB-8大孔树脂吸附紫山药多酚的过程中,吸附时间小于4 h时,吸附率与吸附时间呈明显的正相关性。但当吸附时间超过4 h,吸附率的增加放缓,这是由于树脂对于紫山药多酚的吸附接近饱和状态。因此,选定AB-8树脂对于紫山药多酚的静态吸附时间为4 h,此时吸附率为85.43%。

图2 AB-8树脂静态吸附曲线Fig.2 Static adsorption curve of AB-8 resin
2.2.2 样品浓度对AB-8树脂吸附率的影响
由图3可知,在质量浓度低于2.0 g/L时,紫山药多酚质量浓度与吸附率呈正相关,质量浓度为2.0 g/L时吸附率最大,浓度继续增大,吸附率有所降低。在一定质量浓度范围内,浓度增加有利于酚类物质分子与树脂的接触,提高树脂的吸附率,但是浓度过高溶液黏度增加,流动性降低,且体系中相关杂质也会增加,不利于酚类物质与树脂的接触,从而降低了吸附率[17]。因此,选择多酚质量浓度为2.0 g/L作为分离纯化的上样浓度,此时吸附率为89.33%。

图3 样品浓度对AB-8树脂吸附率的影响Fig.3 Effect of sample concentration on adsorption rate of AB-8 resin
2.2.3 样品溶液pH对AB-8树脂吸附率的影响
由图4可知,溶液的pH值为2~5时,AB-8树脂对紫山药多酚的吸附率与溶液的pH值呈正相关,样品液的pH值为5时吸附率最高,此时吸附率为91.97%。当pH继续升高时,吸附率反而降低。多酚是一类含有羟基的化合物,pH的大小直接影响酚类物质在溶液中的状态[18]。紫山药多酚溶液在弱酸性环境下较稳定,有利于AB-8树脂对酚类物质的吸附,当溶液酸性减弱时,更多的酚羟基电离,致使酚类物质与大孔树脂间的作用减弱,从而降低了大孔树脂对多酚的吸附能力,导致吸附率降低[19]。
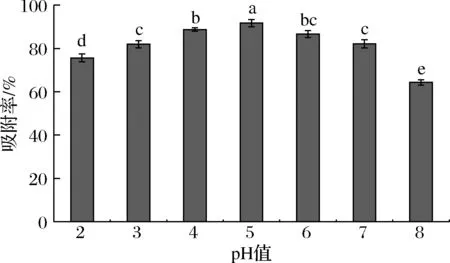
图4 pH值对AB-8树脂吸附率的影响Fig.4 Effects of pH value on absorption rate of AB-8 resin
2.2.4 乙醇浓度对解吸率的影响
由图5可知,乙醇体积分数为20%~90%时,解吸率呈现先增后降的趋势,当乙醇的体积分数为50%时,其对紫山药多酚的解吸率最大,为87.7%。乙醇水溶液对多酚的解吸率与其极性有关,随着乙醇浓度的增大,其极性降低,当乙醇体积分数为50%时,紫山药中酚类物质的极性可能与此时溶液的极性更相近,更多的酚类物质被解吸下来。因此,选择50%的乙醇作为解吸剂较为适宜。

图5 乙醇体积分数对AB-8树脂解吸率的影响Fig.5 Effect of ethanol volume fraction on desorption rate of AB-8 resin
2.3 动态吸附-解吸试验结果
2.3.1 动态吸附曲线
由图6可知,上样流速对AB-8树脂吸附有较大影响,随着样品流速的增大,泄漏点出现的时间越早,树脂的吸附量越少,这个可能与流速过大会导致吸附的多酚重新被洗脱下来有关[20]。当样品流速分别为0.5、1.0、1.5 mL/min时,泄露点分别在110、80、40 mL时出现,此时的吸附量分别为198、144、72 mg。试验结果表明,上样流速越慢,树脂吸附的多酚越多,为了提高整个树脂吸附效率,缩短分离纯化时间,上样流速为1.0 mL/min较为适宜。

图6 上样流速对吸附效果的影响Fig.6 Effect of loading velocity on adsorption
2.3.2 动态洗脱曲线
由图7可知,洗脱速度为0.6 mL/min时,洗脱液的浓度峰值出现在第4管,酚类物质主要集中在1~12管;而流速为1.2、1.8 mL/min时,洗脱液的浓度峰值均在第6管,但后者的洗脱液浓度峰值较低,酚类物质分别集中在1~14管与1~17管,由此可见,以流速为1.2 mL/min洗脱时,酚类物质洗脱的较为集中且耗时短。一般来说,洗脱液的流速慢有利于洗脱剂与树脂上的多酚接触从而充分解吸,但如果流速过慢,会导致解吸的时间过长,流动过程中一些被洗脱下来的多酚可能会被重新吸附[21],而洗脱液的流速过快时,会导致洗脱剂与树脂接触时间过短,洗脱剂不能充分解吸多酚,拖尾现象严重,降低生产效率[21]。因此,选择1.2 mL/min的洗脱流速较为适宜,在此条件下,洗脱液体积为104 mL,多酚回收率为72.7%,多酚纯度由13.91%提升到59.06%,纯度提高了3.25倍。

图7 洗脱流速对解吸效果的影响Fig.7 Effect of elution velocity on desorption
2.4 不同溶剂洗脱组分对α-葡萄糖苷酶活性的抑制作用
α-葡萄糖苷酶是一种重要的碳水化合物水解酶,抑制α-葡萄糖苷酶的活性能有效减少碳水化合物的水解,降低肠道对葡萄糖的吸收,从而降低血糖浓度,对于治疗和预防糖尿病具有重要的意义[22]。分别用50%乙醇、乙酸乙酯和三氯甲烷作为洗脱剂,获得了3种洗脱组分,测定了其对α-葡萄糖苷酶活性的抑制效果。结果如图8所示,在一定的质量浓度范围内,样品浓度与α-葡萄糖苷酶的抑制率呈正相关,但不同洗脱溶剂洗下来的多酚组分对α-葡萄糖苷酶活性的抑制作用差异较大,由图8可知,乙酸乙酯洗脱组分>50%乙醇洗脱组分>三氯甲烷洗脱组分。由表1可知,乙酸乙酯洗脱组分对α-葡萄糖苷酶的抑制活性的IC50值最小,为0.126 g/L,50%乙醇的IC50值为0.216 g/L,而三氯甲烷的IC50值为14.69 g/L。由此可见,乙酸乙酯洗脱组分中含有较多的抑制α-葡萄糖苷酶活性的成分。

图8 不同溶剂洗脱物的α-葡萄糖苷酶的抑制能力Fig.8 The α-glucosidase inhibition ability of eluted fractions with different solvents

表1 不同洗脱组分的α-葡萄糖苷酶活性抑制比较(IC50值)Table 1 Comparison of α-glucosidase inhibition of eluted fractions with different solvents (IC50value)
2.5 紫山药多酚不同洗脱组分分析
由图9可知,与标准品图谱对照,50%乙醇洗脱组分主要含有儿茶素、咖啡酸、表儿茶素、阿魏酸、芦丁和槲皮素;乙酸乙酯洗脱物中主要含有绿原酸、表儿茶素、阿魏酸、芦丁和槲皮素;三氯甲烷含有没食子酸,其他未知。有研究表明,绿原酸[23]、槲皮素[24]、芦丁等具有α-葡萄糖苷酶抑制活性,且芦丁[25]对α-葡萄糖苷酶的抑制作用较强,这与实验得出的乙酸乙酯洗脱组分具有较强的α-葡萄糖苷酶抑制活性相一致。

1-没食子酸;2-儿茶素;3-绿原酸;4-咖啡酸;5-表儿茶素;6-阿魏酸;7-芦丁;8-槲皮素;9-山奈酚a-标准品;b-50%乙醇洗脱物;c-乙酸乙酯洗脱物;d-三氯甲烷洗脱物图9 标准品和不同洗脱组分的高效液相色谱图Fig.9 The HPLC results of polyphenols standard,and eluted fractions with different solvents
3 结论
(1)AB-8大孔树脂较适于紫山药多酚分离纯化,其分离纯化工艺为:静态吸附4 h,溶液pH为5.0,上样质量浓度为2.0 g/L,上样流速为1.0 mL/min;用50%(体积分数)的乙醇作为洗脱剂,在流速为1.2 mL/min时洗脱,收集洗脱液体积104 mL,此时多酚回收率为72.7%,多酚纯度由13.91%提升到了59.06%,纯度提高了3.25倍。
(2)比较了50%(体积分数)乙醇、乙酸乙酯和三氯甲烷洗脱组分的α-葡萄糖苷酶抑制活性,乙酸乙酯洗脱组分具有最强的α-葡萄糖苷酶抑制活性,其抑制率达到91.92%,经高效液相色谱分析其主要含有芦丁、绿原酸、表儿茶素、阿魏酸和槲皮素,试验结果为紫山药多酚降血糖的研究提供了基础数据,后续研究进一步分离单组分,采用质谱、核磁共振对其结构进行鉴定,明确其功能。

