人多能干细胞来源的肾定向分化平台的构建
周冰蕊, 魏云亮, 梁 婷, 何 生, 冯志伟, 靳 宁, 刘志贞,赵 虹, 侯淑琳, 于保锋, 解 军*
(1)山西医科大学 生物化学与分子生物学教研室 出生缺陷与细胞再生山西省重点实验室;2)山西医科大学 第一医院影像科,太原 030001)
肾是人体重要的器官之一,具有调节体内电解质平衡、排出代谢废物等重要的生理学功能。有研究发现,成人的肾一天可以过滤近150 L的液体[1]。世界范围内,慢性肾疾病的患病率为5%~13%[2]。随着我国人口老龄化,以及肥胖、高血压、糖尿病等疾病发病率逐年增加,我国肾疾病的患病人数呈现逐年上升的态势。慢性肾疾病已经成为严重危害公共健康的问题。肾元(肾单位)作为肾的基本结构和功能单位,在肾疾病发病过程中逐渐地且不可逆地减少。肾元由肾小体和肾小管构成,肾小体可将流经它的血液进行过滤,形成原尿,通过由多种管腔组成的肾小管系统进行重吸收,而最终形成尿液。由于构成肾的细胞类型的多样性以及肾结构的复杂性,导致在体外建立肾元极具挑战。因此,通过多能干细胞体外诱导分化建立肾元,是一种模拟肾早期发育,建立肾疾病模型,进行药物筛选的新策略。
多能干细胞是一类具有无限增殖能力和多种分化潜能的细胞。1998年获得的第一株人胚胎干细胞(human embryonic stem cell,hESC)[3]和2006年建立的人诱导多能干细胞(induced pluripotent stem cell,iPSC)[4]都属于多能干细胞的范畴。干细胞体外定向诱导分化技术的兴起为多种疾病进行细胞治疗提供了极具潜力的细胞来源。目前,已经有多个研究小组报道,将多能干细胞体外诱导分化成为多种类型的细胞,例如心肌细胞[5-7]、胰岛β细胞[8-10]、骨骼肌细胞[11]、神经细胞[12]、肝细胞[13, 14]和视网膜色素上皮细胞等[15, 16]。并且,从ES或者iPSC分化得到的细胞已被用于多种疾病的临床研究,例如帕金森疾病[17]、 I型糖尿病[18]等。
追溯肾元的细胞来源,发现它是来源于原条后段部分的一群细胞,这群细胞之后会发育成为后端中胚层的一部分,随着发育的进展,形成后肾间叶组织,产生肾的祖细胞,最终发育成肾元的各个组成部分。有一些研究小组已经可以将小鼠或者人的多能干细胞定向诱导分化到肾细胞。但是,已经发表的一些将多能干细胞诱导至肾细胞的方法具有局限性,例如分化过程中需要使用一些成分不明确的材料(例如小鼠胚胎的脊髓)[19];或者分化形成不成熟的肾元萌芽结构[19, 20]。本文通过在体外条件下模拟肾的发育过程,建立了一种体外诱导分化方法,可将人多能诱导干细胞(包括人胚胎干细胞和人诱导多能干细胞)逐步诱导成原条、后端中间中胚层、肾的祖细胞,最终形成肾元结构。此方法分化效率高、稳定性好和可重复性强,可为后期开展研究肾的早期发育、肾疾病模型构建以及药物筛选等研究提供基础。
1 材料与方法
1.1 细胞来源
本研究中使用的人胚胎干细胞从国家干细胞资源库获得,人诱导多能干细胞购自北京塞贝生物。本试验的所有流程已经通过山西医科大学学术伦理委员会许可。
1.2 试剂和仪器
主要试剂及耗材:mTesR培养基(85850,加拿大 STEMCELL Technologies公司)、Accutase分散酶(7920,加拿大 STEMCELL Technologies公司)、DMEM/F12培养基(C11330500BT,美国 Gibco公司)、Advanced RPMI1640培养基(12633-012,美国Gibco公司)、Dispase(04942078001,德国Roche公司)、CHIR99021(SML1046,美国 Sigma公司)、Y-27632(72304,加拿大 STEMCELL Technologies公司)、SB431542(S4317,美国 Sigma公司)、FGF9(100-23-500UG,美国PeproTech公司)、基质胶(356237,美国Corning公司)、细胞培养板(3516,美国Corning公司)、RNA提取试剂Tirzol(15596026,美国Invitrogen公司)、反转录试剂盒(RR037A,日本Takara公司)、荧光定量试剂盒(RR820A,日本Takara公司)。免疫荧光染色所用的抗体:NANOG(4903 S, 美国Cell Signaling Technology公司)、OCT4(75463 S,美国Cell Signaling Technology公司)、T(sc-166962,美国Santa Crue Biotechnology公司)、TBX6(SC-517027,美国Santa Crue Biotechnology公司)、WT1(sc-7385,美国Santa Crue Biotechnology公司)、HOXD11(18734-1-AP,美国Proteintech公司)、SIX2(11562-1-AP,美国Proteintech公司)、CDH1(610181,美国BD Biosciences公司)、PODXL(AF1658,美国R&D Systems公司)、SALL1(PP-K9814-00,日本Perseus Proteomics Inc公司)、LTL(FL-1321,美国vector laboratories公司)、DAPI(ab104139,英国Abcam公司)。试验所用二抗均购自美国Thermo Fisher公司。
主要仪器包括:CO2培养箱(Eppendorff公司,型号:CellXpert C170)、生物安全柜(海尔,HR1500-IIA2-X)、离心机(Eppendorff公司,型号5702R)、荧光倒置相差显微镜(尼康,型号Ti2-U)、PCR仪器(Thermo Fisher,型号QuantStudio3)、激光共聚焦显微镜(Olympus,型号FV1000)、流式细胞仪(Becton Dickinson,型号BD FACSCelesta)。
1.3 干细胞维持培养
将人胚胎干细胞或者人诱导多能干细胞在包被过基质胶的细胞培养板中置于37 ℃ 5% CO2培养箱进行培养,使用mTesR培养基。细胞密度达到80%时,严格按照说明书使用分散酶(dispase)进行消化处理,并按照1∶10进行传代。
1.4 肾的分化
将生长状态良好的干细胞用Accutase分散酶进行消化,制备成单细胞悬液后,加入10 μmol/L Y27632,并按照1.5~2.0×104/cm2细胞密度接种细胞。在5% CO2培养箱中以37℃培养24 h后换液,继续培养48 h。待细胞长到50%密度时(分化第0 d),在分化培养液Advanced RPMI中加入WNT信号通路激活剂CHIR-99021(10 μmol/L)和TGF-β信号通路抑制剂SB431542(1 μmol/L),每天换液。96 h后(分化第4 d),使用分化培养液Advanced RPMI,继续培养72 h,每天换液。分化第7 d,在分化培养液Advanced RPMI中加入50 ng/mL的FGF9,培养48 h,每天换液。分化第9 d在分化培养液Advanced RPMI中加入50 ng/mL的FGF9和3 μmol/L CHIR-99021。分化到第11 d时,将细胞换至Advanced RPMI中加入50 ng/mL的FGF9继续培养,每天换液。
1.5 细胞免疫荧光检测
将细胞用4 %多聚甲醛进行固定,10 min后弃掉多聚甲醛溶液,加入封闭液室温30 min进行封闭处理。加入稀释后的一抗,放置在摇床上4 ℃孵育过夜。PBS清洗3次,加入稀释后的二抗置于摇床上,室温2 h。用PBS清洗3次,滴加DAPI进行细胞核染色,室温避光放置5 min。加入防荧光猝灭封片剂进行封片。待片子干燥后,使用荧光共聚焦显微镜进行数据收集。
1.6 细胞生物标记物基因表达检测
严格参照RNA提取试剂Trizol说明书进行细胞总RNA提取。使用核酸浓度测定仪器检测提取的RNA浓度及纯度。用Takara的反转录试剂盒将RNA反转录为cDNA。使用TaKaRa的荧光定量试剂盒对目的基因的表达水平进行检测。目的基因引物序列见Table 1。引物委托上海生工股份有限公司合成。

Table 1 Primer list for qPCR
1.7 肾的祖细胞流式细胞检测
将分化至第10 d处于肾的祖细胞阶段的细胞,用Accutase分散酶于 37 ℃消化处理5 min,以制备成单细胞悬液。加入4 %多聚甲醛固定后,用PBS清洗1次,离心去上清液后,加入稀释好的肾的祖细胞标志物SIX2和SALL1室温孵育30 min。用PBS清洗1次后,离心去上清液,加入稀释后的二抗室温孵育30 min。用PBS清洗1次后,离心去上清液,加入适量PBS,使用流式细胞仪进行检测。
1.8 统计学方法
本试验全部统计数据采用平均数±标准差表示。所有试验进行3次或3次以上重复,使用Graphpad统计软件进行单因素方差分析,P<0.05表示统计学差异显著。
2 结果
2.1 干细胞形态观察与鉴定
光镜下干细胞集落呈现不规则圆形,细胞紧密排布,边缘折光率较高。细胞集落表面光滑平整,无褶皱。通过对干细胞多能性的生物标志物进行免疫荧光检测发现,多能性标志物NANOG和OCT4有明显表达(Fig.1)。该结果表明,细胞状态良好,可进行下一步的肾体外分化研究。
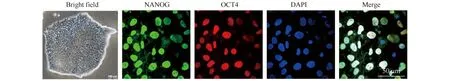
Fig.1 Stem cell colony morphology and pluripotent markers expression The first picture on the left showed pluripotent stem cell colony under bright field. Pluripotent markers (NANOG and OCT4) were tested by immuno-staining. The immuno-staining pictures were captured by laser scanning confocal microscope. The immuno-staining showed high expression of NANOG and OCT4 in pluripotent stem cells used in this study
2.2 干细胞定向分化至原条
在分化第一步,即干细胞从多能态诱导至原条阶段。首先使用不同浓度的WNT信号通路激活剂CHIR99021(5 μmol/L,8 μmol/L,10 μmol/L,12 μmol/L)对多能干细胞进行处理。结果如Fig.2C显示,干细胞在只添加WNT信号通路激活剂CHIR99021的条件下,只有极少数细胞分化为原条(T阳性,TBX6阳性)。经过筛选,在同时添加WNT信号通路激活剂CHIR99021和TGF-β信号通路抑制剂SB431542处理的条件下,可成功将绝大多数干细胞从多能态诱导分化至原条阶段(Fig.2 D)。将分化结果进行横向比较发现,CHIR99021(10 μmol/L)联合SB431542(1 μmol/L)的原条诱导效果优于单独使用CHIR99021对原条的诱导(Fig.2B-D)。荧光定量PCR结果显示(Fig.2E),原条的生物标志物T和TBX6在分化至第4 d时,基因表达量最高。综上所述,多能干细胞在CHIR99021和SB431542的作用下,第4 d时,已经诱导分化至原条状态,且在所有测试条件中诱导效果最佳。
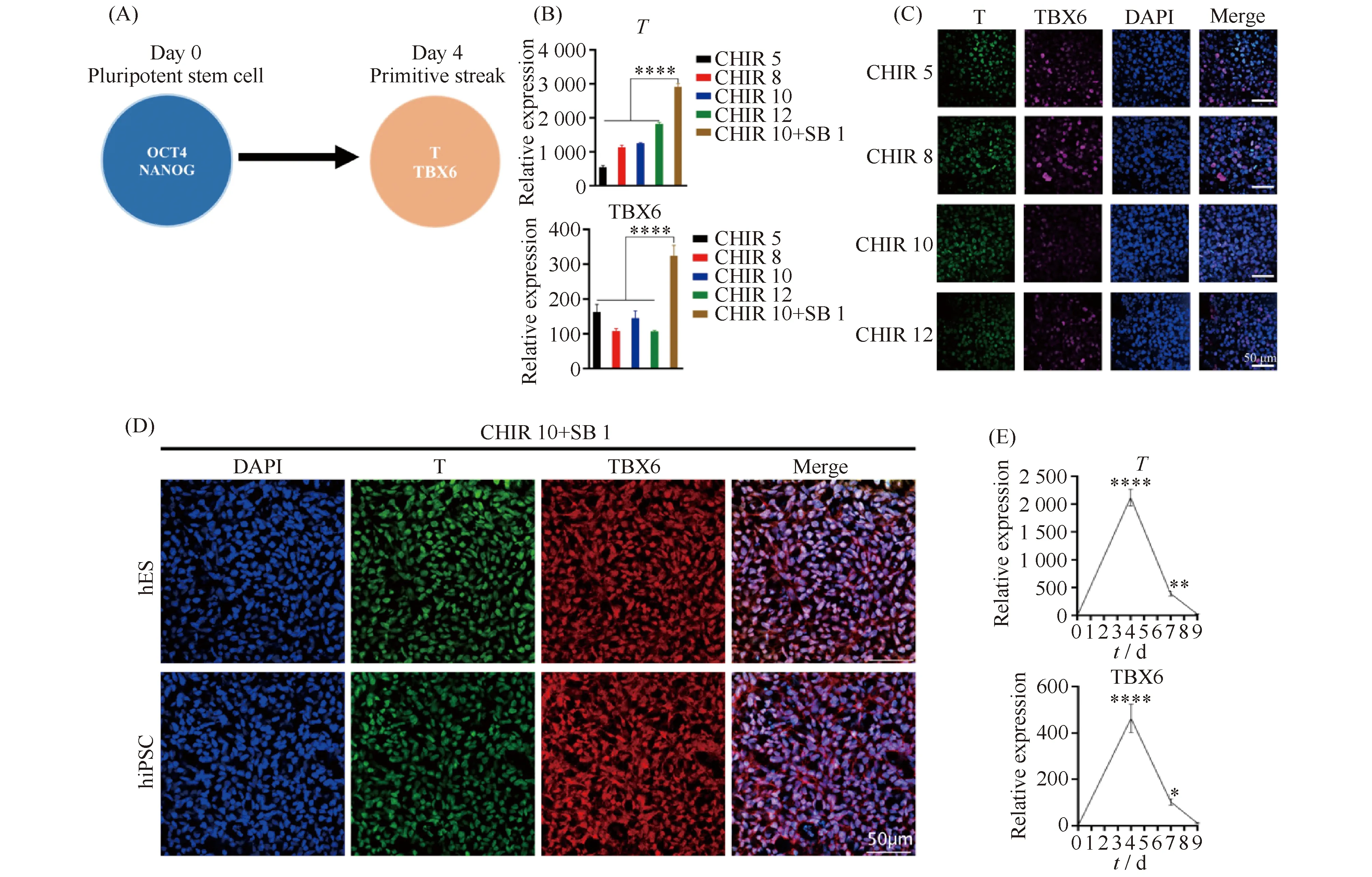
Fig.2 Inducing pluripotent stem cell into primitive streak (A) Schematic of the kidney differentiation in first four days. (B) The gene expression of primitive streak markers under different conditions at day 4 (CHIR99021 of 5 μmol/L, 8 μmol/L, 10 μmol/L, 12 μmol/L, and 10 μmol/L CHIR99021 with 1 μmol/L SB431542). (C) Immunol staining of T and TBX6 under CHIR99021 concentration gradient (5 μmol/L, 8 μmol/L, 10 μmol/L, 12 μmol/L) at day 4. (D) Immunol staining of T and TBX6 under combination condition of CHIR99021(10 μmol/L) and SB431542(1 μmol/L) in hES and hiPSC. (E) Time course analysis of gene expression of primitive steak markers (T and TBX6) from day 0 to day 9. The data were analyzed using GraphPad Prism version 8.0 and one-way ANOVA. *P < 0.05,****P < 0.0001
2.3 原条定向分化至中间中胚层
分化至第7 d,对中间中胚层的细胞标记物HOXD11和WT1进行免疫荧光检测。结果如Fig.3B所示,HOXD11和WT1在分化第7 d的细胞中高表达。Fig.3为中间中胚层的标记物HOXD11,WT1和OSR1的基因表达水平,在分化至第7 d时显著增加(P< 0.0001)。表明细胞分化在第7 d时已经处于中间中胚层状态。

Fig.3 Deriving intermediate mesoderm from primitive streak (A) Schematic of kidney differentiation between day 4 to day 7. (B) Immunol staining of intermediate mesoderm markers (HOXD11 and WT1) at day 7 in hES and hiPSC. (C) Time course analysis of gene expression of intermediate mesoderm markers (HOXD11, WT1 and OSR1) from day 0 to day 9. The data were analyzed using GraphPad Prism version 8.0 and one-way ANOVA. ***P < 0.001,****P < 0.0001
2.4 肾的祖细胞的获得
分化第7 d到分化第9 d(Fig.4A),在FGF9的作用下细胞由中间中胚层进一步分化至肾的祖细胞阶段。如Fig.4B免疫荧光染色结果所示,分化至第9 d,肾的祖细胞标记物SIX2和SALL1表达,第10 d,SIX2和SALL1表达增多,到第12 d,SIX2和SALL1的表达明显减弱,甚至消失。正如Fig.4C荧光定量PCR所示,SIX2、SALL1和OSR1的基因表达在第9 d时,也显著增加(P< 0.0001)。表明体外分化至第9 d时,细胞已经处于肾的祖细胞阶段。本文将分化至第10 d的细胞进行流式细胞检测。如Fig.4 D所示,hES和hiPSC来源的肾祖细胞SIX2和SALL1双阳性的细胞,占比分别为61.9%和51.5%。

Fig.4 Differentiation into kidney progenitor cells (A) Schematic of kidney differentiation between day 7 to day 9. (B) Immunol staining of nephron progenitor markers: SIX2 and SALL1 at day 9, day 10 and day 12. (C) Time course analysis of gene expression of nephron progenitor markers (SIX2, SALL1 and PAX2) from day 0 to day 9. The data were analyzed using GraphPad Prism version 8.0 and one-way ANOVA. *P < 0.05, ****P < 0.0001. (D) FACS analysis of nephron progenitors in hES and hiPSC
2.5 肾单位的结构鉴定
结果如Fig.5A所示,分化至第21 d光镜下可观察到三维的肾单位结构。进行免疫荧光染色结果如Fig.5B所示。本文获得的结构中包含近端小管(LTL阳性)、远端小管(CDH1阳性)以及构成的肾小球的足细胞(PODXL阳性)。

Fig.5 Bright field and structure validation of kidney nephron (A) Bright field picture of nephron structure at day 21. (B) Immunol staining of nephron structure at day 21. CDH1 is the marker of distal tubule. PODXL is the marker of podocyte. LTL is the marker of proximal tubule
3 讨论
本文建立了一种将人多能干细胞定向诱导分化成为肾元结构的方法。分化得到的三维结构中包含肾元的基本结构,例如足细胞构成的肾小球,以及由近端小管和远端小管构成的肾小管结构。
3.1 从多能干细胞建立后端原条
Ramzy等[18]和Taguchi等[19]使用WNT信号通路激活剂CHIR99021,从而激活β-联蛋白信号通路,将多能干细胞诱导至原条阶段。然而,经过多次试验,本文用不同浓度的CHIR99021(5 μmol/L,8 μmol/L,10 μmol/L,12 μmol/L)处理,表达原条生物标记T和MixL1的细胞比例较低,最终导致肾的分化失败。通过筛选,本文发现,同时激活WNT信号通路和抑制TGF-β信号通路,能将人多能干细胞高效地诱导至原条阶段。
3.2 从后端原条建立后端中间中胚层
Takasato 等[20]建立的肾分化方法中,需要对原条阶段的细胞添加Activin A来诱导其分化成为中间中胚层。然而,在本文的体系中,多能干细胞诱导至原条后,在不添加任何诱导因子的情况下,原条可以自发分化到中间中胚层。表明用本分化方法获得的T和MixL1双阳性的原条细胞,其分化命运已经被决定,可以自发分化成为中间中胚层。
3.3 生成肾的祖细胞
FGF9被用来诱导中间中胚层的细胞继续向肾的祖细胞分化。与之前发表的一些分化方法:例如使用小鼠胚胎脊髓[19]或者200 ng/mL的FGF9[21]相比,本文使用成分明确的较低剂量的FGF9(50 ng/mL)。本文建立的分化方法,适用于胚胎干细胞和诱导多能干细胞的肾定向诱导分化。在人胚胎干细胞中的分化效率可以达到61.9%,而在人诱导多能干细胞中分化效率达到51.5%。
3.4 肾元结构
肾是一种复杂的器官,包含多种细胞和结构。多样的细胞类型是其完成复杂生理功能的基础。本文使用人多能干细胞为初始材料,经过定向诱导分化,在光镜下能明显可见簇状的三维立体的肾元结构。免疫荧光标记的结果显示,这些结构中包含构成肾小球的祖细胞(PODXL阳性)、近端小管(LTL阳性)和远端小管(CDH1阳性)等肾的结构。以上结果表明,本体外诱导分化方法可以成功将人多能干细胞诱导为肾元。
本研究结果表明,使用不同的人多能干细胞并且进行多次分化实验,本方法均能将细胞从多能态诱导分化成肾的细胞类型,并形成肾元结构。且具有较高的分化效率和稳定的分化结果。本分化平台可以用于后续研究肾的早期发育机制和建立肾疾病模型。
- 中国生物化学与分子生物学报的其它文章
- DeepCKI:一个基于变分图自编码器预测细胞-细胞因子相互作用的生物信息学模型
- 半翻转生物化学教学模式对学生学业成绩和自我认知的影响
- 泛素样蛋白UBQLN2通过抑制结肠癌Wnt信号通路发挥抑癌作用
- 两种表达系统来源新冠病毒RBD蛋白免疫小鼠后的IgG抗体水平对比研究
- Potent Anti-bacteria Activity of Tamsulosin Hydrochloride and Ningmitai Capsule in Combination by Regulating the Gene Expression Related to β-Lactamase, Hemolysis, and Virulence
- 利拉鲁肽抑制高糖诱导的小鼠胰岛细胞损伤

