运动调控昼夜节律在抗肌萎缩中的作用
黄杰轮, 梁计陵, 陈 宁
(1)武汉体育学院研究生院,武汉 430079; 2)武汉体育学院健康科学学院,运动训练监控湖北省重点实验室,天久运动营养食品研发中心, 武汉 430079)
骨骼肌作为人体最大的外周组织,约占体重的40%,主要负责机体运动、代谢以及分泌相关肌肉因子调控其他脏器,其质量受多种因素影响,例如运动和疾病等[1]。随着应用科学技术和卫生保健服务的进步,促进了人类寿命的延长。据报道显示,截至2019年,全球65岁以上的人口约有7.03亿;而到2050年,这一数字将达到15亿[2]。由于老年人口的逐年递增,伴随而来的慢性疾病给医疗保健系统造成极大的压力,肌萎缩作为常见的慢性疾病之一,正逐渐成为不可忽视的公共卫生问题。目前,骨骼肌萎缩的诱因复杂,包括营养、遗传因素、激素改变、慢性炎症和运动量减少等;其主要是病理机制表现为细胞蛋白质合成与降解失衡、细胞自噬功能低下、线粒体功能障碍、细胞凋亡增加以及肌卫星细胞功能受损等[3]。究其本质而言,主要源于骨骼肌蛋白质合成和分解净失衡,从而造成骨骼肌质量丢失而导致肌肉萎缩的发生[4]。
近年来,随着昼夜节律研究的进展,骨骼肌作为外周节律的重要组成部分,其蛋白质的合成以及能量代谢均受到昼夜节律的调节。其中,昼夜节律核心基因,例如脑和骨骼肌组织芳香烃受体核转运蛋白的类似蛋白1基因 (brain and muscle ARNT-like-1, BMAL1)和时钟基因 (clock circadian regulator, CLOCK) 的缺失会导致骨骼肌肌纤维内部结构紊乱、造成肌组织病变,影响线粒体的功能和肌肉的质量与力量[5]。与此同时,运动作为目前防治肌萎缩的有效干预手段,相关研究提示,运动也是昼夜节律的重要输入信号,其可通过调控昼夜节律的相位,从而发挥维持骨骼肌质量的作用[6]。为此,本文从运动调控昼夜节律的角度进行阐述,探究昼夜节律调节骨骼肌萎缩的作用及其潜在的分子机制,以期为骨骼肌萎缩的预防、治疗及康复提供新的思路和干预策略。
1 昼夜节律相关的分子机制
昼夜节律是指生命体为适应外界光-暗循环变化表现出的以24 h为周期变动的内源性节律。昼夜节律可以在无外源性时间信号输入时维持24 h的周期,在光暗、运动、温度等外部信号输入后,昼夜节律的相位会发生一定程度的改变。目前,昼夜节律分为核心节律和外周节律两种调控。其中,核心节律位于下丘脑的视交叉上核 (hypothalamic suprachiasmatic nucleus, SCN),光线对视神经刺激后传递至视交叉上核,随后转化为神经或化学信号进而对外周节律进行驱动,这一过程即为昼夜节律的输入、振荡与输出[7]。而核心生物钟基因主要由BMAL1、CLOCK、周期基因(period, PERs)以及隐花色素基因(cryptochrome, CRYs) 等组成。昼夜节律周期起始阶段,转录激活因子CLOCK和BMAL1促进周期基因(PER1,PER2)和隐花色素基因(CRY1,CRY2)的转录表达[8]。PER和CRY基因产物积累,二聚化形成PERs-CRYs复合物,该复合物易位到细胞核中与CLOCK和BMAL1相互作用,抑制其转录[9]。当PERs-CRYs复合物浓度下降后,BMAL1-CLOCK抑制作用被解除,重新开启昼夜节律的调节[10]。
外周节律的启动依赖于核心节律的输出,其对非节律性振荡存在一定的影响。昼夜节律的转录组学研究表明,时钟基因可在多个组织中表达,这表明不同组织中的外周节律都产生了组织特异性功能的生物节律[11]。其中,骨骼肌的昼夜节律受到相应昼夜节律基因转录及表达的调控,而外周节律的启动,主要是核心节律通过对内分泌、代谢等系统的调节而实现[12]。此外,相比于外周节律 (例如肝或成纤维细胞),核心节律单个时钟基因缺失的反馈更加及时,可能原因在于神经间的强通信和神经元 PAS 结构域蛋白 2(neuronal PAS domain protein 2, NPAS2)基因的表达[13]。在SCN中,BMAL1是唯一能够产生节律的基因,而在外周组织时钟中,BMAL1、PER1、CRY1和CLOCK都是节律产生所必需的[14]。综上所述,昼夜节律的周期与光线等外界信号输入存在联系,外周节律不仅受到核心节律的影响,在不同组织中的表达存在组织特异性。
2 肌萎缩病理机制
肌萎缩主要病理表现为肌纤维变细和肌纤维数量的减少导致的肌肉体积减少,而提升骨骼肌蛋白质合成水平、增加肌纤维数量,改善骨骼肌卫星细胞的激活,促进骨骼肌纤维的再生和修复是缓解骨骼肌萎缩的重要途径[15]。相关分子机制通路中,磷脂酰肌醇-3激酶 (phosphatidylinositol 3-kinase, PI3K)/蛋白质激酶B (protein kinase B, Akt)/雷帕霉素蛋白 (mammalian target of rapamycin, mTOR)信号通路主要负责蛋白质的合成。其中,胰岛素样生长因子1 (insulin-like growth factor 1, IGF-1)可促进Akt的磷酸化,增加下游mTOR的表达,上调p70核糖体蛋白S6激酶 (ribosomal protein S6 kinase, p70S6K),磷酸化真核翻译起始因子4E结合蛋白1 (EIF4E-binding protein 1, 4E-BP1),促进蛋白质翻译启始复合物的形成,从而增强骨骼肌纤维肥大,加速蛋白质合成[16]。同时,泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)和自噬溶酶体系统(autophagolysosomal system, ALS) 共同调控蛋白质降解[17]。在蛋白质降解过程中,Akt可磷酸化FoxO3a进入细胞核,降低肌肉萎缩盒F基因 (muscle atrophy F-box, MAFbx/atrogin-1)和蛋白肌肉环状指基因1 (muscle ring finger protein-1, MuRF1) 的表达,从而抑制骨骼肌蛋白质降解[4]。
与此同时,机体受损时,肌卫星细胞中Notch、整合素(integrins )和 Fzd7 (frizzled-7) 受体 Sdc-3 和 Sdc-4 表达上调,促进卫星细胞的增殖。骨骼肌卫星细胞增殖后转变为肌细胞,肌细胞受到肌源性调控因子 生肌因子5 (myogenic factor 5, Myf5)、成肌分化因子(myogenic differentiation protein, MyoD)等调控进行分化[18]。此外,细胞自噬功能障碍与炎症诱导的凋亡同样可以影响着肌萎缩的发生与发展。研究证实,异常的细胞自噬功能会导致细胞内物质循环和利用受到抑制,进而使衰老或损伤的细胞器不能被及时清除而造成异常堆积,从而导致体内ROS的聚集促使细胞色素c (cytochrome c, Cyt-c) 和其他细胞凋亡因子释放,诱导胱天蛋白酶(caspase)家族相关的细胞凋亡信号通路的激活,加速细胞凋亡程度影响骨骼肌内环境稳态[19]。其次,细胞凋亡的激活可诱导炎症信号通路肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)/核因子κB (nuclear factor kappa-B, NF-κB)的激活,进一步加剧骨骼肌细胞凋亡程度,形成恶性循环加速骨骼肌萎缩[20]。
3 昼夜节律与肌萎缩的关系
越来越多的证据表明,昼夜节律与肌萎缩或慢性疾病密切相关,仅在小鼠骨骼肌中就已发现1 628个基因的表达存在昼夜节律振荡,其主要功能涉及骨骼肌蛋白质降解和脂肪代谢等,而昼夜节律相关基因的缺失、周期、相位、振幅的异常均可能引起骨骼肌萎缩[21]。此外,衰老与昼夜节律的交替之间存在相互作用。例如,在衰老小鼠的肌肉干细胞中发现重新编程的振荡,从而导致应激反应有关的基因表达发生改变[22]。通过关键昼夜节律基因BMAL1缺陷小鼠的研究表明,昼夜节律基因影响寿命,并导致衰老相关疾病诱发过早衰老,寿命缩短,超过90%的动物在1年内死亡,而野生型小鼠的平均寿命为28个月[23]。
转录组近年来研究证实,昼夜节律作为一个关键因素在肌萎缩中可能愈发扮演着重要角色。其中,昼夜节律基因与骨骼肌质量的联系最早是在BMAL1基因缺陷小鼠中被发现, BMAL1-CLOCK异二聚体能直接上调骨骼肌中的Atrogin-1和MuRF1的基因水平,并在夜晚达到峰值[24]。全身性BMAL1基因敲除小鼠可出现昼夜节律紊乱,体重、寿命和肌肉量呈现不同程度降低[25]。此外,昼夜节律相关基因敲除小鼠模型中均发现,其骨骼肌蛋白质的降解程度加剧。例如,CRY1/2基因敲除后表现出细胞自噬的水平上升,其机制是细胞质中PER2未与CRY1/2结合形成PERs-CRYs复合物,最终导致PER2的积累,造成与骨骼肌萎缩中PER2的增加相一致;而PER2受到抑制时,细胞自噬水平也相应表现出低下状态[26]。此外,BMAL1抑制剂REV-ERBα可通过调节组织中的UNC-51样激酶1 (UNC-51-like kinase 1, ULK1)和ATP酶,H+转运和溶酶体V1亚基D (ATPase, H+transporting, lysosomal V1 subunit D, ATP6V1D) 对细胞自噬进行调节[24]。而骨骼肌中缺乏REV-ERBα会影响线粒体自噬相关基因Bnip3、PINK1和Parkin的mRNA表达以及LC3-II/LC3-I比值,而过表达REV-ERBα可以下调细胞自噬和UPS相关的基因[27]。然而,在特异性敲除BMAL1基因的衰老和去神经支配小鼠实验中,骨骼肌的萎缩程度并不明显。由于目前对REV-ERBα是否通过BMAL1进而对骨骼肌质量进行调控仍无明确的定论,但研究证实,两者之间存在一定的关联性。然而,另一项BMAL1基因全身敲除的小鼠研究中,小鼠骨骼肌严重萎缩,甚至幼鼠也出现相同症状,推测其机制可能与SCN的异常或代谢有关[28]。
与此同时,相关研究也发现,昼夜节律与炎症密切相关,炎症诱导的泛素化水平增加也是骨骼肌蛋白质降解的重要途径[29]。此外,肌管分泌白细胞介素6(IL-6)、白细胞介素8(IL-8)和单核细胞趋化蛋白-1(MCP-1)存在昼夜节律振荡,当CLOCK基因沉默导致人体昼夜节律受到影响,IL-6的分泌出现显著下降,而REV-ERBβ蛋白质表达或活性的降低促进IL-6的表达和分泌[30]。以上研究都表明,昼夜节律在骨骼肌炎症中发挥调节作用。一方面,适度的炎症可以促进细胞的再生,但长期的慢性炎症会对骨骼肌细胞产生负面影响,甚至会加速肌肉质量的丢失[31]。因此,昼夜节律在UPS、ALS中均发挥调控作用,而保持正常的昼夜节律可能有助于骨骼肌质量的健康维持。
4 运动与昼夜节律
相关研究表明,运动与昼夜节律的联系极为密切,不同条件下的运动方式产生的效益也各不相同。对无光条件下小鼠进行转轮运动实验,小鼠的昼夜节律发生改变[32]。在恒定的黑暗条件下,轮转会抑制SCN中PER1和PER2的表达[33]。此外,运动的时间也涉及到生理时钟的调节。小鼠活动期开始时进行转轮运动比活动期结束时更能降低SCN中PER2的振幅,而且在明暗条件下,规定时间的运动会影响骨骼肌和肺的昼夜节律,但对SCN的影响较小[32]。这些结果表明,尽管在非光照条件下,运动诱导的核心节律的改变是有限的,但定时规律运动可以改变SCN和外周组织中的分子时钟。除动物研究外,在人体研究中也观察到运动引起的昼夜节律相位变化。与抗阻运动组相比,非运动组相位发生延迟,而抗阻运动组相位提前[34]。运动不仅加强核心时钟基因PER2的表达,还会促使肌肉细胞PER2相位节律性移动[35]。这些发现表明,运动也作为一种潜在方法,以减轻昼夜节律紊乱带来的影响。此外,运动不仅是调节人体外周节律的重要因素,运动能力也受到时间的影响[36]。时间对运动能力的影响主要表现为下午晚期至傍晚是人体最佳的运动时间,此时人体的核心体温处于峰值,体内酶活性升高,神经传导速度加快,肌肉的粘滞性降低及肌腱的柔韧性增加,从而有效提升运动功能的表现[37]。相关研究发现,即使环境条件和时间安排相对运动员训练有偏差,下午时分神经肌肉功能、最大摄氧量和握力等方面表现为一天中最佳,与清晨相比,体力、力量和耐力通常在下午和晚上得到增强[38]。此外,运动周期似乎对运动能力具有特殊的影响,与随机时间的运动相比,固定时间的最大等长自主联合收缩训练,可以更好地提高骨骼肌的无氧运动能力即肌肉的最大爆发力[39]。随着运动科学的进一步发展,昼夜节律与运动科学的相互作用机制越发清晰,运动将会作为一种潜在方式来有效改善和预防昼夜节律紊乱。
5 运动调控昼夜节律在肌萎缩中的作用机制
骨骼肌作为外周节律的重要组成部分,运动过程中骨骼肌的能量代谢、线粒体供能以及运动时段的选择都会对昼夜节律产生影响,而昼夜节律的变化可反作用于骨骼肌,进而对相关因素产生影响。
5.1 运动改善骨骼肌昼夜节律紊乱
骨骼肌重塑是生物体对环境变化做出反应的关键组成部分。运动会引起肌肉的结构变化,并会引起昼夜节律的相移、生理和行为的波动,持续时间约为 24 h,由核心时钟机制维持。运动诱导的重塑和昼夜节律都依赖于关键基因的转录调控[40]。运动干预会影响人类骨骼肌的分子钟机制,包括骨骼肌BMAL1基因表达和PER2蛋白表达的显著增加[41]。高强度离心收缩增加了BMAL1的mRNA表达,对PER1-3的mRNA表达并无显著影响。相比之下,有氧运动并未改变BMAL1的表达,而是促进PER1表达,对PER2 和PER3的表达影响较小[42]。此外,一项在啮齿类动物模型中对失神经骨骼肌的研究表明,运动可以激活并改善失调的昼夜节律转录活性[43]。在人类,与对侧对照腿相比,单腿耐力运动改变了昼夜节律基因的表达,并明显诱导了核心时钟基因CRY1、PER2 和BMAL1的相移[44]。在对人类的研究中,耐力训练运动员中提取的原代细胞中发现,REVERBA/B、SIRT1和NAMPT的节律性基因表达上升,而在久坐不动的人群中原代细胞中则未被发现[45]。
与此同时,昼夜节律的紊乱可能对骨骼肌损害机体健康。对人体研究发现,骨骼肌自身的昼夜节律可以由SCN与运动进行调节[46]。急性运动后60 min,PER1和PER2表达急剧增加1~1.5倍,而CRY1的表达仅在抗阻运动后呈现上升趋势[35]。骨骼肌转录组学数据揭示,急性有氧和抗阻运动(运动后0~3 h)改变了特定时钟基因的表达。在单次抗阻运动对骨骼肌时钟基因调控的研究中发现,与非运动腿相比,单腿抗阻运动促进核心生物钟基因BMAL1、CRY1和PER2的表达[44]。此外,运动可以显著调节昼夜节律相移效应。有研究表明,清晨训练促进昼夜节律相位提前,夜间训练诱发昼夜节律相位延迟[47, 48]。由此可见,运动时间在相位延迟和相位提前效应中的重要性。相似的运动时间和强光照射引发的相移效应幅度相似。同样,90 min的高强度运动(65%~75% 心率)引起的平均相位延迟与夜间同一时间90 min强光(5 000勒克斯)照射引起的延迟同步率达到84%[49]。在对夜行啮齿动物研究中同样发现,转轮或跑台运动会改变骨骼肌核心时钟基因的表达,可能对昼夜节律产生影响[42]。而在长期的自主转轮小鼠实验中,也发现小鼠体内受昼夜节律调控相关基因的转录表达峰值呈现增长趋势[50]。与此同时,老年人坚持每天进行1/2 h以上的有氧运动,则可以缓解衰老引发的昼夜节律紊乱[51]。由以上研究可知,运动可以调节骨骼肌中核心时钟机制,运动时间可改变昼夜节律的相位,从而缓解骨骼肌昼夜节律紊乱。
5.2 运动调控昼夜节律改善骨骼肌线粒体功能
众多的研究表明,外周组织时钟以组织特异性方式影响新陈代谢[52]。线粒体作为影响骨骼肌新陈代谢和昼夜节律的重要因素。与此同时,AMPK 可以改变 CRY1 和 PER2 的稳定性,AMPK 的激活会增加骨骼肌成纤维细胞的昼夜节律表达幅度[53]。AMPK 不仅在肌肉生理学对运动的反应发挥关键作用,还被证实可调节肌肉中的时钟基因表达[54]。另一方面,AMPK还可激活过氧化物酶体增殖物激活受体 (peroxisome proliferators-activated receptors,PPARs),促进骨骼肌细胞的胞质代谢和能量的偶联,提升运动能力[55]。作为昼夜节律的抑制因子CRY1/2可能参与PPARs转录因子的调节。CRY1/2敲除基因小鼠的运动能力也有显著提高[56]。因此,AMPK可能通过促进CRY1的降解和减轻PPARs的抑制来改善运动能力。
运动不仅会引起骨骼肌昼夜节律相移效应,也影响线粒体功能。最新研究证明,骨骼肌约38% 的线粒体蛋白质表现出昼夜节律的振荡性[57],线粒体氧化能力在傍晚达到峰值[58],而有氧运动的峰值同样出现在傍晚时分[59],可能的原因是线粒体功能的昼夜节律振荡性。其他研究表明,不仅急慢性运动可以增加动物和人类骨骼肌的线粒体功能,单次运动对大鼠骨骼肌线粒体功能同样有改善作用,包括线粒体呼吸和Ca2+保留能力[60, 61]。但是特定运动时间及其伴随的线粒体功能峰值是否会增加运动对肌肉功能的影响尚未完全明确。此外,运动时间似乎对运动能力有特定影响。研究发现,人体进行12周抗阻训练后,相对于上午,下午进行抗阻训练促使骨骼肌质量增加效益更加明显[62]。与上午相比,下午16:00至18:00期间,人体骨骼肌肌力和扭矩显著增加[63]。这可能与骨骼肌功能和氧化能力同样存在昼夜变化有关[58]。值得注意的是,运动时间的异常可能会导致昼夜节律相位的变化,甚至会致使骨骼肌萎缩的风险增大。规律的有氧训练可以恢复由昼夜节律基因突变引起的骨骼肌线粒体含量下降,表明运动能挽救由异常昼夜节律引起的骨骼肌线粒体功能障碍[64]。
与清晨训练相比,下午或晚上的运动能力有所提高,其原因可能与神经肌肉功能的提升,昼夜温度的变化以及骨骼肌昼夜节律的调控[65]。不同训练时间诱发肌肉质量和功能表现的不同[66]。相比于清晨,夜间运动促进过氧化酶体增殖物激活受体γ共激活因子-1α(PGC-1α)mRNA水平的增加,这表明线粒体生物与昼夜节律运动时间存在相关性[67]。然而,昼夜节律运动对骨骼肌线粒体的影响的信息仍然较少,需要进一步研究来探索特定的运动时间是否会促进骨骼肌线粒体功能和骨骼肌整体运动表现。
5.3 运动调控昼夜节律改善骨骼肌肌肉质量
运动作为骨骼肌昼夜节律的重要调控因素,运动调控昼夜节律相位可以更有效地维持骨骼肌质量。长期规律的运动不仅可以增加SCN自身生物钟的振幅,还能够更加高效调节昼夜节律[68]。骨骼肌作为外周节律的重要组成部分,抗阻运动是增加其质量的最佳运动方式。抗阻运动后,骨骼肌组织活检遗传分析发现,昼夜节律基因振荡受运动影响显著[44]。运动过程中,可激活AMPK进而磷酸化CRY1,使PER2-CRY1复合体的稳定性发生改变,从而促进骨骼肌成纤维细胞昼夜节律蛋白质表达[53]。CRY1的下调可改善BMAL1-CLOCK复合体抑制作用,这与运动过程中昼夜节律振荡增加相一致。
而BMAL1-CLOCK异二聚体可以促进烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyl transferase, NAMPT) 的表达,NAMPT可调控烟酰胺腺嘌呤二核苷酸 (nicotinamide adenine dinucleotide, NAD+)的合成。此外,昼夜节律的NAMPT基因在维持骨骼肌的质量以及骨骼肌收缩功能方面起到极为重要的作用。随着年龄的增加,NAMPT的含量会逐渐降低,运动可以逆转NAMPT水平的下降,增加NAD+的恢复速率,使ATP的产生加快,以昼夜振荡的方式对骨骼肌的质量和功能进行维持[69]。NAD+的加速恢复可对SIRT1进行激活,SIRT1激活后可与BMAL1-CLOCK二聚体结合,进而乙酰化PER2,而且可参与BMAL1、PER2、CRY1昼夜转录的调控[70]。不同运动模式对昼夜节律影响存在一些差异,这可能与骨骼肌纤维类型和能量供应信号通路有关[42]。
另一方面,骨骼肌作为外周节律的重要组成部分,抗阻运动可有效增加骨骼肌质量,抗阻运动后的骨骼肌检验分析也证明昼夜节律基因的振荡受到运动干预的影响[44]。在分子水平的研究证实,激活mTOR可提高BMAL1、CLOCK、CRY1等昼夜节律相关基因转录水平表达[71]。通过运动同样能够刺激mTOR信号传导,进而增加骨骼肌蛋白质合成,从而起到提高肌肉质量的效应[72]。此外,运动周期同样对运动能力产生较大影响,规律性自主联合收缩运动对骨骼肌爆发力提升作用显著[39]。运动时间对运动能力的影响与人体核心体温呈线性相关,核心体温越高,运动表现提升越为显著[37]。综上所述,正常的昼夜节律可以对骨骼肌产生影响,运动与昼夜节律的结合可以更加优化运动处方,进一步提高运动改善骨骼肌质量和功能带来的效益。然而,目前在运动调控昼夜节律在肌萎缩相关的实验证据还十分有限,这提示我们在未来的运动方案中,可进一步去考虑昼夜节律的因素,从而更优化运动促进肌萎缩所带来的健康效益。Fig.1总结了运动生理节律对肌萎缩的作用机制。
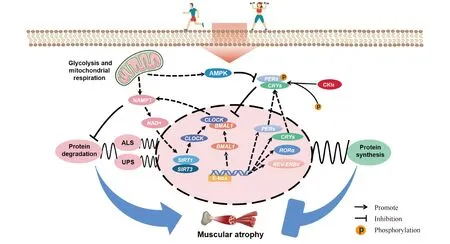
Fig.1 Overview of the mechanisms of exercise-induced circadian rhythms on muscular atrophy This figure demonstrates the regulation of circadian rhythm-related genes on protein synthesis and energy metabolism in skeletal muscles. To a certain extent, it explains the underlying mechanisms for which different exercise training modes interfere with circadian rhythm genes and affect skeletal muscles, which can provide the reference for the prevention and treatment of skeletal muscle atrophy in the future
6 问题与展望
昼夜节律紊乱是导致不同个体肌萎缩的关键因素之一,尤其是对于目前轮班工作、社交时差和睡眠障碍等综合症人群。为此,昼夜节律在骨骼肌的生理功能中起着至关重要的作用,充分了解其调控机制对于骨骼肌相关疾病尤为重要。虽然在人体实验中,还缺乏昼夜节律紊乱与肌萎缩之间的直接证据。但大量基础实验证实,昼夜节律与骨骼肌蛋白质合成、能量代谢、线粒体质量控制等密切相关,可协同调节骨骼肌的再生和修复,改善骨骼肌结构、功能和代谢。与此同时,其他慢性疾病如心血管疾病、糖尿病、骨质疏松症、阿尔兹海默症等中也表现出明显的昼夜节律特性,其功能障碍会影响甚至加重疾病的进程。这表明,正确的昼夜节律表达可能是许多慢性疾病干预的一个靶向方向。
运动作为干预和改善肌萎缩有效手段,利用昼夜节律相位移效应,有助于重置生物钟并优化运动带来的有益效应。尤其是,个性化的运动处方结合特定的运动时间可进一步预防和延缓不规律生活方式造成肌萎缩程度。未来研究中,应进一步阐明特定的运动时间是否会改善骨骼肌功能,以及定期运动锻炼延缓肌萎缩的分子机制,从而促进运动防治慢性疾病及健康老龄化的进程。

