基于网络药理学探讨巴豆制霜的作用机制Δ
尚津锋,李倩楠,崔一然,刘 欣#
(1.北京中医药大学中药学院,北京 100029; 2.首都医科大学附属北京中医医院药学部,北京 100010)
巴豆为大戟科植物巴豆CrotontigliumL.的干燥成熟果实,具有泻下冷积、逐水退肿和祛痰利咽等功效,在临床被应用于寒积便秘、腹水膨胀等[1]。巴豆的主要成分包括有机酸类、二萜类、生物碱类和植物蛋白类,其中巴豆脂肪油和巴豆毒素是巴豆大毒的物质基础[2-3]。因此,目前常使用取仁蒸煮后去油制霜的炮制方法,以达缓和峻泻、降低毒性的目的[4]。基于中医药百科全书数据库(ETCM)、中医药整合药理学研究平台(TCMIP),通过大数据的智能化数据挖掘,分析药物、成分和靶点的网络关联,阐释中药多成分-多靶点-多途径作用机制[5-6]。本研究以效毒关系为切入点,运用网络药理学方法筛选巴豆和巴豆霜成分和靶标并进行通路分析,预测并探讨巴豆制霜的机制,为临床巴豆霜的应用提供参考。
1 资料与方法
1.1 化学成分靶点筛选
通过TCMIP V2.0[7]的中药材数据库,检索巴豆、巴豆霜的化学成分和靶点。获得的中药基因靶标由MedChem Studio预测,只保留可靠性分值>0.8的靶标。
1.2 化学成分ADMET预测
admetSAR-2.0(http://lmmd.ecust.edu.cn/admetsar2/)从多种数据库收集化合物药理学相关信息,能够预测化合物ADMET参数,包括血脑屏障、人体小肠吸收性、Caco-2细胞透过性和急性口服毒性等定性定量参数[8]。利用该数据库检索巴豆、巴豆霜成分的ADMET参数,分析化学成分的药动学和毒理学性质。
1.3 靶点蛋白质-蛋白质相互作用(PPI)网络构建
为明确靶标间的相互关系,利用Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)将巴豆和巴豆霜靶点取交集,并将共有靶点和特有靶点提交至STRING 11.0数据库[9](https://string-db.org)构建PPI网络,设定生物种类为“Homo sapiens”,最小互作阈值为“highest confidence”(>0.900),其余均为默认设置,得到PPI网络,并通过Cytoscape 3.8.0对PPI网络进一步可视化。
1.4 成分的通路富集分析
利用DAVID软件[10](http://david.abcc.ncifcrf.gov/)将筛选得到的靶点进行京都基因与基因组百科全书(KEGG)通路富集分析,保留P<0.01的通路,并根据P值筛选出前20条通路进行分析。
1.5 成分-靶点-通路网络图构建和分析
将成分、靶点和通路数据导入Cytoscape 3.8.0[11],构建“成分-靶点-通路”网络图。成分、靶点和通路以节点(node)表示,利用Cytoscape内置工具Analyze Network分析各节点的网络拓扑参数,其中,节点的度值(degree)是与节点相连边的数量,度值越大,说明网络中与该节点直接相关的节点数越多,表明该节点越重要[12]。根据网络拓扑学参数可判断中药发挥药效、表现毒性的主要成分以及核心靶点。
2 结果
2.1 巴豆、巴豆霜化学成分靶点获取和筛选
根据TCMIP V2.0中药材数据库检索巴豆、巴豆霜分别有47、9个化学成分,筛选去除无作用靶标的成分,得到巴豆苷(crotonoside)、月桂酸(lauric acid)等巴豆成分37个以及巴豆醇(phorbol)等巴豆霜成分6个。去重基因靶标,得到巴豆有309个靶点,巴豆霜有202个靶点。筛选结果表明,巴豆的成分包括巴豆霜的6个化学成分。
2.2 化学成分ADMET预测结果
将上述筛选的6种巴豆-巴豆霜共有成分导入admetSAR-2.0中检索,结果见表1—3。巴豆苷、β-谷甾醇等成分均能透过血脑屏障并被人体小肠吸收,分布在细胞核、线粒体和溶酶体,对CYP酶的抑制性较低,其中β-谷甾醇的Caco-2细胞通透性和口服生物利用度较高。除β-谷甾醇、巴豆醇-12-十四烷酸酯-13-乙酸酯、4-脱氧-4-巴豆醇和巴豆醇是CYP3A4底物,巴豆醇-12-十四烷酸酯-13-乙酸酯是CYP2C9抑制剂外,其余成分均不是CYP酶亚型的底物或抑制剂。根据化合物毒性指标,6种成分均无钾电压门控通道亚家族H成员2(HERG)相关基因抑制性、交链孢酚单甲醚(AME)致畸性、致癌性,且生物降解度较低。值得注意的是,巴豆醇和异鸟嘌呤具有肝毒性,β-谷甾醇的急性口服毒性处于危险等级。
表1中以巴豆苷为例,人体小肠吸收性为“+”,说明巴豆苷在小肠吸收性较好;Caco-2细胞通透性为“-”,说明巴豆苷使Caco-2细胞通透性变差;血脑屏障为“+”,说明巴豆苷可以透过血脑屏障;P糖蛋白底物为“-”,说明巴豆苷不是P糖蛋白底物。表3中以巴豆苷为例,肝毒性为“+”,说明巴豆苷具有肝毒性;生物降解度为“-”,说明巴豆苷的生物降解度降低。
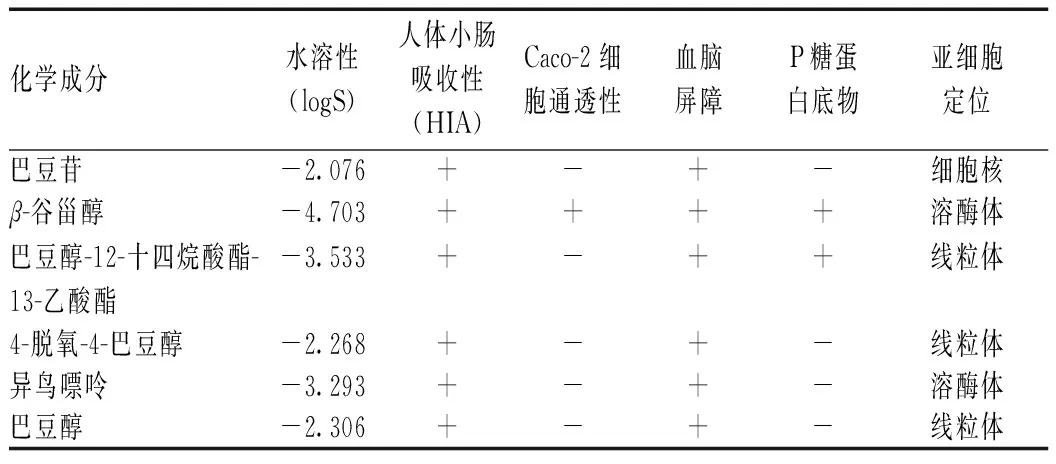
表1 巴豆化学成分的吸收、分布和排泄相关指标Tab 1 Absorption, distribution and excretion of chemical components of croton
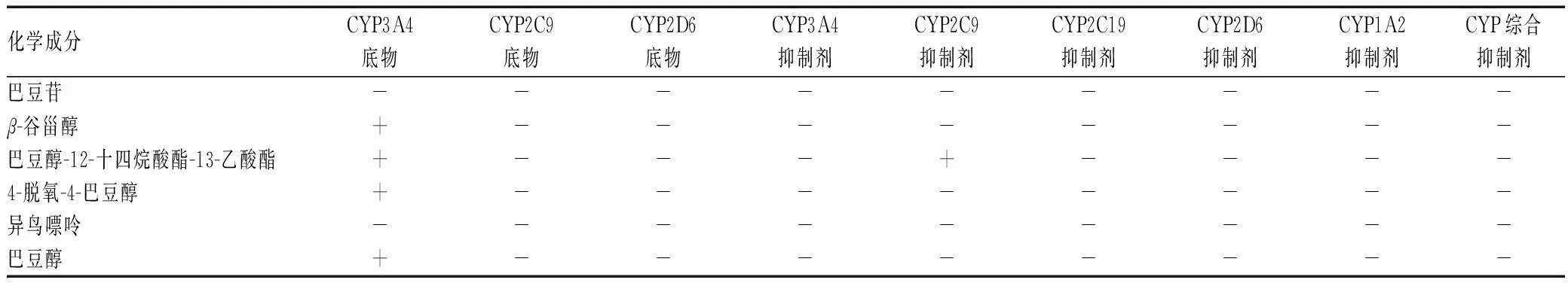
表2 巴豆化学成分的代谢相关指标Tab 2 Metabolism-related indicators of chemical components of croton
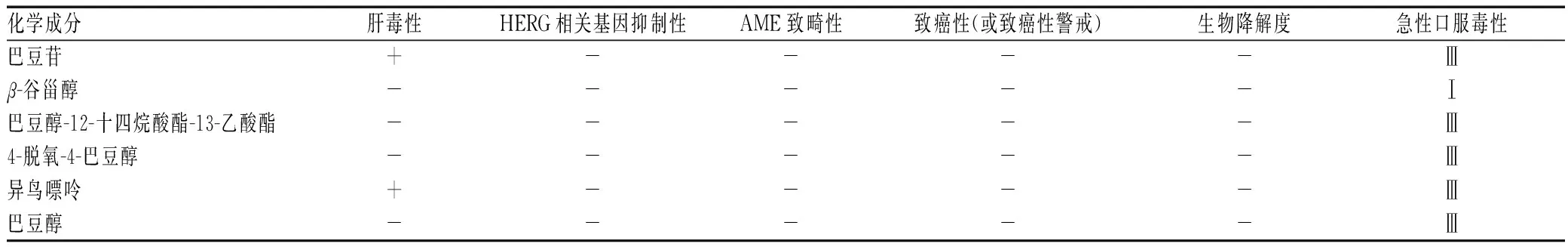
表3 巴豆化学成分的毒性相关指标Tab 3 Toxicity related indicators of chemical components of croton
2.3 靶点的PPI网络构建
将筛选的巴豆化学成分靶点与巴豆霜化学成分靶点取交集,并通过Venny 2.1.0绘制韦恩图,得到巴豆-巴豆霜共同靶点202个,均为巴豆靶标,以及巴豆的特有靶点107个,见图1。将巴豆-巴豆霜共有靶点和巴豆特有靶点分别提交至STRING 11.0平台得到PPI网络,并导入Cytoscape 3.8.0对PPI网络进一步可视化,见图2—3(节点面积越大代表度值越高)。
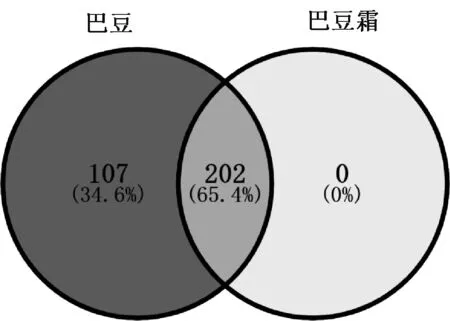
图1 巴豆-巴豆霜靶点的韦恩图Fig 1 Venn diagram of targets of croton and semen crotonis pulveratum
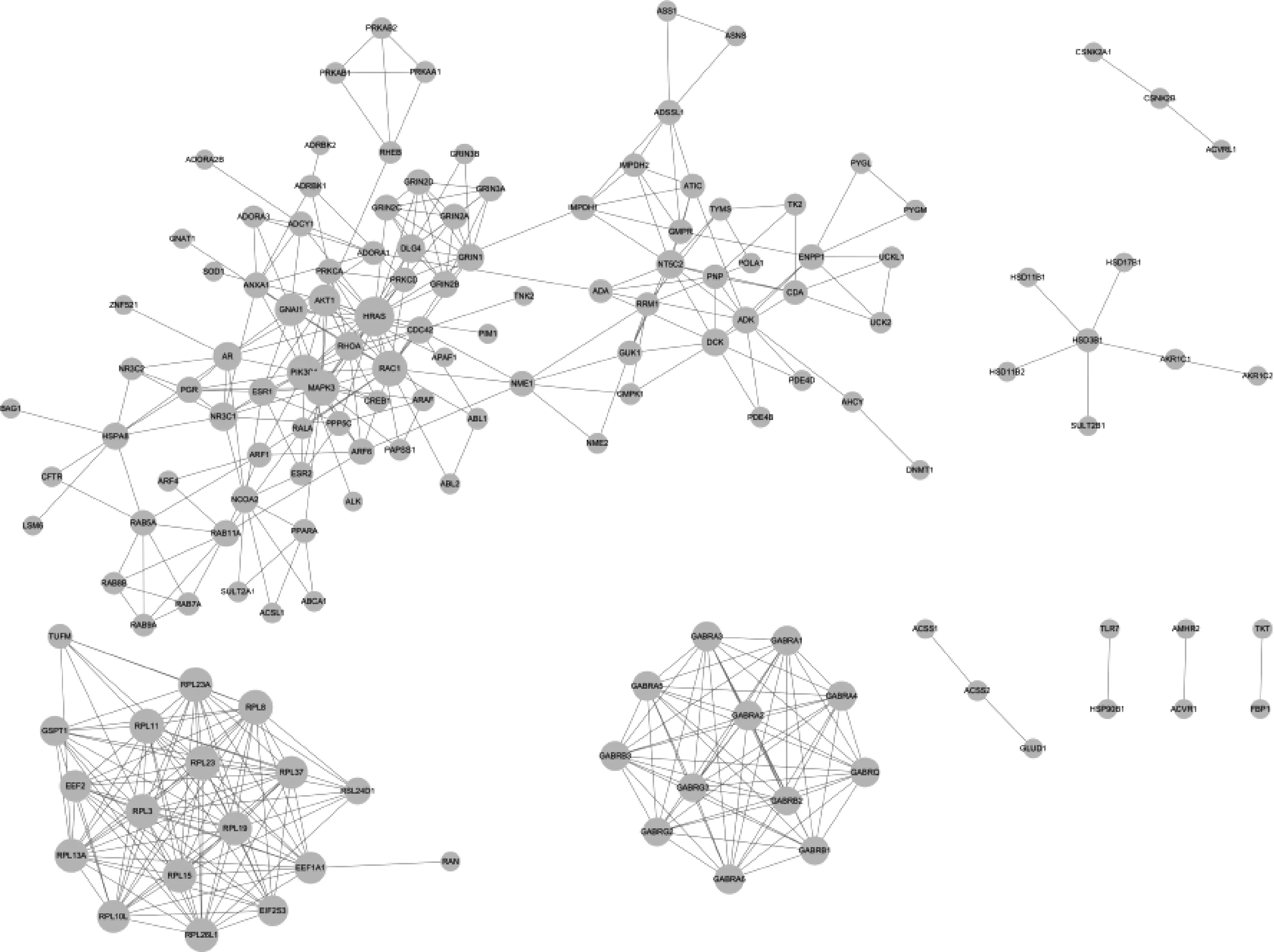
图2 巴豆-巴豆霜共有成分靶点PPI网络Fig 2 PPI network of common component targets of croton and semen crotonis pulveratum
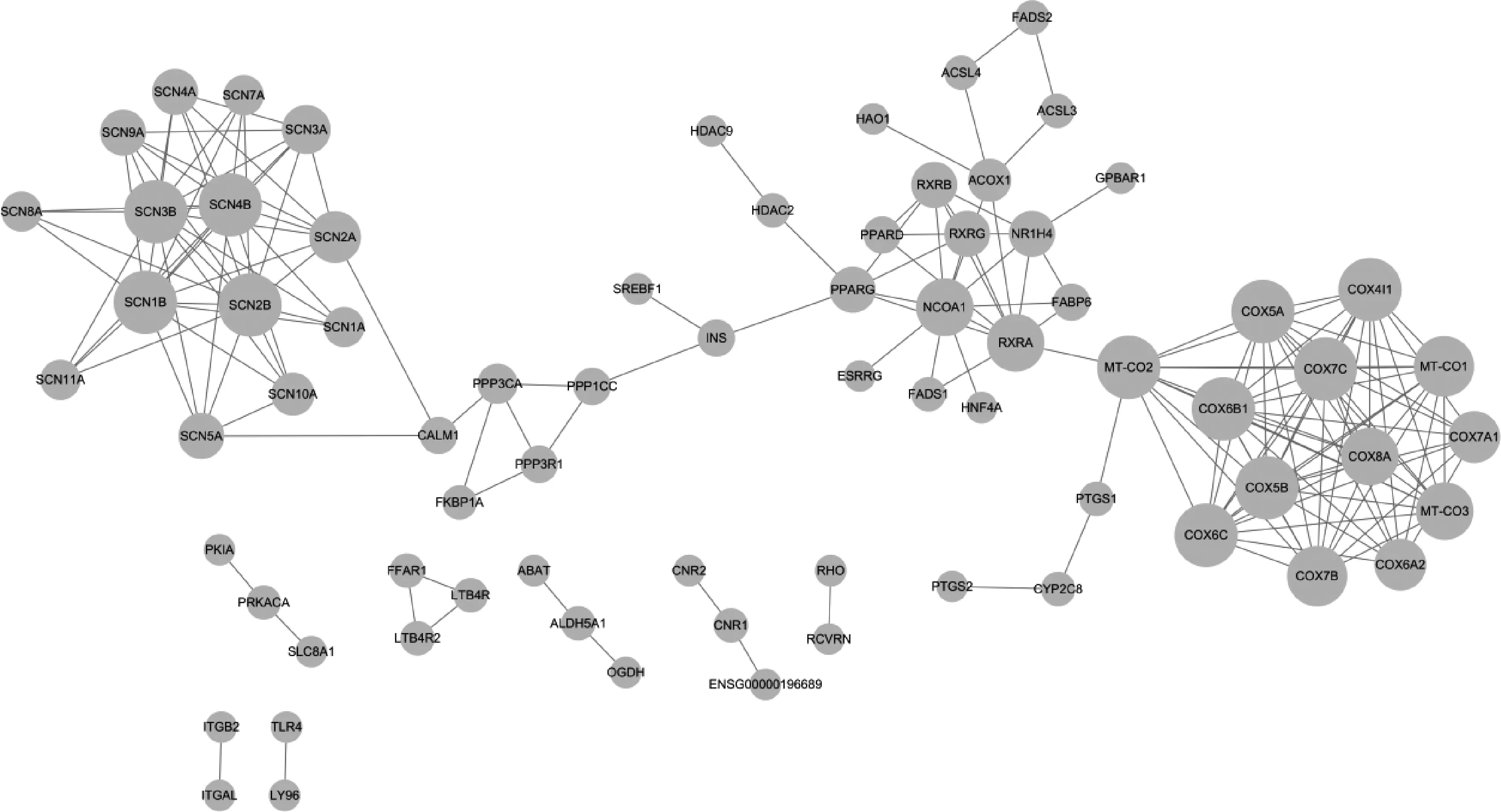
图3 巴豆特有成分靶点PPI网络Fig 3 PPI network of specific component targets of croton
2.4 KEGG通路富集分析
为阐明巴豆、巴豆霜成分的效毒关系机制,将巴豆-巴豆霜的共有成分靶点和巴豆的特有成分靶点输入DAVID数据库进行KEGG通路富集分析。202个共有靶点富集得到77条通路,筛选P<0.01的通路共38条,涉及尼古丁成瘾(nicotine addiction)、GABA能突触(GABAergic synapse)、神经活性配体受体相互作用(neuroactive ligand-receptor interaction)、嘌呤代谢(purine metabolism)、cAMP信号通路(cAMP signaling pathway)、Rap1信号通路(Rap1 signaling pathway)和Ras信号通路(Ras signaling pathway)等。选择前20条通路使用Omicshare平台(https://www.omicshare.com/tools/)可视化,见图4(RichFactor值越大,表示通路富集程度越高;点的大小表示富集的靶点数量;点的颜色由浅到深表明P值由大到小)。

图4 巴豆-巴豆霜共有靶点KEGG通路富集分析气泡图Fig 4 Bubbles of KEGG pathway enrichment analysis of common targets of croton and semen crotonis pulveratum
107个巴豆特有成分靶点富集得到44条通路,筛选P<0.01的通路共21条,涉及PPAR信号通路(PPAR signaling pathway)、非酒精性脂肪肝[non-alcoholic fatty liver disease(NAFLD)]、阿尔茨海默病(Alzheimer’s disease)、帕金森病(Parkinson’s disease)、脂肪酸降解(fatty acid degradation)、α-亚麻酸代谢(alpha-Linolenic acid metabolism)、血管平滑肌收缩(vascular smooth muscle contraction)和甲状腺癌(thyroid cancer)等。其中,长时程增强作用(Long-term potentiation)、苯丙胺成瘾(amphetamine addiction)是共有靶点和特有靶点富集得到的2条共有通路。选择前20条通路使用Omicshare平台可视化,见图5(RichFactor值越大,表示通路富集程度越高;点的大小表示富集的靶点数量;点的颜色由浅到深表明P值由大到小)。
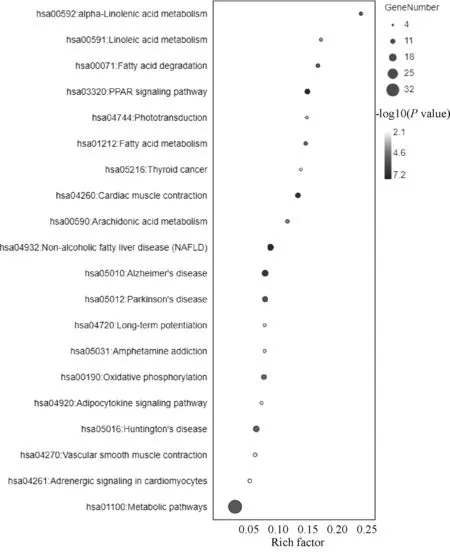
图5 巴豆特有靶点KEGG通路富集分析气泡图Fig 5 Bubbles of KEGG pathway enrichment analysis of specific targets of croton
2.5 成分-靶点-通路网络图的构建及拓扑分析
将巴豆、巴豆霜的化学成分及相关靶点和富集分析得到的通路导入Cytoscape 3.8.0,绘制“成分-靶点-通路”网络图。度值是节点的直接相连节点数目,度值越大,该节点在网络中更重要。共有化学成分、相关靶点及富集通路导入该软件,绘制出130个节点、417条边的“成分-靶点-通路”网络图,见图6(形状代表类型,八边形为成分,矩形为靶点,三角形为通路;节点的面积代表其度值,面积越大说明该节点越重要)。网络分析表示,巴豆苷连接度为75,介度为0.642 2,紧密度为0.581 1,说明巴豆苷是巴豆霜发挥药效的主要成分。腺苷酸环化酶1(ADCY1)、G蛋白亚基α I1(GNAI1)、丝裂原活化蛋白激酶3(MAPK3)、CAMP响应性元素结合蛋白1(CREB1)、磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α(PIK3CA)、苏氨酸激酶1(AKT1)、ATP结合盒C亚家族1(ABCC1)和ATP结合盒亚家族A成员1(ABCA1)等靶点在网络中有较高连接度值,说明上述靶点在巴豆发挥药效过程中具有重要作用。
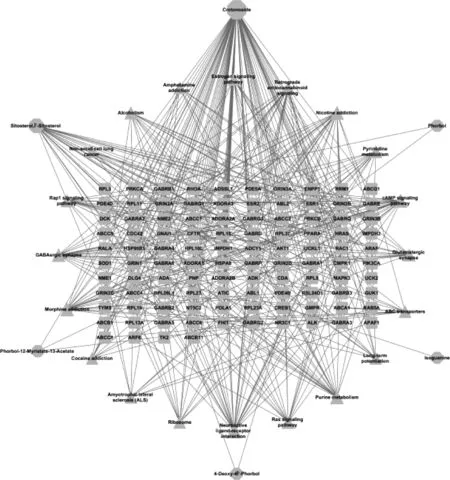
图6 巴豆-巴豆霜共有成分-靶点-通路网络图Fig 6 Common component-target-pathway network diagram of croton and semen crotonis pulveratum
将特有成分、相关靶点及富集通路导入该软件,绘制出86个节点、427条边的“成分-靶点-通路”网络图,见图7(形状代表类型,八边形为成分,矩形为靶点,三角形为通路;节点的面积代表其度值,面积越大说明该节点越重要)。Cytoscape网络分析表示,棕榈酸、花生酸、硬脂酸、肉豆蔻酸和亚麻酸的连接度等网络拓扑值均较大,说明这些脂肪油类成分与巴豆产生毒性作用有密切关系。钙调蛋白1(CALM1)、磷脂酶A2组IB(PLA2G1B)、酰基辅酶A合成酶长链家族成员3(ACSL3)、磷脂酶A2组IIA(PLA2G2A)、蛋白激酶 CAMP 活化催化亚基α(PRKACA)、酰基辅酶A氧化酶1(ACOX1)和过氧化物酶体增殖剂激活受体γ(PPARG)等靶点连接度较高,是巴豆产生毒性的基础。
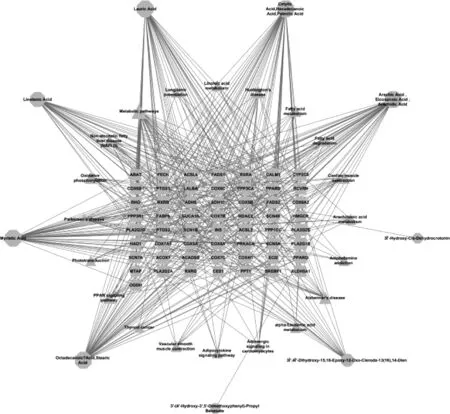
图7 巴豆特有成分-靶点-通路网络图Fig 7 Specific component-target-pathway network diagram of croton
3 讨论
3.1 巴豆(霜)药效机制分析
巴豆霜在临床上可用于治疗寒积便秘、水肿腹胀、乳食停滞和喉风喉痹等,也用于恶性肿瘤的治疗[13-14]。本研究通过网络药理学方法初步筛选出巴豆霜发挥药效的主要成分为巴豆苷、异鸟嘌呤等生物碱和二萜类成分。相关研究结果表明,巴豆提取物具有明显的抗肿瘤活性,能抑制多种肿瘤细胞,其作用机制与诱导肿瘤细胞凋亡、影响膜系统分子动力学、抑制肿瘤转移和诱导肿瘤细胞分化等有关[15]。此外,巴豆生物碱促使细胞G2/M期阻滞和抑制细胞的有丝分裂,诱导骨肉瘤细胞凋亡[16]。药理研究结果表明,巴豆属植物中的二萜类成分有抗炎的药理活性[17]。巴豆苷也具有抗炎作用,表现为抑制毛细血管通透性和耳肿胀[18]。同时,巴豆霜给小鼠灌服,可抑制小鼠腹腔巨噬细胞的吞噬活性,还可降低小鼠碳廓清率及胸腺重量[19]。
网络拓扑分析和富集结果显示,巴豆霜成分作用的核心靶点包括ABCA1、PIK3CA、CREB1和AKT1等,主要作用于2类通路:一是神经系统相关通路,包括尼古丁成瘾、GABA能突触、ABC转运蛋白、Rap1信号通路和Ras信号通路等;二是癌症通路,包括非小细胞肺癌、胰腺癌、肾细胞癌和前列腺癌等。此外,巴豆霜还通过嘌呤代谢、嘧啶代谢等通路参与机体的物质代谢,通过Fcγ受体(FcγR)介导的吞噬作用通路在免疫系统调节和免疫应答过程中发挥作用[20]。药理学研究结果表明,尼古丁加剧胃溃疡和恶性肿瘤侵袭性因素的有害作用,并减弱胃肠防御因素的保护作用,在胃十二指肠溃疡中发挥重要作用,同时通过调节细胞增殖凋亡和血管生成促进恶性肿瘤进展,导致胃肠道癌变[21]。γ-氨基丁酸(GABA)是重要的抑制性神经递质,在中枢神经系统生理学和免疫细胞免疫调节中的作用至关重要,与胃肠动力密切相关[22-23]。肠道中广泛的GABA表明,GABA可能被应用于运动性胃肠道疾病,如胃轻瘫和肠梗阻,从而恢复生理性胃肠动力[24]。ABC转运蛋白家族,如ABCA1、ABCB1、ABCC1和ABCC9等,能够利用ATP水解产生的能量,协助各种物质进行跨膜转运[25]。研究结果表示,ABC转运蛋白可将疏水亲脂的化疗药主动排出肿瘤细胞外,降低细胞内药物蓄积,从而使肿瘤细胞产生多药耐药[26]。Ras和Rap1对细胞的增殖、分化等基本生命活动起重要的调控作用,与肿瘤密切相关[27-28]。研究结果显示,Rap1b通过参与多条信号调节过程,在肿瘤发生发展中起着重要作用[29]。同时,随着Ras蛋白表达升高,肿瘤组织更易进展、浸润和转移[30]。巴豆霜可能通过Rap1和Ras相关通路抑制恶性肿瘤细胞的增殖和转移。PIK3CA是磷脂酰肌醇3激酶催化亚单位的基因,能够调控磷酸化的苏氨酸激酶(p-Akt)蛋白的表达,从而降低非小细胞肺癌的侵袭及迁移能力[31];临床上,非小细胞肺癌患者的PIK3CA突变则预后不良[32]。CREB基因和食管癌、膀胱癌等多种恶性肿瘤关系密切,抑制该基因表达能够抑制恶性肿瘤细胞增殖[33-34];此外,CREB表达上调的食管鳞癌患者预后不良[35]。由此可知,CREB为肿瘤的关键靶点。研究结果表明,Akt是靶向抗肿瘤药研发的重要靶标,抑制Akt可有效抑制肿瘤生长[36]。总体而言,巴豆(霜)的多个成分通过多种靶点、多条途径在抗肿瘤中取得了显著效果,同时调节胃肠动力,抑菌抗炎,预测其药效机制涉及GABA能突触受体、ABC转运蛋白和Rap1信号通路等通路。
3.2 巴豆毒性机制分析
本研究通过网络拓扑参数筛选出棕榈酸、花生酸等脂肪酸为巴豆产生毒性的主要化学成分。ADMET结果显示,巴豆、巴豆霜对肝药酶抑制较低,进入体内后会保持较高的血药浓度。巴豆苷和异鸟嘌呤不是CYP3A4底物,可能与巴豆损伤肝脏,导致肝毒性有关。网络拓扑参数和基因富集结果显示,巴豆毒性的核心靶点ACOX1等主要作用于脂肪酸代谢相关通路,如脂肪酸代谢通路、脂肪酸降解、脂肪细胞因子信号通路、非酒精性脂肪肝、PPAR信号通路、α-亚麻酸代谢和亚油酸代谢通路。过氧化物酶体增殖物激活受体α(PPARα)是肝脏中高表达的代谢性核受体,主要功能是参与脂肪酸氧化,包括激活脂肪酸摄取、加速脂肪酸氧化、抑制糖异生、抑制炎症和纤维化,这些过程都与非酒精性脂肪肝的发病机制密切相关[37]。有研究结果发现,共轭亚油酸与PPARα联系紧密。共轭亚油酸可能通过PPARα激活,介导抗神经炎症[38];PPARα在共轭亚油酸诱导的肝脂肪变性中调节脂肪生成和脂肪酸氧化,对维持脂质稳态发挥双重作用[39]。由此可见,巴豆毒性作用的产生与体内产生亚油酸及其代谢过程紧密相关。同时,巴豆特有靶点的富集通路涉及神经系统退行性疾病,包括阿尔茨海默病、帕金森病和亨廷顿病。说明巴豆毒性可能造成神经系统损伤。此外,巴豆油有弱致癌作用,可诱导大鼠癌基因的增加[40]。巴豆油对小鼠耳有致炎作用,导致其水肿和中性粒细胞浸润[41]。因此,巴豆的毒性机制可能与脂肪酸代谢通路、PPAR信号通路等脂肪酸代谢类通路相关。
3.3 巴豆制霜机制分析
巴豆大毒,在传统炮制工艺中,通常采用去油制霜的方法降低毒性,缓和峻下,即取巴豆仁碾碎蒸煮,压榨去油至松散成粉状[42]。在这一过程中,巴豆毒蛋白因加热变性而除去,巴豆油大部分去除,以此达到降低毒性的目的。根据本研究富集分析,巴豆发挥“效”“毒”作用有2个共同通路,即苯丙胺成瘾和长时程增强。有研究结果显示,GABA对长时程增强的影响是通过受体介导的突触前、后抑制效应而实现的[43]。GABA受体拮抗剂不影响神经病理性痛大鼠海马突触长时程增强诱出及维持[44];而GABA激动剂降低依赖药物引起的加强作用,可缓解苯丙胺类药物依赖[45]。说明巴豆与巴豆霜因成分变化或成分含量不同,对神经系统的作用不同。综合以上分析,巴豆制霜去除或减少巴豆油等致炎、弱致癌成分,增强了巴豆的抗肿瘤、抗菌和抗病毒的功效,同时降低了巴豆毒性,减少了临床不良反应,并可能对神经系统产生影响,通过网络药理学方法预测巴豆制霜机制可能与苯丙胺成瘾和长时程增强等神经系统通路有关。
综上所述,本研究通过TCMIP V2.0等数据库,采用网络药理学方法,以巴豆的效毒关系为切入点,对巴豆和巴豆霜的成分进行筛选、靶点进行预测、通路进行分析。结合现代药理学、毒理学研究以及传统炮制方法,分析巴豆发挥“效”“毒”作用机制,探讨巴豆制霜的分子机制。巴豆(霜)调控Rap1信号通路、非小细胞肺癌等通路,对肿瘤具有明显的治疗作用。巴豆苷等导致肝毒性,影响脂肪酸代谢通路,是巴豆的主要毒性机制。巴豆制霜不仅能降低巴豆的不良反应和毒性效应,而且能更好地发挥巴豆霜的抗肿瘤抑菌治疗作用。然而,本研究缺乏实验验证,今后可基于体内外模型分别给予巴豆和巴豆霜,检测各组神经系统相关通路的蛋白表达变化,进而验证预测结果。总之,本研究探讨了巴豆制霜的分子机制,发现这种巴豆炮制方法与苯丙胺成瘾、长时程增强等神经系统相关通路有关。

