规模化猪场猪繁殖与呼吸综合征的诊断与防控
贾 佩,连 星,张 琪,郭抗抗,许信刚,周宏超*
(1.陕西正能农牧科技有限责任公司,陕西高陵 7102011;2.西北农林科技大学动物医学院,陕西杨凌 712100)
中国是生猪产业大国,生猪饲养量占世界生猪饲养量的50%。2018年国内突然暴发的非洲猪瘟(African swine fever,ASF)疫情使得我国生猪的养殖、屠宰、经营和运输情况都发生了较大的改变。联防联控等相关措施限制了异地猪源的调动,导致区域内种猪场引种种源质量差的问题,若未经严格检测筛选,引种易引发猪群疫病的发生。
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种重要猪传染病,其特征是妊娠母猪的繁殖障碍,包括妊娠后期母猪流产、死胎、木乃伊胎和弱仔,以及生长猪的呼吸道疾病,如间质性肺炎等[1-2]。该病给全球养猪业造成了严重经济损失[3]。自1996年郭清宝[4]分离出我国的第1株猪繁殖与呼吸综合征病毒毒株后,随后的20多年中,PRRSV一直广泛传播并不断变异[5],2006年出现了能够使感染猪表现高发病率、高病死率、高体温的“三高”症状的高致病性猪繁殖与呼吸综合征病毒[6],即HP-PRRSV。从2012年开始中国多个省份报道了多株NADC30 PRRSV毒株,且与经典PRRSV、HP-PRRSV等不同类型毒株发生重组[7-9]。到2016年,此类毒株已蔓延至我国大部分省份,是导致我国目前PRRS流行的主要原因之一[10-11]。由于PRRSV 类NADC30毒株间存在广泛的重组,不仅导致病毒毒力发生变化,而且PRRS商品疫苗无法提供完全保护[12-13],可见仅依靠疫苗免疫对PRRSV 类NADC30的田间防控是不够的。本文对陕西省某规模化猪场发生的繁殖障碍母猪群进行实验室检测诊断,确诊为PRRSV类NADC30引起的猪群波动,根据检测结果制定综合防控方案,并对该防控方案的有效性进行追踪评价,以期为陕西地区规模化猪场后期有效防控此类疾病提供临床经验和技术支持。
1 基本情况
1.1 猪群发病情况
陕西省咸阳市某规模化猪场存栏基础母猪4 800头,2020年11月10日引种后备母猪200头,后备猪入场2周后后备猪群出现大规模咳嗽、呼吸困难、皮肤发红、采食量下降、急性死亡,2020年12月23日妊娠母猪群出现发热、流产,流产胎儿皮肤发红、耳尖发紫、脐带肿胀、剖检可见肺脏水肿、间质性肺炎、淋巴结肿大发青,分娩母猪产死胎、木乃伊、弱仔(0.7 kg以下)的比例增加,高达20.5%。仔猪断奶1周后出现发热、咳嗽,呼吸道症状明显,瘦弱,死亡率增加。
1.2 诊断及评估检测
1.2.1 仪器 -25℃冰箱(YCD-265),澳柯玛股份有限公司产品;离心机(D3024),大龙医疗设备有限公司产品;离心管架、加样槽、电热恒温箱(DHP-2),上海一恒科技有限公司产品;移液器(F3)、酶标仪,赛默飞世尔科技公司产品;荧光定量PCR仪,北京爱德士元亨生物科技有限公司产品;核酸提取仪,上海医脉赛科技有限公司产品。
1.2.2 试剂 猪繁殖与呼吸综合征抗体检测试剂盒和猪繁殖与呼吸综合征qPCR检测试剂盒,北京爱德士元亨生物科技有限公司产品;医脉赛磁珠法核酸提取试剂,上海医脉赛科技有限公司产品。所有样品的检测试剂为同批次试剂盒,试剂均在规定有效期内使用,猪繁殖与呼吸综合征抗体试剂盒4℃保存备用,核酸提取试剂常温保存备用,猪繁殖与呼吸综合征病原扩增试剂盒-25℃冷冻保存。
1.2.3 方法
1.2.3.1 病原检测方法 核酸提取参照医脉赛磁珠法病毒RNA提取试剂盒说明书进行病毒核酸的提取。从试剂盒中取出预分装96深孔板,颠倒混匀(目的是重悬磁珠),撕去铝箔封口膜,在样本提取孔加入200 μL样本和20 μL蛋白酶K,放置于核酸提取仪中,选择RNA提取程序运行,运行结束后收集核酸。目标病原扩增参照爱德士蓝耳猪繁殖与呼吸综合征qPCR检测试剂盒说明书进行病原扩增,取50 μL的PCR反应管,每个反应管添加10 μL PRRS检测预混液,添加10 μL RNA扩增预混液,微量振荡器震振混匀后添加5 μL样品提取核酸,将配好体系的反应管至于PCR仪中,选择扩增程序(50℃ 15 min;95℃ 1 min;95℃ 15 s,60℃ 30 s,45个循环),程序运行结束后分析结果。试验结果判断标准:在试验成立的情况下(阳性对照FAM通道有标准型“S”型曲线且Ct值<38、阴性对照FAM无“S”型扩增曲线且无Ct值),若样本对应的FAM通道有标准“S”型扩增曲线且Ct值<38则为阳性,若样本对应的FAM通道无标准“S”型扩增曲线且无Ct值则为阴性。对于试验不成立的实验样本需重新进行试验。
1.2.3.2 抗体检测方法 参照爱德士猪繁殖与呼吸综合征抗体检测试剂盒说明书,操作程序为:样品稀释(40倍稀释)-孵育(30 min)-洗板-酶标抗体孵育(30 min)-洗板-显色(15 min)-终止-读数;试验结果计算及判断标准:在650 nm处读取阴阳性对照和每个样品的OD值,在试验成立的情况下(阳性对照OD值-阴性对照OD值≥0.15且阴性对照OD值≤0.15),计算每个样本的S/P值,若S/P值<0.4为阴性,若S/P值≥0.4为阳性。对于试验不成立的样本需重新进行试验。
1.3 检测结果
1.3.1 病原检测结果 对于采集的后备舍咳嗽猪只的口鼻拭子(1~4号样本)、分娩舍流产母猪的口鼻拭子(5~8号样本)、母猪流产分泌物(9~12号样本)及流产胎儿的肺脏、脾脏和淋巴结(13~16号样本)等组织进行PRRSV病原的qPCR试验。试验结果显示,试验成立(阳性对照具有标准“S”型扩增曲线且Ct值=28.47、阴性对照FAM通道无“S”型扩增曲线且无Ct值),1~16号样本检测结果均为蓝耳病病原阳性(1~16号样本对应的FAM通道有标准“S”型扩增曲线且Ct值<38)(图1)。
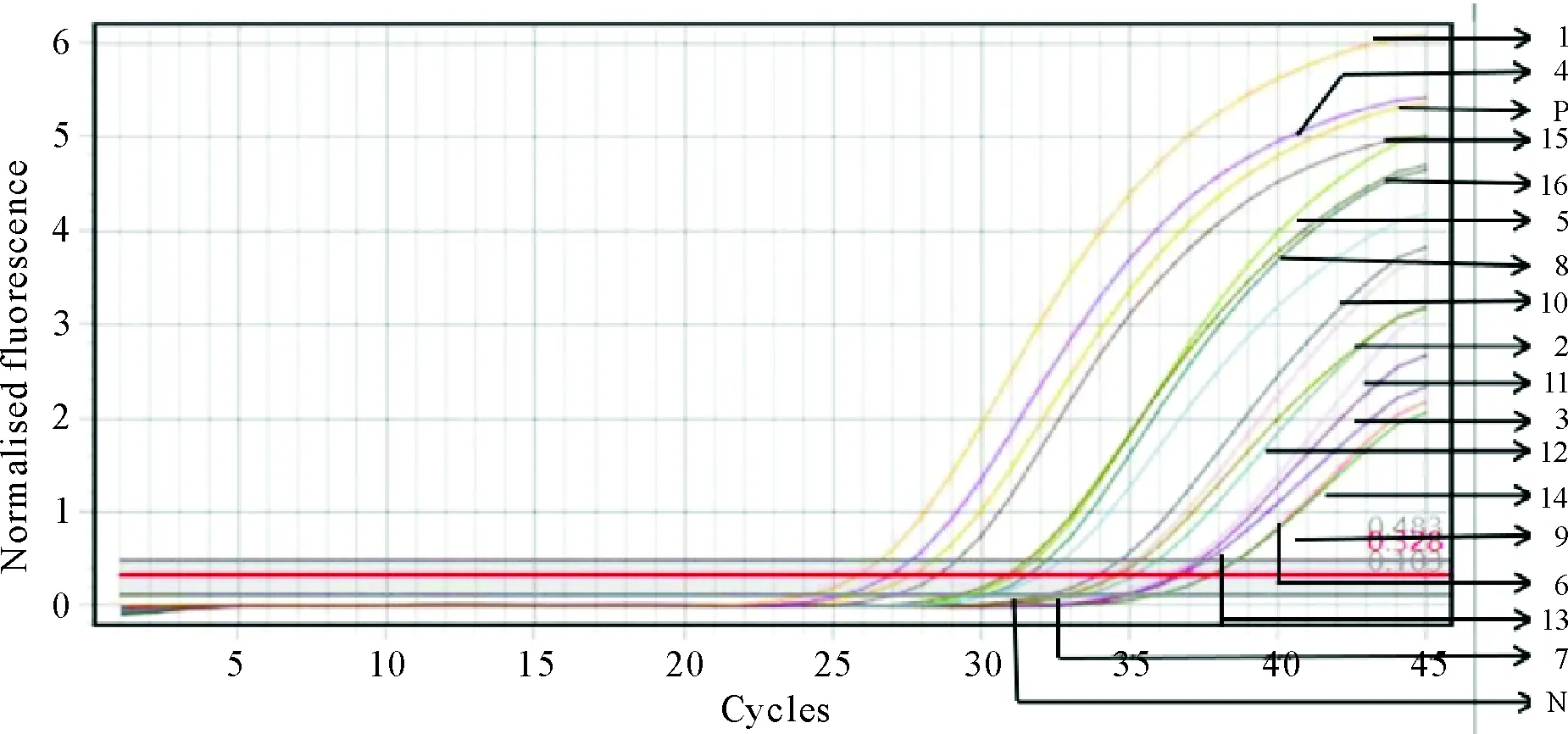
数字为样本号;P.阳性对照;N.阴性对照。Digts are sample numbers; P.Positive control; N.Negative control
1.3.2 抗体检测 对于引种前随机采集的后备舍母猪30份血清、引种1个月后随机采集的后备舍母猪30份血清、引种前随机采集的妊娠舍妊娠母猪30份血清、引种1个月后随机采集的妊娠舍妊娠母猪30份血清进行猪繁殖与呼吸综合征的抗体检测。检测结果显示,后备舍引种前猪群的抗体S/P均值为1.25、离散度为30.5%、阳性率为100%,其中S/P<0.4占比0%、0.4≤S/P<0.8占比13.3%、0.8≤S/P<1.6占比63.3%、1.6≤S/P<2.0占比23.3%、2.0≤S/P<2.5占比0%、S/P>2.5占比0%;后备舍引种后猪群的抗体S/P均值为1.64离散度为34.7%、阳性率为96.7%,其中S/P<0.4占比3.3%、0.4≤S/P<0.8占比10%、0.8≤S/P<1.6占比26.73%、1.6≤S/P<2.0占比26.7%、2.0≤S/P<2.5占比30%、S/P>2.5占比3.3%;妊娠舍引种前猪群的抗体S/P均值为1.41、离散度为26.5%、阳性率为100%,其中S/P<0.4占比0%、0.4≤S/P<0.8占比6.7%、0.8≤S/P<1.6占比66.7%、1.6≤S/P<2.0占比23.3%、2.0≤S/P<2.5占比.3.3%、S/P>2.5占比0%;妊娠舍引种后猪群的抗体S/P均值为1.83、离散度为45%、阳性率为90%,其中S/P<0.4占比10%、0.4≤S/P<0.8占比3.3%、0.8≤S/P<1.6占比23.3%、1.6≤S/P<2.0占比13.3%、2.0≤S/P<2.5占比26.7%、S/P>2.5占比23.3%(图2和图3)。
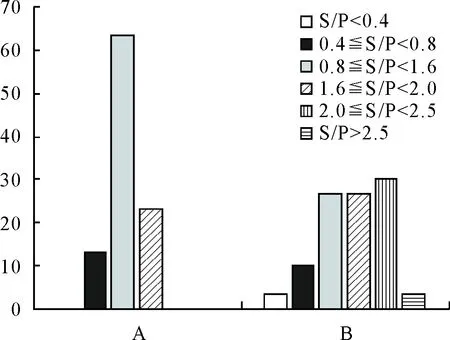
A.引种前后备猪群PRRS抗体检测结果S/P值数据分布图;B.引种一个月后后备猪群PRRS抗体检测结果S/P值数据分布图。
1.3.3 PRRSV阳性样本ORF5基因测序 将该猪场PRRSV阳性样本测序序列毒株命名为212442-1,测序的PRRSV ORF5的基因序列和国内外代表毒株序列用生物信息学软件DNASTAR和MEGA7进行同源性比对和系统进化树构建。同源性比对结果表明,该毒株ORF5基因与NADC30和类NADC30的基因相似性最高,为93.4%和91.2%,与疫苗株CH-1a,VR-2332及TJ基因相似性较低,分别为86.2%、85.7%、84.4%,进化树分析结果显示,212442-1处在NADC30和类NADC30的分支上(图4和图5)。

C.引种前妊娠猪群PRRS抗体检测结果S/P值数据分布图;D.引种一个月后妊娠猪群PRRS抗体检测结果S/P值数据分布图。
1.4 诊断结果
根据猪群临床表现,发病猪临床症状,死亡猪只的剖检变化及实验室检测结果分析,该病例诊断为PRRSV引起的猪群异常波动。
2 防控方案
2.1 生产防控措施
场内猪群紧急封群,半年内不做引种计划。猪群严格按照批次化管理,实现全进全出。加强猪场内外部生物安全管理,门口设消毒洗手盆和脚踏盆,生产人员洗澡换衣后方可进舍。用0.3%过氧乙酸带猪消毒,1周1次。产房仔猪剪牙、断尾、补铁及免疫等用具消毒剂浸泡处理,一窝一套。弱仔直接淘汰,21 d断奶仔猪全部转离母猪场。
2.2 药物治疗方案
2020年12月25日用20%替米考星+20%多西环素+电解多维(2 kg/t)给猪群保健7 d,用200 mg/L卡巴匹林钙给发烧猪只保健3 d。
2.3 疫苗免疫方案
2021年1月5日,后备猪群全群紧急免疫PRRS VR2332毒株弱毒活疫苗1头份/头,2021年1月29日后备猪全群免疫PRRS VR2332毒株弱毒活疫苗1头份/头;妊娠母猪产前40 d免疫PRRS灭活疫苗(浙江美保龙)1头份/头;仔猪14日龄免疫PRRSV VR2332毒株弱毒活疫苗1头份。
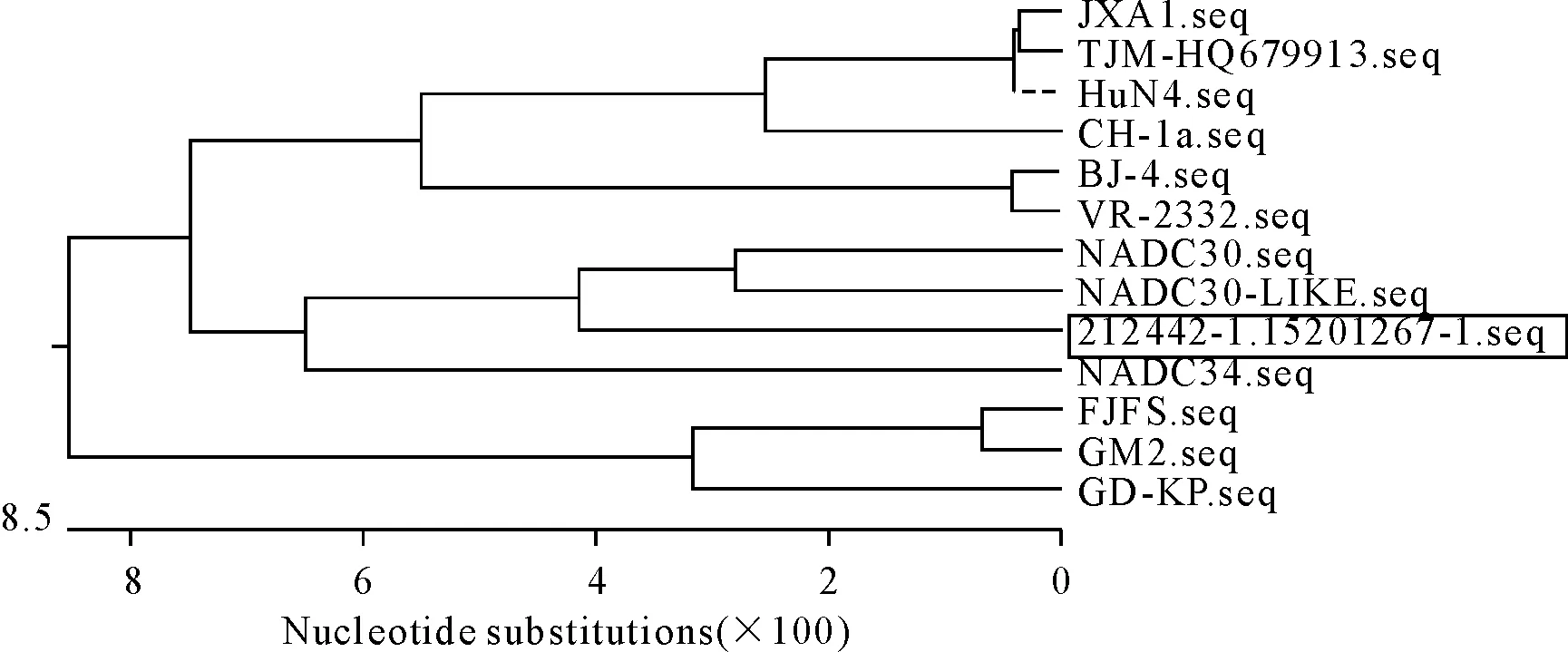
图4基于ORF5基因的进化树

图5 GP5核苷酸序列比对结果
3 防控效果
3.1 实验室检测评估
3.1.1 PRRSV病原评估
3.1.1.1 后备舍水平传播评估 在方案实施前后,对比后备舍的固定栏位环境样本的PRRSV检出情况(表1),以此来评估后备舍PRRSV水平传播情况。检测结果显示,综合防控方案实施前A1栏、A7栏、A13栏、A20栏、B4栏、B6栏、B10栏、B16栏、圈舍环境及生产工具的样本检测qPCR检测结果均为阳性;综合防控方案实施4个月后A1栏、A7栏、A13栏、A20栏、B4栏、B6栏、B10栏、B16栏、圈舍环境及生产工具的样本检测qPCR检测结果除圈舍环境为阳性(Ct=37.66)外,其余样本均为阴性。可见,经过为期4个月的综合防控方案的实施,后备舍的环境中病毒载量明显降低,间接表明猪群健康状况逐渐好转。
3.1.1.2 分娩舍垂直传播评估 在方案实施前后,对比分娩舍的仔猪脐带血的PRRSV检出情况(表2),以此评估分娩舍PRRSV垂直传播情况。检测结果显示,综合防控方案实施前随机采集分娩舍30份脐带血样本PRRSV qPCR检测结果均为阳性(PRRSV阳性检出率100%);综合防控方案实施4个月后随机采集分娩舍30份脐带血样本PRRSV qPCR检测结果除1~5号样本为阳性(Ct=37.99)外(阳性检出率为20%),其余样本均为阴性。可见经过为期4个月的综合防控方案的实施,分娩母猪的垂直传播率明显降低,间接表明猪群健康状况逐渐好转。
3.1.2 猪群PRRSV抗体评估 在方案实施前后,对比后备舍和妊娠母猪的PRRSV抗体变化,以此评估猪群的健康状况。检测结果显示,综合防控方案实施前后备母猪和妊娠母猪的PRRSV抗体平均值、离散度、阳性率及S/P>2.5的比例分别为:1.55、51.6%、100%、31%和1.34、46.7%、100%、25%;综合防控方案实施4个月后后备母猪和经产母猪的PRRSV抗体平均值、离散度、阳性率及S/P>2.5的比例分别为1.1、41%、100%、0%和1.2、43.1%、100%、0%(表3)。可见经过为期4个月的综合防控方案的实施,后备母猪和妊娠母猪的平均值和离散度均有不同程度的降低,S/P>2.5的比例明显降低。

表1 PRRSV水平传播评估结果(qPCR ct值)

表2 PRRSV垂直传播评估结果(qPCR ct值)
3.2 猪群生产成绩
根据猪场每月生产报表,统计发病时2个月和PRRS防控方案实施后4个月的窝均产仔数、窝均健子数及分娩舍死亡率,以此对比结果评估PRRS防控方案的有效性。生产成绩跟踪结果表明,发病时和防控方案实施4个月后,窝均产仔数均为12~13;发病时,窝均健子数从原来的10.16下降到8.91,综合防控方案实施4个月后,窝均健子数恢复到9.33;发病时,产房死亡率从7.5%上升至21.1%,防控方案实施4个月时,产房死亡率下降至11.3%(表4)。
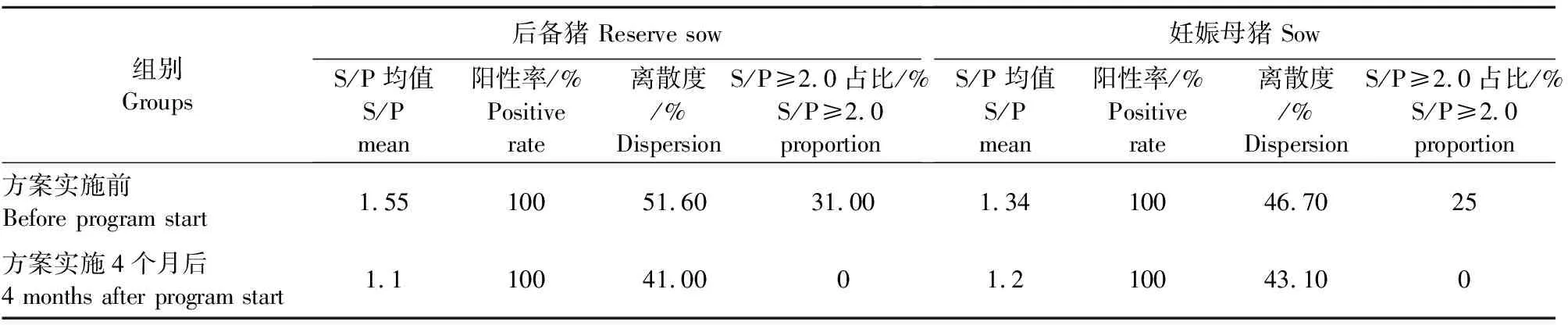
表3 PRRSV抗体检测结果
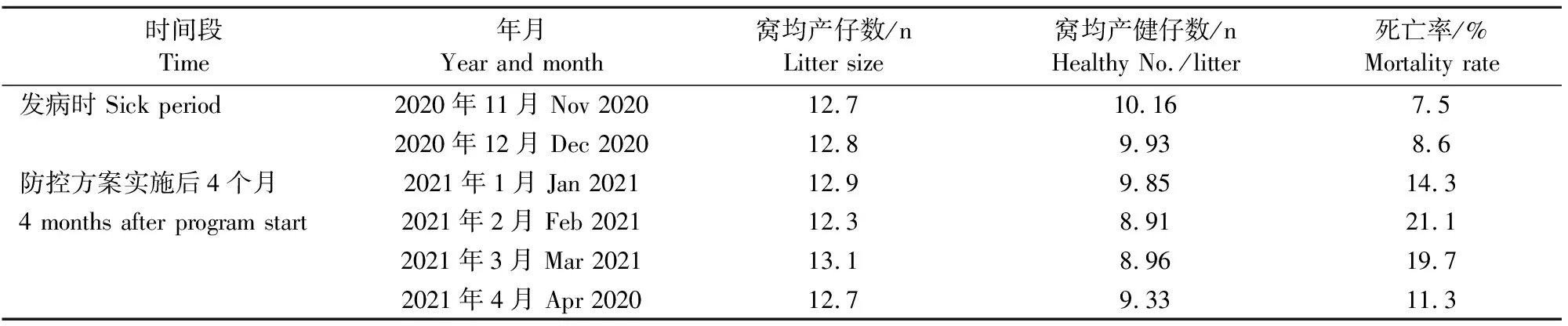
表4猪场生产成绩结果统计
3.3 防控成效
通过实验室检测评估和猪群生产成绩评估的双向评估,该综合防控方案对PRRSV NADC30引起的猪场流产风暴有效。
4 讨论
自2012年我国首次报道PRRSV NADC30以来,许多PRRSV NADC30株与国内HP-PRRSV、VR-2332之间的重组毒株相继被发现,包括HENAN-HEB、JL580、HNjz15、HNhx、TJnh1501、FJ1402、Chsx1401和HNyc15等[14-17]。有研究发现,我国中部地区HP-PRRS似乎逐渐消失,取而代之的为类NADC 30毒株[18],类NADC30是由NADC30变异而来,两者位于同一个进化分支。
临床随意更换不同毒株的弱毒苗,加之病毒间的重组变异的发生,致使田间出现多种不同毒株的混合感染,猪繁殖与呼吸综合征防控仅靠疫苗免疫达不到满意效果[19]。张洪亮等[20]通过攻毒试验评价HP-PRRS活疫苗对类NADC30的免疫保护,结果表明,HP-PRRSV活疫苗(HuN4-F112株)对类NADC30 PRRSV SD53-1603株可用提供较好的临床保护,但不能提供完全保护。段振华等[21]曾通过灭活苗和药物保健的方法成功控制了猪场类NADC30 引发的猪场大规模流产。马坚[22]比较了弱毒苗和灭活苗对类NADC30的防控效果,结果显示,弱毒苗免疫组、灭活苗免疫组和联合免疫组对类NADC30都有一定的防控效果,其中弱毒疫苗和灭活疫苗的联合免疫组效果最为显著。周磊等[23]评估了3种商用疫苗对类NADC30毒株的保护效果,发现疫苗免疫能缩短攻毒猪的发热时间、弱化临床症状、提高日增重。杨汉春[24]指出,目前没有可抵抗类NADC30毒株感染的商用疫苗,但疫苗免疫可提供一定的交叉保护。
本研究与上述文献报道结果一致,通过生产防控措施、药物保健、生物安全管控及疫苗免疫等综合防控措施,经过4个月的生产数据跟踪及检测评估,后备舍的水平传播和分娩舍的垂直传播情况均有好转,后备猪群和经产母猪群类NADC30病毒排毒情况均有降低,生产成绩也有相应的提高,PRRS防控是一个复杂而系统的工作,猪群应对蓝耳病类NADC30毒株应采取综合手段,而且应长期严格执行[25],该猪场从PRRS活跃场转为PRRS阳性稳定场还需要更长的时间。
从目前商用疫苗的效果来看,疫苗免疫不能有效阻断PRRSV的传播和发生,且疫苗本身也存在一定的安全问题[26]。在猪场生产过程中应加强生物安全管控、强化生产管理、谨慎引种、合理选择疫苗、使用PRRSV阴性精液、定期监测场内PRRS的活跃情况、通过监测剔除长期排毒猪只、高风险期闭群,以此综合防控措施来逐步实现PRRS的稳定控制或者净化。

