7 个常用草地早熟禾品种对立枯丝核菌侵染的生理响应
张露露,刘兴菊,马源,余晓媛,吴彤,马晖玲
(1. 甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2. 青海大学畜牧兽医科学院,青海 西宁 810016)
草坪是城市生态系统的重要组成部分,草坪可降低噪音强度、净化空气、调节温度、平衡生态环境,为城市居民提供洁净、舒适的生活环境。草地早熟禾(Poa praterrsis)具有适应性强、绿期长、耐践踏等优点,是草坪建植的主要草种之一,也是全世界种植最为广泛的冷季型草坪草[1]。草地早熟禾在春秋季生长旺盛,夏季生长缓慢,且不耐高温,易感病害[2]。草坪病害的发生会大大降低草坪草的经济价值和观赏性能。
褐斑病(Brown spot)又称为丝核菌褐斑病,是危害程度最为严重的草坪草病害之一[3],具有发病率高,传染范围广等特点。立枯丝核菌(Rhizoctonia solani)是草坪草褐斑病最主要的病原菌,属于土传真菌,该病原菌常以菌丝或菌核的形态存在于土壤或寄主残体上[4]。立枯丝核菌主要通过产生侵染垫、菌丝圈等侵染结构直接穿透植物叶片、叶鞘和茎秆表皮[5],吸取寄主养分,破坏原有组织细胞结构,引起叶腐、鞘腐和茎基腐,出现椭圆形或不规则形黄褐色叶斑[2],最终导致植物褪绿黄化、萎蔫,甚至死亡。
在草坪防治过程中使用大量的化学药剂不仅降低植物本身抵抗病害的能力,还造成严重的土地污染、水污染和空气污染。因此,草坪病害的研究对于生态环境可持续发展至关重要。目前国内对于草地早熟禾的研究,主要集中在盐胁迫[6]、温度胁迫[7]、干旱胁迫[8]及重金属胁迫[9]等非生物因素引起的生理生化变化方面。而对于草地早熟禾感染褐斑病的相关研究鲜见报道较少。本试验以国内草坪建植中常用的7 个草地早熟禾品种作为材料,通过研究不同草地早熟禾品种在褐斑病病原菌短时期胁迫下的基础生理响应,综合评价不同材料的抗病性,以期为后期草坪草的抗性诱导研究奠定理论基础,同时为草坪草病害防治工作及草坪建植时良种选择提供参考。
1 材料和方法
1.1 试验材料
7 个草地早熟禾品种:巴润(Baron)、公园(Park)、纳苏(Nassau)、蓝宝石三代(Sapphire 3rd generation)、福临门(Fulinmen)、优美(Over glade)和橄榄球2 号(Rugby 2),均购自北京克劳沃草业技术开发中心。褐斑病病原菌:立枯丝核菌购自中国科学院菌种保存中心。
1.2 试验方法
1.2.1 植物材料制备和处理 种子清洗:将供试种子弃去杂质和有虫蚀及成熟度较低的种子,用无菌水侵泡5 h,乙醇(70%)浸泡1 min,次氯酸钠(20%)浸泡15~20 min,用蒸馏水冲洗6~7 次,至刺鼻酸味消失为止,将其放置于室内,自然阴干。
幼苗种植:将土壤、细沙、蛭石混合(体积比1∶1∶1)在180 ℃烘箱中灭菌3 h,以充分杀菌。冷却后装入直径为10 cm,高度为8 cm 的育苗钵中,充分浸水。将不同草地早熟禾种子均匀撒播在育苗钵中,表面覆沙,放置于恒温培养室。培养条件为光照16 h/d、23 ℃,黑暗8 h/d、20 ℃。
1.2.2 草地早熟禾褐斑病接菌方法及严重度分级PDA 培养基上接入立枯丝核菌,用石蜡封口膜封口。将其倒置于光照14 h/d、25 ℃,黑暗10 h/d、20 ℃的恒温培养箱中,培养7 d。
接菌物制备:参考Cortes⁃Barco 等[10]的接菌物制备方法并改进。用无菌水完全浸泡500 g 麦粒,隔夜,晾干水分后放置于240 mL 组培瓶中,约占瓶体积1/2,加盖封口膜,连续灭菌3 次,冷却后用打孔器打取立枯丝核菌PDA 生长物,接入麦粒组培瓶中,混匀后于恒温培养箱中培养14 d。每天摇晃使麦粒充分被病原菌侵染,待麦粒充分长满菌丝后,颜色呈现深褐色时,将其倒入托盘中在通风处阴干,完全干硬后粉碎成粉末状,放置在4 ℃冰箱备用。
幼苗接菌:幼苗生长30 d 后,对其接种立枯丝核菌,每个育苗钵中施入0.3 g 接菌物。接菌时,先对幼苗喷水雾,使植物叶片湿润,然后向叶片均匀撒播病原菌粉末,保温罩遮盖,放置于恒温培养室。参考陈海波[11]对草坪草褐斑病的研究方法,在接菌后第3、9、15 天,观察并统计病情。草地早熟禾褐斑病严重度分级标准如表1。

表1 草地早熟禾褐斑病严重度的分级标准Table 1 Classification criteria for severity of brown spot ofPoa pratensis
发病率(%)=发病叶数/调查叶片总数×100%
病情指数=100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)。
1.2.3 指标测定 接菌后第0,3,9,15 天分别采样,每个样0.2 g,每个指标3 个重复。用锡箔纸装袋,封口,经液氮冷冻后放置在-80 ℃下冷藏备用。用于测定生理生化指标。
生理指标测定:叶绿素(Chlorophyll,Chl)含量采用乙醇浸提法;相对电导率(Relative electrical conduc⁃tivity,REC)采用电导仪测定;丙二醛(Malondialde⁃hyde,MDA)含量采用硫代巴比妥酸法测定[12];可溶性糖(Soluble sugar,SS)含量采用蒽酮比色法测定[12];可溶性蛋白(Soluble protein,SP)含量采用考马斯亮蓝染色法测定[12];游离脯氨酸(Proline,Pro)含量采用茚三酮 显 色 法 测 定[12];过 氧 化 氢(Hydrogen peroxide,H2O2)含量采用碘化钾分光光度法测定[12];超氧化物歧化酶(Superoxide dismutase,SOD)活性采用氮蓝四唑法测定[12];过氧化物酶(Peroxidase,POD)活性采用愈创木酚法测定[12];过氧化氢酶(Catalase,CAT)活性、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)活性和谷胱甘肽还原酶活性(Glutathione reductase,GR)均采用紫外分光光度法测定[12]。
1.2.4 数据处理 采用SPSS 19.0 系统软件分析数据,采用单因素Anova 对多组样本进行分析处理,Duncan’s 新复极差法进行显著性方差分析;采用Mi⁃crosoft Excel 2010 绘制图表。
运用隶属函数平均值(D值)法[13],对各指标进行标准化处理。

式中,Xj为指标测定值;Xmin和Xmax分别为所有参试材料某一指标的最小值和最大值;若指标与抗病性呈正相关用公式(1),指标与抗病性呈负相关用公式(2)。
采用加权单因子法将各指标叠加,获得每个品种抗病性的综合评价D值:D=1/n∑=R(Xi)
抗性评定等级[14]:0.70≤D≤1.00,高抗(High re⁃sistance,HR);0.50≤D<0.70,中 抗(Medium resis⁃tance,MR);0.30≤D<0.50,感病(Susceptible,S);0.1≤D<0.3,中 感(Medium susceptible,MS);D<0.10,高感(Highsusceptible,HS)。
2 结果与分析
2.1 不同草地早熟禾品种接种立枯丝核菌后的病情统计
随病原菌胁迫天数的延长,7 个草地早熟禾品种的发病率和病情指数都在逐渐增大,且差异显著(P<0.05)(表2)。胁迫3 d 时,植株上部叶片或边缘出现白色斑点。纳苏的发病率和病情指数最大,分别是17.52%和8.51,之后依次是公园、橄榄球2 号、巴润和优美,其发病率和病情指数均显著高于蓝宝石三代和福临门(P<0.05)。胁迫15 d 时,植株叶片上形成黄褐色病斑。公园、纳苏的发病率和病情指数分别达到69.36%、为48.14 和73.27%、52.65,显著高于其他5 个品种(P<0.05)。巴润、橄榄球2 号和优美的发病率和病情指数均在45%~65% 和25~45,蓝宝石三代、福临门的发病率和病情指数最低,抗病能力最强。
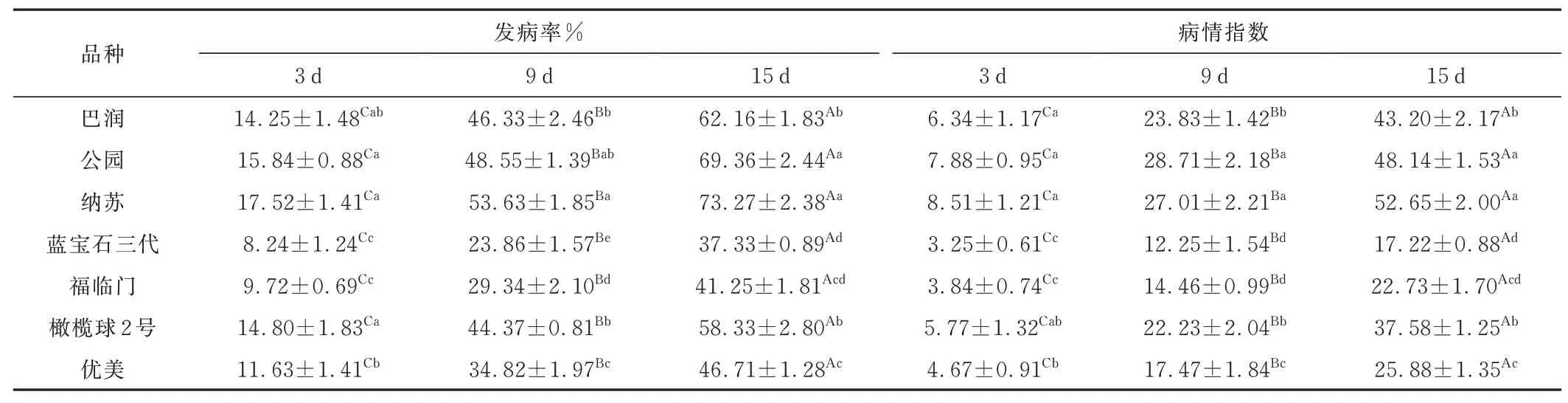
表2 病原菌胁迫下7 个草地早熟禾品种的病情统计Table 2 Disease statistics of sevenPoa pratensismaterials under pathogen stress
2.2 不同草地早熟禾品种接种立枯丝核菌后的生理特性变化
2.2.1 病原菌胁迫下草地早熟禾叶绿素含量的变化 胁迫3 d 时,蓝宝石三代、福临门和优美的Chl 含量无明显变化(P>0.05),而巴润、公园、纳苏和橄榄球2 号的Chl 含量均有下降,其中公园的Chl 含量降幅18.7%,差异显著(P<0.05)。之后随病原菌胁迫时间延长,7 个品种的Chl 含量整体呈现逐级递减趋势。胁迫15 d 时,蓝宝石三代、福临门和优美的Chl 含量降幅较小,依次为27.2%、30.7%、31.9%,具有显著差异(P<0.05),其 叶 片Chl 含 量 均 高 于 其 他4 个 品种(图1)。
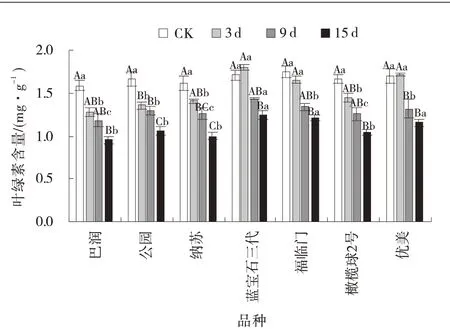
图1 病原菌胁迫下草地早熟禾叶绿素含量Fig.1 Chlorophyll content ofPoa pratensisunder pathogen stress
2.2.2 病原菌胁迫下草地早熟禾相对电导率和丙二醛含量的变化 7 个草地早熟禾品种体内的REC 和MDA 含量随病菌胁迫时间的延长均呈逐渐升高的趋势(图2)。当病原菌胁迫9 d 时,巴润、蓝宝石三代、福临门、橄榄球2 号和优美的REC 达到最大,与CK 相比差异显著(P<0.05)。其中蓝宝石三代、福临门和优美的细胞膜结构自身恢复能力较强,故它们的REC 值在胁迫后期有所降低。而在胁迫15 d 时,公园和纳苏的REC 依然持续上升,电解质外渗严重,与CK 相比上升幅度分别达到40.1%和42.9%,差异显著(P<0.05)(图2⁃A)。

图2 病原菌胁迫下草地早熟禾相对电导率和丙二醛含量Fig.2 REC and MDA content ofPoa pratensisunder pathogen stress
2.2.3 病原菌胁迫下草地早熟禾渗透调节物质的变化 蓝宝石三代和福临门品种在未受到外界环境胁迫时,叶片中含有的Pro 含量较高,自我调节能力强。在胁迫期间虽Pro 含量上升,但和CK 差异不显著(P>0.05)。在胁迫15 d 时,橄榄球2 号和优美的Pro 含量持续上升,增幅分别为32.1%和40.8%,和CK 差异显著(P<0.05)。巴润的Pro 含量在胁迫期间变化幅度小,后期下降与CK 差异显著(P<0.05)。纳苏的Pro 含量几乎无变化。公园的Pro 含量在胁迫3 d 时突增,增幅为67.3%,和CK 差异显著(P<0.05),9 d 保持稳定,15 d 时突降,与CK 含量一致,该品种的抗性极不稳定(图3⁃A)。
7 个草地早熟禾品种的SS 含量随病原菌胁迫天数的增加而增加,并在胁迫后期呈现快速积累(图3⁃B)。在胁迫3 d 时,纳苏和福临门的SS 含量与CK 相比差异显著(P<0.05),其他5 个品种的SS 含量变化不明显。在胁迫9 d 时,巴润、公园和福临门的SS 含量在升高后保持相对稳定,与CK 相比具有显著差异(P<0.05)。其中,福临门的SS 增幅最大,公园的SS增幅最小,分别为83.1%和49.7%。而其他4 个品种的SS 含量均呈梯度式增加,并在胁迫15 d 时,其叶片中SS 含量达到最高,与CK 差异显著(P<0.05)。
7 个草地早熟禾品种的SP 含量随着病原菌胁迫天数的增加,最终都呈现下降趋势(图3⁃C)。其中蓝宝石三代和福临门品种本身含有的SP 高于其他5 个品种。在胁迫期间,公园、纳苏、福临门和橄榄球2 号的叶片中SP 含量逐级下降。而其他3 个品种的SP 含量在胁迫3 d 时均有小幅上升,其中巴润和优美的SP含量与CK 相比增加8.8%和10.9%,差异显著(P<0.05),之后逐渐下降。纳苏的SP 含量降幅最大,达到41.1%,和CK 差异显著(P<0.05)。
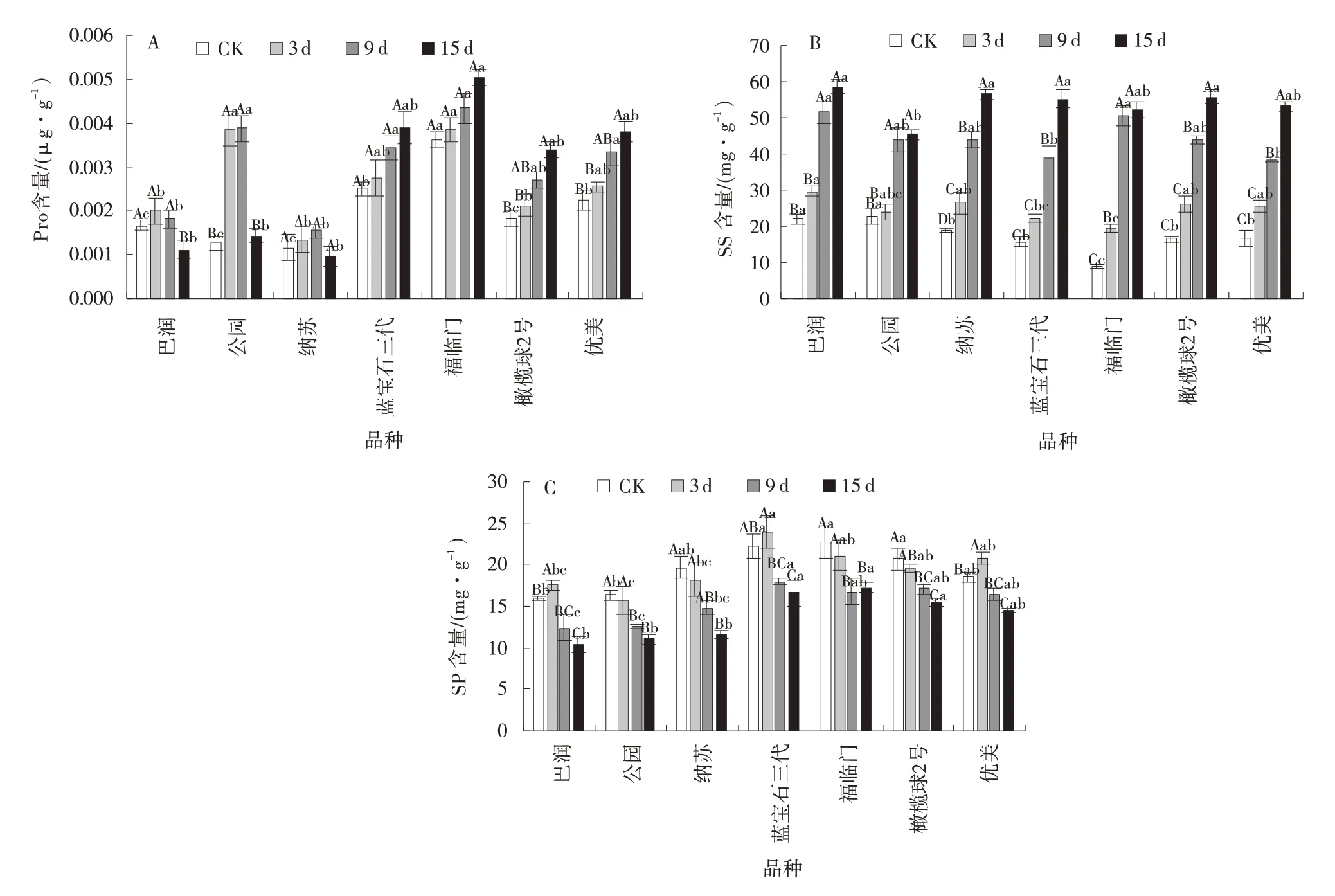
图3 病原菌病原菌胁迫下草地早熟禾游离脯氨酸、可溶性糖和可溶性蛋白含量Fig.3 Pro、SSand SP content ofPoa pratensisunder pathogen stress
2.2.4 病原菌胁迫下草地早熟禾H2O2含量的变化7 个草地早熟禾品种叶片中的H2O2含量随着病原菌胁迫天数的增加呈逐渐上升趋势(图4)。在胁迫初期,除公园外,其他6 个品种体内的H2O2含量增加不明显(P>0.05),7 个品种在后期H2O2含量都快速积累。在胁迫9 d 时,蓝宝石三代、福临门、橄榄球2 号和优美的叶片中积累的H2O2含量,与CK 相比差异显著(P<0.05),并在胁迫15 d 依然保持稳定。而巴润、公园和纳苏的H2O2含量在胁迫中后期大量积累,并呈现阶梯式增加,胁迫15 d 时增幅分别达到78.4%、81.3%和65.5%,与CK 差异显著(P<0.05)。

图4 病原菌胁迫下草地早熟禾过氧化氢含量Fig.4 H2O2content ofPoa pratensisunder pathogen stress
2.2.5 病原菌胁迫下草地早熟禾抗氧化酶活性的变化 在病害较轻时,除优美外,其他6 个草地早熟禾品种的SOD 活性变化不显著(P>0.05),后期稳定上升。(图5⁃A)在胁迫9 d 时,蓝宝石三代、福临门和优美的SOD 活性与CK 相比增幅依次为49.5%、38.4%和37.4%,差异显著(P<0.05),之后保持稳定。在胁迫15 d 时,巴润、纳苏和橄榄球2 号的SOD 活性达到最大,增幅依次为47.9%、44.6%和42.0%,差异显著(P<0.05)。而公园的SOD 活性在胁迫期间变化不明显(P>0.05)。
7 个草地早熟禾品种的POD 活性随病原菌胁迫天数的增加均呈现不同程度的上升(图5⁃B)。当没有病原威胁时,蓝宝石三代和福临门叶片中含有的POD活性远高于其他5个品种,差异显著(P<0.05)。当病原菌胁迫9 d时,蓝宝石三代、福临门、橄榄球2号和优美的POD 活性上升到最大值,与CK 相比差异显著(P<0.05),之后保持稳定。而在胁迫15 d时,公园的POD 活性依然上升,增幅为25.0%,差异显著(P<0.05)。巴润和纳苏的POD活性在胁迫期间变化不明显。
7 个草地早熟禾品种的CAT 活性随病原菌胁迫天数的增加而下降(图5⁃C)。在胁迫3 d 时,蓝宝石三代和福临门的CAT 活性小幅上升。而公园、纳苏和橄榄球2 号的CAT 活性下降明显,降幅分别为19.1%、16.5% 和14.0%,与CK 差 异 显 著(P<0.05)。在胁迫9 d 时,除纳苏外,其他6 个品种的CAT 活性均下降到稳定值,后期无明显变化。而纳苏CAT 活性在胁迫15 d 时下降到最低,降幅为35.8%,与CK 差异显著(P<0.05)。

图5 病原菌胁迫下草地早熟禾SOD、POD 和CAT 活性Fig.5 SOD、POD and CA activities ofPoa pratensisunder pathogen stress
2.2.6 病原菌胁迫下草地早熟禾APX 和GR 活性的变化 7 个草地早熟禾品种的APX 活性随着胁迫天数的延长呈先快速升高再下降的变化趋势(6⁃A)。其中巴润、蓝宝石三代、福临门和优美的叶片在受到原菌侵染3 d 时,细胞中APX 活性增到最高,增幅依次为47.7%、37.7%、37.7%和39.2%,与CK 相比差异显著(P<0.05)。之后活性下降,保持稳定,并高于CK。而公园、纳苏和橄榄球2 号的叶片受侵染严重,其APX 活性在胁迫9 d 时依然保持上升,与CK 之间差异显著(P<0.05),并在胁迫15 d 时APX 活性才有所下降。
第二是日用品的改变导致的谜语费解。从前的一些日用品已经或者行将淘汰,以之为谜底的谜语就令年轻人费解,自然面临着被淘汰的命运。如例11的谜底“火钳”,例12的谜底“草鞋”,现在在城镇甚至在一些乡村都已经很难觅其踪迹了,其谜语的费解是显而易见的:
在病原菌胁迫3 d 时,7 个草地早熟禾品种的GR活性都快速增加,与CK 相比差异显著(P<0.05)(图6⁃B)。之后随着胁迫天数的延长,巴润、公园和纳苏GR 活性又快速降低,并保持稳定,与CK 之间无显著差异。而蓝宝石三代、福临门、橄榄球2 号和优美的GR 活性下降缓慢。其中福临门的GR 活性保持最稳定,能高效清除体内积累的H2O2。
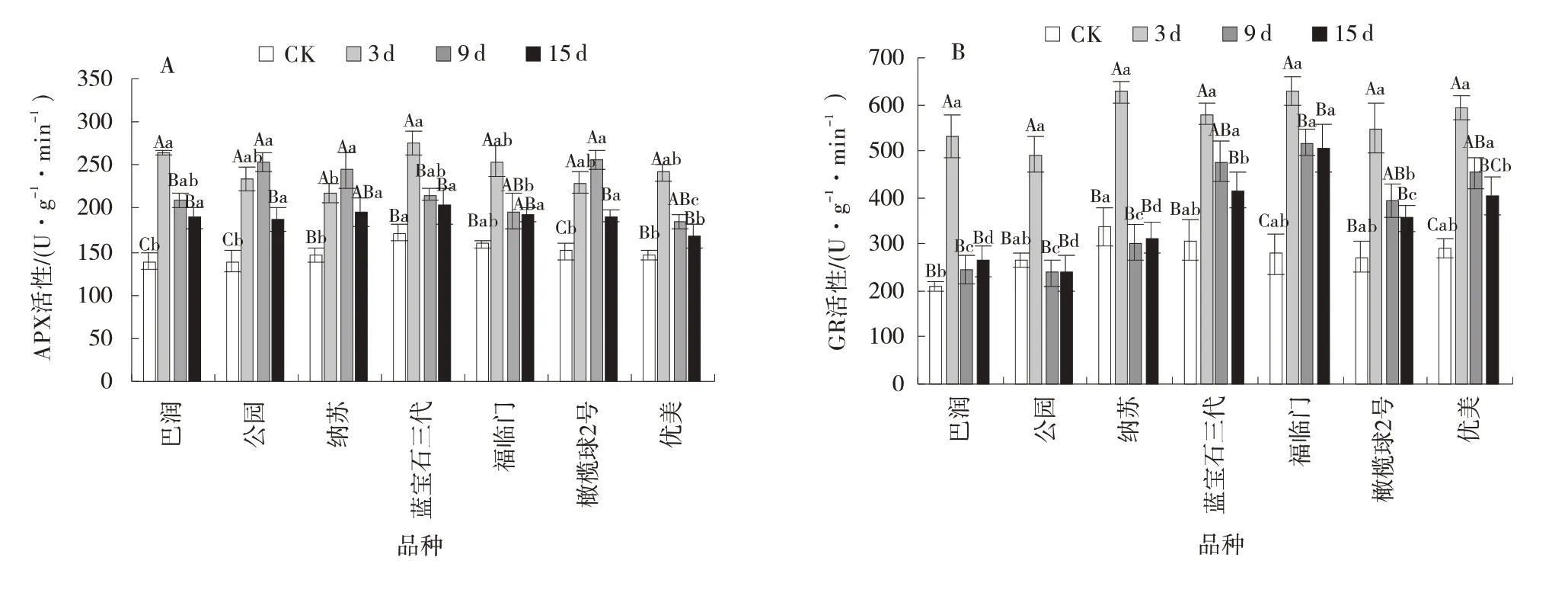
图6 病原菌胁迫下草地早熟禾的APX 和GR 活性Fig.6 APX and GR activities ofPoa pratensis underpathogen stress
2.3 抗病性综合评价
通过隶属函数法对7 个草地早熟禾品种在15 d 内的各抗性生理指标平均值进行综合评价(表3)。D值为0.23~0.69。蓝宝石三代、福临门和优美的D值为0.50~0.70,属于中抗品种,其中蓝宝石三代的D值为0.69,综合抗病能力最强。巴润、公园和橄榄球2 号的D值为0.30~0.50,为感病品种。纳苏的D值为0.23,为中感品种。因此,7 个草地早熟禾品种对褐斑病的抗性强弱依次为:蓝宝石三代>福临门>优美>橄榄球2 号>巴润>公园>纳苏。
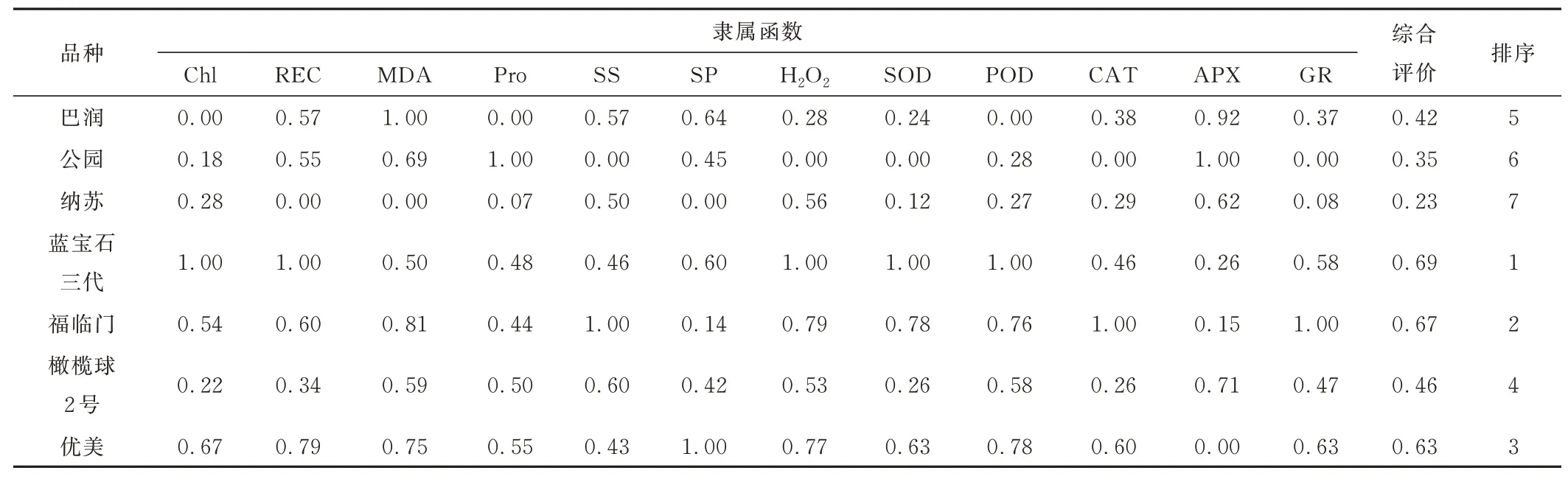
表3 病原菌胁迫下7 个草地早熟禾品种的抗病性综合评价(D值)Table 3 Comprehensive evaluation of disease resistance(D value)of sevenPoa pratensis materials under pathogen stress
3 讨论
3.1 7 个草地早熟禾品种接种立枯丝核菌后的病情
本试验对7 个草地早熟禾品种接种立枯丝核菌后的发病率和病情指数统计结果表明,在不同时间下,抗病品种和感病品种的发病率和病情指数都在逐渐增加,且差异显著。在同一时间下,抗病品种和感病品种的发病率和病情指数差异显著。7 个草地早熟禾品种在胁迫期间的病情指数大小依次为:纳苏>公园>巴润>橄榄球2 号>优美>福临门>蓝宝石三代。有研究表明蓝宝石品系的幼苗色泽深绿,根系发达,具有极强的抗寒、抗旱和抗病能力,可作为草皮卷生产的专用品种[15]。王跃栋等[14]对北京地区生长的不同草地早熟禾品种感染褐斑病的病情进行比较,结果表明公园和橄榄球2 号的发病率低,属于抗病品种。同一品种出现差异的原因可能是不同地区,不同时期及不同的培养方式的差异造成的。
3.2 不同草地早熟禾品种接种立枯丝核菌后的生理特性变化
叶绿素为植物进行光合作用合成化合物提供基础保障。病原菌入侵植物细胞内,与叶绿体相互作用,使叶绿素合成受阻。徐秉良等[16]在研究南瓜与白粉病的相互作用中指出,叶片内叶绿素含量高低与植株抗性强弱呈正相关性。Yang 等[17]通过对水稻纹枯病菌(立枯丝核菌)毒素的研究,发现该病菌会严重损伤水稻叶片组织,使叶片光合能力逐渐下降。本研究中,抗病品种的叶绿素含量在病害初期保持稳定,有微弱升高变化。在病害后期含量下降明显,并维持在一定水平范围。在病原菌胁迫期间感病品种的叶绿素含量持续性下降,降幅普遍大于抗病品种,在病害后期植株叶片均出现不同程度的黄化,叶尖干枯等现象。
植物在遭受病害入侵时,细胞膜通透性增大,电解质渗漏、膜脂过氧化是早期最显著的生理变化。本研究中,抗病品种的REC 和MDA 含量先升后降,表明抗病品种的细胞膜自身恢复能力好,抗氧化能力强,毒害效应低。感病品种的MDA 含量在病害后期突增,远大于CK,REC 维持在较高水平。表明感病品种的机械防御能力弱,应激反应慢。张正禹等[18]的研究发现立枯丝核菌改变膜透性的主要机理是毒素与降解酶对植物细胞膜脂和膜蛋白的破坏。葛秀春等[19]研究水稻与稻瘟病菌的互作后发现,REC 和MDA 含量明显增加,且与品种抗性呈负相关,这与本研究结果一致。
植物体内,游离脯氨酸、可溶性糖和可溶性蛋白作为渗透调节剂维持细胞水分平衡。研究表明细胞中脯氨酸的积累与抗渗透胁迫之间有显著的正相关[20]。本研究中,抗病品种与感病品种相比,本身含有的Pro 含量高,渗透调节能力强。感病品种巴润和纳苏含有的Pro 含量低,在胁迫过程中该调节机制并未发挥作用,后期严重失调。公园的Pro 含量在初期突增,后期突降,抗病能力极不稳定。感病品种脯氨酸渗透调节机制在病原菌大量入侵时被严重破坏。因此,可得出草地早熟禾本身脯氨酸含量的高低是评价其抗病能力的重要指标。
可溶性糖作为小分子溶质,为植物提供碳能量,对细胞膜和原生质胶体起到稳定巩固作用,有效抵御逆境伤害。本研究中,7 个草地早熟禾品种的SS 含量在病原菌胁迫后期快速积累用来加固细胞壁垒,抵抗菌丝的入侵和扩展,抗病品种福临门的SS 积累量显著高于感病品种公园。可溶性蛋白可为植物细胞提供基础营养物质。李妮亚等[21]的研究表明植物在受到生物胁迫和非生物胁迫时,其体内正常的蛋白质合成常会受到抑制。本研究结果表明,7 个草地早熟禾品种在受到病原菌入侵后,SP 含量变化最终呈现下降趋势。抗病品种的SP 含量下降幅度小于感病品种。这可能与ROS 浓度有关,高浓度ROS 会大批量进攻蛋白质的疏基或氨基酸残基,使蛋白质的多肽链发生断裂而失活,造成细胞内蛋白质含量迅速降解[22]。张笑宇[23]的研究认为马铃薯在感染黑痣病过程中,SS 含量与抗病无显著相关性,SP 含量越低越抗病。这可能是立枯丝核菌侵染不同的受体后产生的不同抗性表现。
过氧化氢作为活性氧(Reactive oxygen species,ROS)的一种类型,性质活泼,存在于植物体的多个部位中。在病原物入侵时,机体产生的H2O2在低中等浓度条件下,可抑制真菌孢子萌发和菌丝生长,参与细胞壁木质化,诱导植保素合成,引发细胞过敏性反应等一系列防御措施[24]。若细胞中产生H2O2的速度大于或远超于机体清除H2O2的速度,则会使H2O2浓度过高,产生氧化伤害[25]。本研究中,抗病品种在胁迫后期,H2O2含量在抗氧化酶的抑制作用下保持稳定,体内H2O2处于动态平衡状态。感病品种的H2O2含量持续上升,在胁迫后期增加量较大。可能是感病品种体内产生的H2O2破坏了抗氧化酶的结构,降低了酶活性,造成细胞内H2O2过量积累。因此,在本次研究中H2O2变化可以作为草坪草病情评价的重要指标之一。
3.3 病原菌胁迫下草地早熟禾抗氧化酶类活性的变化
活性氧清除酶系统的存在,使得植物体内活性氧代谢保持在低水平动态平衡之中。SOD 催化超氧阴离子自由基(O2·-)形 成H2O2,POD 和CAT 协调配合,清除过量的H2O2,减轻植物氧化伤害[26]。本研究中抗病品种在受病原菌胁迫后,SOD 活性增加速度快,稳定性高,POD 活性增加幅度大,CAT 活性下降范围小。感病品种的SOD 活性在病害后期明显上升,POD 活性上升变化小,CAT 活性下降范围大。这表明感病品种在病原菌入侵时,体内抗氧化酶系统的感应能力弱,防御反应发生迟缓,不能够及时有效的清除ROS。后期ROS 浓度上升,破坏酶结构,降低酶含量水平。李捷等[27]的研究表明对枸杞接种尖孢镰孢菌后,野生品种的SOD 和POD 活性增加量高于栽培品种,CAT 活性持续时间长,并认为酶活性的增加是枸杞抗镰孢菌根腐病能力的重要指标。这与本研究结果一致。
细胞内过量的H2O2也可通过抗坏血酸-脱氢抗坏血酸-谷胱甘肽循环系统清除,其中APX 和GR 是主要组成酶[28]。当植物受到外界逆境胁迫时,APX 可将过量的H2O2脱氢还原为水分子,与CAT 相比APX清除更快速、更精确。GR 是一种黄素蛋白氧化还原酶,在胁迫条件下对清除H2O2起关键作用[29]。本研究中7 个草地早熟禾品种在接种立枯丝核菌后,APX 和GR 活性都表现为快速增加。抗病品种的APX 增加速度快,有效减少H2O2积累,后期下降维持稳定。GR 活性在病害胁迫后期维持在高水平,在清除ROS 伤害中起到重要作用。感病品种的APX 活性维持在相对较高水平,持续性清除不断升高的H2O2。GR 活性在病害后期与CK 相比变化不明显,其中,公园和纳苏的GR 活性低于CK。这表明H2O2积累已严重破坏细胞结构,使酶液中GR 活性降低。本研究结果表明抗病品种的酶系统在清除ROS 方面明显强于感病品种。
4 结论
7 个草地早熟禾品种对立枯丝核菌抗病性强弱依次为:蓝宝石三代>福临门>优美>橄榄球2 号>巴润>公园>纳苏。在病原菌胁迫期间,抗病品种的叶片细胞膜质过氧化程度低,渗透调节能力强,病原抑制效应要明显好于感病品种。同时植物细胞中渗透调节物质的积累量以及抗氧化酶系统的应激清除力,是评价植物抗病性强弱的关键,其共同作用调控着细胞结构和功能的稳定性。

