ALKBH5对人肝癌细胞上皮间质转化的影响
孙姚承, 汤建军, 魏 来, 杭苏宁,仓 杰, 王梦涛, 奚剑波
(1. 江苏大学附属武进医院/徐州医科大学武进临床学院 普通外科, 江苏 常州, 213002;2. 江苏大学医学院, 江苏 镇江, 212013)
肝细胞癌(以下简称肝癌)是最常见的恶性肿瘤之一,也是导致癌症相关性死亡的主要原因[1]。肝癌起病隐匿, 70%~80%的肝癌患者确诊时己是晚期,经诊断后平均存活时间仅约6个月, 5年总生存率低于19%[2]。目前,临床治疗肝癌的主要方法有外科手术肝脏切除、介入治疗、肝移植、化疗等,外科手术肝脏切除为首选治疗方法[3]。但肝癌患者肝切除后5年复发率高,其初期症状不明显,不能早期筛查,多数发现时已处于中晚期,且已无手术指征[4]。当前肝癌治疗效果不佳,是由于其肿瘤形成的分子机制尚不清楚。因此,临床人员亟需揭示肝癌发生发展的机制,寻找有效的治疗方式以改善肝癌患者预后。
N6-甲基腺嘌呤(m6A)修饰普遍存在于各种类别的RNA中,其中以信使RNA较为多见,表观转录组学研究[5]发现,其丰度水平直接影响转录后的表达。ALKBH5作为m6A修饰中非常重要的一个元件,其与多种肿瘤的临床预后有关,通过不同的分子机制影响肿瘤的进程。但ALKBH5在肝癌进程中的作用尚未阐明,故本研究挖掘了ALKBH5的表达与临床各项指标参数的内在关系,成功构建shRNA干扰质粒,筛选出稳定低表达ALKBH5的细胞株,探讨ALKBH5对肝癌细胞生物学功能中迁移、侵袭及上皮间质转化(EMT)作用的影响。
1 材料与方法
1.1 材料
1.1.1 细胞培养及转染: 本实验中所用的正常肝细胞系LO2以及2种肝癌细胞系SMMC-7721、HepG2由江苏大学附属武进医院中心实验室保存,所用培养基为DMEM与10%胎牛血清混合而成,在恒温、恒湿培养箱内孵育。在www.sigmaaldrich.cn/网站找到验证后的shALKBH5 oligos序列,上游序列5′-CCGGGAAAGGCTGTTGGCATCAATACTCGAGTATTGATGCCAACAGCCTTTCTTTTG -3′, 下游序列5′-AATTCAAAAAGAAAGGCTGTTGGCATCAATACTCGAGTATTGATGCCAACAGCCTTTC-3′。按照慢病毒包装试剂盒说明书,使用pLKO.1-TRC载体质粒、穿梭质粒psPAX2和包装质粒pMD2. G共同构建相应质粒,同时把干扰质粒sh-EGFP/sh-ALKBH5及其他2种质粒共转染入293T细胞,转染4~6 h后更换为培养基,放入温箱孵育,细胞培养2 d后,吸管吸取富含慢病毒颗粒的培养基液体备用。
转染前24 h, 取适当的处于对数生长期的细胞消化,用完全培养基重悬后将数量合适的细胞接种至6孔板中(大约为5×105个/孔),保证细胞在孔中分布均匀。转染前30 min, 吸管吸去培养皿中原有液体,加入新鲜的DMEM培养基,要求不含有抗生素及血清。根据分组配制慢病毒转染液,加入相应培养孔中,轻轻晃动混匀,置37 ℃、5% CO2、饱和湿度下继续进行培养。4~6 h后吸管吸去培养皿中原有液体,培养箱中继续孵育24~48 h。
1.1.2 主要试剂: DMEM、反转录试剂盒、ECL试剂盒均由美国Thermo公司生产; 兔抗人EMT抗体试剂盒购自美国Cell Signaling公司; LipofectamineTM 2000购自美国Invitrogen公司; 30%丙烯酰胺购自中国上海Takara公司产品; Tris-HCl(pH值8.8、pH值6.8)为中国康为世纪公司产品; Marigel基质胶购自美国BD公司; 2×SYBR Green实时定量PCR预混合溶液购自美国Bioworld公司; Transwell小室购自美国Corning公司; 鼠抗人β-Tubulin购自美国Santa Cruz公司; RNA抽提Trizol试剂由Takara中国大连有限公司生产; 胎牛血清购自美国Gibco公司; PVDF膜购自美国Millipore公司; 引物合成购自南京金斯瑞生物科技公司; 鼠抗人ALKBH5抗体购自美国Sigma公司。
1.1.3 纳入病例: 本实验采集2016年1月—2020年1月江苏大学附属武进医院收治的50例肝癌患者的肝癌组织,所有患者均签署知情同意书。纳入标准: 在本科进行手术治疗者,手术病理结果为肝细胞癌者; 术前预计生存时间大于3月者。排除标准: 已接受肝癌手术治疗者; 已接受肝动脉化疗栓塞术(TACE)治疗或化疗者; 合并其他恶性肿瘤疾病者。具体实施计划、方案经医院伦理委员会批准。
1.2 方法
1.2.1 实时荧光定量聚合酶链反应(qRT-PCR): 细胞RNA提取的步骤参考Trizol试剂说明书,随后进行PCR建立实时扩增曲线。qRT-PCR反应条件: 98 ℃预变性30 s; 98 ℃变性10 s; 56 ℃退火30 s; 72 ℃延伸10 s,所有步骤40个循环,合成产物置于冰上保存。ALKBH5上游引物序列5′-CACATCCTGGAAGGCAGCAA-3′, 下游引物序列5′-CCCCCAAAGTGGTGGTATCC-3′。GAPDH上游引物序列5′-TGGGGAAGGTGAAGGTCGG-3′, 下游引物序列5′-CTGGAAGATGGTGATGGGA-3′。本实验将目的基因表达量作为1, 数据结果用2-△△Ct表示,GAPDH作为内参,所有样品均有复孔, 3次独立实验。
1.2.2 蛋白质免疫印迹(Western blot): 转染48 h后收集对照组与实验组细胞, 100 ℃煮沸10 min, 12 000转/min离心5 min。10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE), 分离后的蛋白质在低温调节为300 mA电流移动黏附到膜上; 转膜2 h后,将膜取出,常温下5%脱脂牛奶封闭1 h, 洗膜缓冲液(TBST)洗膜2次,根据分子量切下目标蛋白所处膜,一抗4 ℃孵育过夜; 洗膜3次完成后,常温下二抗孵育1 h, 结束后洗膜3次。滤纸吸干所有液体,滴上适量ECL发光液涂抹均匀,拍照、显影、储存。
1.2.3 Transwell迁移及侵袭实验: 对照组和实验组细胞分别转染相应质粒, 48 h后以0.25%胰蛋白酶消化,磷酸盐缓冲液(PBS)洗2次, 600转/min离心4 min, 弃上清液。加600 μL无血清DMEM重悬细胞,计数板计数细胞,将1×106细胞种入Transwell小室上层(迁移实验不含基质胶,侵袭实验含有基质胶),小室下层加入500 μL含血清的DMEM, 置于细胞培养箱孵育。36~48 h后将小室取出,吸尽培养基,将小室于4%多聚甲醛固定20 min, 结晶紫染色30 min, 观察拍照,计数细胞迁移数,结果取平均值。
1.2.4 免疫组化: 切片烤片并脱蜡,柠檬酸盐修复抗原封闭,一抗4 ℃孵育过夜,二抗免疫显色试剂37 ℃孵育30 min, DAB染色,苏木精复染,乙醇去水,中性胶密封,高倍显微镜视野下结合色泽强弱和阳性细胞所占总细胞数百分比实行半定量检测。不着色为0分,淡黄色为1分,棕黄色为2分,黄褐色则为3分;阳性细胞数<5%为0分, 5%~25%为1分, >25%~50%为2分, >50%~75%为3分, >75%~100%为4分。评分相乘作为分组标准, 0分为阴性, 1~4分为弱阳性, 5~8分为阳性, 9~12分为强阳性。
1.3 统计学分析

2 结 果
2.1 ALKBH5蛋白水平与肝癌患者临床病理特征的关系
根据免疫组化半定量将标本分为高表达组(阳性和强阳性)、低表达组(阴性和弱阳性)。ALKBH5表达与临床分期、肿瘤分化程度存在相关性(P<0.05), 与血清甲胎蛋白(AFP)水平、肿瘤大小、年龄、性别均无相关性(P>0.05), 见表1。
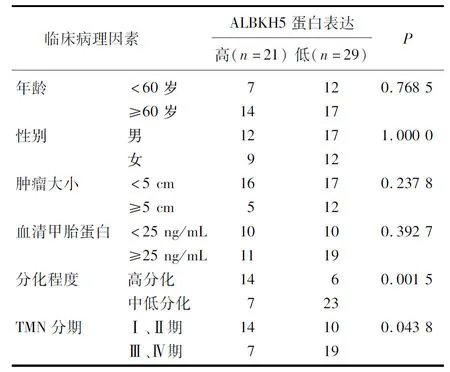
表1 ALKBH5蛋白水平与肝癌患者临床病理特征的关系
2.2 ALKBH5在肝癌细胞中的表达及获得稳定低表达细胞株
qRT-PCR结果显示,在肝癌细胞系HepG2、SMMC7721中,ALKBH5mRNA相对表达量分别为1、(2.47±0.35); 人正常肝细胞LO2中ALKBH5mRNA相对表达量为(3.87±0.55)。Western blot检测结果见图1A。
为了获得稳定低表达的细胞株,将已感染慢病毒的细胞用高浓度嘌呤霉素筛选,后将存活的细胞以低浓度嘌呤霉素维持培养至对数生长期,收获蛋白质及总RNA。HepG2和SMMC7721细胞实验组(sh-ALKBH5)ALKBH5蛋白质水平低于对照组,差异有统计学意义(P<0.05); HepG2和SMMC7721细胞干扰组ALKBH5mRNA水平分别为(0.38±0.03)、(0.29±0.04), 均低于对照组(sh-EGFP), 差异有统计学意义(P<0.05), 干扰效果明显。见图1B。

A: ALKBH5在肝癌细胞中的表达情况; B: ALKBH5在肝癌细胞中敲低效率验证。与对照组比较, **P<0.01。图1 在肝癌细胞中ALKBH5 mRNA表达和ALKBH5蛋白表达
2.3 下调ALKBH5基因促进HepG2和SMMC7721细胞迁移、侵袭
Transwell迁移试验显示, HepG2细胞中对照组和实验组的每高倍镜视野(200倍)下穿透细胞数为(123±22)、(335±21)个; SMMC7721细胞中对照组和实验组的每高倍镜视野(200倍)下穿透细胞数为(220±27)、(453±23)个。Transwell侵袭试验显示, HepG2细胞中对照组和实验组的穿透细胞数为(118±29)、(282±17)个; SMMC7721细胞中对照组和实验组的穿透细胞数为(200±11)、(388±20)个, 2组间差异均有统计学意义(P<0.05), 见图2。由此表明,下调ALKBH5基因,肝癌细胞HepG2和SMMC7721细胞迁移和侵袭能力受到促进。

A: Transwell实验检测下调ALKBH5对HepG2和SMMC7721细胞迁移能力的影响; B: Transwell实验检测下调ALKBH5对HepG2和SMMC7721细胞侵袭能力的影响。与sh-EGFP比较, **P<0.01, ***P<0.001。图2 下调ALKBH5对HepG2和SMMC7721细胞迁移、侵袭能力的影响
2.4 下调ALKBH5基因促进HepG2和SMMC7721细胞上皮间质转化(EMT)
下调ALKBH5表达水平后, Western blot检测结果显示,上皮表型标志物E-cadherin蛋白表达水平降低,间质表型标志物Vimentin、Snail蛋白表达水平增高,说明下调ALKBH5表达水平促进了肝癌细胞的EMT。见图3。

图3 下调ALKBH5对HepG2和SMMC7721细胞EMT相关蛋白表达的影响
3 讨 论
N6-甲基腺嘌呤修饰是众多转录后调控事件的一种,与其他RNA修饰相比,动态可逆性调控使其具有独特的生物学功能[6]。最新的m6A修饰测序技术[7-9]发现,大量m6A修饰位于长链的外显子和终止密码子附近, m6A修饰和其他mRNA转录后的加工修饰过程类似,如剪接除去内含子、3′-端加上多聚核苷酸、5′-端加上m7GTP的结构等,均是通过m6A甲基转移酶复合物来实现转录后的修饰[10]。m6A修饰的调控是通过一些被称为“书写器”(writer)的甲基转移酶,如甲基转移酶样3(METTL3)、Wilms′肿瘤蛋白1相关蛋白(WTAP)和甲基转移酶样14(METTL14), 一些被称为“擦除器”(eraser)的脱甲基酶,如脂肪量和肥胖相关基因(FTO)和ALKBH5, 以及一些被称为“阅读器”(reader)的识别蛋白,如YTH结构域m6A RNA结合蛋白1(YTHDF1)、YTH结构域m6A RNA结合蛋白2(YTHDF2), 以实现动态可逆的平衡[11]。研究[12-15]显示,参与m6A修饰的各种元件一直被认为和癌症的发病有密切关系,如WTAP是白血病的一个关键性抗原;FTO基因突变会增高结直肠癌、子宫内膜癌、胃癌的发病风险,前列腺癌、乳腺癌、胰腺癌的发生也与FTO等位基因的变异有直接关系;METTL3的磷酸化作用可以导致细胞DNA损伤和肿瘤形成。近年来研究[16]指出, m6A修饰在癌症的初始阶段和转移复发过程中扮演了非常重要的角色。
ALKBH5作为m6A修饰中非常重要的一个元件,与多种肿瘤的临床预后有关,通过不同的分子机制影响肿瘤进程。研究[17]发现,ALKBH5过表达能够降低干性基因胚胎干细胞关键因子(NANOG)mRNA甲基化的水平,增加NANOG的表达以及乳腺癌干细胞的丰度,诱导缺氧表型的发生; 在乳腺癌干扰ALKBH5的水平后,裸鼠体内肿瘤形成的能力明显减弱[17]。另一研究[18]发现,ALKBH5高表达与脑恶性胶质患者的临床预后有关,ALKBH5通过提高叉头框转录因子M1(FoxM1)起始区域内去甲基化水平,增高了FoxM1转录后表达,诱导了胶质母细胞瘤的干性,ALKBH5-FoxM1轴在增殖及体内成瘤过程中发挥关键性的作用。在胰腺癌中,ALKBH5可作用于LncRNA KCNK15-AS1, 进而抑制肿瘤细胞的迁移能力[19], 但其对肝癌细胞的影响及作用的相关报道较少。
本研究发现,肝癌中ALKBH5蛋白表达与分化程度、临床分期存在负相关,与性别、年龄、肿瘤大小、血清AFP水平均无相关性,提示ALKBH5与肝癌的临床预后密切相关;ALKBH5在2种肝癌细胞株中差异性表达,且显著低于正常肝细胞LO2。本研究分别选择2种不同的肝癌细胞系(HepG2和SMMC7721细胞)进行基因沉默实验,以探讨ALKBH5对肝癌细胞的影响; 在此基础上,进一步检测了细胞迁移、侵袭能力变化。结果表明,抑制ALKBH5表达, HepG2和SMMC7721细胞的迁移和侵袭能力显著增强,说明ALKBH5对于肝癌的迁移、侵袭作用有显著影响,但其具体作用机制仍然不清楚。
EMT是一个特有过程,上皮细胞经过一系列的分子生物改变,逐渐失去排列极性、细胞与细胞间存在紧密连接、附着力等特征,由不能移动的上皮细胞转变成为具有迁移、侵袭的能力的间质细胞。EMT是肿瘤转移过程中的重要限速环节,在肿瘤的侵袭和转移进程中发挥重要作用[20]。本研究表明,下调ALKBH5表达水平后,上皮表型标志物E-cadherin蛋白表达水平降低,间质表型标志物Vimentin、Snail蛋白表达水平增高。E-cadherin的主要功能是维持上皮细胞形态完整性,其是存在于人和动物上皮的一种钙依赖性细胞黏附分子; E-cadherin可以在多个环节影响肿瘤侵袭转移,表达减少或缺失可导致细胞失去原有的形态,细胞间相互融合能力下降,进而移动性增加; 在上皮性肿瘤中,突破上皮和基底膜的限制,通过内渗进入周围组织细胞转移或侵入淋巴管血管,这些血液循环肿瘤细胞到达目的区域后,借助间质上皮过程完成侵略过程,故E-cadherin是防止肿瘤向恶性转化、发生侵袭转移的一种保护性因子[21]。Snail在病理状态(尤其是癌症中)常呈现过度表达状态,研究[22]发现, Snail的核转运参与调节EMT,可以特异性识别E-cadherin的启动子区域后结合,在转录水平抑制其表达,继而启动EMT。同时, Snail可以联合SMAD同源物3/SMAD同源物4(Smad3/Smad4)影响蛋白激酶B(AKT)与E-cadherin结合,表达水平受到核转录因子-κB(NF-κB)、转化生长因子-β/Smad(TGF-β/Smad)、磷脂酰肌醇3-激酶(PI3K)、糖原合酶激酶-3 (GSK-3β)等多条复杂的信号通路调节,并促进肿瘤细胞的迁移、侵袭和转移。本研究未探讨ALKBH5抑制EMT进程的信号通路及具体机制,还需进一步深入研究。
综上所述,ALKBH5与临床预后密切相关,且能够显著抑制肝癌细胞迁移、侵袭及EMT, 提示ALKBH5作为一种抑癌基因参与肝癌的发生发展过程,但其具体分子机制有待进一步研究。同时,通过靶向药物来逆转肝癌细胞的转移复发有望为肝癌治疗提供新思路。

