基于UPLC指纹图谱和多成分定量评价不同产地升麻药材质量
周湘媛,陈万发,丁 青,马懿飞,曹斯琼,霍文杰,魏 梅,秦 升,李振雨*
基于UPLC指纹图谱和多成分定量评价不同产地升麻药材质量
周湘媛1, 2,陈万发1, 2,丁 青1, 2,马懿飞1, 2,曹斯琼1, 2,霍文杰1,魏 梅1, 2,秦 升3,李振雨1, 2*
1. 广东一方制药有限公司,广东 佛山 528244 2. 广东省中药配方颗粒企业重点实验室,广东 佛山 528244 3. 中国中药控股有限公司,广东 佛山 528303
采用超高效液相色谱法(UPLC)建立升麻药材指纹图谱,并同时测定3种有效成分的含量,评价不同产地升麻药材质量的差异。采用UPLC法进行测定,色谱柱为Agilent SB C18(100 mm×2.1 mm,1.8 μm);流动相为乙腈-0.05%磷酸溶液,梯度洗脱,体积流量为0.3 mL/min,波长为320 nm,柱温为35 ℃,进样量为1 μL;建立15批升麻药材指纹图谱,通过对照品比对并结合质谱分析,对共有峰进行鉴定,并对3种成分的含量进行测定;对15批升麻药材指纹图谱进行相似度评价及主成分分析(principal component analysis,PCA),利用正交偏最小二乘法-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)寻找不同产地升麻药材的差异性成分。升麻药材指纹图谱有16个共有峰,指认出其中3个峰,分别为咖啡酸、阿魏酸和异阿魏酸;除辽宁产区的3批样品外,其余12批相似度均大于0.95;PCA将15批升麻药材划分为2类,OPLS-DA法确定7个差异标志物,差异显著性排序,分别为峰7>峰11>峰9>峰8>峰10>咖啡酸>峰4。辽宁产区咖啡酸、阿魏酸和异阿魏酸总含量明显高于其它产地。该方法能有效地分析不同产地升麻药材质量的差异性,为不同产地升麻药材质量的评价提供参考。
升麻药材;UPLC指纹图谱;多成分定量;差异标志物;咖啡酸;阿魏酸;异阿魏酸
升麻为毛茛科植物大三叶升麻Kom.、兴安升麻(Turcz.) Maxim.或升麻L.的干燥根茎,具有发表透疹、清热解毒、升举阳气之功效,用于治疗风热头痛、齿痛、口疮、咽喉肿痛、麻疹不透、阳毒发斑、脱肛、子宫脱垂[1]。已有研究表明,升麻具有抗病毒、抗炎、抗肿瘤、抗骨质疏松、抑制核苷运转等多种作[2],黄广欣等[3]研究预测认为,升麻中的酚酸、三萜及其苷类等是升麻药材中与药效和传统药性相关的主要质量标志物。中药有效成分的多样性及复杂性,单一成分定量的化学药品质量控制模式既缺乏专属性,又难以反映中药内在质量属性,因此,需要创新研究思维和基于功能主治的多元质量控制模式[4],指纹图谱结合化学计量学对中药的整体质量控制提供一种的新的思路[5-6],在中药材质量控制、中药饮片炮制、中药复方和中成药的质量标准研究中屡见不鲜[7-10],但对于采用UPLC指纹图谱结合化学计量学评价升麻药材的质量仍鲜有报道。本研究采用UPLC指纹图谱和主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),并结合质谱指认和多成分定量,从多角度评价不同产地大三叶升麻的质量,为升麻药材质量标准的提高提供参考。
1 仪器与试药
1.1 仪器
Waters H-Class型超高效液相色谱仪(美国沃特世公司);Scientific Q-Exactive Obitriap MS型四极杆-静电轨道阱高分辨质谱仪(美国赛默飞公司);mzVault质谱数据库(美国赛默飞公司)Agilent SB-C18色谱柱(100 mm×2.1 mm,1.8 μm,美国安捷伦公司),ME204E型万分之一天平(梅特勒-托利多公司);XP26型百万分之一天平(梅特勒-托利多公司);JJ600型百分之一天平(常熟市双杰测试仪器厂);KQ500DE型超声波清洗器(昆山市超声仪器有限公司);HWS28型恒温水浴锅(上海一恒科技有限公司);超纯水系统(Milli-Q级,德国默克股份有限公司)。
1.2 试剂与药材
除液相用甲醇、乙腈(默克股份有限公司),磷酸、甲酸(天津市科密欧化学试剂有限公司)为色谱级,其余试剂皆为分析纯。对照品阿魏酸(批号110773-201614,质量分数以99.0%)、异阿魏酸(批号111698-201103,质量分数以99.2%)、咖啡酸对照品(批号110885-200102,质量分数以100.0%,)均购自中国食品药品检定研究院;15批升麻药材经广东一方制药有限公司魏梅主任药师鉴定均为毛茛科植物大三叶升麻Kom.的干燥根茎,经检验,均符合《中国药典》2020年版升麻药材项下的规定,药材来源信息见表1。
表1 15批升麻药材来源信息
Table 1 Origin information form of 15 batches of Cimicifuga Rhizoma
编号药材批号产地 S1G1708044河北承德 S2G1708045河北承德 S3G1708046河北承德 S4G1709004辽宁鞍山 S5G1709005辽宁鞍山 S6G1709006辽宁鞍山 S7G1709009吉林通化 S8G1709010吉林通化 S9G1709011吉林通化 S10G1709055内蒙古呼伦贝尔鄂伦 S11G1709056内蒙古呼伦贝尔鄂伦 S12G1709057内蒙古呼伦贝尔鄂伦 S13G1709064黑龙江黑河 S14G1709065黑龙江黑河 S15G1709066黑龙江黑河
2 方法与结果
2.1 升麻药材UPLC指纹图谱的建立
2.1.1 色谱条件 色谱柱:Agilent SB C18(100 mm×2.1 mm,1.8 μm)色谱柱;流动相为乙腈(A)-0.05%磷酸溶液(B,质谱分析为0.05%甲酸溶液);梯度洗脱:0~1 min,12% A;1~3 min,12%~18% A;3~6 min,18% A;6~13 min,18%~35% A;13~18 min,35%~90% A;18~19 min,90%~80% A;体积流量为0.30 mL/min;检测波长为320 nm;柱温为35 ℃;进样量为1 μL。
2.1.2 对照品溶液的制备 取阿魏酸、咖啡酸和异阿魏酸对照品适量,加10%乙醇制成含阿魏酸、咖啡酸0.1 mg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备 取升麻药材粉末(过二号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入稀乙醇25 mL,密塞,称定质量,超声处理(功率250 W、频率40 kHz)30 min,放冷,再称定质量,用稀乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.1.4 质谱条件 采用电喷雾离子源(HESI),喷雾电压为3.24 kV,扫描模式为正、负离子模式;扫描范围为/150~2000;鞘气体积流量为35 arb;辅助气体积流量为10 arb;毛细管温度为350 ℃;辅助器加热温度为350 ℃;一级扫描分辨率为70 000 FWHM;二级扫描分辨率为17 500 FWHM;二级碰撞能量为40 eV;S-lens电压为50 V。
2.1.5 精密度试验 取升麻药材(批号G1709055)供试品溶液,按“2.1.1”项下确定的色谱条件下连续进样6次,检测指纹图谱,以异阿魏酸色谱峰为参照峰(S),计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值,均小于3.0%。
2.1.6 重复性试验 取同一批次的升麻药材粉末(批号G1709055)共计6份,按“2.1.3”项下确定的制备方法制备6份供试品溶液,分别进样测定,检测指纹图谱,以异阿魏酸色谱峰为参照峰(S),计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于3.0%。
2.1.7 稳定性试验 取升麻药材(批号G1709055)供试品溶液,分别在0、2、4、6、8、12、24 h进样分析,检测指纹图谱,以异阿魏酸色谱峰为参照峰(S),计算各共有指纹峰与S峰的相对保留时间和相对峰面积RSD值均小于3.0%。
2.1.8 指纹图谱的建立及共有峰标定 取15批升麻药材样品,按“2.1.3”项下方法制备15份供试品溶液,分别按“2.1.1”项下确定的色谱条件进行测定,记录各样品指纹图谱的色谱图,并导出指纹图谱的.cdf格式,将15批升麻药材.cdf格式导入“中药色谱指纹图谱相似度评价系统(2012版)”软件中,以编号为S1样品(批号G1708044)的指纹图谱为参照图谱,以6号峰为Mark峰进行保留时间校正,同时进行全峰匹配,15批升麻药材和升麻对照药材指纹图谱叠加图见图1,以平均数法生成升麻药材对照指纹图谱,见图2。异阿魏酸为升麻的主要有效成分之一,在所有的已知色谱峰里位置最为居中,且该成分色谱峰峰面积较大,与相邻的色谱峰分离效果好,另外,该对照品容易获得,因此选择异阿魏酸色谱峰为参照峰(S),标定出16个共有指纹峰,计算各指纹峰的相对保留时间和相对峰面积,各指纹峰的相对保留时间RSD值在0.05%~0.33%,相对峰面积RSD值在30.85%~79.35%。

图1 15批升麻药材UPLC指纹图谱

图2 升麻药材对照指纹图谱
2.1.9 相似度评价 采用“中药色谱指纹图谱相似度评价系统”计算15批升麻药材指纹图谱的相似度(表2),结果显示,以省划分产区,不同产区的升麻药材除编号为S4~S6的药材外,其余12批升麻药材指纹图谱与对照指纹图谱的相似度均大于0.95,说明河北、吉林、内蒙古和黑龙江4个产区的升麻药材质量比较一致,辽宁的3批与其他产地相比具有一定的差异。
表2 15批升麻药材相似度评价
Table 2 Similarity analysis forms of 15 batches of Cimicifuga Rhizoma
相似度S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15对照指纹图谱 S11.000 1.000 0.994 0.977 0.879 0.954 0.991 0.994 0.971 0.936 0.947 0.929 0.938 0.971 0.940 0.989 S21.000 1.000 0.994 0.978 0.879 0.955 0.990 0.994 0.970 0.935 0.946 0.928 0.938 0.970 0.939 0.989 S30.994 0.994 1.000 0.966 0.861 0.936 0.993 0.998 0.971 0.947 0.956 0.934 0.941 0.983 0.939 0.986 S40.977 0.978 0.966 1.000 0.926 0.981 0.968 0.969 0.969 0.905 0.923 0.913 0.923 0.948 0.927 0.935 S50.879 0.879 0.861 0.926 1.000 0.971 0.840 0.854 0.855 0.738 0.753 0.740 0.732 0.819 0.764 0.875 S60.954 0.955 0.936 0.981 0.971 1.000 0.923 0.938 0.916 0.827 0.847 0.829 0.842 0.892 0.848 0.944 S70.991 0.990 0.993 0.968 0.840 0.923 1.000 0.993 0.986 0.969 0.977 0.964 0.968 0.990 0.971 0.995 S80.994 0.994 0.998 0.969 0.854 0.938 0.993 1.000 0.968 0.944 0.955 0.933 0.947 0.978 0.939 0.986 S90.971 0.970 0.971 0.969 0.855 0.916 0.986 0.968 1.000 0.971 0.978 0.976 0.964 0.989 0.984 0.993 S100.936 0.935 0.947 0.905 0.738 0.827 0.969 0.944 0.971 1.000 0.998 0.994 0.986 0.986 0.982 0.963 S110.947 0.946 0.956 0.923 0.753 0.847 0.977 0.955 0.978 0.998 1.000 0.995 0.992 0.989 0.985 0.973 S120.929 0.928 0.934 0.913 0.740 0.829 0.964 0.933 0.976 0.994 0.995 1.000 0.990 0.977 0.992 0.964 S130.938 0.938 0.941 0.923 0.732 0.842 0.968 0.947 0.964 0.986 0.992 0.990 1.000 0.971 0.979 0.966 S140.971 0.970 0.983 0.948 0.819 0.892 0.990 0.978 0.989 0.986 0.989 0.977 0.971 1.000 0.975 0.987 S150.940 0.939 0.939 0.927 0.764 0.848 0.971 0.939 0.984 0.982 0.985 0.992 0.979 0.975 1.000 0.971 对照指纹图谱0.989 0.989 0.986 0.9350.875 0.944 0.995 0.986 0.993 0.963 0.973 0.964 0.966 0.987 0.971 1.000
2.1.10 共有峰的指认 采用与对照品的保留时间并结合紫外吸收光谱图,初步确定峰2为咖啡酸,峰5为阿魏酸,峰6为异阿魏酸,结果见图3。取升麻药材(批号G1709055)供试品溶液,按“2.1.1”项下色谱条件和“2.1.4”项下质谱条件进样分析,根据高分辨质谱提供的准确分子量与升麻已知组分的分子量进行对比,对于质量偏差小于2×10−9的组份予以确认,且根据目标色谱峰的二级质谱信息,并与mzVault标准数据库进行匹配进行进一步确认,结果见表3。
2.2 化学模式识别
化学计量学中的模式识别技术已广泛应用于中药材产地、基原、炮制、真伪鉴别等方面[11],分为有、无监督2种统计方法,一般先进行无监督的HCA、PCA,观察样本之间是否有分类趋势,再采用PLS-DA或者OPLS-DA进行有监督的模式识别,显示样本间差异主要由哪些变量引起,寻找差异性标志物[12],

图3 对照品咖啡酸(a)、阿魏酸(b)、异阿魏酸(c) 及升麻药材样品色谱图(d)
表3 升麻药材共有峰的质谱信息
Table 3 Mass spectrum information of common peak of Cimicifuga Rhizoma
峰号tR/min分子式分子离子峰实验值(m/z)理论值(m/z)误差(×10−6)化合物 23.39C9H8O4[M−H]−179.034180.1570.641咖啡酸 56.01C10H10O4 [M+H]+195.066194.0581.203阿魏酸 66.52C10H10O4 [M+H]+195.065194.0580.947 异阿魏酸
2.2.1 PCA 采用SIMCA14.1软件,以15批升麻药材的16个共有指纹峰的峰面积为变量进行PCA分析,共生成9个主成分,累计贡献率达到99.2%,2为0.56,证明模型有效。以前2个主成分的得分值和16个共有指纹峰的峰面积为变量得到主成分得分图(Scores图,图4)和变量载荷图(Loading图,图5),结果显示,15批升麻药材可分为2类,河北、吉林、内蒙古和黑龙江4个产区的升麻药材聚为一类,辽宁产区升麻聚为第2类,分类结果与药材产地相关性较大。根据变量离原点的距离判断变量对主成分的影响权重,距离原点越远,变量对主成分的影响权重越大,分析变量对主成分1的影响权重,大小依次为峰9、峰7、咖啡酸,变量对主成分2的影响权重,大小依次为峰8、阿魏酸、峰11。

图4 15批升麻药材Scores图

图5 升麻药材色谱峰变量Loading图
2.2.2 OPLS-DA 根据PCA分析结果,以16个共有指纹峰峰面积为变量进行OPLS-DA,所建立的模型2=0.916,2=0.967,2=0.776,表明该模型可以用于不同产地升麻的模式识别。通过OPLS-DA的Scores图(图6)可知,不同产地升麻药材也明显分为3类,且通过16个变量的VIP值图(图7)可知,以VIP>1.0为显著影响,共找到7个差异标志物,对其影响显著性排序,分别为峰7>峰11>峰9>峰8>峰10>咖啡酸>峰4,提示这几个化学成分对于区分不同产地升麻的贡献较大,且不同产地的咖啡酸含量具有明显区别。
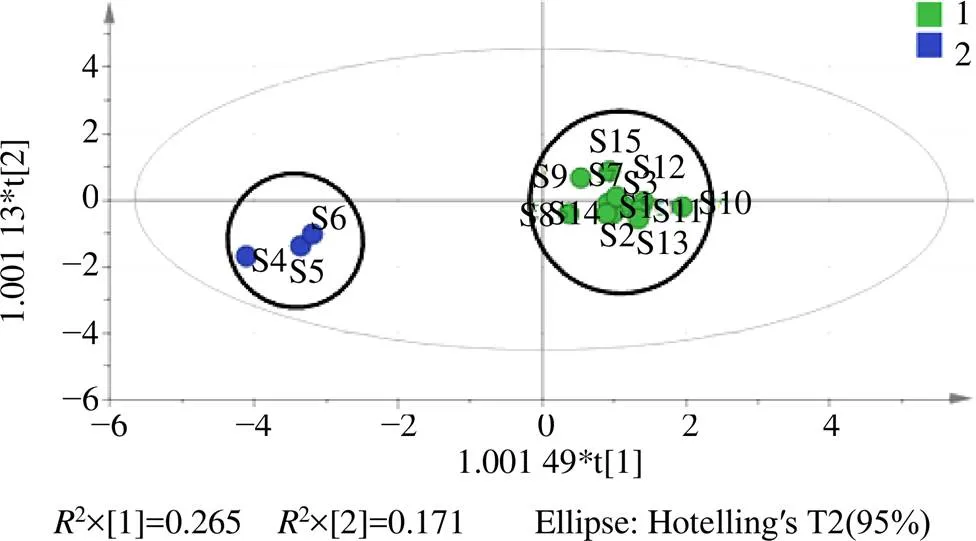
图6 升麻药材的OPLS-DA分析Scores图

图7 升麻药材VIP图
2.3 3种指标成分的含量测定
2.3.1 供试品溶液制备 取升麻药材粉末(过二号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入10%乙醇25 mL,密塞,称定质量,加热回流2.5 h,放冷,再称定质量,用10%乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3.2 线性关系考察 取咖啡酸、阿魏酸及异阿魏酸对照品适量,精密称定,加10%乙醇制成含咖啡酸30.08 μg/mL,阿魏酸59.76 μg/mL,异阿魏酸566.43 μg/mL的混合对照品储备液。精密移取上述混合对照品储备液0.1、0.2、0.5、1.0、2.0、5.0 mL,分别置10 mL量瓶中,加10%乙醇至刻度,摇匀,得到分别含咖啡酸0.30、0.60、1.50、3.01、6.02、15.04 μg/mL,阿魏酸0.60、1.20、2.99、5.98、11.95、29.88 μg/mL,异阿魏酸5.66、11.33、28.32、56.64、113.29、283.22 μg/mL的系列对照品溶液,分别精密吸取上述6个不同质量浓度的对照品溶液各1 μL,按“2.1.1”项下色谱条件进样测定,以色谱峰峰面积为纵坐标(),对照品浓度为横坐标()进行线性回归,绘制标准曲线,3种成分的线性回归方程和线性范围见表4。
表4 3种成分的线性回归方程及线性范围
Table 4 Regression equations coefficient correlation of references and linear ranges
对照品线性范围/(μg·mL−1)标准曲线R2 咖啡酸0.30~30.08Y=16.40 X+0.640.999 9 阿魏酸0.60~59.76Y=16.41 X+4.150.999 5 异阿魏酸 5.66~566.43Y=16.13 X+6.940.999 9
2.3.3 精密度试验 取“2.1.2”项下对照品溶液,按“2.1.1”项下色谱方法连续进样6次,记录咖啡酸、阿魏酸和异阿魏酸的峰面积,并计算咖啡酸、阿魏酸和异阿魏酸峰面积RSD值分别为0.68%、1.05%、0.89%。
2.3.4 稳定性试验 取升麻药材粉末(批号G1709055),按“2.3.1”项下确定的供试品溶液制备方法制备供试品溶液,按“2.1.1”项下色谱条件分别在0、2、4、6、8、10、12、24 h进样分析,记录咖啡酸、阿魏酸和异阿魏酸的峰面积,并计算不同时间点咖啡酸、阿魏酸和异阿魏酸峰面积RSD值,分别为0.64%、1.15%、1.10%。
2.3.5 重复性试验 取升麻药材粉末(批号G1709055),按“2.3.1”项下确定的供试品溶液制备方法制备6份供试品溶液,并按“2.1.1”项下色谱条件进样测定,计算咖啡酸、阿魏酸和异阿魏酸的质量分数分别为0.14、0.29、2.83 mg/g,RSD值分别为1.71%、1.27%、0.37%。
2.3.6 加样回收率测定 取升麻药材粉末(批号G1709055)约0.25 g,精密称定,平行3组,每组3份,按1∶0.5,1∶1及1∶1.5的比例加入对照品,按“2.3.1”项下方法制备9份供试品溶液,按“2.1.1”项下色谱条件进样测定,计算3种成分的回收率范围及RSD值,计算咖啡酸、阿魏酸和异阿魏酸的加样回收率范围分别为92.21%~100.37%、96.82%~101.06%、96.76%~101.63%,平均加样回收率分别为96.89%、99.14%、99.40%,RSD值分别为2.51%、1.65%、1.70%,均小于3.0%。
2.3.7 中间精密度试验 由其他分析人员在不同日期和不同色谱仪下操作,取同一批升麻药材粉末(批号G1709055)约0.5 g,精密称定,平行6份,按“2.3.1”项下方法制备6份供试品溶液,按“2.1.1”项下色谱条件进样测定,计算咖啡酸、阿魏酸和异阿魏酸的质量分数分别为0.14、0.30、2.87 mg/g,与6份重复性试验样品的RSD值分别为1.77%、2.20%和0.65%。
2.3.8 样品测定 取15批升麻药材粉末,按“2.3.1”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样测定,记录色谱图,按外标法计算各批次样品咖啡酸、阿魏酸和异阿魏酸的含量,结果见表5,15批升麻药材咖啡酸质量分数在0.14~0.92 mg/g,阿魏酸质量分数在0.29~0.67 mg/g,异阿魏酸质量分数在2.36~4.03 mg/g,《中国药典》2020年版升麻药材项下规定异阿魏酸含量不得少于0.1%,15批样品均药典符合规定。辽宁产区的3种成分的整体含量高于其他产地,其余产地3种有效成分的含量无明显差异,见图8。
表5 样品测定结果(n=15)
Table 5 Determination results of samples (n=15)
批号咖啡酸/(mg·g−1)阿魏酸/(mg·g−1)异阿魏酸/(mg·g−1)总量/(mg·g−1) S10.250.442.513.20 S20.210.332.362.90 S30.160.402.923.48 S40.920.564.035.51 S50.870.523.935.32 S60.350.673.714.73 S70.160.472.923.55 S80.170.373.524.06 S90.170.363.453.98 S100.140.292.833.26 S110.150.302.993.44 S120.150.302.943.39 S130.210.432.873.51 S140.210.432.873.51 S150.330.422.563.31

图8 不同产地间升麻药材各指标含量均值图
3 讨论
3.1 色谱条件的选择
本实验采用UPLC法建立升麻药材指纹图谱与有效成分含量同时测定方法,在20 min内即完成主要色谱峰的良好分离,指纹图谱研究发现,320 nm处色谱峰数目较多,响应值较大,基线平稳,其中咖啡酸、阿魏酸和异阿魏酸3种有效成分的分离度和峰纯度符合定量要求,因此选择320 nm作为检测波长。流动相的筛选考察了甲醇-0.1%磷酸溶液,乙腈-0.1%磷酸溶液和甲醇-水3种溶剂系统的洗脱和分离效果,结果显示,以乙腈-0.1%磷酸溶液为流动相,各色谱峰出峰时间短,分离度较好。色谱柱筛选考察了Agilent SBC18(100 mm×2.1 mm,1.8 μm)色谱柱、Waters HSS T3 C18(100 mm×2.1 mm,1.8 μm)色谱柱、Waters Acquity BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱这3种不同品牌和柱填料的色谱柱对各色谱峰的分离效果,结果采用Agilent SB-C18(100 mm×2.1 mm,1.8 μm)色谱柱,各色谱峰分离效果最佳。
3.2 指纹图谱的构建及分析评价
本研究15批升麻药材指纹图谱共标识出16个共有指纹峰,通过对照品指认出3个有效成分,分别为咖啡酸、阿魏酸和异阿魏酸。相似度评价结果显示,除3批吉林产区的样品外,其余产地升麻指纹图谱相似度较高。通过PCA将15批升麻药材分为2类,其中辽宁产区分为一类,其余产区为一类。通过OPLS-DA分析找到7个差异标志物,说明不同产区升麻药材的化学成分含量存在一定差异,这种差异可能与药材的生长环境、生长年限、采收加工方式等因素密切相关。
3.3 有效成分的测定与分析
《中国药典》2020年版升麻药材项下以异阿魏酸为含测指标,但仅用单一成分测定尚不足以全面评价升麻药材的质量,故建立多成分同时测定是实现中药材有效质控的重要方法。本研究在指纹图谱的基础上,增加对有效成分咖啡酸、阿魏酸和异阿魏酸的同时测定,从多角度研究不同产地升麻药材质量的差异性,结果表明,除辽宁产区外,其余4个产地的咖啡酸、阿魏酸和异阿魏酸含量差异不大,最小值和最大值不超过3倍,其中以辽宁的升麻整体质量较优。
本研究建立升麻指纹图谱方法及多成分定量,该方法简便,专属性强,重复性良好,分析时间短,提高了分析效率,能有效地分析不同产地升麻药材质量的差异性,为不同产地升麻药材的质量评价提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 75.
[2] 孙启泉, 左爱侠, 张婷婷. 升麻属植物化学成分、生物活性及临床应用研究进展 [J]. 中草药, 2017, 48(14): 3005-3016.
[3] 黄广欣, 龚苏晓, 许浚, 等. 升麻研究进展及其质量标志物的预测分析 [J]. 中草药, 2020, 51(10): 2651-2660.
[4] 鄢海燕, 邹纯才. 基于功能主治及其物质基础的中药多元化质量控制模式探讨 [J]. 国际药学研究杂志, 2019, 46(4): 266-269.
[5] 刘东方, 赵丽娜, 李银峰, 等. 中药指纹图谱技术的研究进展及应用 [J]. 中草药, 2016, 47(22): 4085-4094.
[6] 于洋, 李军, 李宝国. 化学计量学在中药质量控制研究中的应用 [J]. 中成药, 2018, 40(5): 1139-1142.
[7] 陶晓赛, 龚海燕, 谢彩侠, 等. 基于UPLC指纹图谱结合化学计量学评价不同产地盾叶薯蓣药材质量 [J]. 中草药, 2021, 52(1): 227-233.
[8] 张晓男, 魏惠珍, 张丹, 等. 基于化学计量学分析的桃仁炮制前后指纹图谱研究 [J]. 中国现代应用药学, 2020, 37(8): 971-976.
[9] 周丽, 时海燕, 时银萍, 等. 指纹图谱结合化学计量学优选经典名方温胆汤的提取工艺 [J]. 中国医院药学杂志, 2020, 40(21): 2214-2219.
[10] 高森, 王苹, 唐铖, 等. 基于HPLC指纹图谱、多指标成分含量测定及化学计量学的湿热痹片质量评价 [J]. 中草药, 2020, 51(21): 5454-5461.
[11] 孙立丽, 王萌, 任晓亮. 化学模式识别方法在中药质量控制研究中的应用进展 [J]. 中草药, 2017, 48(20): 4339-4345.
[12] 于洋, 李军, 李宝国. 化学计量学在中药质量控制研究中的应用 [J]. 中成药, 2018, 40(5): 1139-1142.
Quality evaluation offrom different producing areas based on fingerprint and multi-components determination
ZHOU Xiang-yuan1, 2, CHEN Wan-fa1, 2, DING Qing1, 2, MA Yi-fei1, 2, CAO Si-qiong1, 2, HUO Wen-jie1, WEI Mei1, 2, QIN Sheng3, LI Zhen-yu1, 2
1. Guangdong E-fong Pharmaceutical Co. Ltd, Foshan 528244, China 2. Guangdong Provincial Key Laboratory of Traditional Chinese Medicine Formula, Foshan 528244, China 3. China Traditional Chinese Medicine Holdings Co. Ltd., Foshan 528303, China
To evaluate the difference offrom different producing areas by establishing UPLC fingerprint and determining contents of three effective components ofUPLC Method was adopted. The determination was performed on a column of Agilent SB C18(100 mm × 2.1 mm,1.9 μm) with acetonitrile-0.05% phosphoric acid solution as the mobile phase by gradient elution at a flow rate of 0.3 mL/min. The detective wavelength was 320 nm, the column temperature was 35 ℃, the injection volume was 1 μL. The UPLC fingerprints of 15 batches ofwere established and the common peaks were identificated by reference substances and mass spectrometry. The contents of three components were determined. Similarity evaluation and principal component analysis (PCA) were carried out on the fingerprints and orthogonal partial least squares discriminant analysis (OPLS-DA) was used to find the different components offrom different producing areas.There were 16 common peaks in the fingerprints ofby comparing with the reference substances, three common peaks were identified, namely, caffeic acid, ferulic acid and isoferulic acid. Except for three batches of samples from Liaoning Province, the similarity of the other 12 batch was greater than 0.95. According to the analysis of PCA, 15 batches ofwere divided into two categories; Seven kinds of biomarkers were determined by OPLS-DA method. The order of significance was peak 7 > peak 11 > peak 9 > peak 8 > peak 10 > caffeic acid > peak 4, respectively. The total contents of caffeic acid, ferulic acid and isoferulic acid.in Liaoning were obviously higher than those in other areas.This method can effectively analyze the quality differences offrom different producing areas and provide reference for the quality evaluation.
; UPLC fingerprints; multi-component determination; difference markers; caffeic acid; ferulic acid; isoferulic acid
R286.2
A
0253 - 2670(2022)17 - 5497 - 07
10.7501/j.issn.0253-2670.2022.17.027
2022-01-20
广东省省级科技计划项目(2018B030323004);广东特支计划科技创业领军人才项目(2017TY04R197)
周湘媛(1996—),女,助理研究员,从事中药饮片及中药配方颗粒研究。
李振雨(1989—),男,硕士,主管中药师,研究员,从事中药饮片及中药配方颗粒研究。Tel: (0757)85128602 E-mail: 1083656123@qq.com
[责任编辑 时圣明]

