两种方法治疗不同直径直肠癌肝转移的效果和影响生存率的因素分析
刘雪平,周余旺,刘庆华,姜露露,王超,余春,吕杨波
[温州医科大学附属衢州医院(衢州市人民医院) 1.超声科;2.胃肠外科;3.肛肠外科,浙江衢州 324000]
直肠癌是临床常见的消化道恶性肿瘤之一,其发病率呈上升趋势[1-3],而肝脏是直肠癌发生转移的靶器官之一[4]。由于直肠癌症状不明显,很多患者就诊时就已经发生肝转移,并且大部分患者都丧失了手术切除的机会,严重影响患者的身体健康和生存时间。近年来,超声引导下射频消融术治疗肝转移癌被广泛应用,取得了较好的疗效。本研究回顾性分析本院不同大小直肠癌肝转移患者的临床资料,对比超声引导下射频消融术和腹腔镜的疗效,分析影响直肠癌肝转移患者生存率的危险因素,以期为临床诊疗提供指导依据。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月-2019年12月本院87 例行原发癌切除的发生直肠癌肝转移的患者的临床资料,依据不同治疗方式分为观察组(n=45)和对照组(n=42)。观察组中,男23 例,女22 例;年龄29~73岁,平均(49.21±8.72)岁;病灶直径1.29~8.02 cm,平均(4.15±1.98)cm;肝转移癌发病时间1~8 个月,平均(3.13±2.34)个月;Child-Pugh 分级:A 级27 例,B 级18 例;病灶数:小病灶(直径<3.00 cm)19 例31 个,中等病灶(直径3.00~5.00 cm)15例21个,大病灶(直径>5.00 cm)11例14个。对照组中,男23例,女19例;年龄21~75岁,平均(50.45±7.96)岁;病灶直径1.34~7.95 cm,平均(3.92±2.13)cm;肝转移癌发病时间1~9 个月,平均(3.57±2.78)个月;Child-Pugh 分级:A 级23例,B 级19 例;病灶数:小病灶(直径<3.00 cm)17 例29 个,中等病灶(直径3.00~5.00 cm)13 例19个,大病灶(直径>5.00 cm)12 例15 个。两组患者年龄、病灶直径和发病时间等方面比较,差异均无统计学意义(P>0.05),具有可比性。见表1。纳入标准:诊断明确为直肠癌肝转移;肝转移癌在1年内;能够配合治疗者。排除标准:肝脏原发性恶性肿瘤或合并其他肝脏疾病者;肝癌发病时间超过1年;有精神症状,不能配合治疗者。
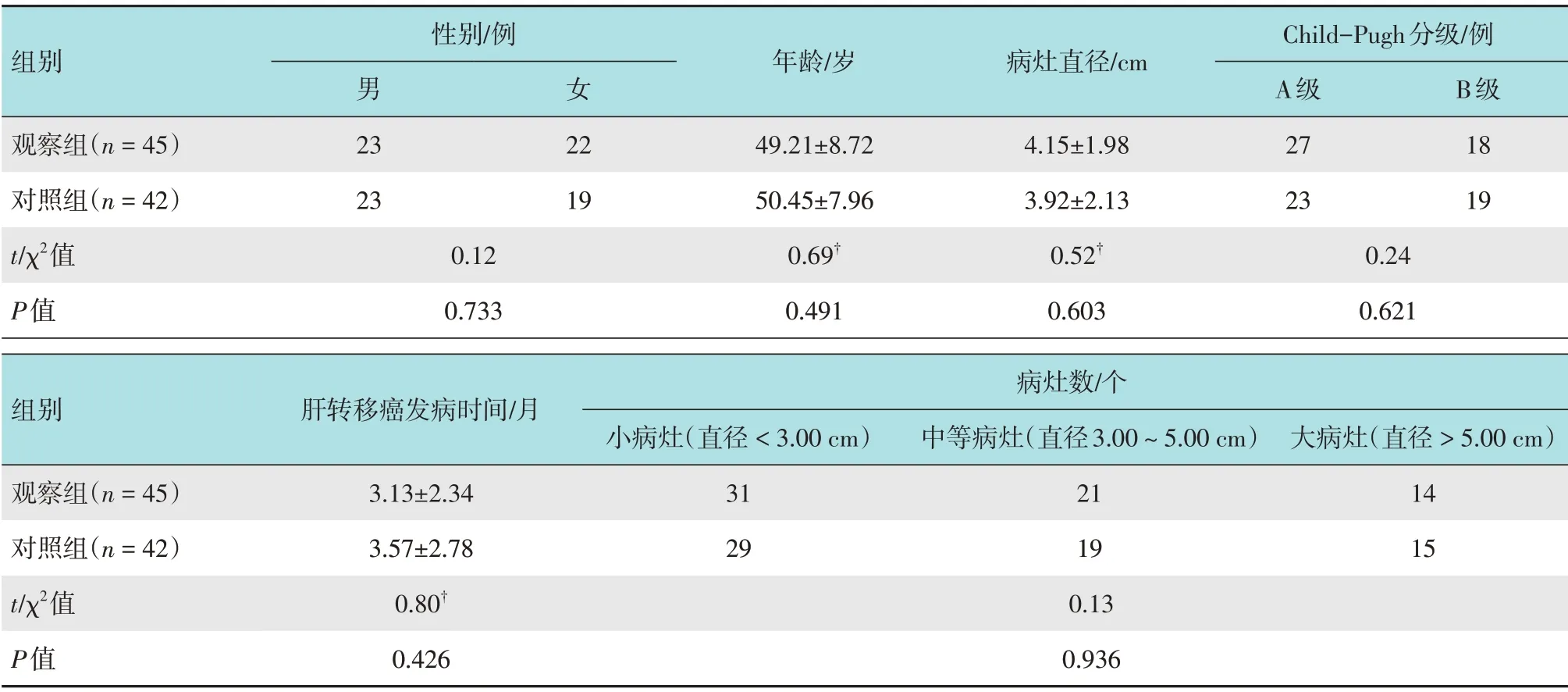
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2 方法
所有患者术前均给予积极的术前准备,肝脏行CT 和磁共振成像(magnetic resonance imaging,MRI)检查,进一步明确病灶位置。
1.2.1 观察组采用超声引导下射频消融术。彩色多普勒超声检测病灶数目、位置和大小等情况,标记穿刺部位,设定消融方案,对病灶按照由深至浅的顺序进行消融处理,对3.00 cm 以内的病灶采取单点灶消融,对3.00 cm 以上的较大病灶采取多点叠加消融处理,消融范围至肿瘤边缘1.00 cm。结束后行超声造影检查消融残余情况,对残余灶及时补充消融。治疗过程中,密切观察患者生命体征。
1.2.2 对照组采用腹腔镜手术切除。术前经彩色多普勒超声准确定位病灶位置,常规麻醉后,于脐下1.0 cm 开口,穿刺气腹针建立气腹,置入Trocar,放入腹腔镜镜头探查,根据肿瘤位置,确定其他操作Trocar位置,置入腹腔镜系统。直视下观察肿瘤位置及具体情况,用超声刀拨开肝脏周围韧带并游离,对肝门、胆道和血管进行阻断,切除肿瘤组织,常规送病理。
1.3 观察指标
记录两组患者治疗前后的碱性磷酸酶(alkaline phosphatase, ALP)、 谷草转氨酶 (glutamicoxaloacetic transaminase, GOT)、 谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、血清白蛋白(albumin, ALB) 和癌胚抗原(carcinoembryonic antigen,CEA)等肝功能指标和肿瘤标志物水平。记录患者2年内的生存状态。
1.4 评价标准
1.4.1 术后1个月疗效完全灭活:超声造影未见造影剂灌注,未见彩色血流信号;局部残留:超声造影可见不同程度及大小的动脉期增强,门脉期及延迟期消退,见彩色血流信号。
1.4.2 肝转移癌的疗效(术后6个月)治疗效果分为显著、有效和无效3种类型。显著:症状消失,病灶减少60%以上;有效:症状减轻,病灶减少在30%以上60%以下;无效:症状变化不明显,病灶减少在30%以下。总有效率= (显著+有效)/总数×100%。
1.5 统计学方法
选用SPSS 22.0 统计软件处理数据。计数资料以例(%)表示,行χ2检验;计量资料以均数±标准差(±s)表示,行t检验;将单因素分析差异具有统计学意义的指标纳入多因素Logistic 回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者短期疗效比较
观察组病灶灭活比例为81.82%(54/66),明显高于对照组的52.38%(33/63),两组患者比较,差异有统计学意义(P<0.05)。观察组大、中、小病灶灭活程度均高于对照组,差异有统计学意义(P<0.05)。见表2。
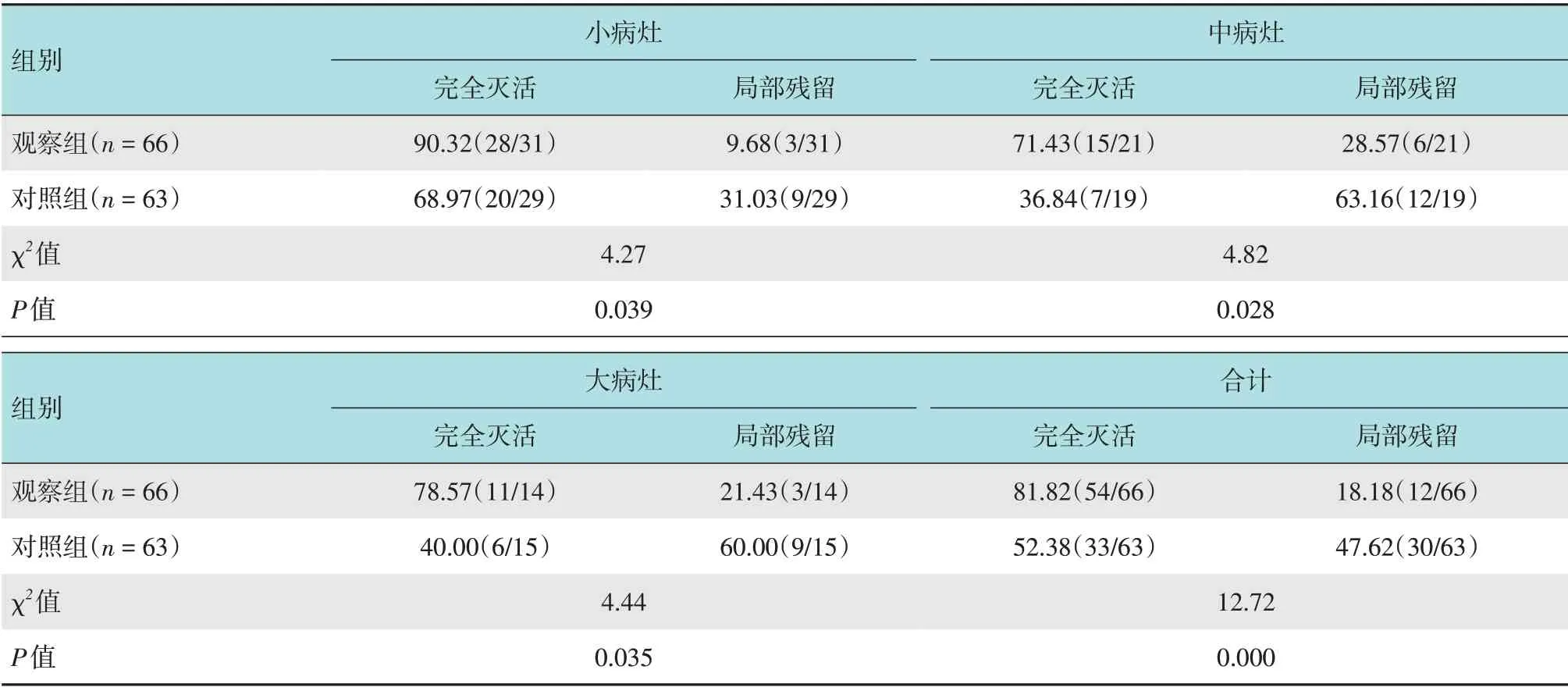
表2 两组患者短期疗效比较 %Table 2 Comparison of short-term efficacy between the two groups %
2.2 两组患者术前及术后肝功能情况比较
如表3 所示,两组患者术前ALB、GPT、ALP 和GOT比较,差异均无统计学意义(P>0.05);两组患者术后ALB、GPT、ALP和GOT均高于术前(P<0.05);观察组术后ALB、GPT和GOT均低于对照组,差异有统计学意义(P<0.05)。
表3 两组患者术前及术后肝功能情况比较 (±s)Table 3 Comparison of preoperative and postoperative liver function between the two groups (±s)
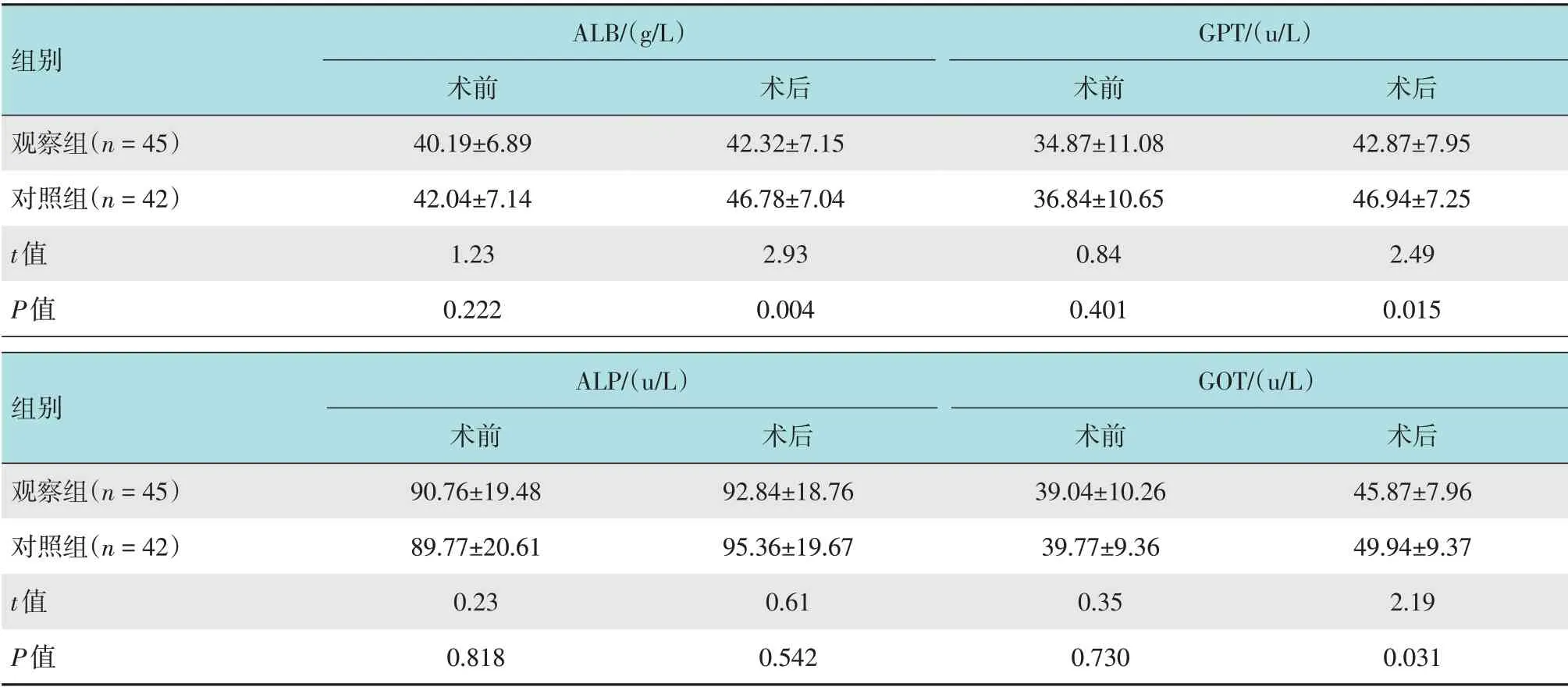
表3 两组患者术前及术后肝功能情况比较 (±s)Table 3 Comparison of preoperative and postoperative liver function between the two groups (±s)
ALB/(g/L)GPT/(u/L)组别术前34.87±11.08 36.84±10.65 0.84 0.401术前40.19±6.89 42.04±7.14 1.23 0.222术后42.32±7.15 46.78±7.04 2.93 0.004观察组(n=45)对照组(n=42)t值P值术后42.87±7.95 46.94±7.25 2.49 0.015 ALP/(u/L)GOT/(u/L)组别术前90.76±19.48 89.77±20.61 0.23 0.818术后92.84±18.76 95.36±19.67 0.61 0.542术前39.04±10.26 39.77±9.36 0.35 0.730观察组(n=45)对照组(n=42)t值P值术后45.87±7.96 49.94±9.37 2.19 0.031
2.3 两组患者治疗有效情况比较
观察组总有效率为86.67%,明显高于对照组的69.05%,差异有统计学意义(P<0.05)。见表4。
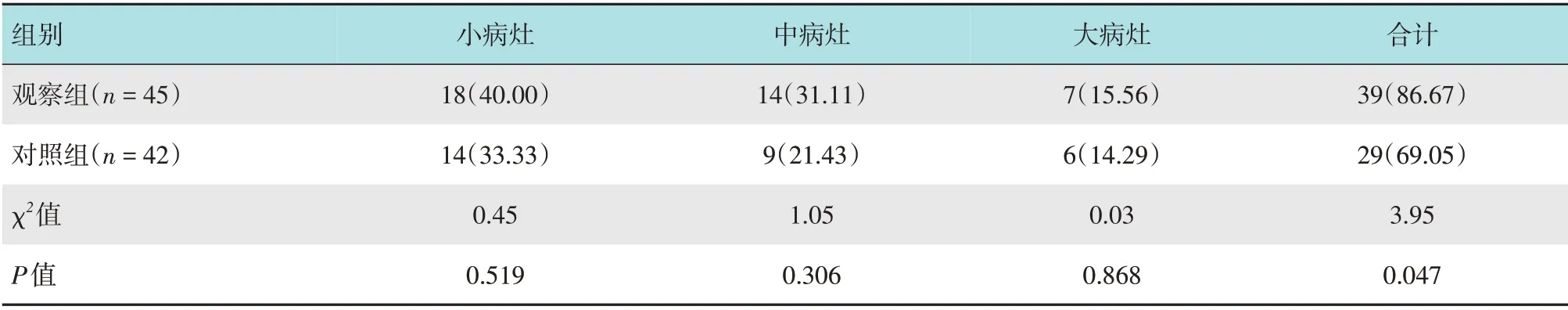
表4 两组患者治疗有效情况比较 例(%)Table 4 Comparison of treatment effectiveness between the two groups n(%)
2.4 两组患者术后死亡率比较
术后2年,观察组死亡率为15.56%,明显低于对照组的26.19%,两组患者比较,差异有统计学意义(P<0.05);两组患者不同直径病灶死亡率比较,差异有统计学意义(P<0.05)。见表5。

表5 两组患者术后死亡率比较 例(%)Table 5 Comparison of postoperative mortality between the two groups n(%)
2.5 影响直肠癌肝转移患者生存的单因素分析
按照患者死亡与否分成死亡组和存活组,结果显示:两组患者在病灶大小、术前CEA、肝外转移、TNM 分期、组织分型、转移灶数目和转移灶发现时间等方面比较,差异有统计学意义(P<0.05)。见表6。
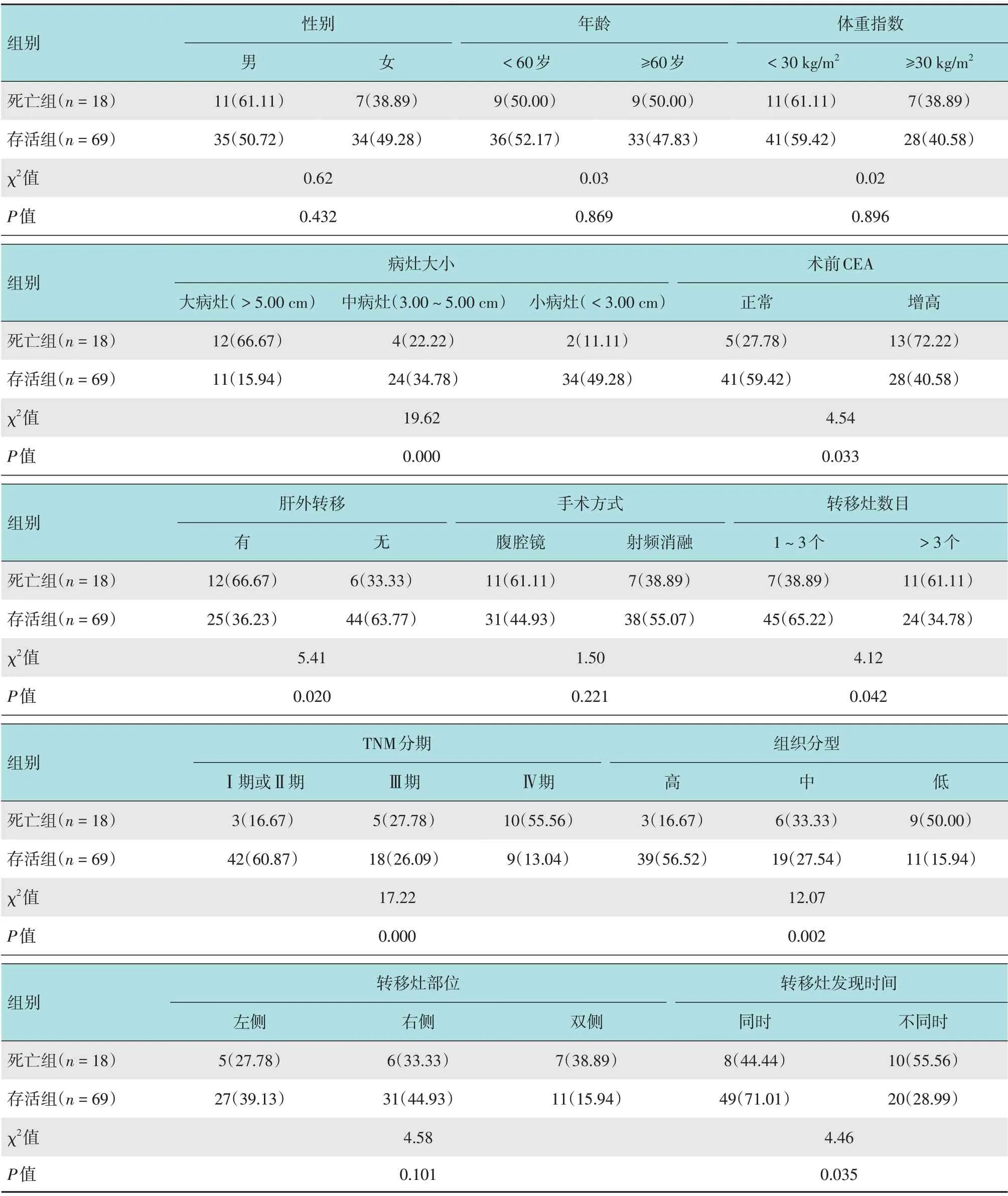
表6 影响直肠癌肝转移患者死亡的单因素分析 例(%)Table 6 Univariate analysis of mortality in patients with liver metastasis of rectal cancer n(%)
2.6 影响直肠癌肝转移患者生存的多因素分析
将单因素分析差异有统计学意义的指标纳入多因素Logistic 回归方程,以可疑危险因素为自变量,以患者死亡发生与否作为因变量,进行Logistic 多因素回归分析。结果显示:术前CEA(=2.117,P=0.021)、肝外转移(=1.897,P=0.015)和大病灶(=8.787,P=0.007)是影响直肠癌肝转移灶患者生存的独立危险因素。见表7。
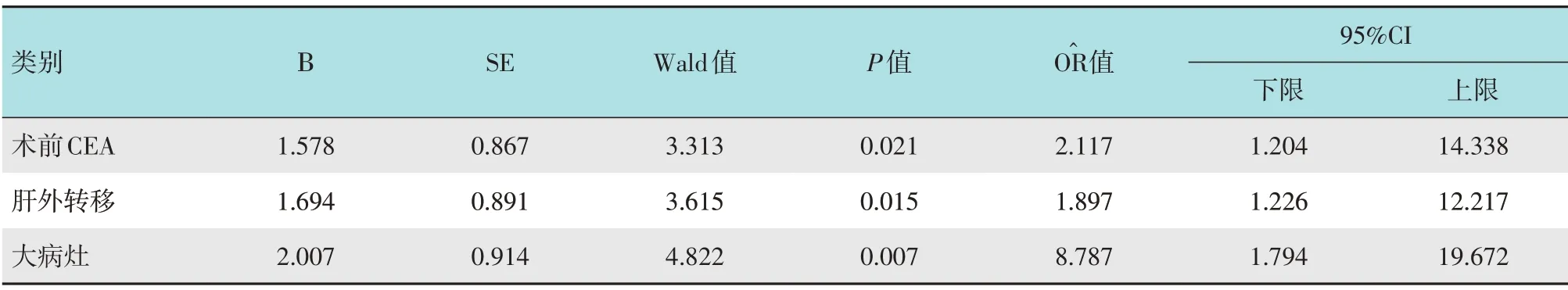
表7 影响直肠癌肝转移患者死亡的多因素分析Table 7 Multivariate analysis of mortality in patients with liver metastasis of rectal cancer
2.7 典型病例
2.7.1 观察组术前超声造影见直肠癌术后左肝转移瘤动脉期快速增强,静脉期及延迟期消退,病理结果证实为转移性肝癌,采用超声引导下射频消融术治疗。术中见左肝肿瘤消融范围大于原肿瘤区域,提示消融完全,术后超声造影显示左肝转移瘤全期无造影剂灌注,考虑消融完全。见图1。
2.7.2 对照组患者为直肠癌术后左肝转移性肿瘤,采用腹腔镜下左肝肿瘤切除术,术后切缘阴性,术中快速病理证实:术后病理切缘无残存肿瘤细胞。见图2。
3 讨论
肝脏血运丰富,是重要的代谢器官,全身各处的恶性肿瘤均有转移至肝脏的可能。因此,肝转移癌在临床比较常见。其起病隐匿,约有15.00%~25.00%的直肠癌患者在确诊时发生肝转移[5-6],并且很多转移灶不能完全切除。目前,手术完全切除是治疗直肠癌肝转移的首选方法[7],切除肝转移灶能够减少肿瘤细胞数量,从而降低肿瘤细胞播散入血的风险,延缓肿瘤细胞肝外转移的进程。未接受治疗的肝转移癌患者生存时间在16~18 个月,而手术切除转移灶的患者生存时间大大延长,5年生存率能够达到25.00%~50.00%[8]。
有研究[9-10]显示,仅有20.00%的直肠癌肝转移患者具备手术切除指征。受疾病状态、机体耐受能力、转移病灶的发病位置、数量和分布等因素影响,很多转移癌并不能行全切手术。近年来,射频消融因其微创和安全性高等优点,在肝转移癌治疗中被广泛应用。射频消融的原理是:将射频针穿刺进入肿瘤组织,热效应使肿瘤细胞凝固变性坏死,从而杀伤肿瘤细胞。其已被美国国立综合癌症网络中肝癌治疗指南列为继手术切除和介入治疗后的第3类根治性治疗方法[11-12]。射频消融具有疗效确切、创伤小和安全性高等优点[13-14],其治疗肝癌小病灶的有效率可达80.00%以上,能够减轻肝脏损害和组织损伤[15-16]。有文献[17]表明,射频消融治疗恶性肿瘤的5年生存率在22.00%以上,中位生存时间为40 个月,远期疗效与手术切除基本一致。
但射频消融治疗范围偏窄小,对较大体积的肿瘤边界消融不完全,易残留,超声引导下射频消融术一定程度上能够减少副损伤,扩大消融范围,提高消融率。有研究[18]显示,腹腔镜结直肠癌根治术联合肝转移灶射频消融术对直径在3.0 cm以下的肝肿瘤治疗效果较好。本研究中,观察组大中小病灶的灭活程度明显高于对照组,差异有统计学意义(P<0.05)。说明:超声引导下射频消融术在治疗肝转移癌方面效果较好。超声引导能够更精确地查找到转移病灶,尤其是利用超声造影技术可明显提高肝脏病灶的检出率,从而提高了消融的精确度。两组患者术前GPT、ALB和GOT水平无明显差异,但在术后3个月复查,观察组GPT、ALB 和GOT 明显低于对照组,考虑原因为:通过超声引导下射频消融术治疗,可精准、微创地消融病灶,对机体损伤小,肝功能受损轻微。CEA是直肠癌特异性较高的肿瘤标记物。有研究[19]表明,直肠癌肝转移患者若术前CEA 明显增高,其预后一般不佳,这类患者往往存在肝内外未发现的转移灶。本研究通过单因素与多因素分析发现,术前CEA 增高是影响直肠癌肝转移患者死亡的独立危险因素。
有学者[20]认为,肝转移灶的大小对预后有明显影响,肝转移灶在5.00 cm 以下的患者生存率明显高于5.00 cm 以上的患者,与本研究结果一致。本研究随访2年发现:不同直径转移癌的治疗效果不尽相同,大病灶的死亡率明显高于中小病灶(P<0.05),说明:转移癌灶的直径影响患者的术后生存情况。直肠癌肝转移合并有肝外转移患者预后一般比较差,可能与这类患者病情进展快、肿瘤负荷重相关。本研究中,肝外转移是影响患者预后的独立危险因素,与报道[21]一致。
综上所述,超声引导下射频消融术治疗直肠癌肝转移,较腹腔镜治疗,对肝脏损伤小且疗效好。肝转移癌肿瘤大小会影响患者生存情况,术前CEA 和肝外转移也是影响直肠癌肝转移患者生存的独立危险因素。

