miR⁃375靶向YAP1调节宫颈癌细胞侵袭迁移的机制研究
何小丽 林蓓蓓 范幸
宫颈癌是一种常见的发生于女性生殖系统的妇科恶性肿瘤,其发病率及死亡率呈逐年上升趋势,给女性的生命健康带来严重的威胁[1]。微小RNA(microRNA,miRNA)是一类长度为19~25 个核苷酸的小分子非编码RNA,被认为是基因表达转录后的调控因子[2]。研究显示,miRNAs 参与调控恶性肿瘤的发生及发展,已成为肿瘤生物靶向治疗的靶标[3]。YAP1 是Hippo 信号通路的组成部分,通路包含像Hippo/MST1⁃2 激酶、Sav1 结合体、LATS1/2 激酶在内的激酶级联反应。裴峰等[4]研究表明,LATS1/2 激酶对肿瘤有抑制作用,而YAP1 有致瘤基因的功能,调控YAP1 表达可能成为宫颈癌靶向治疗的新思路。miR⁃375 在宫颈癌等实体瘤内为异常低表达,提示其有可能存在抑癌基因的效应,但目前miR⁃375 是否通过靶向YAP1 调控宫颈癌细胞的生物学行为尚未明确[5]。本文通过探讨miR⁃375 靶向YAP1 调节宫颈癌细胞侵袭迁移的机制,旨在为临床诊断及靶向治疗宫颈癌的提供新的方向。报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年1月在长沙市妇幼保健院行宫颈癌根治术患者50 例,取切除的癌组织、癌旁组织标本。患者平均年龄(58.27±9.57)岁。纳入标准:①符合《宫颈癌诊断与治疗指南(第四版)》中宫颈癌的诊断标准[6],且经病理确诊为原发性宫颈癌;②未并发其他肿瘤;③无恶性肿瘤家族史。排除标准:临床病理资料及随访信息不完整者,临床病理资料包含组织学分级、有无淋巴结转移、肿瘤分期(Federation of Gynecology and Obstetrics,FIGO)等。本研究已获得长沙市妇幼保健院伦理委员会审核批准,且均经患者知情同意。
1.2 方法
取标本磨碎后匀浆,12 000 rpm 转速离心15 min(离心半径10 cm)。TRIzol 试剂盒(北京雷根生物技术有限公司)提取总RNA。mRNA 和mi⁃croRNA 的反转录分别使用PrimeScriptTMRT Mas⁃ter Mix(TaKaRa,日本)和miScript Reverse Tran⁃scription Kit(Qiagen,德国)。使用Mastercycler nexus X2(Eppendorf,德国)进行实时荧光定量聚合酶链反应(Real⁃time fluorescence quantitative polymerase chain reaction technology,qRT⁃PCR)进行扩增。扩增条件:95℃,15 s,60℃,60 s,72℃,40 s,进行35 个循环。用2⁃ΔΔCt方法处理数据,并分别以GAPDH作为内参计算miR⁃375和YAP1mRNA 相对表达水平。引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.2.2 细胞培养
宫颈癌细胞系Hela 购自上海生工生物工程技术服务有限公司。将细胞放在含有10%胎牛血清(Sigma⁃Aldrich,St.Louis,美国)、100 U/mL 青霉素、100 mg/mL 链霉素的RPMI 1640(Gibco,Rock⁃ville,美国)培养基中,置于37℃、5% CO2、饱和湿度的细胞培养箱(Thermo Fisher Scientific,美国)中静置培养,选取对数生长期细胞进行实验。
1.2.3 细胞转染分组
细胞按照3×105接种细胞,待细胞融合度80%时,去病毒上清按照最优的感染复数MOI 值,转染细胞。转染48 h 后,荧光显微观察荧光蛋白。传代后,换用含抗性DMEM 培养液进行筛选,得到稳定传代的细胞克隆。获得miR⁃miR⁃375 细胞、shYAP1 细胞、miR⁃375+YAP1 细胞。同时设空白对照(normal control,NC)组,予以常规培养。
1.2.4 细胞划痕试验检测细胞迁移活性
消化细胞、重悬后,将上述稳定转染的细胞均匀接种于6 孔板内,次日待细胞贴壁并长满后用微量加样器枪头垂直于6 孔板底和标记,分别于划痕后0、12、24、48 h 拍照,用photoshop 软件测量划痕宽度,划痕愈合率代表迁移能力线划一条划痕。
同时,要结合实际,不断加强现代信息技术攻关,针对农业基层统计工作实际情况,探索更加有效的统计调查方法,与经济普查、人口普查等活动有机结合起来,不断构建基层农业统计信息服务体系和平台,加强部门联动[3],切实减轻工作人员负担,提高智能化、自动化信息检索和收集统计效率,提高信息共享利用水平。
1.2.5 细胞迁移侵袭试验技术(Transwell)检测细胞侵袭活性
基质胶溶液均匀铺在小室,向24 孔板孔内加入500 μL 含10% FBS 的培养液,FBS 作为趋化因子诱导细胞穿膜。将各组细胞消化、收集、离心、重悬,制成单细胞悬液后调整细胞密度并接种至小室内,置于细胞培养箱内培养36 h。4%的多聚甲醛溶液中固定10 min,结晶紫溶液染色5 min,随机选取10 个视野,计数平均每个视野细胞数。
1.2.6 蛋白质印迹(Western blot)法检测各组上皮间充质转化(Epithelial⁃Mesenchymal Transiton,EMT)相关蛋白表达情况
检测EMT 相关β⁃catenin、Snail、Twist、E⁃cad⁃herin、Vimentin 的表达情况。各组细胞用PBS 清洗3 次后,加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,100℃变性5 min,等量蛋白进行SDS⁃PAGE 凝胶电泳分离并转移至PVDF 膜上。经5%的BSA 封闭1 h 后加入相应的一抗,4℃过夜孵育后加入辣根过氧化物酶标记的二抗,室温孵育1.5 h,加入发光液后凝胶成像仪进行曝光拍照并统计灰度值计算相对表达量。
1.2.7 荧光素酶系统验证miR⁃375与YAP1 的靶向性
构建YAP1 的3′UTR 区域突变,将其与mimic和mimic control 共转染入HCT116 细胞中培养24 h。吸去上清,加入75 μL/孔的新鲜培养基,并加入75 μL/孔配置好的Luciferase 底物,震荡10 min,用多光能酶标仪测定荧光值;加入75 μL/孔配置好的Stop regent,震荡10 min,测定荧光值。
1.3 统计学方法
应用SPSS 16.0 软件分析处理数据,计量资料用()表示,行t检验;Pearson 分析miR⁃375 与YAP1 表达的相关性,另分析miR⁃375 与YAP1 表达与宫颈癌临床病理学参数的关系,以P<0.05 为差异有统计学意义。
2 结果
2.1 miR⁃375、YAP1 表达量比较
与癌旁组织相比,miR⁃375 在癌组织当中低表达,YAP1 在癌组织中高表达,差异有统计学意义(P<0.05)。见表2、图1。
表2 miR⁃375、YAP1 表达量比较(±s)Table 2 Comparison of miR⁃375 and YAP1 expression levels(±s)

表2 miR⁃375、YAP1 表达量比较(±s)Table 2 Comparison of miR⁃375 and YAP1 expression levels(±s)
分组癌组织癌旁组织t 值P 值n 50 50 miR⁃375 0.58±0.11 3.58±0.87 24.190<0.001 YAP1 4.76±0.68 0.47±0.09 44.225<0.001
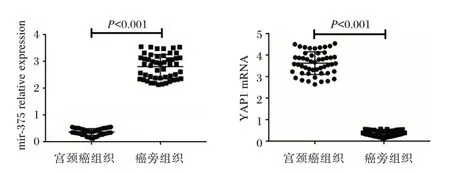
图1 miR⁃375、YAP1 在宫颈癌及癌旁组织的表达量比较Figure 1 Comparison of Mir⁃375 and YAP1 expression levels in cervical cancer tissues and adjacent tissues
2.2 miR⁃375 和YAP1 mRNA 与宫颈癌组织的相关性
Pearson 分析显示miR⁃375 和YAP1 mRNA 在宫颈癌组织中呈负相关(r=-0.973,P<0.001)。
2.3 miR⁃375 和YAP1 mRNA 表达与宫颈癌临床病理学参数的关系
miR⁃375 和YAP1mRNA 在不同组织学分级、FIGO 分期、淋巴结转移间表达差异有统计学意义(P<0.05)。见表3。
表3 miR⁃375 和YAP1 mRNA 表达与宫颈癌临床病理学特征的关系(±s)Table 3 Relationship between miR⁃375 and YAP1 mRNA expression and clinicopathological features of cervical cancer(±s)

表3 miR⁃375 和YAP1 mRNA 表达与宫颈癌临床病理学特征的关系(±s)Table 3 Relationship between miR⁃375 and YAP1 mRNA expression and clinicopathological features of cervical cancer(±s)
临床病理特征年龄(岁)n t 值1.745 P 值0.087 t 值0.125 P 值0.901组织学分级49.451<0.001 10.188<0.001 FIGO 分期33.920<0.001 15.999<0.001肌层浸润深度分类≥60<60 G1+G2 G3Ⅰ期+Ⅱ期Ⅲ期≥1/2<1/2 1.734 0.089 0.487 0.628淋巴结转移31.167<0.001 14.376<0.001病理学类型是否鳞癌1.095 0.279 0.235 0.815腺癌21 29 18 32 30 20 18 32 30 20 45 5 miR⁃375 0.35±0.02 0.36±0.02 0.54±0.03 0.19±0.02 0.55±0.05 0.15±0.02 0.36±0.03 0.35±0.01 0.21±0.02 0.43±0.03 0.36±0.02 0.35±0.01 YAP1 3.63±0.29 3.62±0.27 3.24±0.21 4.12±0.33 3.04±0.23 4.35±0.35 3.61±0.21 3.65±0.31 4.23±0.24 3.11±0.31 3.64±0.27 3.61±0.28
2.4 细胞划痕实验检测细胞的迁移活性
24 h、48 h 时miR⁃375mimic、shYAP1 细胞迁移率低于NC 和sh⁃miR⁃375+sh⁃YAP1,差异有统计学意义(P<0.05)。见图2。
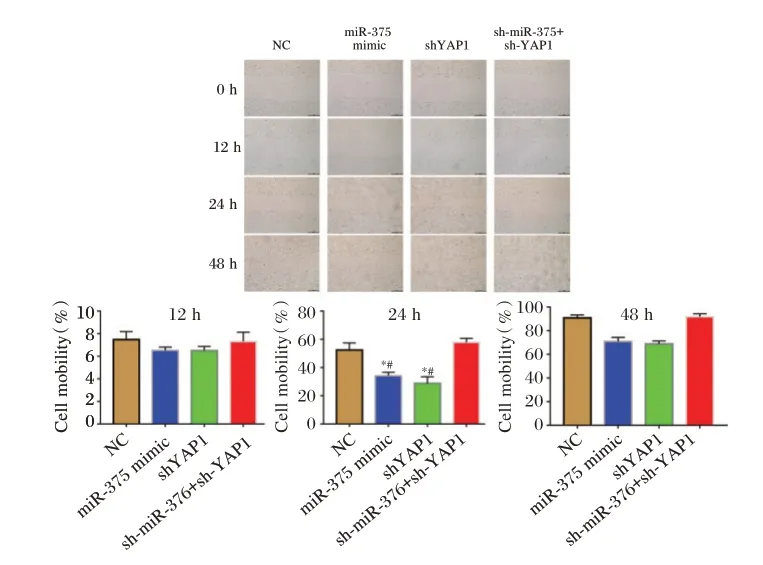
图2 细胞划痕实验检测Hela 细胞的迁移活性Figure 2 Cell scratch assay for migration activity of Hela cells
2.5 Transwell 小室实验检测细胞的侵袭活性
24 h miR⁃375 mimic、shYAP1 细胞侵袭数量明显低于NC 和sh⁃miR⁃375+sh⁃YAP1,差异有统计学意义(P<0.05);miR⁃375 mimic、shYAP1 细胞侵袭数量差异无统计学意义(P>0.05),NC 和sh⁃miR⁃375+sh⁃YAP1 细胞侵袭数量差异无统计学意义(P>0.05)。见图3。

图3 Transwell 检测Hela 细胞的侵袭Figure 3 Invasion of Hela cells detected by Transwell
2.6 Western blot 法检测细胞EMT 相关蛋白表达情况
miR⁃375 mimic、shYAP1 细胞β⁃catenin、Snail、Twist、E⁃cadherin、Vimentin 蛋白表达明显明显低于NC 和sh⁃miR⁃375+sh⁃YAP1,差异有统计学意义(P<0.05)。见图4。

图4 Western blot 法检测Hela 细胞β⁃catenin、Snail、Twist、E⁃cadherin、Vimentin 表达Figure 4 Expression of β⁃catenin,Snail,Twist,e⁃cadherin and Vimentin in Hela cells detected by Western blot
2.7 双荧光素酶报告系统研究miR⁃375 与YAP1靶向关系
miR⁃29a 降低含有WT 3′UTR 的YAP1 的荧光素酶活性,但不降低含有Mut 3′UTR 的YAP1 的荧光素酶活性。见图5。
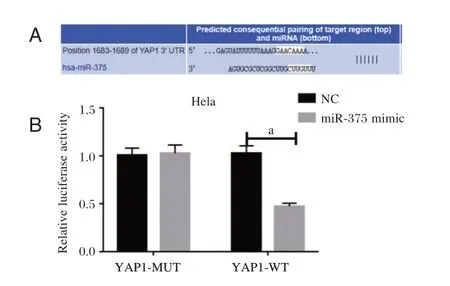
图5 双荧光酶素试验结果Figure 5 Results of double luciferase test
3 讨论
本研究结果提示miR⁃375 在宫颈癌的发生及发展中可能发挥重要调控作用。进一步结果表明miR⁃375 在宫颈癌细胞系中的表达水平均呈现为异常低表达,与既往研究[7]一致。miR⁃375在宫颈癌中存在异常低表达已得到多项研究证实,Bayra⁃moglu 等[8]发现其在宫颈鳞癌中低表达,且可通过靶向转录因子SP1 抑制癌细胞的迁移和侵袭过程;Morel 等[9]研究发现miR⁃375通过抑制蛋白E6 蛋白从而抑制人宫颈癌HPV16 细胞增殖、侵袭过程。为了进一步明确miR⁃375在宫颈癌细胞侵袭、迁移中的作用,通过转化的平板中挑去阳性克隆测序验证后,细胞划痕实验结果显示24 h、48 h 时miR⁃375mimic、shYAP1 细胞迁移率低于NC 组和sh⁃miR⁃375+sh⁃YAP1;Transwell 实验结果显示,miR⁃375 mimic、shYAP1 细胞侵袭数量低于NC 和sh⁃miR⁃375+sh⁃YAP1。过表达miR⁃375 可有效抑制宫颈癌细胞的侵袭和迁移,其机制与靶向YAP1 有关,提示miR⁃375 可通过靶向YAP1 抑制宫颈癌的发展。张强等[10]研究显示,miR⁃375 具有阻滞宫颈癌细胞增殖和迁移的作用,其作用机制可能与靶向调控PIK3CA 密切相关,提示miR⁃375 可能在宫颈癌中发挥抑癌作用。
miRNA 调控肿瘤细胞的生物学功能主要是通过与靶基因3′UTR 结合,因此,本研究通过生物信息学平台RNAInter 进行预测,确定YAP1 评分较高的靶点(Confidence Score=0.982)。YAP1 是Hippo通路中重要的组成部分,已被证实是一个促肿瘤靶点[11]。YAP1 基因的mRNA 在大多数肿瘤细胞内均呈现高表达,且和肿瘤的进展有较强的相关性。此外,周雅青等[12]研究表明,YAP1 能对多数细胞株起到体外诱导作用引发EMT,进而推动恶性肿瘤的发展。ENT 是肿瘤微环境调控癌细胞转移的最重要机制,上皮性肿瘤细胞发生ENT 表示着细胞发生转移、侵袭能力加强[13]。因此,本研究通过Western blot 法检测细胞EMT 相关蛋白表达情况,结果显示miR⁃375 mimic、shYAP1 细胞相关蛋白表达低于NC 组和sh⁃miR⁃375+sh⁃YAP1 组,提示miR⁃375 能够抑制细胞EMT,而YAP1 能够促进细胞EMT。叶星明等[14]表示miR⁃375 可通过靶向YAP1 的表达对曲妥珠单抗耐药细胞株的EMT 进行调控。
本研究的双荧光素酶报告系统显示,YAP1 是miR⁃375 靶标,且miR⁃375 与YAP1 3′UTR 区域存在结合位点,提示YAP1 可能受到miR⁃375 的调节。此外,本研究发现miR⁃375 与YAP1 在肿瘤组织中呈负相关,与Kang 等[15]报道一致,结果提示miR⁃375 参与宫颈癌的发生,异常低表达会促进疾病发生恶化。本研究还探讨了miR⁃375 和YAP1 mRNA 表达与宫颈癌临床病理学特征的关系,结果发现,miR⁃375 和YAP1 mRNA 表达在不同组织学分级、FIGO 分期、淋巴结转移间存在统计学意义。提示miR⁃375、YAP1 在宫颈癌的发展及淋巴转移过程有参与作用,同时也表明了miR⁃375、YAP1 可作为宫颈癌术后监测及预后的临床参考指标。
综上所述,可通过miR⁃375 靶向负调控YAP1从而抑制EMT,进一步抑制宫颈癌细胞的侵袭以及迁移,为宫颈癌的治疗提供了新的靶点。此外,术后的miR⁃375、YAP1 的表达情况可作为临床上术后的监测及预后指标。

