131I清甲治疗前sTg水平与DTC术后清甲治疗疗效的关系
赵玮 史良平 程义壮
甲状腺癌是内分泌系统常见恶性肿瘤之一,近年来,随着人们生活节奏及饮食习惯上的改变,其发病率逐渐升高。甲状腺癌中超过90%为分化型甲状腺癌(differentiatedthyroid carcinoma,DTC),其治疗及预后受到越来越多的关注[1]。目前临床上主要是采用手术切除甲状腺组织治疗DTC,而术后通常采用放射性131I 清除残余甲状腺癌组织,从而降低DTC 的复发及转移[2]。关于131I清甲治疗效果受多方面因素影响,有学者[3]认为清甲距手术时间、术前血清促甲状腺激素(thyroid Stimulating Hormone,TSH)水平与疗效相关。近来也有研究[4]认为131I 清甲治疗前刺激状态下甲状腺球蛋白(stimulating thyroglobulin,sTg)及其动态变化对131I 治疗后的远处转移具有较高预测价值。故本研究旨在探究影响131I 清甲治疗效果的危险因素,及sTg 与治疗效果的相关性,以期为提高临床治疗DTC 疗效提供参考,报告如下。
1 资料与方法
1.1 研究对象
选择2019年1月至2021年6月来安徽省肿瘤医院就诊的DTC 患者206 例,其中男性60 例,女性146 例。纳入标准:①符合DTC 诊断标准[5],均进行甲状腺切除手术,且术后经病理学确诊为DTC;②术后接受131I 清甲治疗清除残余甲状腺组织;③131I 清甲治疗前TSH>30 mU/L;④患者资料完整,且能按时进行复查。排除标准:①存在131I 治疗禁忌症患者;②伴有其他恶性肿瘤患者;③存在较为严重的心、肝、肾功能障碍患者;④有垂体手术史或病变史患者;⑤头颈胸部既往接受过放疗患者;⑥妊娠或哺乳期患者。根据治疗后131I 全身显影结果将其分为清甲成功组(n=122)与清甲未成功组(n=84)。患者均知情并同意参与本研究,研究经医学伦理委员会同意。
1.2 方法
1.2.1131I 清甲治疗
治疗前,叮嘱患者术后停服甲状腺素片约3~4 w,保持低碘饮食,于131I 清甲治疗前检测相关生化指标、心电图、颈部彩超等,并计算残留甲状腺大小,治疗前血清TSH 水平升至30 mU/L 以上。131I清甲治疗:131I 首次剂量为100 mci,在空腹状态服用,服药后2 h 开始进食,多饮食,将其置于辐射隔离病房观察,服药2 d 后进行左甲状腺素替代治疗,131I 治疗7 d 后,行131I 全身显像(美国GE infinia Hawkeye SPECT 仪),治疗6 个月后评估治疗效果。
1.2.2 清甲治疗的效果评价清甲治疗成功的标准[6]:131I 显像甲状腺床无放射性浓聚或停用T4 后sTg<1 μg/L。
1.3 观察指标
①收集患者一般资料,包括性别、年龄、体质质量、病理类型、手术方式、残余甲状腺质量、治疗前是否存在转移灶、131I 清甲治疗前sTg 水平。②治疗前TSH、sTg 水平检测:治疗前,取患者静脉血3 mL,离心后分离上层血清,采用电化学发光免疫分析法检测sTg、TSH 水平。③多因素分析:以131I 清甲是否成功(清甲成功=0,清甲未成功=1)作为因变量,将单因素中差异存在统计学意义的因素(手术方式、残余甲状腺估算质量、治疗前甲状腺外转移灶、131I 清甲治疗前sTg 水平)作为自变量,并进行赋值,手术方式(全切=0,其他=1),残余甲状腺估算质量(≤3.00 g=0,>3.00 g=1),治疗前甲状腺外转移灶(无转移灶=0,有转移灶=1)、131I 清甲治疗前sTg 水平(≤20.00 μg/L=0,>20.00 μg/L),将其纳入Logistic 回归模型中,回归方程为LogitP=0.825×手术方式+0.718×残余甲状腺质量+0.597×转移灶+0.684×131I 清甲治疗前sTg 水平+0.257。
1.4 统计学方法
采用SPSS 20.0 统计学软件进行数据分析;计量资料以()表示,两两比较采用t检验;计数资料以n或(%)表示,采用χ2检验;多因素分析采用二元Logistic 回归分析,并根据分析结果建立预测模型,131I 清甲治疗前sTg 水平对DTC 患者术后131I清甲治疗效果的诊断价值采用ROC 曲线分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 DTC 患者术后131I 清甲治疗效果的单因素分析
两组性别、年龄、体质质量、病理类型比较,差异无统计学意义(P>0.05),两组的手术方式、残余甲状腺估算质量、治疗前甲状腺外转移灶、131I 清甲治疗前sTg水平比较,差异有统计学意义(P<0.05)。见表1。
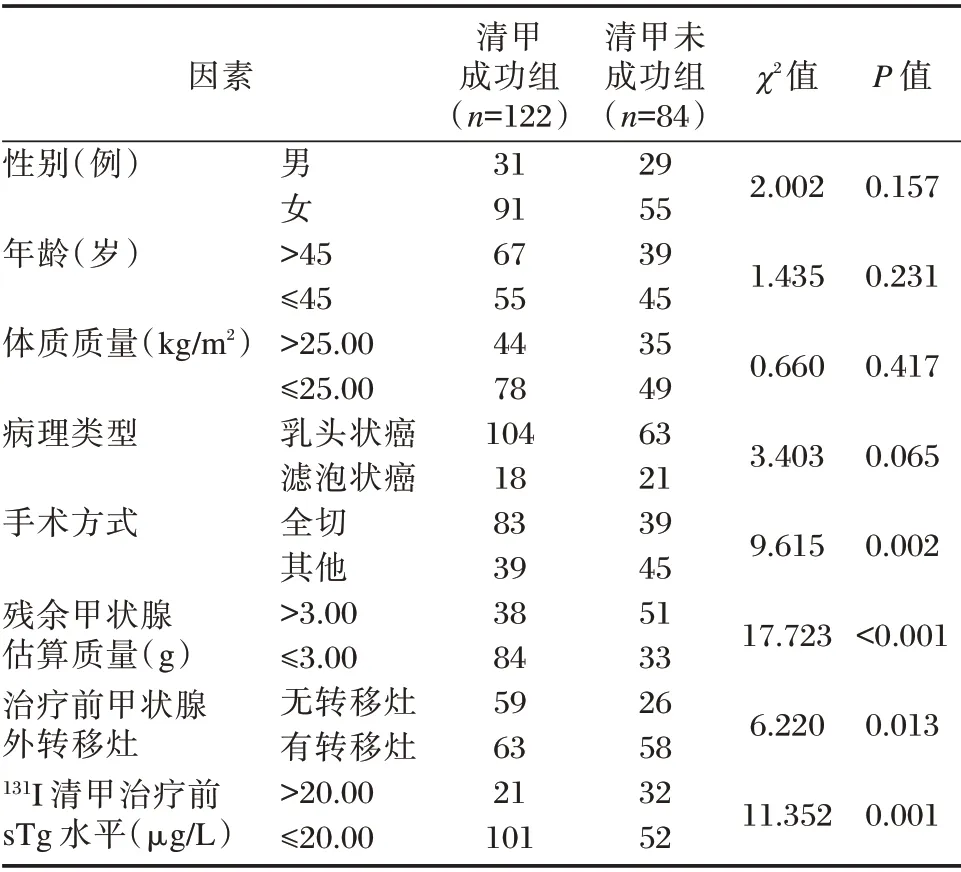
表1 DTC 患者术后131I 清甲治疗效果的单因素分析Table 1 Univariate analysis on the curative effect of131I thyroid remnant ablation on patients after DTC surgery
2.2 DTC 患者术后131I 清甲治疗效果的多元Logistic 分析
多因素分析结果显示,手术方式非全切,残余甲状腺质量>3.00 g,治疗前存在转移灶、131I 清甲治疗前sTg 水平>20.00 μg/L 是术后131I 清甲治疗效果的独立危险因素。见表2。
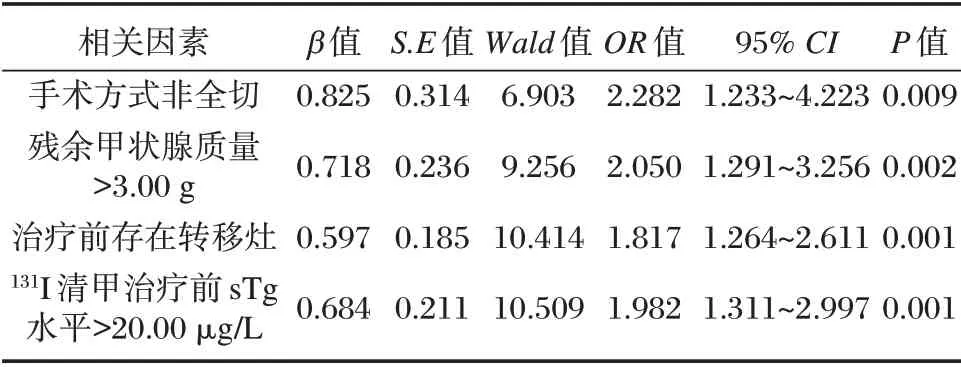
表2 DTC 患者术后131I 清甲治疗效果的多元Logistic 分析Table 2 Multivariate Logistic analysis on the curative effect of131I thyroid remnant ablation on patients after DTC surgery
2.3 单纯颈部淋巴结转移及远处转移与131I 清甲治疗前sTg 水平比较
远处转移组(n=37)131I 清甲治疗前sTg 水平(29.18±7.24)高于单纯颈部淋巴结转移组(n=84)(19.65±5.83),差异有统计学意义(t=7.679,P<0.05)。
2.4 131I 清甲治疗前sTg 水平对DTC 患者术后131I清甲治疗效果的预测价值分析
清甲成功组治疗前sTg水平为(16.52±4.78)μg/L,清甲未成功组治疗前(28.54±6.39)μg/L,采用ROC 曲线分析可知,131I 清甲治疗前sTg 水平对DTC 患者术后131I 清甲治疗效果的AUC 为0.935,其Cut off 值为22.59 μg/L,敏感度为0.83,特异性为0.91。见图1。
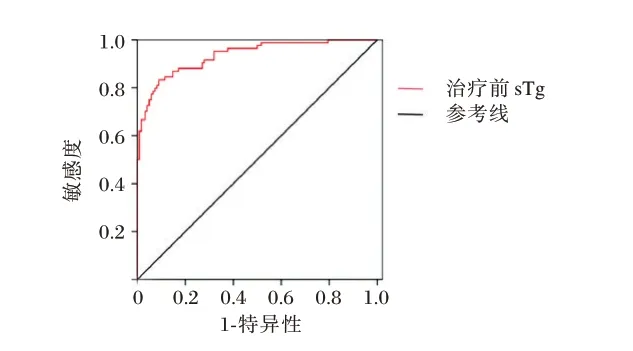
图1 ROC 曲线Figure 1 ROC curve
3 讨论
DTC 是甲状腺癌的常见类型,30~45 岁是DTC发病的高峰,近年来随着环境变化,人们生活节奏加快及饮食习惯改变等,发病率呈升高趋势[7]。DTC 分化程度较高,恶性程度较低,因此临床治疗多采用手术切除,能取得较好的效果;但是由于颈部解剖结构复杂,会残留部分甲状腺及淋巴结,因而在术后会存在复发或转移,影响患者预后[8]。随着技术的发展,目前术后采用131I 产生的电离辐射清除残留甲状腺组织,辅助改善患者预后[9]。而治疗效果除与个体差异相关,还与很多因素相关。有研究表明131I 的治疗剂量与疗效相关,由于残余甲状腺体积接受的131I 辐射量与其治疗剂量成正相关,随着131I 的治疗剂量的增加,清除残余甲状腺组织的疗效越高[10];还有研究表明[11]残余甲状腺大小、手术方式、病程等与清甲效果相关;因而寻找与清甲疗效相关的影响因素对于临床具有重要意义。
有研究报道[12]显示清甲成功率为43.0~87.2%,而本研究中,术后清甲成功率59.22%,与前人研究具有一致性。进行单因素分析,本研究中清甲成功组与未成功组在性别、年龄、体质指数、病理类型上无明显差异,而两组手术方式、残余甲状腺质量、有无转移灶、131I 清甲治疗前sTg 水平存在明显差异。多项研究表明[13]首次清甲效果与病理类型无关,这与本研究结果具有一致性。还有研究表明[14]年轻DTC 患者的131I 治疗缓解率很高,而本研究中年龄对治疗效果影响不大,这可能与本研究患者样本量较少,中年患者较多相关。进一步采用多因素分析发现,手术方式、残余甲状腺质量、有转移灶、131I 清甲治疗前sTg 水平>20.00 μg/L是影响术后临床疗效的独立危险因素。甲状腺的手术方式包括甲状腺全切术、近全切、次全切及腺叶切除,近年来多主张全切或近全切,以保证术后残余甲状腺组织尽量少。而残余甲状腺质量越少,甲状腺激素处于低水平状态,导致Tg 水平随之下降,而TSH 激素则代偿性升高[15⁃16]。值得注意的是TSH 能促进残余甲状腺组织的131I 摄取率,因此治疗前须停用甲状腺激素2~4 周待TSH 升高到一定水平再行治疗[17]。研究表明[18]存在远处转移灶患者的预后较差,治疗缓解率低,而本研究中单纯颈部淋巴结转移患者131I 清甲治疗前sTg 水平低于远处转移患者,提示131I 清甲治疗前sTg 水平对于远处转移可能具有具有较高价值。
Tg 是甲状腺组织的滤泡上皮细胞分泌,被认为是DTC 的重要肿瘤标志物,而sTg 是在DTC 术后未服或停服甲状腺激素状态下,TSH 水平升至30 mIU/L 以上时测定的血清Tg 水平[19]。有研究表明[20]首次131I 治疗前的sTg 水平对判断DTC 有无转移、转移部位、转移灶数目及直径均有一定预测价值。也有研究表明[21]131I 治疗前的sTg 水平受到残余甲状腺组织、血清中TSH 等因素影响,目前尚未无明确的最佳sTg 界值点可用来预测治疗反应。本研究预测术后疗效时,131I 清甲治疗前sTg对清甲治疗效果具有较高的预测价值,这有助于发现常规影像学检查无法发现的隐匿病灶。本研究中,131I 清甲治疗前sTg 预测疗效的Cut off 值高于部分研究[22]中清甲治疗后sTg 诊断复发或转移的临界值10 μg/L,考虑这与少许残余甲状腺组织残留相关。
综上,手术方式、残余甲状腺质量、治疗前存转移灶、131I 清甲治疗前高sTg 水平是影响清甲疗效的重要因素,在治疗前应采取相应手段降低sTg水平来提高成功率。

