一种宫颈鳞癌瘤芽评估的新方法
郑少秋,罗敬,卢善明,刘清华,谢寿城,刘堃,谢玉珍
1 梅州市人民医院病理科,广东梅州 514000;2 梅州市人民医院盆腔放疗科
瘤芽是肿瘤浸润前缘分散在间质的单个肿瘤细胞或5 个以下的肿瘤细胞簇,是许多实体瘤预后的独立影响因素[1]。在国际癌症控制联盟、美国癌症联合委员会和世界卫生组织发布的癌症分类指南中,瘤芽均被列为肿瘤预后的独立影响因素[2]。瘤芽与肿瘤侵袭、转移和复发密切相关,近年来受到广泛关注。但目前关于宫颈鳞癌瘤芽的研究较少,且未形成统一的瘤芽评估标准。本研究比较了不同瘤芽评估对象与计数方法,旨在探索一种一致性高的宫颈鳞癌瘤芽评估方法,以期为宫颈鳞癌瘤芽评估标准的建立提供参考依据。
1 资料与方法
1.1 临床资料 选择2018 年1 月—12 月梅州市人民医院收治的宫颈鳞癌患者95 例。所有患者经组织病理检查明确诊断。纳入标准:①符合宫颈鳞癌诊断标准;②初诊;③接受宫颈癌根治术;④入院前未接受任何抗肿瘤治疗。排除标准:①合并其他部位恶性肿瘤者;②合并心、肝、肾等重要脏器严重疾病者;③未规范治疗者。患者年龄26~78 岁、中位年龄52 岁,FIGO 分期:ⅠB 期43 例、ⅡA 期52 例,有脉管侵犯43例,有淋巴结转移12例。本研究经梅州市人民医院医学伦理委员会批准(伦理批件编号:梅市伦审2019-C-51),患者或其家属知情同意。
1.2 方法
1.2.1 瘤芽评估 ①瘤芽判断:参照HASE 等[3]研究结果,在肿瘤浸润前缘孤立的单个肿瘤细胞或少于5 个肿瘤细胞的细胞簇。②瘤芽评估对象筛选:随机选取50 例份宫颈鳞癌组织HE 染色切片,由两名经验丰富的病理医师分别筛选出肿瘤浸润最深切片和瘤芽密度最大切片并记录切片号。同一病例,若两名病理医师选取的肿瘤浸润最深和瘤芽密度最大切片为同一切片,则筛选结果一致,反之则筛选结果不一致。统计分析两名病理医师筛选肿瘤浸润最深切片和瘤芽密度最大切片的一致率,并计算肿瘤浸润最深切片与瘤芽密度最大切片为同一切片的概率。③瘤芽计数:选取50例份宫颈鳞癌组织中瘤芽密度最大切片,分别由两名病理医师在20 × 物镜(0.785 mm2,20 mm)下进行瘤芽计数。选择瘤芽密度最大的视野计数单视野最高瘤芽数,采用组内相关系数(ICC)评估两名病理医师计数结果的一致性。以瘤芽密度最大的视野为中心,向左右两侧平移获取10 个不重叠视野,计数10 个视野的瘤芽总数,获取每视野平均瘤芽数,采用ICC 评估两名病理医师计数结果的一致性。筛选一致性高的计数方法。④截取瘤芽评估阈值:选择一致性高的瘤芽评估对象和计数方法对95例份宫颈鳞癌组织HE染色切片重新进行瘤芽评估,采用受试者工作特征(ROC)曲线分析瘤芽数对宫颈鳞癌脉管侵犯的预测效能,并获取瘤芽数的最佳截断值。根据最佳截断值划分高瘤芽组、低瘤芽组,比较两组脉管侵犯的发生率,并分析脉管侵犯与瘤芽数的关系。
1.2.2 CK、p63、p40免疫组化染色 取宫颈鳞癌组织蜡块,3~4 μm 厚连续切片。切片经65 ℃烤片1 h,常规脱蜡至水,3%过氧化氢孵育8 min 以消除内源性过氧化物酶活性,微波炉100 ℃热抗原修复20 min;封闭液中室温封闭5 min 后,分别加入鼠抗人CK、p63 和兔抗人p40 一抗,室温孵育20~35 min;然后加入相应的二抗,室温孵育8 min;最后DAB 显色,苏木素复染,常规脱水、透明,中性树胶封固,显微镜下观察。
CK 阳性染色定位于细胞质和细胞膜,p63、p40阳性染色定位于细胞核,均呈棕黄色颗粒状。
1.3 统计学方法 采用SPSS23.0 统计软件。计数资料比较采用χ2检验。一致性检验采用ICC,ICC<0.4 表示一致性差,ICC>0.75 表示一致性良好。相关性分析采用Spearman 相关分析法。预测效能分析采用受试者工作特征(ROC)曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 瘤芽评估结果 在肿瘤浸润最深切片的筛选中,两名病理医师筛选结果一致41 例、不一致9 例,一致率为82%;在瘤芽密度最大切片的筛选中,两名病理医师筛选结果一致36 例、不一致14 例,一致率为72%。两名病理医师筛选肿瘤浸润最深切片的一致率虽然高于筛选瘤芽密度最大切片的一致率,但二者比较差异无统计学意义(P>0.05)。两名病理医师筛选肿瘤浸润最深切片和瘤芽密度最大切片为同一切片的概率分别为28%(14/50)、36%(18/50)。
两名病理医师计数瘤芽密度最大切片单视野最高瘤芽数的ICC 为0.769,计数10 个视野平均瘤芽数的ICC为0.346。
瘤芽密度最大切片单视野最高瘤芽数预测宫颈鳞癌脉管侵犯的ROC 曲线下面积为0.736(95%CI:0.636~0.836),其最佳截断值为2.5 个,此时其预测宫颈鳞癌脉管侵犯的灵敏度为62.8%、特异度为73.1%。根据瘤芽密度最大切片单视野最高瘤芽数将95 例宫颈鳞癌患者分为高瘤芽组(单视野最高瘤芽数≥3个,最佳截断值为2.5个,实际工作中取最小整数)44 例、低瘤芽组(单视野最高瘤芽数<3 个)51例。高瘤芽组脉管侵犯的发生率为68.2%(30/44),低瘤芽组为25.5%(13/51),高瘤芽组脉管侵犯的发生 率 显 著 高 于 低 瘤 芽 组(χ2=23.22,P<0.05)。Spearman 相关分析显示,宫颈鳞癌患者脉管侵犯与瘤芽数呈正相关关系(r=0.466,P<0.01)。
2.2 CK、p63、p40免疫组化染色结果 瘤芽与无核细胞微滴CK 染色均呈阳性(见图1),而部分肿瘤细胞p63、p40表达缺失(见图2、3)。
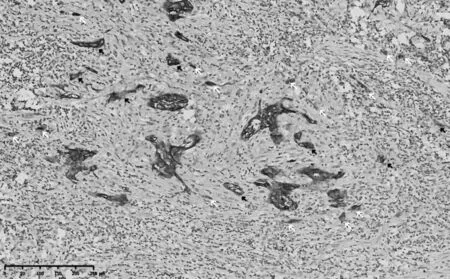
图1 宫颈鳞癌组织CK染色结果(免疫组化染色,10×)
3 讨论

图2 宫颈鳞癌组织p63染色结果(免疫组化染色,10×)
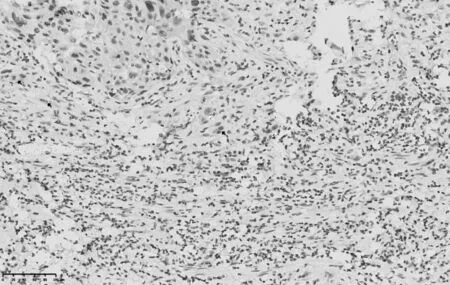
图3 宫颈鳞癌组织p40染色结果(免疫组化染色,20×)
宫颈鳞癌是女性第二大常见恶性肿瘤,虽然近年来宫颈鳞癌的诊治取得了长足进步,但由于其易转移和复发,临床结局仍不尽如人意[4]。黄邦杏[5]研究报道,高瘤芽是宫颈癌盆腔淋巴结转移的独立危险因素,也是早期宫颈癌患者术后复发和死亡的独立危险因素。任燕[6]研究表明,瘤芽不仅与宫颈癌淋巴结转移、组织分化程度低密切相关,还与血管和淋巴结侵犯有关。因此,瘤芽可能是宫颈癌预后的独立影响因素[7]。但目前国际上对宫颈癌瘤芽评估尚无统一的标准。
在不同的研究中,学者们对瘤芽评估对象的选择不同[8-10]。TANAKA 等[9]选择肿瘤浸润最深切片进行评估,而HORCIC 等[10]则选择瘤芽密度最大切片进行评估。由于不同病理医师对肿瘤浸润最深切片或瘤芽密度最大切片的选择存在主观性,导致其选择一致性可能存在偏差,从而对评估方法的可重复性产生影响。为此,本研究首先比较了不同病理医师选择肿瘤浸润最深切片和瘤芽密度最大切片的一致性。结果表明,与筛选瘤芽密度最大切片的一致性比较,不同病理医师选择肿瘤浸润最深切片的一致性较高,但二者比较差异无统计学意义,故认为以肿瘤浸润最深切片为评估对象并不能提高其一致性。瘤芽具有不沿侵袭性边界均匀分布的特征,故对同一病例不同切片进行瘤芽计数,结果可能大不相同。本研究结果显示,不同病理医师筛选肿瘤浸润最深切片与瘤芽密度最大切片为同一切片的概率较低,表明对肿瘤浸润最深切片进行瘤芽计数并不能很好地反映瘤芽密度。瘤芽密度是恶性肿瘤预后的独立危险因素。因此,以瘤芽密度最大切片作为瘤芽评估对象具有更高的临床价值。
对于评估是基于单视野最高瘤芽数还是多视野平均瘤芽数,不同学者持不同意见[11-15]。HUANG等[14]以单视野最高瘤芽数作为评估对象,并把最高瘤芽数≥5 个作为高瘤芽标准;OLSEN 等[15]以10 个视野的平均瘤芽数作为评估对象,并把平均瘤芽数≥1 个作为高瘤芽标准。评估对象不同,高瘤芽的阈值亦有所不同。本研究中,两名病理医师评估单视野最高瘤芽数的一致性高于评估10 个视野的平均瘤芽数。这可能与评估10 个视野瘤芽数比评估单视野瘤芽数受视野选择和移动的影响更大有关。此外,在局灶性高瘤芽的病例中,计数多个视野平均瘤芽数可能会“稀释”最终的瘤芽数。因此,计数单视野最高瘤芽数比多个视野的平均瘤芽数能够更好地反映浸润前沿的瘤芽[16-17]。以计数瘤芽密度最大切片单视野最高瘤芽数为评估对象,观察者之间的主观差异较小,可重复性高、可操作性强。本研究结果发现,在瘤芽密度最大切片中单视野最高瘤芽数对宫颈鳞癌脉管侵犯具有较高的预测效能,高瘤芽组脉管侵犯的发生率显著高于低瘤芽组;Spearman 相关分析显示,宫颈鳞癌患者脉管侵犯与瘤芽数呈正相关关系。进一步证实瘤芽密度最大切片单视野最高瘤芽数的临床价值更高。
SHINTO 等[18]研究发现,CK 免疫组化染色除了能标记廇芽外,还能标记无核细胞微滴。本研究发现,瘤芽与无核细胞微滴CK染色均呈阳性,提示CK阳性染色能够增加瘤芽计数。此外,凋亡小体亦可能因CK 阳性染色被认为是瘤芽而被纳入计数[4],从而导致瘤芽数被高估。而p63、p40 在肿瘤细胞中存在表达缺失情况,故采用p63、p40 免疫组化染色切片进行瘤芽计数可能导致瘤芽数被低估。因此,应采用HE 染色切片进行宫颈鳞癌瘤芽评估,而且HE染色在临床上更易推广。
综上所述,通过HE 染色评估瘤芽密度最大切片单视野最高瘤芽数是简单易行、重复性较高的宫颈鳞癌瘤芽评估方法;瘤芽数≥3 个定义为高瘤芽,其对宫颈鳞癌脉管侵犯具有较高的预测效能,高瘤芽预示其脉管侵犯的发生风险较高。

