miR-205-5p靶向HMGB1/TLR4途径对变应性鼻炎免疫功能的作用研究
匡玉婷,胡彬雅,赵斯君,黄敏,吴雄辉,龙松良,张梦萍,郑立春
(湖南省儿童医院 耳鼻咽喉头颈外科,湖南 长沙 410007)
变应性鼻炎(allergic rhinitis,AR)以鼻塞、流涕、打喷嚏等为常见表现,是由免疫球蛋白E(immunoglobulinE,IgE)所介导的超敏反应性疾病,目前世界范围内AR发生率大约占40%,且呈逐年升高的趋势[1-2]。尽管AR临床表现症状较弱,对机体带来的损伤较小,但其所带来的负担和成本较大,给社会经济和健康带来巨大影响,且目前所使用药物无法治愈此病,因此寻找有效治疗此病的新靶点具有重要的意义[3]。随着对AR的深入研究发现,miRNA参与AR的发生,研究认为[4]miR-205-5p与鼻炎的发生密切相关,认为其参与鼻炎发生过程中免疫炎症反应,但就目前而言,微小RNA-205-5p(microrna-205-5p,miR-205-5p)作为miRNA 家族中的一种,被发现在多种肿瘤患者血清中均呈高表达,且与肿瘤恶性程度具有一定的相关性,但在AR中的表达研究尚未发现,基于此,在上述形式下,本次研究分析miR-205-5p是否经靶向高迁移率族蛋白B1/Toll样受体4(high mobility group box protein B1/Toll-like receptor 4,HMGB1/TLR4)途径改善AR免疫功能,以明确miR-205-5p在AR中的具体作用,为临床上此病的治疗提供新靶点。
1 材料与方法
1.1 研究动物
选取6~8周龄无特定病原体(specific pathogen free,SPF)清洁级SD雄性大鼠60只,体质量90~120 g,均购自默沙东(宁波)动物保健科技有限公司,动物许可证号:SYXK(浙)2021—0022。所有大鼠均适应性饲养1周,在饲养过程中自由饮食、饮水。本次研究在我院伦理委员会的批准下完成。
主要试剂:miR-205-5p抑制剂(antagomir)、激动剂(agomir)由广州瑞博生物技术有限公司提供。ELISA试剂盒由上海烜雅生物科技有限公司提供。小鼠抗大鼠HMGB1、TLR4、核因子-κB(nuclear factor κB,NF-κB)抗体均由美国Abcam公司提供。LipofectamineTM2000转染试剂盒、荧光素酶报告试剂盒和检测仪均由美国Promega公司提供。
1.2 方法
1.2.1 分组及建模 将所购买的60只大鼠随机分为正常对照组(A组)、AR组(B组)、AR+miR-205-5p agomir组(C组)、AR+miR-205-5p antagomir组(D组)共4组,每组各15只。
A组不做任何处理,B、C、D组均采用卵清白蛋白鼻腔强化致敏建立AR模型[5],将0.3 mg卵清白蛋白溶解于1 mL生理盐水中,与30 mg佐剂AI(OH)3制备为混悬液,腹腔注射,隔日1次,连续注射8次。在第16天经鼻滴入每鼻孔滴注10%卵清白蛋白溶液 20 μL(溶于 1 mL生理盐水中),连续7 d。末次滴入后观察各组0.5 h内抓鼻、打喷嚏、流涕情况,做行为学评分(表1),若评分≥5分则表明AR建模成功,最终B、C、D组均成功建模。

表1 行为学评分
1.2.2 miR-205-5p干预 建模成功后C、D组分别尾部注射300 μg miR-205-5p agomir、miR-205-5p antagomir,A、B组注射等量生理盐水。每周2次,1周后观察各组大鼠变化。
1.3 指标观察
1.3.1 行为学评价 参照表1内容,对4组大鼠做行为学评价。
1.3.2 免疫相关指标测定 抽取各组0.5 mL尾静脉血,离心取上清血清(3 000 g/min,r=5 cm),采用ELISA法检测免疫相关指标:干扰素-γ(interferon-γ,IFN-γ)、白介素-2(interleukin-2,IL-2)、白介素-4(interleukin-4,IL-4)、白介素-10(interleukin-10,IL-10)及IgE水平。
1.3.3 鼻黏膜组织采集 在上述操作完成后立即处死大鼠,迅速取鼻黏膜组织,分为4份,其中2份用于病理组织学观察,1份用于蛋白检测,1份分离出鼻黏膜上皮细胞用于双荧光素酶报告分析。
1.3.4 鼻黏膜炎性反应观察 取鼻黏膜组织,在行常规组织切片处理后做HE染色处理,显微镜下对各组鼻黏膜组织炎性反应情况进行分析。
1.3.5 鼻黏膜上皮细胞间紧密连接、内质网形态观察 取鼻黏膜组织,在行常规组织切片处理后醋酸铀、枸橼酸铅双染色,使用透射电镜分别在20 000倍、15 000倍观察鼻黏膜上皮细胞间紧密连接、内质网形态。
HE染色于高倍镜(×400) 下计数5个视野EOS后取平均值。紧密连接蛋白的阳性表达以鼻黏膜及腺体-上皮的细胞膜和细胞质呈棕黄色、细颗粒状为判定标准。根据细胞膜和/或细胞质的染色程度及染色细胞百分率进行分析评分:基本不着色为0分;着色淡为1分;着色适中为2分;着色深为3分。另外,每张切片400倍视野下随机选择不重复的5个视野,每个视野计数100个上皮细胞,计算其中着色细胞的百分率。着色细胞占计数细胞百分率<5%为0分;5%~25%为1分;26%~50%为2分;>50%为3分。将每张切片细胞着色程度得分与着色细胞百分率得分各自相乘,总分0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),6分以上为强阳性(+++)。+为低表达即阴性表达,++与+++为高表达,即阳性表达。
1.3.6 紧密连接蛋白Claudin-1、Occludin、HMGB1/TLR4途径蛋白测定 取鼻黏膜组织,加80 μL裂解缓冲液,将鼻黏膜组织制备为组织匀浆,12 000×g 离心15 min,离心后采集上清液,做蛋白变性、电泳处理,采用Western blot法测定Claudin-1、Occludin、HMGB1/TLR4途径相关蛋白表达量。
1.3.7 双荧光素酶报告实验 经Starbase网站获得miR-205-5p、TLR4碱基结合位点,以分析miR-205-5p与TLR4的靶向关系,建立MUT-TLR4、WT-TLR4的TLR4 3’-UTR双荧光素酶报告载体。使用LipofectamineTM2000将miR-205-5p agomir、miR-205-5p antagomir、MUT-TLR4、WT-TLR4共转染至鼻黏膜上皮细胞,测定鼻黏膜上皮细胞荧光素酶活性,miR-205-5p与TLR4特异性结合时,荧光素酶活性降低。
1.4 统计学分析
2 结果
2.1 4组行为学评价
如表2所示,B组、C组、D组行为学评分高于A组(P<0.05);C组行为学评分高于B组(P<0.05);D组行为学评分低于B组(P<0.05);D组行为学评分低于C组(P<0.05)。

表2 4组行为学评分对比 (分,
2.2 4组免疫相关指标水平对比
如表3所示,B、C、D组IL-4、IgE高于A组,IFN-γ、IL-2、IL-10低于A组(P<0.05);C组IL-4、IgE高于B组,IFN-γ、IL-2、IL-10低于B组(P<0.05);D组IL-4、IgE低于B组,IFN-γ、IL-2、IL-10高于B组(P<0.05);D组IL-4、IgE低于C组,IFN-γ、IL-2、IL-10高于C组(P<0.05)。

表3 4组免疫相关指标水平对比
2.3 鼻黏膜炎性反应观察
A组鼻黏膜结构完整,纤毛未脱落,未发现炎细胞浸润;B组鼻黏膜纤毛排列较为杂乱,不规则脱落,有炎细胞浸润;C组存在较为严重的纤毛脱落的症状,大量炎细胞浸润;D组鼻黏膜纤毛排列恢复至整齐状态,仅有少量纤毛脱落、炎细胞浸润。见图1。

图1 鼻黏膜炎性反应观察 (HE ×400) a:A组未发现炎细胞浸润;b:B组有炎细胞浸润;c:C组大量炎细胞浸润;d:D组少量纤毛脱落、炎细胞浸润
2.4 鼻黏膜上皮细胞间紧密连接和内质网形态观察
如表4和图2、3所示,B、C、D组紧密连接宽度高于A组,紧密连接蛋白表达量低于A组(P<0.05);C组紧密连接宽度高于B组,紧密连接蛋白表达量低于B组(P<0.05);D组紧密连接宽度低于B组,紧密连接蛋白表达量高于B组(P<0.05);D组紧密连接宽度低于C组,紧密连接蛋白表达量高于C组(P<0.05)。4组鼻黏膜上皮细胞内质网形态观察见图4。

图2 Western blot检测紧密连接蛋白水平表达

图3 鼻黏膜上皮细胞间紧密连接 (醋酸铀+枸橼酸铅 ×20 000) a:A组鼻黏膜上皮细胞紧密连接呈连续的狭窄带;b:B组紧密连接松弛,细胞间隙增大;c:C组紧密连接较为松弛,细胞间隙明显增大;d:D组内质网扩张程度、核糖体脱落情况显著缓解

图4 鼻黏膜上皮细胞内质网形态 (醋酸铀+枸橼酸铅 ×15 000) a:A组鼻黏膜上皮细胞内质网形态规整;b:B组内质网扩张,核糖体脱落;c:C组内质网扩张、甚至空泡样,核糖体脱落明显;d:D组内质网扩张程度、核糖体脱落情况显著缓解

表4 鼻黏膜上皮细胞间紧密连接宽度、紧密连接蛋白表达对比
2.5 4组HMGB1/TLR4途径蛋白表达对比
如表5所示,B、C、D组HMGB1、TLR4、NF-κB表达量高于A组(P<0.05);C组HMGB1、TLR4、NF-κB表达量高于B组(P<0.05);D组HMGB1、TLR4、NF-κB表达量低于B组(P<0.05);D组HMGB1、TLR4、NF-κB表达量低于C组(P<0.05)。
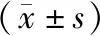
表5 4组HMGB1/TLR4途径蛋白表达对比
2.6 双荧光素酶报告实验结果
双荧光素酶报告实验结果显示,WT-TLR4组miR-205-5p agomir活性显著高于MUT-TLR4组,miR-205-5p antagomir显著低于MUT-TLR4组,差异具有统计学意义(P<0.05),如表6所示;miR-205-5p agomir组miR-205-5p和TLR4表达量均显著低于miR-205-5p antagomir组,差异具有统计学意义(P<0.05),如表7所示,提示miR-205-5p可与TLR4靶向结合,结合位点见图5。
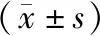
表6 各组细胞中荧光素酶活性对比
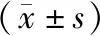
表7 各组细胞中miR-205-5p、TLR4表达对比

图5 miR-205-5p与TLR4靶向结合位点
3 讨论
miRNA属非编码RNA分子,由20~25个核苷酸组成,miR-205-5p属miRNA成员之一,定位于人1号染色体q32.2位置的LOC642587基因座中的第2个内含子,其长度大约为110个碱基[6]。有研究显示[7-9],miR-205-5p在人肺、乳腺、胸腺、前列腺等组织中特异性表达,能够通过调控多种靶基因表达,与癌细胞恶性生物学行为有关。但随着对miR-205-5p深入研究,发现其不仅参与恶性肿瘤的发生发展,还可促进AR发生过程中免疫炎症级联,在AR中表达升高,Zhang等[10]在其最新一项研究中认为下调miR-205-5p可通过靶向BCL-2减轻变应性鼻炎的炎症反应,其结果证实了miR-205-5p与AR的关系。本研究结果示,经抑制miR-205-5p表达后的AR大鼠,AR行为学明显改变,鼻黏膜炎性浸润减轻,此结果证实了miR-205-5参与AR的发生。
目前关于AR发病机制研究呈现多方面的深入细化,大体包括鼻黏膜上皮屏障破坏、Th1/Th2失衡等[11-12]。有研究认为[13],在AR发生过程中,变应原所引发的黏膜通透性明显降低,鼻黏膜上皮屏障功能受到抑制,表现为鼻黏膜上皮细胞紧密连接受损,破坏紧密连接蛋白Claudin-1、Occludin,其中Claudin-1作为紧密连接形成的首要骨架,兼具作为紧密连接密封件的核心作用,是Claudin家族中对屏障的结构和功能影响最大的跨膜蛋白,Claudin-1基因缺陷会导致屏障功能丧失。Occludin对于屏障形成也是必须,因其具有磷酸化/去磷酸化的特性,能够和紧密连接中蛋白质相互作用,影响屏障功能以及物质的跨上皮和跨内皮运输[14]。另外AR鼻黏膜上皮屏障功能障碍表现为内质网形态改变,且导致内质网扩张、大量空泡状,核糖体明显脱落,间接反应蛋白质合成的能力下降等[15]。本文结果显示,抑制miR-205-5p表达后AR大鼠紧密连接蛋白Claudin-1、Occludin表达升高,内质网扩张改变恢复,提示抑制miR-205-5p表达可经修复鼻黏膜上皮屏障损伤抑制AR进展。另外Th1/Th2失衡是导致AR发生进展的主要影响因素,Th1经分泌IFN-γ、IL-2参与机体细胞免疫,Th2经分泌IL-4、IL-10参与机体体液免疫,在AR发生进展过程中IFN-γ、IL-2、IL-4、IL-10等指标表达紊乱,此时IgE表达异常升高,最终诱导AR发生过程中的免疫炎症反应[16-18]。本文结果显示,抑制miR-205-5p表达可改善Th1/Th2失衡,修复鼻黏膜上皮屏障损伤,表现为IFN-γ、IL-2、IL-10升高、IL-4、IgE降低,鼻黏膜上皮细胞间紧密连接、内质网形态改变恢复,此结果提示miR-205-5p参与AR发生过程中Th1/Th2失衡,抑制miR-205-5p表达可逆转Th1/Th2失衡,抑制疾病进一步进展。
目前关于miR-205-5p发挥作用途径尚未明确,有研究显示[19-21],HMGB1/TLR4途径参与AR发生过程,在正常生理状态下HMGB1定位于细胞核,但当机体受到外界刺激后,其被大量释放于细胞外,可经刺激免疫系统分泌大量的免疫相关因子,进而导致免疫炎症级联反应发生,与AR严重程度相关。HMGB1在AR发病过程中与TLR4特异性结合,激活下游NF-κB,而NF-κB可扰乱Th1/Th2平衡[22-24]。本文结果显示,miR-205-5p表达被抑制后HMGB1、TLR4、NF-κB表达量降低,提示抑制miR-205-5p表达逆转Th1/Th2失衡的机制可能与HMGB1/TLR4活性降低有关,此结果在Zhang等研究的基础上进一步验证了miR-205-5p参与AR发生的具体途径。且经双荧光素酶报告实验分析显示,TLR4为miR-205-5p靶基因,进一步证实了miR-205-5p经HMGB1/TLR4途径而发挥修复AR免疫损伤的作用。
本研究初步分析了miR-205-5p可靶向HMGB1/TLR4途径抑制Th1/Th2失衡所引起的AR免疫障碍,但检索国内外相关文献,并未有研究发现上述关系,因此,此论点尚需进一步验证。
综上,miR-205-5p可靶向HMGB1/TLR4途径抑制Th1/Th2失衡所引起的AR免疫障碍,加强鼻黏膜屏障功能,从而减少变应原的入侵,缓解AR相关症状,对AR的治疗产生积极作用。

