添加碳源对不同pH水稻土中反硝化关键功能基因的影响
李健 曲植 张立鑫 李铭江 陆江岳
1 西安理工大学 省部共建西北旱区生态水利国家重点实验室,西安,710048 2 中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京,100085
0 引言
水稻是我国第一大粮食作物,其产量约占全国粮食产量的1/3,截止2022年,我国栽培面积达到2 900万hm2[1].为提高作物产量,自20世纪70年代以来,我国农业生产中的氮肥施用量迅速增加.根据FAO的统计资料,平均每年增加约7.8×105t.2008年耕地面积仅占世界7%的中国,消耗了3.3×107t氮肥,占全球当年氮肥消耗量9.2×107t的36%,有预测表明,我国的氮肥施用量还可能继续增加[2-3].目前,中国稻田的氮素平均利用率仅在30%~40%之间,而造成稻田氮素利用率低下的一个主要原因是稻田中发生反硝化作用导致氮素以气态形式流失[4-6].
反硝化作用作为土壤中参与氮循环的重要一环,是农业上N2O排放的主要来源.反硝化作用是指反硝化微生物在厌氧条件下,将硝酸盐、亚硝酸盐逐步还原,最终将氮以一氧化氮(NO)、氧化亚氮(N2O)或分子态氮(N2)的形式释放的过程[7-8],它提高了农田生态系统中氮素流失的风险,并导致了严重的经济损失.
反硝化过程是由微生物驱动的酶促反应过程,其反映速率和产物组成显著受到多种环境因素直接或间接的影响,如温度、pH、Eh、水分、含氧量、碳源类型、氮源类型、碳氮比、土壤质地、耕作方式及土地利用类型等.近年来,国内外众多学者围绕环境因子对反硝化作用的影响开展了一系列深入的研究.Tang等[9]通过向亚热带和温带森林土壤中添加N、P,发现pH值是反硝化微生物活性的主要控制因子;Tao等[10]通过有无施用有机肥对农田土壤反硝化微生物群落结构及N2O排放的试验中发现施加有机肥可显著提高土壤反硝化酶活性,增加反硝化过程相关功能基因的数量,并减少N2O排放量;王丽丽等[11]研究发现,生物反硝化系统中最好的电子供体是易于生物降解的有机物,其不仅可提高反硝化速率,还能够提升生物处理装置的能力和效率;王海涛等[12]、郑兰香等[13]发现土壤中C/N比越高,反硝化速率越强.Shan等[14]、Ryden等[15]、Bhandral等[16]研究也表明有机碳含量越高,其反硝化潜势也越大.这是由于反硝化作用是微生物在厌氧条件下进行的硝酸盐、亚硝酸盐的异养还原过程,需要碳源作为电子供体参与反应[17].淹水条件下微生物利用碳源厌氧发酵过程中产生的有机酸[18-19]、氢离子[20]、CO2等物质会降低土壤pH[21],而土壤pH是影响反硝化作用最主要也是最复杂的因素之一,可直接影响参加反硝化作用的反硝化的微生物群落结构和氮氧化物还原酶的活性[22-24].因此碳源是影响反硝化作用的关键因素之一,但是目前关于外加碳源的研究多见于对工农业污水脱氮处理,其对农业土壤尤其是稻田土壤中反硝化作用的影响机理研究较少,碳源添加对反硝化过程的影响机制研究鲜有报道.
本研究通过室内水稻土泥浆厌氧培养试验,在不同本底pH水稻土中添加碳源培养,监测培养过程中土壤pH和无机氮浓度的变化,并基于DNA和RNA水平分别分析反硝化微生物编码亚硝酸盐还原酶的nirK/S和编码氧化亚氮还原酶的nosZ等功能基因丰度变化,旨在探究添加碳源对不同本底pH水稻土反硝化过程的调控机理,为提高氮素利用效率、温室气体减排提供理论支撑.
1 材料方法
1.1 样品采集
供试水稻土分别采自天津市宝坻区王卜庄镇后张司马村(117.55°E,39.65°N)和广东省广州市萝岗区九龙镇洋田村(106.71°E,26.49°N).前者为多年种植单季稻土壤,以字母BD表示;后者为多年种植双季稻土壤,以字母GZ表示.在水稻落干期,采集稻田耕层0~20 cm的土壤,拣去植物残体,自然风干,磨细,过1 mm筛,避光保存,备用.供试土壤的理化性质如表1所示.
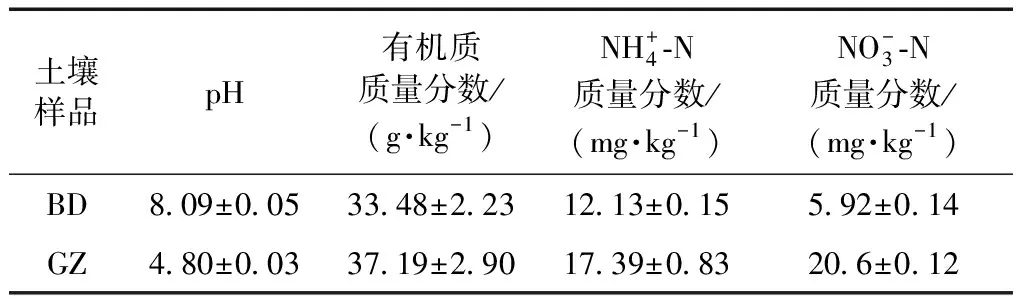
表1 供试水稻土的理化性状
1.2 培养试验
1.2.1 风干土预培养
分别取BD、GZ风干水稻土各1 kg,调节其质量含水率至15%,于20 ℃恒温培养箱中好氧培养7 d以恢复土壤微生物活性.
1.2.2 泥浆厌氧培养试验
试验设置:本试验选取两个因子,即土壤样品本底pH和外源添加有机碳(葡萄糖)浓度,其中土壤样品为酸性的GZ土壤和碱性的BD土壤;葡萄糖浓度设置3个水平,分别为0、25和100 mmol·L-1,依次标记为CK、L和H(表2).
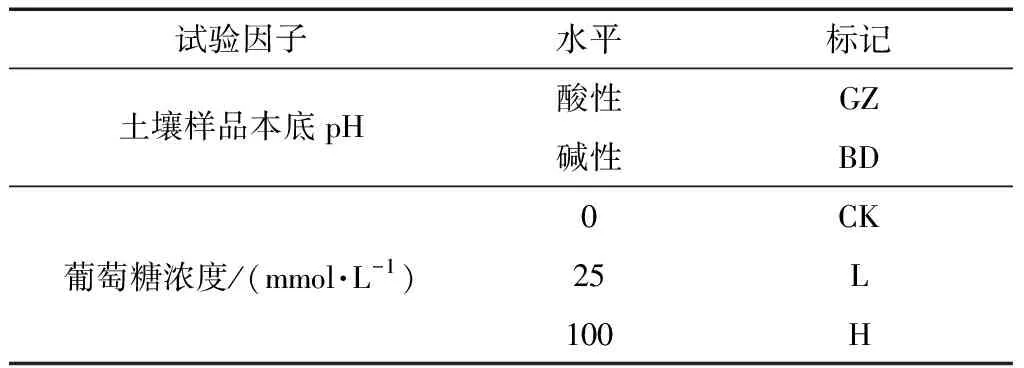
表2 试验设置
淹水处理:取预培养土样3 g置于10 mL玻璃培养瓶中,加入1.5 mL KNO3溶液作为氮源,再根据处理添加1.5 mL相应浓度的葡萄糖溶液作为碳源,最终制成水土比为1∶1的泥浆.
厌氧培养:淹水处理后,培养瓶加橡胶塞封口,以60 mL·min-1的流速充入高纯氮气使瓶中N2交换循环至少20次,以去除瓶中的O2使其达到厌氧环境,后加铝盖密封,置于20 ℃恒温培养箱避光培养.
1.2.3 样品采集与保存
分别于培养开始后的第0、0.5、1、2、3、4、5、6、7、9和11天采集土壤样品,直接用于土壤pH的测定;分别于培养开始后的第0小时、3小时、6小时、0.5天、1天、2天、3天、4天、5天、6天、7天、9天、11天,采集土壤样品置于2 mL冻存管中,液氮冷冻后,-80 ℃保存,供提取土壤DNA和RNA使用;同时采集样品置于-20 ℃冰箱保存,以供土壤无机氮的测定.采集样品时先将培养瓶置于冰上预冷10 min.
1.3 土壤pH测定
取泥浆样品摇匀后,采用pH计(MT-5000)依次对不同处理样品进行测定.
1.4 土壤无机氮素含量测定
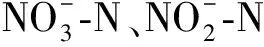
1.5 土壤总DNA的提取
取0.5 g-80 ℃冷冻保存的样品,使用DNA提取试剂盒(E.Z.N.A.® Soil DNA Kit,Omega Bio-tek)按照试剂盒说明书步骤提取土壤总DNA,提取的DNA样品分装后保存在-80 ℃(长期)低温冰箱中.
1.6 土壤总RNA的提取和反转录
取0.5 g-80 ℃冷冻保存的样品,使用RNA提取试剂盒(E.Z.N.A.® Soil RNA Kit,Omega Bio-tek)按照试剂盒说明书步骤提取土壤总RNA,提取的RNA样品在确保没有gDNA后,使用RNA-cDNA反转录试剂盒(PrimeScript II 1st Strand cDNA Synthesis Kit,TaKaRa)将RNA反转录为cDNA,分装后保存在-80 ℃(长期)低温冰箱中.
1.7 实时定量PCR扩增
使用1.5小节和1.6小节中提取的DNA和cDNA为模板分别选取反硝化微生物亚硝酸盐还原酶(nirK/S)基因和氧化亚氮还原酶(nosZ)基因的对应引物对(表3)进行实时荧光定量PCR扩增,与已知浓度的含有各基因的标准质粒扩增结果比对,得到各样品中对应基因表达量.

表3 使用的PCR扩增引物
1.8 数据分析
数据方差分析和相关性分析用SPSS 20.0软件完成,采用单因素方差分析法区分样品间的显著性差异(One Way ANOVE,LSD检验);使用Origin 2021软件绘图.
2 结果与分析
2.1 葡萄糖添加对水稻土pH的影响
BD(宝坻水稻土)在未添加葡萄糖的情况下,其pH几乎没有发生变化;而在添加葡萄糖后的2 d内土壤pH值显著下降,后趋于稳定,并呈现外源添加葡萄糖浓度越高,pH降低幅度越大的特点.在低葡萄糖处理条件下,土壤pH值在2 d内由7.78下降至6.24;而在高葡萄糖处理条件下,土壤pH值在2 d内由7.77下降至6.08,之后仍存在缓慢降低,3 d后基本稳定(图1a).GZ(广州水稻土)在未添加葡萄糖的情况下,其pH值随培养时间延长而缓慢上升,在整个培养期间由初始的4.51上升至6.42,增幅达1.91个单位.其中低葡萄糖添加处理,pH随培养时间呈现先升高后降低再升高的缓慢变化趋势,培养结束时pH上升1个单位;而高葡萄糖添加处理,pH随培养时间呈现先上升后下降的变化趋势,其中培养5 d后pH最高为5.23,培养结束时pH上升0.22个单位,说明添加外源葡萄糖可减小土壤pH上升幅度,尤其是在高浓度葡萄糖处理条件下更为显著(图1b).
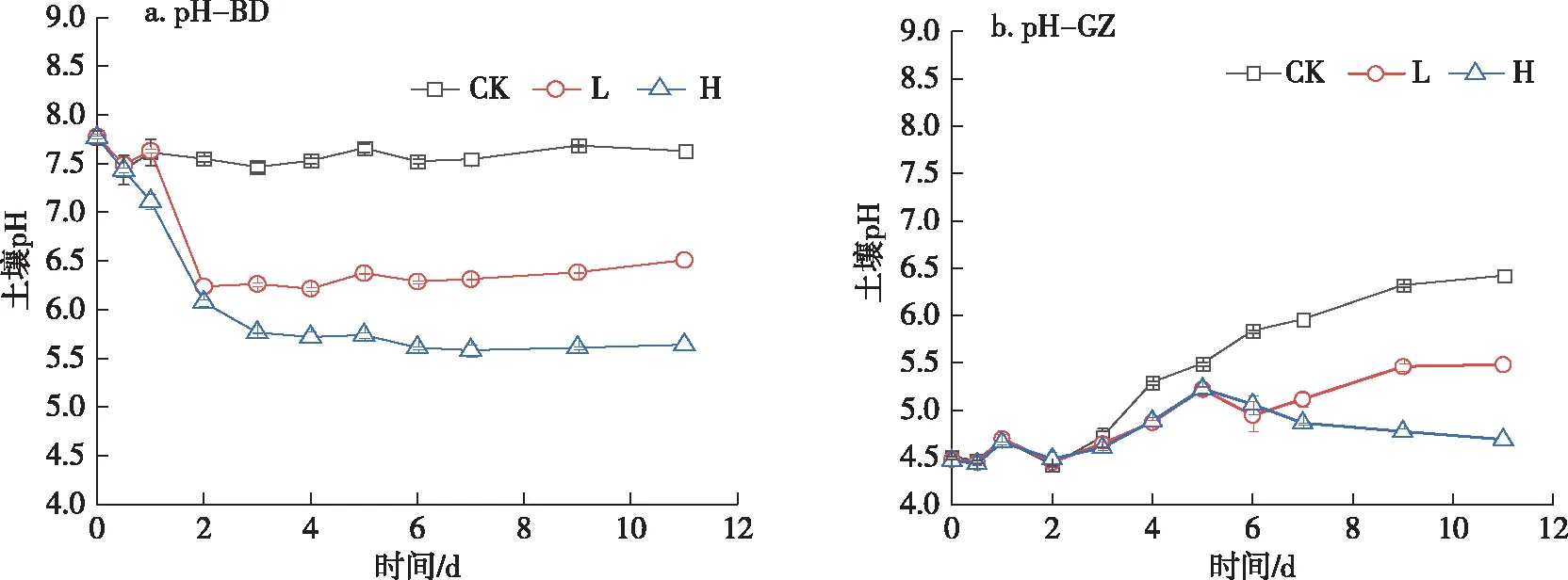
图1 土壤pH变化
2.2 葡萄糖添加对水稻土无机氮含量的影响

图2 无机氮浓度变化

2.3 葡萄糖添加对土壤中反硝化功能基因数量的影响
BD水稻土在未添加葡萄糖的培养过程中nirK基因拷贝数几乎没有变化,而添加葡萄糖处理使得nirK基因拷贝数发生显著变化,其中在低葡萄糖处理下,nirK基因拷贝数整体上随时间呈现出先增后减的趋势,分别于培养3 d和7 d时达到峰值,最大值为6.46×107copies/g(soil);而在高葡萄糖处理下,nirK基因拷贝数变化幅度更大,分别于第4 d和6 d时达到峰值,其最大值为1.17×108copies/g(soil);之后nirK基因拷贝数均下降至初始水平(图3a).GZ水稻土在不同浓度葡萄糖添加下整体上均呈现下降趋势,其中无葡萄糖添加处理的降幅最大,为53.82%,低葡萄糖添加处理和高葡萄糖添加处理分别下降23.54%、41.89%(图3b).
BD水稻土在未添加葡萄糖的培养过程中nirS基因拷贝数在第6 d达到最低值,于第9 d达到峰值,整体上呈现缓慢上升的趋势.在葡萄糖添加下,nirS基因拷贝数变化显著,其中低葡萄糖添加使得nirS基因拷贝数于第3~7天均处于较高水平,7天时存在最大值为1.77×109copies/g(soil),随后nirS基因拷贝数迅速下降,9 d后达到最低,为2.08×108copies/g(soil);而高葡萄糖添加使得在第5 d后存在明显峰值,为1.59×109copies/g(soil),其余阶段nirS基因拷贝数均与培养初期水平相当(图3c).GZ水稻土在高葡萄糖添加下nirS基因拷贝数整体水平较其他两个处理稍高,其余各处理nirS基因拷贝数在整体上均呈现下降趋势,其中无葡萄糖添加处理的降幅最大,为50.36%,低葡萄糖添加处理和高葡萄糖添加处理分别下降42.86%、38.93%(图3d).
BD水稻土在未添加葡萄糖时,nosZ基因呈现出先增加随后缓慢下降趋于稳定的规律,其中于第2天达到峰值1.04×109copies/g(soil);在低葡萄糖处理下,nosZ基因拷贝数变化显著,于第4~7 d均维持在较高水平,最大值为1.58×109copies/g(soil),之后迅速降低,第9天达到最低,为2.59×108copies/g(soil);在高葡萄糖处理下,nosZ基因变化相对平缓,于第5天存在较小峰值,为9.59×108copies/g(soil)(图3e).GZ水稻土在未添加葡萄糖的培养过程中nosZ基因拷贝数整体水平较其他两个处理稍高,呈现先减后增的趋势.葡萄糖添加使得nosZ基因拷贝数整体上均呈现下降趋势,低葡萄糖添加处理和高葡萄糖添加处理分别下降68.46%、66.47%(图3f).
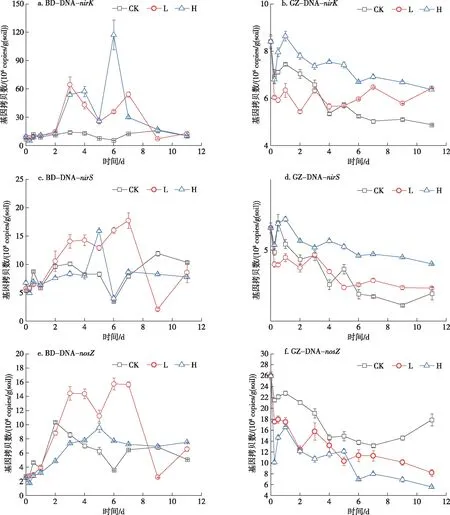
图3 功能基因拷贝数变化
2.4 葡萄糖添加对各功能基因转录本数量的影响
BD水稻土在不同浓度葡萄糖添加下,nirK基因转录本数量均出现明显变动,并且均于培养第6天出现峰值,但低葡萄糖处理的峰值明显要高.此外在整个培养过程中,低葡萄糖处理nirK基因转录本数量变动也更为明显,于培养第3天后较先出现最高峰,其nirK基因转录本的最大值为2.95×105copies/g(soil),显著高于未添加葡萄糖处理的4.12×104copies/g(soil)和高葡萄糖添加处理的5.93×104copies/g(soil)(图4a).GZ水稻土在无葡萄糖和低葡萄糖添加下,nirK基因转录本数量变动不大,且整体水平高于高葡萄糖添加处理.在高葡萄糖添加下,nirK基因转录本数量随培养时间在缓慢下降,至培养结束nirK基因转录本数量减少1.10×104copies/g(soil),同比降低71.21%(图4b).
BD水稻土在未添加葡萄糖和低葡萄糖添加下,nirS基因转录本数量明显高于高葡萄添加处理,并且均于培养第3天出现峰值,但低葡萄糖处理的峰值更高,而高葡萄糖添加下nirS基因转录本数量没有明显变化.此外低葡萄糖处理中nirS基因转录本数量于培养5天后出现第2个峰值,其nirS基因转录本的最大值为4.10×107copies/g(soil),显著高于无葡萄糖处理的2.51×107copies/g(soil)和高葡萄糖处理的8.32×106copies/g(soil)(图4c).在GZ水稻土培养过程中,各个处理nirS基因转录本数量于培养前2 d内均出现不同程度的降低,其中高葡萄糖添加处理下降98.08%,显著高于其余两个处理.至培养结束时,葡萄糖的添加未使得nirS基因转录本数量发生明显改变,而在未添加葡萄糖时,nirS基因转录本数量于培养第9天开始出现明显上升的现象(图4d).

图4 基因转录本数量变化
BD水稻土在低葡萄糖添加下,nosZ基因转录本数量整体要高于其余两个处理,而未添加葡萄糖时,nosZ基因转录本数无明显变化;而添加葡萄糖处理中nosZ基因转录本数均于1 d后出现峰值,且低葡萄糖添加处理的峰值为4.36×107copies/g(soil)明显高于高葡萄糖添加处理的2.04×107copies/g(soil)(图4e).对于GZ水稻土而言,培养前期各个处理中nosZ基因转录本数量均无明显变化.在未添加葡萄糖处理中,nosZ基因转录本数量于培养6 d后迅速上升,至培养结束时增长1.74倍;在低葡萄糖添加处理中,nosZ基因转录本数量于培养6 d后出现较小峰值;在高葡萄糖处理中,nosZ基因转录本数量整体变化不明显(图4f).
3 讨论

图5 nirS/nirK比值变化
nosZ基因编码的氧化亚氮还原酶(N2OR)是目前已知的唯一能将N2O还原为N2的生物酶,当nosZ基因数量和表达量受到不利条件的抑制时,就会导致温室气体N2O的大量累积.在本试验中,酸性土壤(GZ)经过碳源添加处理后,nosZ基因数量和表达量收到了抑制作用,且碳源浓度越高,抑制作用越强;碱性土壤(BD)经低葡萄糖处理后促进了nosZ基因数量和表达量,但是高葡萄糖处理下却抑制了nosZ基因的表达,这主要是由于在酸性土壤中,由于本身pH很低,加入葡萄糖后使得土壤pH再次下降,从而出现nosZ基因的表达受抑制.这与朱永官等[27]、潘亚男等[32]、Qu等[33]研究结果一致,即从基因角度来说,相应编码基因的表达更易受到土壤pH的影响,低pH会影响到生物体产生功能性N2O还原酶的能力,当土壤pH<7时反硝化酶nosZ活性逐渐减小;在碱性土壤中,低浓度葡萄糖作为碳源进入土壤中,激发了反硝化微生物的功能活性;而高浓度葡萄糖进入土壤所带来的土壤酸化反而抑制了反硝化微生物的活性,这与封克等[28]的研究结果一致,即碱性旱地土壤在有碳源加入的情况下,最有利于N2O还原为N2的土壤pH为6.92,当添加高浓度葡萄糖时,土壤将低于这个最适pH,所以反而抑制了nosZ基因的表达.
4 结论
本研究揭示了反硝化微生物对碳源添加的敏感性,葡萄糖添加可以从提供碳源和降低土壤pH两个方面,直接或间接的影响水稻土反硝化过程:1)高pH土壤上添加碳源增强了反硝化作用;低pH土壤上添加碳源对反硝化过程的促进作用不明显.2)不同本底pH的土壤中nirK和nirS基因数量和表达量对加入碳源引起的pH变化的响应具有显著差异,其中nirK基因数量和表达量对于外界环境变化的响应程度相对更高.3)在低pH土壤上,碳源添加对nosZ基因数量和表达量存在抑制作用,且碳源浓度越高抑制作用越强;在高pH土壤上,低葡萄糖处理下,碳源的刺激作用占主导地位;高葡萄糖处理下,碳源引起的pH变化的抑制作用占主导.本研究有助于理解稻田外源有机物输入对土壤反硝化过程的影响机制,为稻田氧化亚氮减排措施的实施与评估提供理论依据.

