多孔聚乳酸/醋酸纤维素电纺支架的制备与生物相容性研究
夏宏燕,陈雪六,谢 康
(1.广东工业大学 机电工程学院,广州 510006;2.广东工业大学 省部共建精密电子制造技术与装备国家重点实验室,广州 510006)
在人们的日常工作或生活中,突发的疾病或意外可能会导致人体器官衰竭或部分组织功能缺损,这通常会降低人们的生活质量甚至严重影响人们的生命健康[1-2]。组织工程的快速发展为组织器官功能修复提供了新的思路[3]。组织工程支架作为组织工程的重要基础之一,不仅从结构和成分上模拟目标组织的细胞外基质的功能和特点,为种子细胞的移植黏附提供一个临时基质,并将细胞顺利地运送到人体内部特定的部位,还能引导组织再生,控制组织的结构、形貌、尺寸及释放活性因子来调控细胞的表达[4-5]。
静电纺丝技术制备的纤维膜不仅具有较大的比表面积[6],适合细胞伸展,而且还具有多孔结构和高孔隙率,方便细胞迁移、长入及物质的输送和交换[7]。除此以外,静电纺丝纤维膜还具有可调的表面性质和可控的物理结构,可以模拟不同结构的细胞外基质[8-9]。特别是三维多孔材料有利于营养物质在其中运输传递,因此,本研究通过制备多孔PLA/CA纤维膜,探究多孔结构对于组织工程支架的影响。
1 实验
1.1 试剂与仪器
聚乳酸(PLA,Mw=1.0×105),山东医疗器械有限公司;醋酸纤维素(CA,Mn=3×104),玛雅试剂;二氯甲烷(DCM,分析纯),光华科技;N,N-二甲基甲酰胺(DMF,分析纯),天津市致远;丙酮(分析纯),广州化学试剂厂;N,N-二甲基乙酰胺(DMAC,分析纯),聚-D-赖氨酸(PDL),上海麦克林;胎牛血清、马血清、DMEM培养液、HBSS缓冲液、胰蛋白酶,美国Gibco;二甲基亚砜(DMSO,分析纯),西格玛;MTT,北京索莱宝科技有限公司;静电纺丝机(QZNT-E01),佛山轻子精密测控技术有限公司;聚焦离子束场发射扫描电子显微镜(LYRA 3 XMU),捷克Tescan;X射线光电子能谱(Escalab 250Xi),英国Thermo Fisher;酶标仪(Thermo 3001),美国Thermo。
1.2 PLA/CA纤维膜的制备
称量0.5 g PLA与0.5 g CA加入7 g DCM与3 g DMF的混合溶液,搅拌2 h后得到无孔PLA/CA纤维纺丝液。称量0.5 g PLA与0.5 g CA加入8 mL DCM与2 mL丙酮的混合溶液,搅拌2 h后得到多孔PLA/CA纤维纺丝液。采用10 mL注射器吸取纺丝液,设置针头与接收器的距离为15 cm,工作电压25 kV,溶液推出速度为4 mL/h,滚筒转速为300 r/min。常温常湿条件下开始纺丝,将制好的纤维膜放入50℃真空干燥机干燥12 h,然后常温备用。
1.3 纤维膜的改性
向HBSS缓冲液中加入PDL溶液,配制出质量浓度为40μg/mL的改性PDL溶液,放在水浴锅中备用。将制备的2种PLA/CA纤维膜放置在紫外光照射1 h,然后将2种PLA/CA纤维膜完全浸泡在改性苯丙氨酸解氨酶(PAL)溶液中,室温条件下放置在摇床上以200 r/min的频率摇匀2 h。纤维支架改性完成后取出得到PLA/CA+PDL纤维膜,用HBSS缓冲液将其冲洗3次,以此除去改性支架中为附着的PDL分子。清洗后再次使用紫外灯对纤维支架照射1 h,然后待用。
1.4 纤维膜的表征
1.4.1 SEM
无孔PLA/CA与多孔PLA/CA纤维膜经过离子溅射镀膜仪喷金后,使用聚焦离子束场发射扫描电子显微镜对纤维膜的形貌以及表面结构进行观察。
1.4.2 XPS
使用X射线光电子能谱对多孔PLA/CA纤维膜和多孔PLA/CA+PDL纤维膜进行扫描,分析纤维膜表面元素。
1.4.3 细胞毒性检测
将备用的无孔PLA/CA纤维膜与多孔PLA/CA纤维膜消毒后放置于96孔板,然后把含量为5×106/9.6cm2的PC12细胞分别接种在装有纤维膜的96孔板中,并设置空白对照组。将96孔板置入培养箱内,经过48 h培养后换上新的培养基并加入MTT溶液,继续培养4 h。然后弃去上清液,加入DMSO溶解20 min,将各孔液体转移到新的培养板,使用酶标仪在570 nm波长处测定各孔OD值。
1.5 纤维膜的细胞增殖能力测定
将含量为5×106/9.6 cm2的PC12细胞分别接种在内置无孔PLA/CA、多孔PLA/CA及其改性后的纤维膜,培养48 h后加入MTT溶液,然后加入DMSO溶解紫色晶体,在570 nm处测定各孔OD值。
2 结果与分析
2.1 形貌观察
扫描电镜检测结果如图1所示,从SEM电镜图中可以看到,以DCM/DMF体系的纺丝溶液所制备的静电纺丝纤维呈现为一种光滑、平整且无孔状结构。而采用DCM/丙酮为溶剂时所制备的PLA/CA静电纺丝纤维则为均匀多孔结构。这是因为采用DCM/DMF为溶剂时,混合聚合物中CA中的低乙酰基取代部分不能被混合溶液完全溶解,所以最终得到是无孔的PLA/CA纤维。丙酮作为CA的良好溶剂,在DCM溶液中加入一定比例的丙酮溶液能够将PLA/CA二者的混合物完全溶解。DCM溶液的沸点为40℃,并且丙酮溶液的沸点为56℃左右,两者的沸点都相对较低,但是DMF溶液的沸点却是152℃左右。根据热致相分离原理,静电纺丝的过程中,由于DCM/DMF溶剂体系沸点较高,带电射流在拉伸变细时,溶剂的挥发速率较慢,不能形成有效的热致相分离效应,因此最终只能形成无孔状结构的静电纺丝纳米纤维。但是DCM/丙酮体系的沸点就要比DCM/DMF体系的沸点低得多,所以DCM溶液能够快速挥发,使得纤维在成形过程中温度迅速降低,形成热致相分离。发生热致相分离后,纺丝溶液中的溶质富集相形成了纳米纤维的基本骨架,而溶剂的富集相则是形成了孔。因此,采用DCM/丙酮体系能够制备出具有多孔结构的PLA/CA纳米纤维。

图1 不同溶剂体系下纤维形貌
2.2 表面元素分析
对多孔PLA/CA+PDL纤维膜进行XPS能谱测试,分析经赖氨酸改性后多孔PLA/CA纤维膜的表面元素,结果如图2所示。图2(a)为多孔PLA/CA改性前后的XPS全谱,从图2(a)中可以看出,未改性的纤维膜中只有C和O元素,而改性后的纤维膜中出现了C、O和N元素,这说明赖氨酸中的氨基改性成功。
从图2(b)可以看出,C1s光谱中出现了3种C元素的结合态,分别为284.8 eV处的C—C、286.65 eV处的C—O—C和288.98 eV处的O—C=O。图2(c)的O1s光谱则是在531.85 eV和533.01 eV处分别出现C—O和C==O的结合态。此外,在图2(d)的N1s光谱400.13 eV处出现了属于C—N的结合态。这也说明了PDL对于多孔PLA/CA纤维膜改性的成功。

图2 多孔PLA/CA+PDL纤维膜的XPS光谱图
2.3 纤维膜细胞毒性检测
采用MTT法对无孔PLA/CA膜和多孔PLA/CA膜进行细胞毒性检测,结果如图3所示。无论是无孔纤维膜还是多孔纤维膜的OD值均大于空白对照组的OD值。这说明接种在组织工程支架上的活细胞数量比接种在孔板中更多,也就是说PC12细胞在这2种纤维支架上都能获得增殖。这一结果表明这2种纤维膜不具有细胞毒性,可以作为组织支架在后续实验中继续使用。

图3 不同纤维细胞毒性检测结果
2.4 纤维膜的细胞增殖能力
实验结果如图4所示。由图4可知,无孔PLA/CA纤维膜与多孔PLA/CA纤维膜对于促进细胞增殖的效果是相似的。经过改性的纤维膜OD值均高于未改性纤维膜的OD值,说明PDL能有效修饰纤维膜的表面,提高纤维膜的黏附能力,从而增强细胞在纤维膜上的生长增殖能力。具有微孔结构的纤维膜的OD值大于无孔纤维的OD值。也就是说改性后的微孔纤维膜促进细胞增殖的能力远大于改性后的无孔纤维膜。这可能是因为多孔纤维内部的孔为相互贯穿的连通孔,而这种孔结构能更大程度上吸收PDL,使得改性更加彻底,也有利于营养物质在其中运输传递,进一步提高纤维膜对细胞的促增殖作用。更说明经过改性的具有微孔结构的PLA/CA纤维膜适合作为生物组织支架。
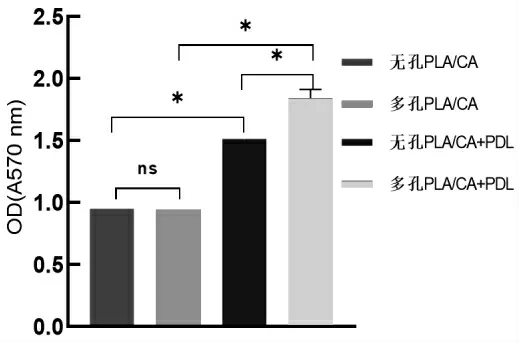
图4 MTT细胞增殖实验结果
3 结论
通过静电纺丝技术,以PLA和CA为溶质,DCM和丙酮为溶剂,在常温常湿条件下制备了多孔纳米纤维膜。SEM图像证实了纤维膜表面存在相互贯穿的连通孔。XPS分析结果显示,PDL的改性对PLA/CA纤维膜进行了氮掺杂,有利于细胞黏附。细胞增殖实验表明,无孔PLA/CA纤维膜与多孔PLA/CA纤维膜在促进细胞增殖方面没有显著差异,但是多孔PLA/CA纤维膜对于表面修饰材料的吸收能力更加突出,经过PDL改性过后的多孔PLA/CA纤维膜上细胞增殖水平远远强于无孔PLA/CA+PDL纤维膜。因此,多孔PLA/CA纤维膜更适合作为组织工程支架。

