303例全自动生化分析仪可疑不良事件报告分析
苏智阳 袁文杰 厦门市食品药品审评认证与不良反应监测中心 (福建 厦门 351000)
内容提要:目的:通过对303例全自动生化分析仪可疑不良事件报告进行分析,发现全自动生化分析仪潜在使用风险,为风险分析及风险控制建议提供了科学证据。方法:对2016年~2018年福建省收集的303例全自动生化分析仪可疑不良事件报告进行统计分析。结果:全自动生化分析仪主要具有与“可靠性”“可用性(易用性)”和“应用条件不确定性风险”相关的三类风险。结论:全自动生化分析仪生产企业应该主动开展不良事件报告工作,针对监测到的使用风险改进产品,强化对医疗机构使用者的教育培训,保障全自动生化分析仪使用安全。
全自动生化分析仪是根据光电比色原理来测量体液中某种特定化学成分的仪器[1]。其结构主要由分析仪主机(含光学分析系统、电解质分析系统、机械运动系统、液路控制系统、电子控制系统和软件系统等)、操作部分(计算机系统)、结果输出部分(打印机)、附件及耗材等组成。全自动生化分析仪是用于检测、分析生命化学物质的仪器,通过对人体体液(血清、血浆、尿液、脑脊液等)样本中成分的定量检测,为临床疾病的诊断、治疗和预后及健康状态提供依据。但随着全自动生化分析仪在临床使用中的普及,其引发或涉及的不良事件也日益增多。为进一步评估全自动生化分析仪的安全性及其风险,本文对福建省2016年1月~2018年12月在国家医疗器械不良事件监测系统上收集到的全自动生化分析仪不良事件报告进行统计和分析。
1.资料与方法
1.1 资料来源
资料源于2016年1月~2018年12月在国家医疗器械不良事件监测系统上收集到的福建省区域内全自动生化分析仪不良事件报告。
1.2 统计学分析
利用Excel和人工归类整理的方法,将收集到的303例全自动生化分析仪不良事件报告作为整体样本进行统计分析。
2.结果
2.1 报告的年度分布
2016年1月~2018年12月,在国家医疗器械不良事件监测系统上共收集到的福建省区域内全自动生化分析仪不良事件报告303例。按年份统计,2016年收到全自动生化分析仪的可疑医疗器械不良事件报告数量19例,2017年56例,2018年228例,由此可见,2016年~2018年,全自动生化分析仪的可疑医疗器械不良事件报告数量呈逐年上升趋势(见图1)。

图1. 303份不良事件报告数量的年度分布
对全自动生化分析仪的可疑医疗器械不良事件的报告数量进行逐月统计分析(见图2),从整体上看,报告数量呈总体上升趋势,并且在每年的七八月份报告数量会出现第一次激增,随后下降,直到每年的十一月和十二月之间报告数量出现第二次激增,且数量达到全年最多。从这些报告数量分析情况也从侧面反映了医疗器械不良事件监测工作的整体发展情况,这也将为下一步的风险分析和风险控制提供理论依据。

图2. 303例不良事件报告数量逐月分析情况
2.2 报告的地区分布
303例监测报告来自福建省的9个地市(见表1),从报告地区分布情况来看,报告数量排名前三位的地市分别是厦门市、福州市和龙岩市。

表1. 303例不良事件报告的地区分布情况
2.3 上报单位、报告来源及其数量
303例报告全部来源于医疗机构使用单位,包括我省9个地市的36个区县的65家医疗机构。65家医疗机构中,含医院43家,卫生院18家,社区卫生服务中心4家。其中43家医院按照医院等级划分,含三级甲等医院18家,三级乙等医院7家,二级甲等12家,二级乙等1家,一级甲等1家,一级乙等1家,无等级3家。
2.4 人口学资料
由于全自动生化分析仪不直接作用于人体,其人口学资料(性别分布、年龄分布)与不良事件是否发生无关,故本报告不统计人口学相关资料数据。
2.5 国内外各品牌不良事件发生频次二维分析
303例全自动生化分析仪不良事件报告涉及16个品牌共计109台(见表2),其中进口品牌8个合计75台,占总台数的68.8%,包括美国贝克曼库尔特有限公司、株式会社日立高新技术公司、Siemens Healthcare Diagnostics Inc、东芝医疗系统株式会社、德国罗氏诊断有限公司、奥林巴斯株式会社、美国雅培公司、Ortho-Clinical Diagnostics。国产品牌8个合计34台,占总台数的31.2%,包括深圳迈瑞生物医疗电子股份有限公司、上海科华实验系统有限公司、长春迪瑞医疗科技股份有限公司、深圳市锦瑞电子有限公司、济南鑫贝西生物技术有限公司、南京神州英诺华医疗科技有限公司、艾康生物技术(杭州)有限公司、南京颐兰贝生物科技有限责任公司。109台进口及国产品牌中,使用数量排名前三位的品牌分别是:进口的美国贝克曼库尔特有限公司39台,总占比35.78%;国产的深圳迈瑞生物医疗电子股份有限公司23台,总占比21.10%;进口的株式会社日立高新技术公司11台,总占比10.09%。

表2. 全自动生化分析仪品牌分布情况
对303例全自动生化分析仪不良事件发生频次(定义发生频次=不良事件报告数量÷仪器台数)按品牌进行整理分析(见表3),并以各品牌为横坐标,以发生频次为纵坐标作图,绘制柱状图进行分析(见图3)。
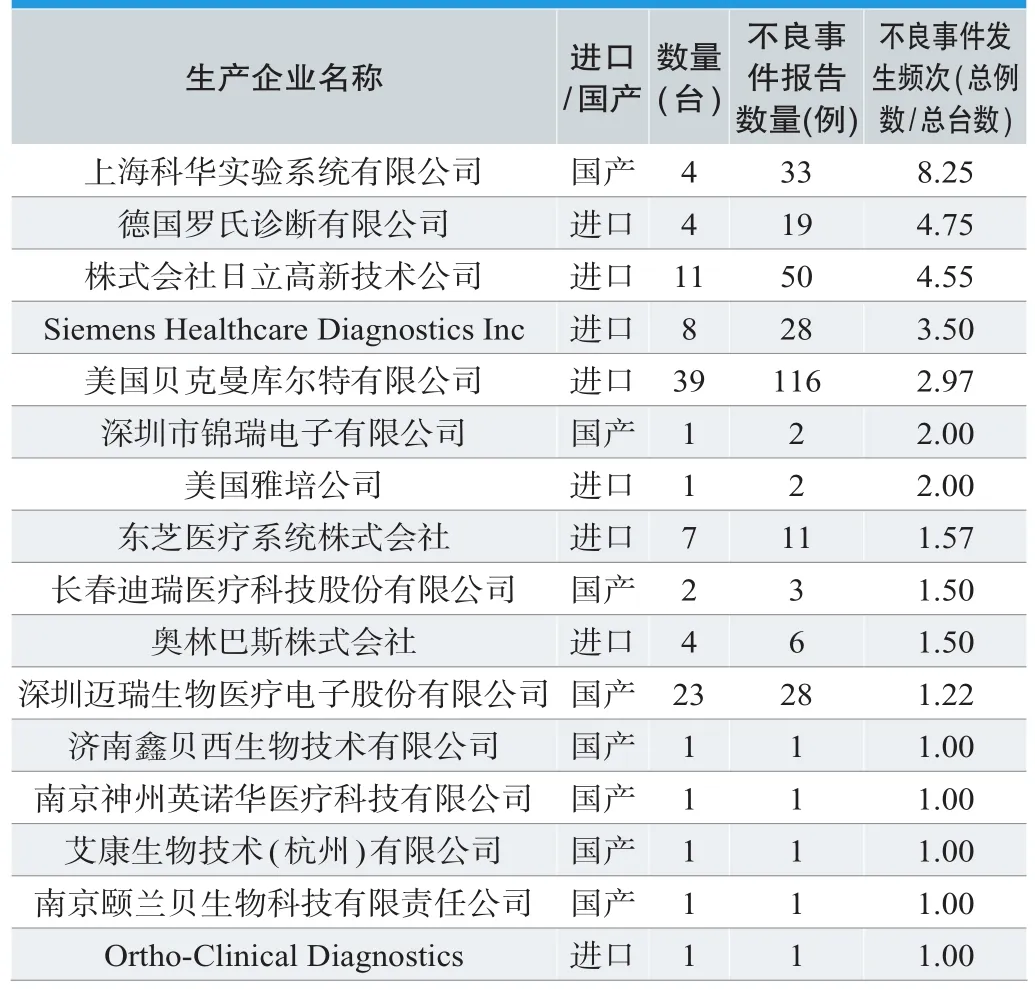
表3. 全自动生化分析仪进口和国产品牌不良事件发生频次比较

图3. 全自动生化分析仪进口和国产品牌不良事件发生频次柱状比较图
2.6 不同故障类型的伤害类型及发生频次二维分析
303例全自动生化分析仪不良事件,其中含使用问题4例次,仪器故障部件失效299例次。对303例不良事件发生频次(定义发生频次=不良事件报告数量÷仪器总台数)按照故障类型进行整理分析(见表4),并以具体故障类型为横坐标,以发生频次为纵坐标作图,绘制柱状图进行分析(见图4)。

表4. 303例报告不同故障类型的伤害类型及发生频次比较
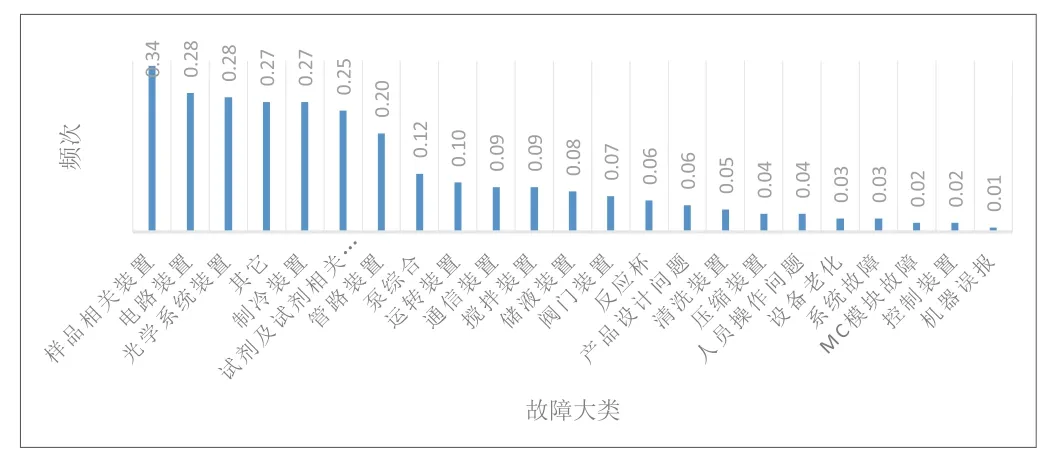
图4. 303例不良事件报告不同故障类型发生频次柱状比较
由表4可见,303例全自动生化分析仪不良事件共包含23种故障类型,且在不同故障类型中,以样品相关装置、电路装置、光学系统装置、制冷装置失效的报告所占比例最大,分别占此类报告总数的12.21%、10.23%、9.90%和9.57%,发生频次分别为0.34、0.28、0.28、0.27。
2.7 危害类型和风险分析
对303例全自动生化分析仪不良事件进行危害类型和风险分析。参照ISO14971标准,以X轴表示不良事件发生率,Y轴表示危害程度(含“严重、较严重、一般、可忽略”四种)(见表5),对303例不良事件绘制二维风险图(见图5)。对于每一种危害或者危害处境,可将危害类型和发生率绘成风险图中的一个单独的点。圆圈中的数字代表相同发生率以及相同危害程度的不良事件记录的数目。

表5. 303例不良事件损害程度归类统计

图5. 二维风险图
为进一步评估风险,参照ISO14971标准,将图5中的发生频次定义为5个级别:频次在0.0~3.5的定义为低,频次在3.5~7.0的定义为较低,频次在7.0~10.5的定义为中,频次在10.5~14.0的定义为较高,频次在14.0~17.5的定义为高。并以发生频次的5个级别做行,4种危害类型做列,形成一个5×4的半定量风险矩阵,估计的风险(R1,R2,R3,R4,R5)输入到适当的格子中,结果在图6中表示。

图6. 5×4的半定量风险矩阵
以5×4的半定量风险矩阵表进一步绘制半定量风险图(见图7),并进行风险分析(见图8)。根据ISO14971标准,区分出303例不良事件中,含“不可接受的风险”2例,占0.66%;“研究进一步降低风险”56例,占18.48%;“可接受的风险”245例,占80.86%。

图7. 半定量风险图
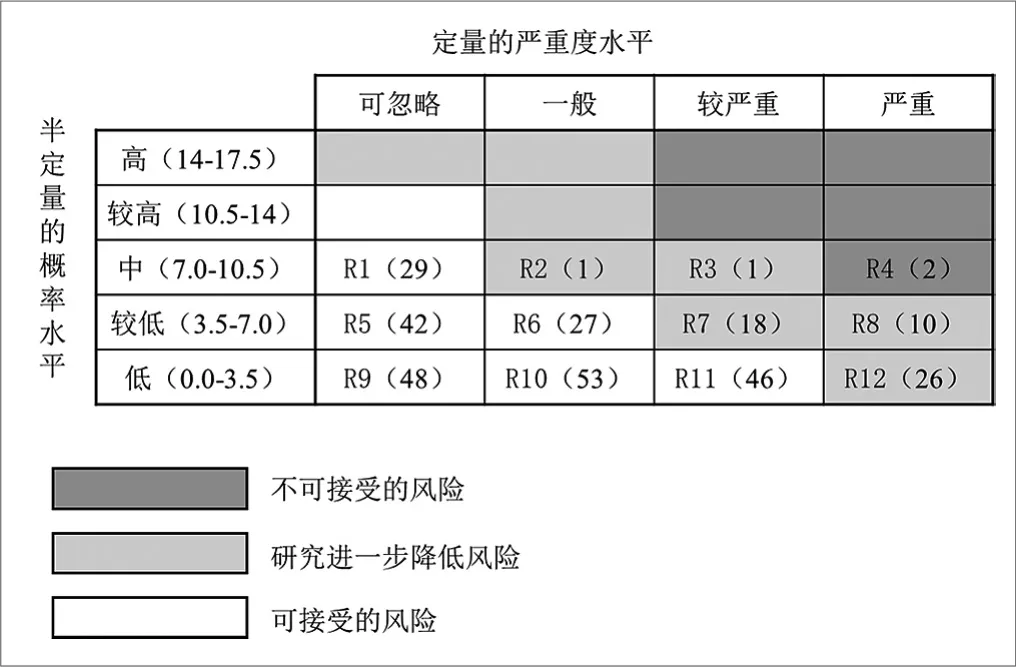
图8. 303例不良事件记录的风险分析与评价
3.风险控制意见与建议
综合以上分析评价结果,全自动生化分析仪主要具有与“可靠性”“可用性(易用性)”和“应用条件不确定性风险”相关的三类风险。部件可靠性风险和产品可用性(易用性)风险本质上属于人为因素风险,可通过完善标准、强化监管、做好说明和警示进行控制。全自动生化分析仪生产企业作为安全有效的第一责任人,是医疗器械不良事件上报的主体之一,应主动及时对发生的医疗器械不良事件开展收集、调查、分析、评价,采取措施控制风险[2]。通过不良事件监测评价,分析可能导致不良事件的影响因素,提高产品技术标准,采取有效的风险管理措施,最大限度减少使用风险的发生。
3.1 加强关键部位设计和制造的可靠性
加强“样品相关装置”“试剂及试剂相关装置”设计和制造的可靠性。“样品相关装置”发生故障的表现主要是“吸样针(采样针、加样针)损坏或堵塞”“试剂及试剂相关装置”发生故障的表现主要是“试剂针损坏或堵塞、试剂盘温度异常”。建议生产企业采取措施提高吸样针、试剂针等的设计和质量,降低“样品相关装置”和“试剂及试剂相关装置”的故障风险。提高研发和技术创新能力,提高生产工艺标准。加强如机械臂、传动装置等关键部件的生产工艺与设计思路,更好地保证在出现故障时样品得以完好保存,避免样品报废带来的问题。
3.2 加强测控软件的验证和确认
全自动生化分析仪的参数测控软件是该产品的核心组件,同时也是保证参数测量和控制准确度和精确度的关键部位。对参数测控软件的设计,要重点加强其算法模型的信度和效度、信号采集、测量/控制方式、与硬性兼容性等方面的验证和确认。虽然本次监测涉及软件失效的数据不多,但是随着当今物理信息系统融合技术的发展,由于软件设计导入的风险问题将呈现上升趋势。建议生产企业参照IEC 62304-2006医疗器械软件-软件生存周期过程,进一步加强全自动生化分析仪测控软件的验证和确认。
3.3 与可用性(易用性)相关风险的控制意见与建议
可用性(易用性)是指具有有效性、效率、易学性和用户满意的人机接口特性。可用性设计的目的就是设计良好的人—机接口,有效避免使用错误,从而保证产品的正确使用。比如:监测参数阈值报警的有效性、可靠性以及可识别性的设计;人机操作界面的交互性设计;产品使用说明/标签/标识的易读性设计等。本次监测,发现了使用错误模式,涉及说明书、标签/标识、操作不规范等方面问题。因此,建议生产企业参照IEC62366-2007可用性工程在医疗器械的应用,进一步加强全自动生化分析仪的可用性设计。
3.4 进一步加强对仪器使用者的培训
全自动生化分析仪主要是在专业的医疗机构中使用,要通过强化使用环节的培训教育,提升医护人员对全自动生化分析仪的认识水平,提高风险意识,确保按说明书要求规范做好日常维护、检验工作,对于出现故障、报警能及时反映、正确处理。
4.小结
全自动生化分析仪生产企业应该主动开展不良事件报告工作,针对监测到的使用风险改进产品,强化对医疗机构使用者的教育培训,保障全自动生化分析仪使用安全。

