果蔗根腐病病原菌分离鉴定及生物学特性分析
任庆肖,张金旭,王继华,徐世强,姚伟,张木清
(1. 广西大学农学院/广西甘蔗生物学重点实验室/亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004;2. 广东农业科学院作物研究所,广东 广州 510640)
甘蔗(Saccharum officinarum)广泛种植于热带和亚热带地区,是重要的糖料作物,也是最好的可再生生物质能源作物之一[1]。 果蔗(chewing cane)是一种可鲜食的水果型甘蔗,其口感清甜,营养丰富,深受人们的青睐[2],是我国南方重要的经济作物,广泛种植于广东、广西、浙江、福建和云南等地区,主栽品种为“拔地拉”(Badila),其种植面积占果蔗总面积的70%[3]。 近年来,广东蔗区根腐病连年加重,造成大面积减产,严重打击农户的果蔗种植积极性,对果蔗产业健康发展构成严重威胁。
甘蔗根腐病是一种发生在甘蔗根部的土传性病害,在果蔗上尤为严重。 2018年本实验室首次报道了由Fusarium commune(共享镰刀菌)引起的甘蔗根腐病,通过田间调查发现患病果蔗生长初期田间表现植株矮小,发根力弱,根系逐渐变褐、变软和腐烂,叶片因根系吸收水分、养分能力下降而出现卷曲、发黄甚至枯萎,严重时植株死亡;即使部分幼苗仍能继续带病生长,但生长后期植株纤细,茎基部和根部的纵切面呈现黑褐色[4]。 而健康植株表现为地上部生长良好,根系发达且附着土壤的能力强(图1)。 调查发现,根腐病对甘蔗产量影响巨大,发病地块平均减产30%~50%,造成重大经济损失。 因此,初步认为果蔗根腐病是一种新兴的较为严重的病害,该病害贯穿于果蔗整个生长期,果蔗生长初期(2 ~3 个月)最易感染根腐病,应加以重视并及时防治。

图1 果蔗根腐病患病与健康植株及其根系的田间表型
本研究对广东省广州市果蔗区根腐病田间发病情况进行调查并采集发病样品分离病原菌,通过形态学观察和分子生物学鉴定并测定其致病性,初步分析其生物学特性,以期为果蔗病害防治和病原菌研究提供理论依据,保障果蔗产业健康发展。
1 材料与方法
1.1 试验材料
材料为具有典型根腐病症状的果蔗植株样品,2019年12月采集于广东省广州市番禺区果蔗种植基地,采集后立即送往实验室进行处理。
1.2 病原菌的分离与纯化
采用传统组织分离法进行病原菌的分离,具体方法为:首先将患病植株根系洗净沥干水分,置于超净工作台上,用灭菌手术刀在患病根部的病健交界处切取5 mm 的根段,75%乙醇消毒30 s,后移至无菌水中洗涤3 次,最后用灭菌滤纸吸干多余水分,接种于PDA(马铃薯葡萄糖琼脂)培养基(含链霉素、噻孢霉素)中央,28℃恒温培养箱中黑暗培养2 ~3 d。 不断对菌落进行纯化,直至菌落整齐一致没有杂菌出现,获得分离菌株,用于后续鉴定。
1.3 形态学与分子生物学鉴定
1.3.1 形态学鉴定 用打孔器沿分离菌株的菌落边缘打取6 mm 菌饼接种在PDA 平板上,28℃恒温箱黑暗培养,观察菌落形态、颜色、质地以及气生菌丝的生长状况等培养性状。 配制土壤琼脂培养基以观察厚垣孢子[5]。 培养数天后,挑取菌丝在光学显微镜、荧光显微镜以及扫描电子显微镜下观察分离菌株的显微形态特征,并在显微镜下拍照,按照Skovgaard 等[2]的方法对分离菌株进行形态学鉴定。
1.3.2 分子生物学鉴定 DNA 提取:将分离菌株接种在PDW(马铃薯葡萄糖水)培养基上,28℃摇床培养3 d 后,用四层灭菌纱布过滤,收集200 mg新鲜菌体,用全自动样品快速研磨仪进行预冷研磨,采用SDS 裂解法提取病原菌基因组DNA。 提取的DNA 置于-20℃冰箱中暂时保存。
PCR 扩增:采用真菌ITS 序列通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)、镰刀菌特异性引物EF1(5′-ATGGGTAAGGARGACAAGAC-3′)和EF2(5′-GGAAGTACCAGTSATCATGTT-3′)[7]对病原菌基因组DNA 进行PCR 扩增。 PCR 扩增产物送至生物工程(上海)股份有限公司进行纯化和检测。
序列比对:登录NCBI 网站(https:/ /blast.ncbi.nlm.nih.gov/Blast.cgi),通过BLAST 功能将测序结果在GenBank 数据库中进行同源性搜索和比对分析,初步确定分离菌株的种属。
系统发育分析:从GenBank 数据库中下载已知种名的近源菌TEF1-α基因序列,利用MEGA-7 软件进行ClustalW 多序列比对后,采用邻接法(Neighbor-Joining)构建基于TEF1-α序列的系统发育树,并对所构建的系统发育树进行Bootstrap重复分析1000 次,从而确定其系统发育关系。
1.4 致病性测定
将果蔗茎用多菌灵消毒后,25℃(保持湿润)催芽7 d 长出健康根系,作为后续待处理植株。用打孔器沿分离菌株菌落边缘打取菌饼接种在PDA 平板上,28℃黑暗培养5~7 d,用挑针轻轻刮下菌落,8 层纱布过滤菌丝得到孢子悬浮液,用无菌水将孢子悬浮液浓度调至1.0×106cfu/mL。 室温条件下,将10 mL/株的分生孢子悬浮液均匀接种在果蔗植株的根围,以接种10 mL/株无菌水作为对照处理,每处理重复3 次。 处理后1~20 d 连续观察植株根系的发病情况,出现明显发病症状后,对病原菌进行再分离和柯赫氏法则验证。
1.5 生物学特性研究
将分离菌株在PDA 培养基上培养7 d,用打孔器沿其菌落边缘打取6 mm 菌饼,分别接种在PDA(马铃薯葡萄糖琼脂)、LA(LB 肉汤琼脂)、CDA(察氏琼脂)、MEA(麦芽浸膏琼脂)、SDA(沙氏葡萄糖琼脂)、SAM(改良沙氏琼脂)6 种培养基上,28℃黑暗培养,每处理重复3 次,每隔24 h 采用十字交叉法测量菌落直径,培养7 d 后,在培养皿中加10 mL 无菌水,制备孢子悬浮液,用血球计数板测定每个处理下的孢子产量。
将6 mm 菌饼接种在PDA 培养基上,分别置于16、20、24、28、32℃条件下恒温黑暗培养,每处理重复3 次,每隔24 h 采用十字交叉法测量菌落直径。 培养7 d 后,用血球计数板测定不同温度处理下的孢子产量。
用1 mol/L HCl 和1 mol/L NaOH 溶液调节pH,配制不同pH 值(pH=3~11)的PDA 培养基,将6 mm 菌饼接种在培养基上,置于28℃条件下恒温黑暗培养,每处理重复3 次,每隔24 h 采用十字交叉法测量菌落直径,培养7 d 后用血球计数板测定不同pH 值处理下的孢子产量。
1.6 数据处理与分析
采用SPSS 软件进行数据处理和差异显著性分析。
2 结果与分析
2.1 病原菌的形态学特征
本试验共分离27 株菌,其中6 株与Fusariumcommune(共享镰刀菌)[6]形态特征相似(编号为F.C6、F.C15、F.C16、F.C25、F.C27、gx4-46),主要形态特征如下。
在PDA 培养基上菌落颜色为白色,菌丝紧贴培养基生长,气生菌丝较少且为绒毛状,培养数天后,菌落不变色,培养基背面逐渐变为淡黄色。 小分生孢子较多,呈卵圆形,大小为(3.11 ~13.09)μm×(1.69 ~3.86) μm;大分生孢子较少,呈长卵形微弯或月牙形两端微尖,隔膜最多为3 个,大小为(11.05 ~33.21)μm×(3.03 ~5.65)μm。 扫描电镜下的分生孢子形态为扁船形或腹侧内卷状。 光学显微镜下观察的分生孢子梗多为粗短的简单瓶梗,偶尔出现较为细长的单瓶梗。 厚垣孢子为球形,直径(5.49~10.95)μm。 由于分离菌株可以产生长度超过25 μm 的细长单瓶梗,符合Skovgaard等[6]对F. commune区别于尖孢镰刀菌的形态特征描述,因此初步鉴定为F. commune(图2)。

图2 分离菌株gx4-46 的显微形态特征
2.2 分子生物学鉴定
测序结果在GenBank 数据库中进行同源性比对,结果显示分离菌株的TEF1-α基因序列与GenBank 中F. commune( GenBank 登 录 号:MT947795.1)的相应片段相似度均达到99%以上,E-value 值为0。
利用MEGA-7 软件将分离菌株和已知种名的镰刀菌菌株的基因序列(表1)进行聚类分析,选取F.solani(登录号:DQ247544.1)作为外群,采用NJ 法构建基于TEF1-α基因序列的系统发育树。 结果显示供试菌株与F. commune处于同一分支,分支置信度为98%(图3)。 因此将该6 株分离菌鉴定为F. commune。
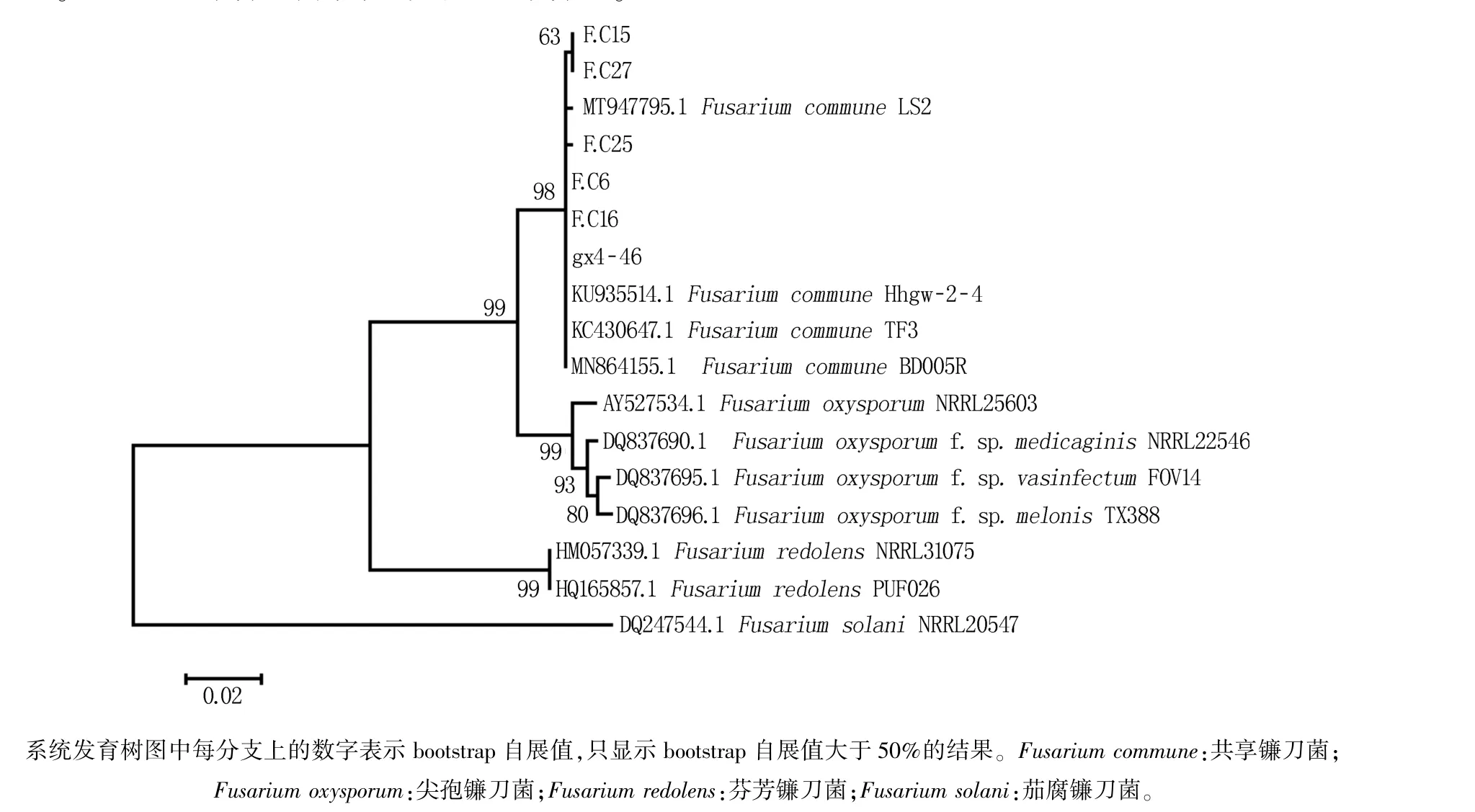
图3 基于TEF1-α 基因序列采用邻接法构建的分离菌株与相关菌株的系统发育树

表1 用于系统发育分析的菌株及其GenBank 登录号
2.3 致病性测定
致病性测定结果(图4)显示,接种分离菌株后果蔗根系均有一定程度的发病,表现为植株矮小,生长缓慢,主根逐渐变为深褐色并伴有不同程度的腐烂,新生根的数量减少,和田间发病情况相似。 不同菌株对果蔗根系的致病力不同,接种gx4-46 菌株后根系的发病率高达79.96%,显著高于其他菌株,F.C16、F.C27、F.C25、F.C15、F.C6的发病率分别为25. 13%、20. 09%、17. 86%、16.50%、12.77%(图5)。

图4 致病性测定结果

图5 接种不同菌株的果蔗根系发病率
2.4 生物学特性
2.4.1 培养基对菌株生长的影响 gx4-46 菌株在不同培养基上表现出不同的生长特性(图6)。在LA 培养基中气生菌丝发达,菌丝生长最快,菌落直径平均生长速率为1.47 cm/d,之后依次为CDA 培养基、MEA 培养基、SDA 培养基、SAM 培养基和PDA 培养基。 在CDA 培养基上菌丝紧贴培养基生长,菌丝纹路清晰,但气生菌丝体较少。菌株在LA 培养基上产孢量最大,显著高于其他处理。 可见LA 培养基为该菌株的最适培养基。
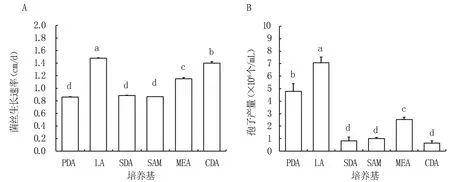
图6 培养基对gx4-46 菌丝生长速率和孢子产量的影响
2.4.2 温度对菌株生长的影响 由图7 可知,在16~32℃范围内果蔗根腐病病原菌均能生长。 当温度为24℃时菌丝生长最快,菌落直径平均生长速率为1.13 cm/d,生长7 d 天后的孢子产量为6.07×106个/mL,均显著高于其他培养温度。 因此,24℃为最适合该菌株菌丝生长的温度。
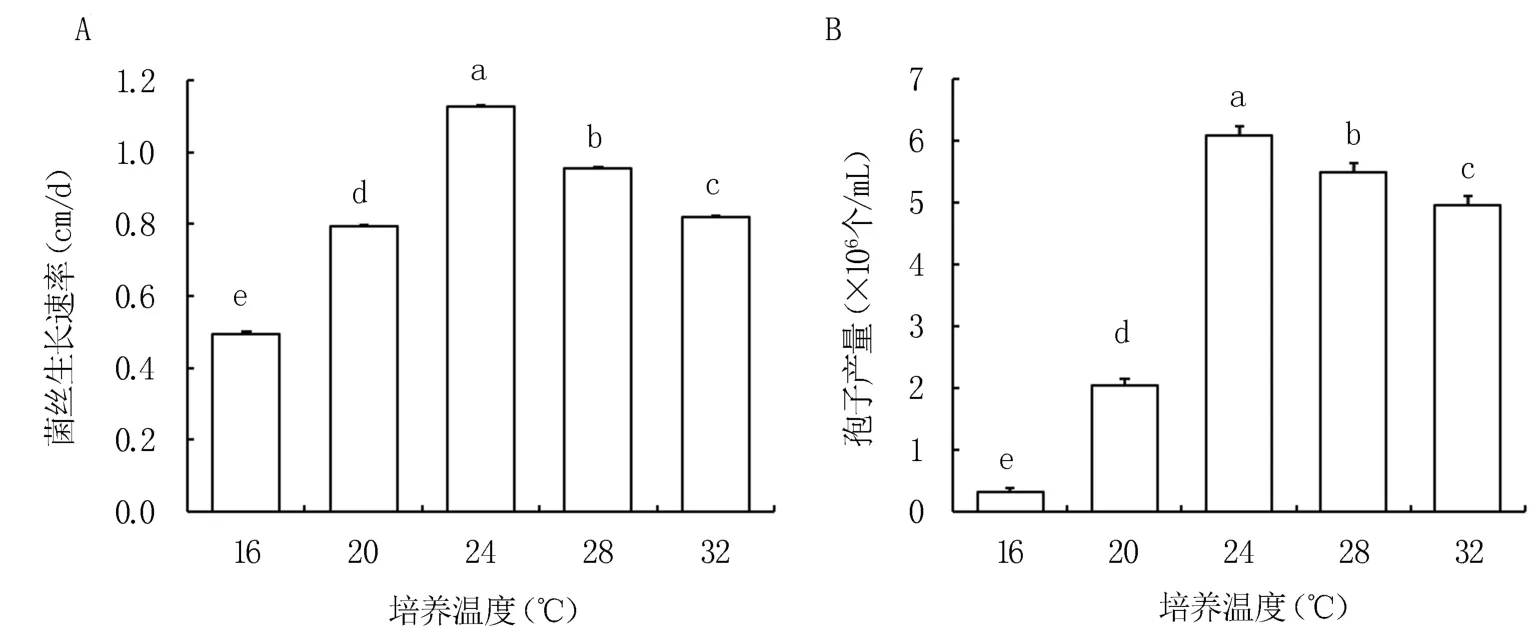
图7 培养温度对gx4-46 菌丝生长速率和孢子产量的影响
2.4.3 pH 值对菌株生长的影响 果蔗根腐病病原菌对酸碱度的适应范围广泛,在pH 值为3 ~11 范围内均可生长。 pH =7 时最适合病原菌的生长,菌落直径平均生长速率为1.39 cm/d。 在pH 值为3~11 范围内均能产孢,pH=11 时产孢量最大,pH 为3~4 时几乎不产孢(图8)。
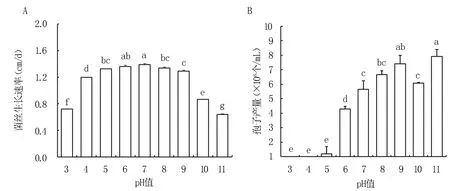
图8 pH 值对gx4-46 菌丝生长速率和孢子产量的影响
3 讨论与结论
本试验从果蔗根腐病根系样品中分离到的27 株分离物中,有6 株被鉴定为Fusarium commune,分离频率为22.22%。 致病性测定结果表明,供试菌株间存在一定的致病性差异,与前人的研究结果相同[5,8]。 果蔗根系接种gx4-46 菌株后发病严重,发病率高达79.96%,因此,选取该菌株进行进一步生物学特性分析。 结果表明,LA 培养基为病原菌的最适培养基;24℃为该菌株菌丝生长的最适温度,这与曾莉莎等[9]对荷花腐败病菌以及张河庆等[10]对豇豆根腐病病原菌的菌丝最适生长温度的研究结果相似;pH =7 最适合该菌株的生长。
已知为害甘蔗根部的主要病原菌有Pythium arrhenomanes(强雄腐霉)、Pachymetra chaunorhiza、Macrophomina phaseolina(壳球孢菌)、Xylaria arbuscula(木生炭角菌)等[11-15]。 2018年本实验室首次报道了由F. commune引起的甘蔗根腐病[4],F. commune作为尖孢镰刀菌的姐妹种[6],是一种具有广泛寄主范围和地理分布的植物致腐病菌,能引起道格拉斯冷杉[16]、美国森林苗圃[17]、水 稻[5]、大 豆[18]、烟 草[19]、豇 豆[10]、番茄[20]和软枣猕猴桃[21]等多种作物的根腐病。 在水量丰富的地区或者水生植物上,该菌更容易生存繁殖。 如近年来报道的较为严重的荷花腐败病以及荸荠枯萎病均由该菌引起[22,23]。 福建省烟草种植区普遍采用烟草与水稻轮作的种植方式,根腐病病原菌可能广泛存在于水田中[19]。 百合枯萎病在5、6月份潮湿多雨季节发生严重,发病率达到30%[24];此外,由该菌引起的水稻枯萎病与根腐病近年来也被首次报道[5]。 果蔗种植地区水量丰富,垄旁的水渠长期处于满水状态,农户常施大水大肥,这也可能为病原菌的生存繁殖提供了有利条件。 因此,对于F. commune如何在水中或水量丰富地区繁殖以及侵染水生植物或水量丰富地区作物的致病机理还有待进一步研究。
本试验通过对病原菌的鉴定及生物学特性的研究,确定F. commune为果蔗根腐病的致病菌,为病害防治和病原菌的研究提供了理论依据。 目前对于该病原菌侵染果蔗的流程、致病机理以及病原菌与寄主互作的机制还尚不明确。 后期需进一步探究高效的化学防治方法以及时应对果蔗根腐病的流行与发生,以期为病害的防治及高抗品种选育与栽培提供指导。

