黄瓜GR-RBP3 启动子克隆及低温对其活性的诱导
王斌 黄泳谚易景怡原远
(1. 广东省粤北食药资源利用与保护重点实验室,广东 韶关 512005;2. 韶关学院英东生物与农业学院,广东 韶关 512005)
富含甘氨酸蛋白(glycine-rich proteins,GRPs)是植物中一类具有半重复甘氨酸基序(semi-repetitive glycine-rich motifs)的蛋白质,氨基酸序列中的甘氨酸含量在20%~70%之间[1]。根据氨基酸序列中重复序列的排列以及是否含有保守结构域,可将GRPs 家族细分为4 个亚家族[2],其中,亚家族Ⅰ的GRPs 在(GGX)n重复序列的后面连着一个信号肽;亚家族Ⅱ的GRPs 序列中含有一个信号肽,并在C 端含有一段半胱氨酸重复基序;亚家族Ⅲ的GRPs 也含有信号肽,但与其他GRPs 相比,甘氨酸含量较低;亚家族Ⅳ的GRPs 也称为富甘氨酸RNA 结合蛋白(glycinerich RNA-binding proteins,GR-RBPs)[3],其氨基酸序列的N 端含有1 个或多个RNA 识别域(RNA recognition motifs,RRM)或冷休克结构域(cold-shock domain)或锌指结构(zinc fingers)等保守结构域[4]。
GR-RBPs基因的表达与植物抗冷性密切相关。 拟南芥(Arabidopsis thaliana)的AtGR-RBP2、AtGR-RBP4和AtGR-RBP7在低温处理后表达量显著增加;与野生型和gr-rbp2突变体相比,过表达AtGR-RBP2显著增强拟南芥幼苗耐冷性和抗冻性[5]。AtGR-RBP同源基因AtRZ-1b和AtRZ-1c表达与拟南芥抗冻性密切相关,但在冷敏感大肠杆菌中异源超表达AtRZ-1c不能修复其对低温的敏感性[6]。 在拟南芥中过表达油菜(Brassica napus)GR-RBP1,能促进拟南芥种子萌发,提高转基因拟南芥的耐冷性和抗冻性[7]。 可见,GR-RBPs表达在增强植物耐冷性中发挥着至关重要的作用。
黄瓜(Cucumis sativus)是重要的果菜类蔬菜,深受消费者喜爱[8,9]。 采后黄瓜组织含水量高,呼吸强度大,室温贮藏很容易腐烂变质,贮藏期很短[10]。 因此,生产上通常采用低温贮运以保持采后黄瓜品质,延长贮藏期[11]。 但黄瓜对低温十分敏感,低温贮藏时很容易发生冷害[12]。 因此,挖掘耐冷相关基因并解析其在采后黄瓜耐冷性中的作用,对耐冷黄瓜新品种的培育及种质资源改良具有重要意义。
启动子是启动和调控基因表达的重要元件,在基因转录调控中占有核心地位,决定基因的表达水平[13]。 本研究前期结果证实,低温锻炼处理能显著诱导采后黄瓜耐冷性和CsGR-RBP3表达[14];在拟南芥中异源超表达CsGR-RBP3,能增强拟南芥幼苗的耐冷性,促进其在低温条件下的生长[15]。 表明CsGR-RBP3表达与采后黄瓜耐冷性密切相关,但调节其表达的转录调控机制仍不清楚。 因此,本研究根据黄瓜基因组信息,利用黄瓜果皮DNA 克隆了CsGR-RBP3启动子,并采用基因工程方法在烟草和拟南芥中分析了启动子活性以及低温对其活性的影响,以期从转录调控的角度解析低温处理诱导CsGR-RBP3表达的分子机理,明确CsGR-RBP3响应低温信号的方式。
1 材料与方法
1.1 试验材料与试剂
本研究所用黄瓜品种为“翠夏”,由广东现代金穗种业有限公司培育。 2017年6月采收成熟度好的黄瓜果实,立即在室温条件下运回实验室;挑选果形一致、无病虫害、无机械伤的果实作为试验材料,并将其分成3 组,每组15 根,用塑料薄膜保鲜袋扎口包装后分装在3 个塑料筐中,分别贮藏在25℃和5℃的恒温培养箱中,培养箱湿度均为85%。 依次在贮藏0、24、48、72 h 取样,每次取样从一个筐中随机取3 根黄瓜,收集果皮,立即用液氮速冻,并保存于-80℃超低温冰箱,用于提取DNA 和总RNA。
哥伦比亚拟南芥(Arabidopsis thaliana)和本氏烟草(Nicotiana tabacum)的培养条件为23℃、16 h/8 h 光暗周期。 DH5α 大肠杆菌和GV3101农杆菌感受态购自上海唯地生物有限公司。
高保真PCRTaq酶、DNA 提取试剂盒、限制性内切酶,分别购自上海生工生物工程有限公司;Dual Luciferase Reporter Gene Assay Kit 试剂盒和反转录试剂盒购自上海翌圣生物科技股份有限公司;植物总RNA 提取试剂盒和GUS 染色试剂盒均购自北京天根生化科技有限公司。
1.2 DNA 提取、CsGR-RBP3 启动子克隆及生物信息学分析
使用上海生工生物工程有限公司的Rapid Plant Genomic DNA Isolation Kit 试剂盒提取黄瓜基因组DNA,并通过1%琼脂糖凝胶电泳验证DNA 质量。 利用黄瓜基因组数据库,查找CsGRRBP3基因ATG 上游1500 bp 左右的DNA 序列,根据查找到的序列设计启动子克隆引物。 将扩增到的序列送至上海生工生物工程有限公司广州分公司测序,启动子克隆所用引物见表1。
将经过测序验证的启动子序列提交至启动子生物信息学分析网站PlantCARE(http:/ /bioinformatics.psb.ugent.be/webtools/plantcare/html/),分析启动子序列中存在的调控元件。 利用TSSP(http:/ /linux1. softberry. com/berry. phtml? topic =tssp&group=programs&subgroup =promoter)在线网站预测启动子的转录起始位点。 使用TBtools 数据可视化软件绘制顺式作用元件在启动子中的分布[16]。
1.3 启动子活性分析
采用双荧光素酶报道基因实验分析CsGRRBP3启动子。 根据克隆的CsGR-RBP3基因启动子序列设计引物,将其亚克隆到pGreenⅡ0800 Reporter 载体上。 构建载体的引物见表1。
分别将pGreenⅡ62-SK 空载、pGreenⅡ0800空载和CsGR-RBP3 pro::LUC 重组载体转化GV3101 农杆菌,挑选单克隆阳性菌落,LB 液体培养基中扩大培养,直至菌液OD260值为0.5 ~0.8;离心收集菌体,用渗透液(含10 mmol/L MES、10 mmol/L MgCl2和150 μmol/L 乙酰丁香酮)重悬菌体,调整到合适浓度,室温静置2 h;将含有pGreenⅡ62-SK 空载的渗透液分别与含有pGreenⅡ0800 空载和CsGR-RBP3 pro::LUC 重组载体的渗透液按1∶1 比例混合,注射到烟草叶片背面细胞,23℃共培养72 h 后,使用上海翌圣生物公司的Dual Luciferase Reporter Gene Assay Kit 试剂盒检测荧光素酶报告基因LUC和REN活性,并计算两者比值。
1.4 CsGR-RBP3 pro::GUS 融合表达载体构建
使用ScaⅠ和SmaⅠ限制性内切酶双酶切pBI121-GUS 植物表达载体,切除该表达载体的CaMV35S 启动子,使其成为线性化片段;根据Cs-GR-RBP3启动子和pBI121-GUS 植物表达载体ScaⅠ和SmaⅠ酶切位点附近序列设计同源重组引物,将启动子序列亚克隆到pBI121-GUS 表达载体上,替换CaMV35S 启动子,用于驱动GUS基因表达。 构建的载体命名为CsGR-RBP3 pro::GUS。 引物详情见表1。

表1 本研究所用引物信息
1.5 启动子超表达载体瞬时转化烟草叶片和GUS 染色
分别将pBI121-GUS 空载和重组载体转化DH5α 大肠杆菌感受态,对阳性克隆进行菌落PCR 验证,重组载体双酶切并测序鉴定;鉴定后的载体转化GV3101 农杆菌感受态,挑取单克隆阳性菌落,用液体LB 培养基扩大培养至适宜浓度;采用同1.3 的方法,在烟草叶片背面细胞注射含有pBI121-GUS 空载和重组载体的农杆菌悬浮液,侵染后的烟草在23℃环境中暗培养24 h,使农杆菌充分活化,然后分别放置在23℃和5℃的环境中培养48 h。
采用真空渗透的方法,使用一次性注射器将GUS 染色液注入烟草叶片。 然后用打孔器从烟草叶片打取0.5 cm 大小的圆片,放入2 mL 的离心管中,再次用GUS 染色液染色24 h。 染色结束后,使用75%乙醇室温脱去叶片中的叶绿素,拍照固定叶片GUS 染色情况。
1.6 转基因拟南芥鉴定和低温处理
用蘸花法将CsGR-RBP3 pro::GUS 启动子超表达载体转化拟南芥,通过抗性筛选、PCR 检测等鉴定阳性转基因苗,培养至收获T2 代种子。提取T3 代转基因拟南芥DNA,根据GUS基因全长设计引物,采用PCR 法鉴定是否为转基因苗。
将种子萌发后生长22 d 的转基因拟南芥苗用于低温处理试验:将转基因拟南芥苗在5℃处理3 d(16 h/8 h 光暗周期),收集叶片,用于分析GUS基因表达。
1.7 总RNA 提取、cDNA 合成和基因表达分析
使用北京天根生化科技有限公司的RNApre Pure Plant Plus Kit 试剂盒提取黄瓜果皮、烟草叶片和拟南芥叶片总RNA,严格按照说明书操作。
利用上海翌圣生物公司的Hifair®Ⅱ1st Strand cDNA Synthesis SuperMix 反转录试剂盒合成cDNA,具体操作按照试剂盒说明进行。 采用半定量PCR 法分析相应基因的表达情况,CsActin、NtEF1α和AtActin分别作为内参基因,引物详情见表1。
1.8 数据统计与分析
使用Microsoft Excel 2016 软件整理试验数据,并制作图片。
2 结果与分析
2.1 不同温度处理对采后黄瓜GR-RBP3 表达的影响
为探究低温处理对采后黄瓜GR-RBP3表达的诱导作用,检测了不同温度贮藏0 ~72 h 的Cs-GR-RBP3表达情况,结果(图1)表明,在25℃贮藏期间,采后黄瓜GR-RBP3表达量很低,且在贮藏期间的变化不明显;在5℃贮藏期间,与贮藏前(0 h)相比,CsGR-RBP3表达明显上调,且表达随贮藏时间延长而增强。 表明CsGR-RBP3是一个低温诱导型基因,但低温如何诱导采后黄瓜GRRBP3表达尚不清楚。
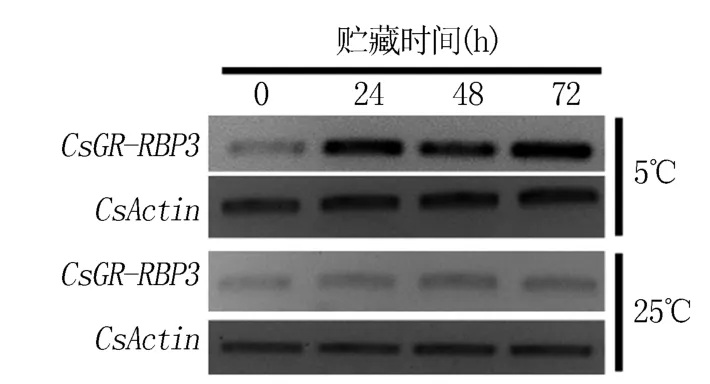
图1 不同温度处理对采后黄瓜GR-RBP3 表达的影响
2.2 CsGR-RBP3 启动子克隆与生物信息学分析
启动子是调控基因表达的核心元件,推测低温可能通过影响CsGR-RBP3启动子活性诱导其表达。 为此,本研究从黄瓜果皮中克隆CsGRRBP3启动子,并构建启动子超表达载体,探讨低温处理对CsGR-RBP3启动子活性的影响。
以黄瓜果皮基因组DNA 为模板,以CsGRRBP3 Pro 为特异性引物,使用高保真Taq酶通过PCR 法扩增CsGR-RBP3基因ATP 上游1500 bp左右的DNA 序列,结果(图2A)显示,扩增到了1条约1500 bp 的目的片段。 将该DNA 片段连接18T 载体,转化DH5α 大肠杆菌,经菌落PCR 检测,也扩增出了一条与目的条带大小一致的DNA片段(图2B)。 经测序鉴定,获得的片段实际长度为1541 bp,其序列与基因组(http:/ /www.cucurbitgenomics.org/)中已公布的序列一致,表明成功克隆到了CsGR-RBP3启动子。

图2 CsGR-RBP3 启动子PCR 产物电泳图谱
将克隆到的DNA 序列提交至PlantCARE 网站,分析启动子中可能存在的顺式调控元件。 结果(表2)显示CsGR-RBP3启动子序列中含有丰富的TATA-box 和CAAT-box,这两个元件是真核生物保守的核心启动子元件[17],表明克隆到的序列具备了启动子基本特性。 另外,在启动子序列中还鉴定到多个环境响应元件(表2、图3),表明CsGR-RBP3表达受低温、光照、干旱胁迫、厌氧诱导等影响。 同时,还发现了多个MYC 和MYB 转录因子的结合位点(图3),表明CsGR-RBP3表达可能受MYB 和MYC 类转录因子的直接调控。TSSP 网站分析显示,CsGR-RBP3基因的转录起始位点在ATG 上游的1302 bp 处。

表2 PlantCARE 网站预测的CsGR-RBP3启动子序列中的顺式作用元件

图3 逆境相关元件在CsGR-RBP3 启动子上的分布
2.3 CsGR-RBP3 启动子活性分析
采用双荧光素酶报道基因实验,分析CsGRRBP3启动子是否具有启动基因转录的活性。 将CsGR-RBP3启动子亚克隆到pGreenⅡ0800 Reporter 载体上(图4A),与pGreenⅡ62-SK Effecter载体共转化烟草叶片。 与SK 对照(pGreenⅡ62-SK 空载与pGreenⅡ0800 空载共转化)相比,Cs-GR-RBP3启动子能增强LUC 活性,提高LUC/REN 比值(图4B),表明CsGR-RBP3启动子具有启动基因转录的活性。

图4 重组载体构建及CsGR-RBP3 启动子活性分析
2.4 低温处理对CsGR-RBP3 启动子活性的影响
为了进一步探究低温对CsGR-RBP3启动子活性的诱导作用,使用克隆到的启动子序列替换pBI121-GUS质粒的CaMV35S 组成型启动子,构建启动子超表达重组载体(图5A),用于驱动GUS基因的表达。
通过卡那霉素抗性筛选、菌落PCR 和双酶切的方法进行验证,确保启动子成功连接到pBI121-GUS 载体上。 重组质粒经双酶切,并进行琼脂糖凝胶电泳,出现了两条DNA 片段(图5B),大片段的长度超过10000 bp,推测为线性化质粒片段;小片段的长度为1541 bp,推测为启动子片段。表明CsGR-RBP3启动子已成功连接到pBI121-GUS 载体上,获得了启动子超表达重组质粒。
分别将pBI121-GUS 空载和重组质粒瞬时在烟草叶片中过表达,并用5℃低温处理烟草,通过检测GUS基因表达和活性变化,探究低温处理对CsGR-RBP3启动子活性的影响,结果(图5C)显示,不论是否低温处理,转化空载的烟草叶片中的GUS 活性和基因表达都很高;在23℃条件下,转化重组质粒的烟草叶片中GUS基因表达和活性都比较低,但在5℃低温处理48 h 后,GUS基因表达和活性都明显增强。 表明低温处理能增强Cs-GR-RBP3启动子活性。
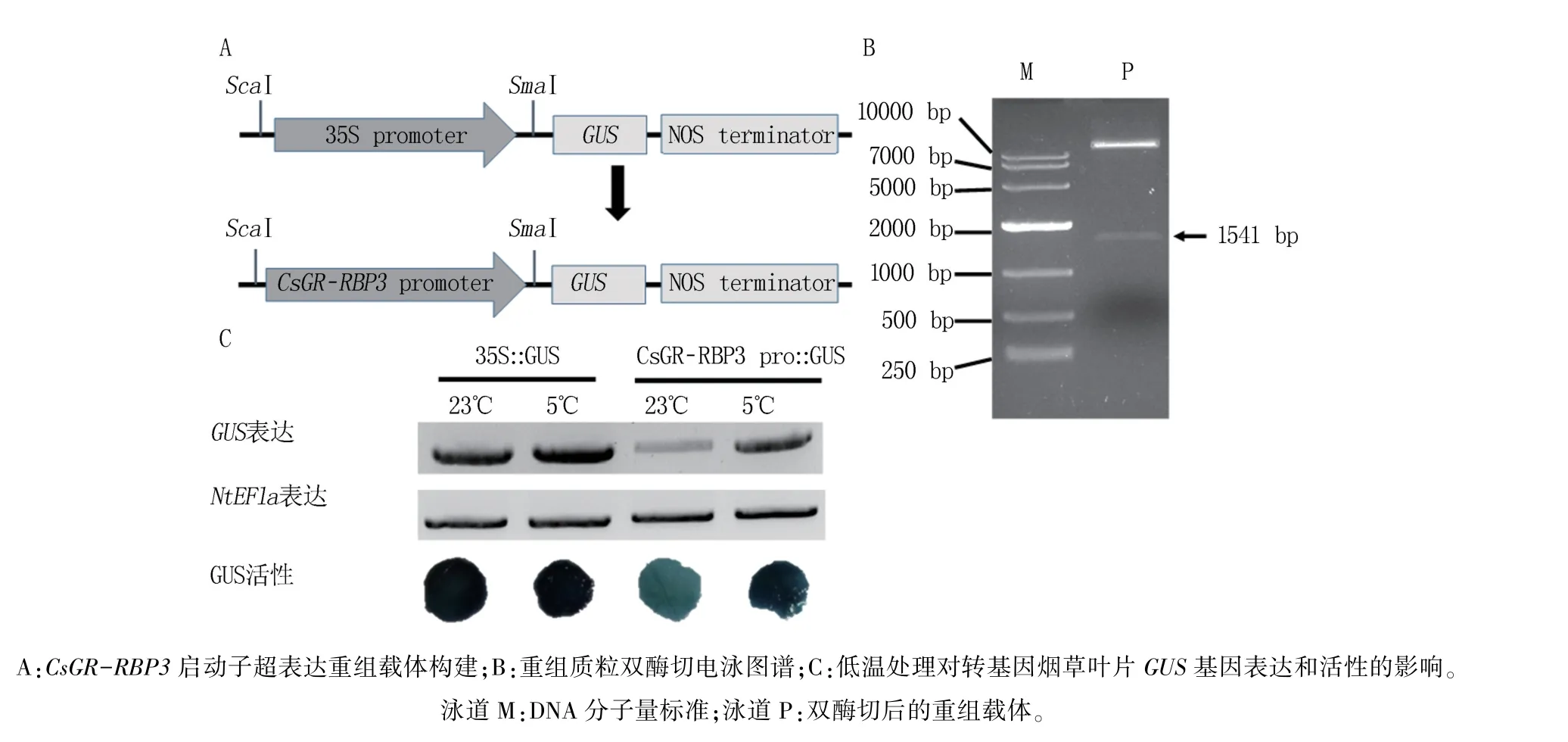
图5 CsGR-RBP3 启动子超表达重组载体构建及低温对转基因烟草叶片GUS 基因表达和活性的影响
将启动子重组质粒在拟南芥中过表达,进一步确认低温处理对CsGR-RBP3启动子活性的活化作用。 通过在MS 平板上抗性筛选,初步获得了6 株卡那霉素抗性苗;将这6 株转基因苗不断培养,并再次通过抗性筛选鉴定,直至收获T2 代种子;以T3 代拟南芥DNA 为模板,采用PCR 法鉴定获得的抗性苗是否为转基因植株。 结果(图6A)显示,6 株抗性苗中均能检测到GUS基因,表明重组质粒已整合到拟南芥基因组中,成功获得过表达CsGR-RBP3启动子的转基因拟南芥。
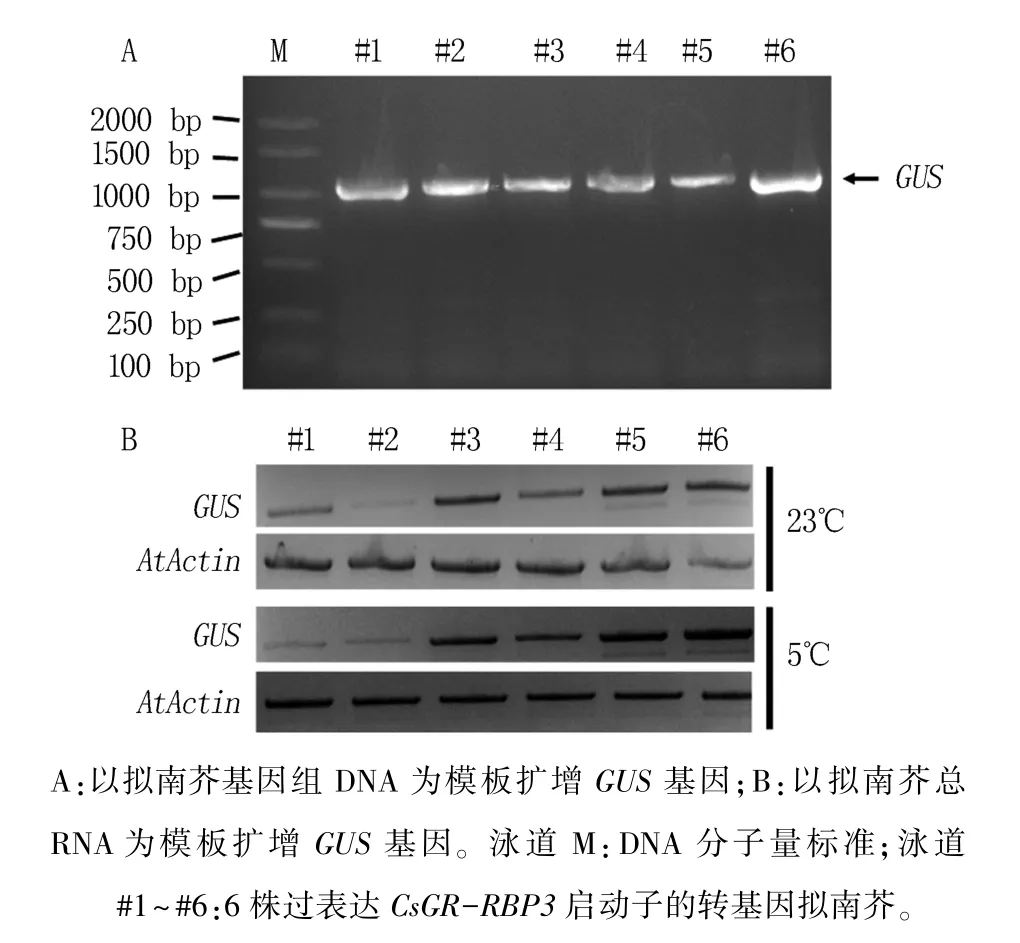
图6 过表达CsGR-RBP3 启动子的转基因拟南芥 鉴定及低温对GUS 基因表达的影响
在苗龄为22 d 时,同样使用5℃低温处理转基因苗,提取总RNA,检测GUS基因的表达情况,结果(图6B)显示,在23℃条件下,6 株转基因拟南芥中的GUS基因都有表达,除#2 转基因拟南芥中GUS表达量较低外,其他5 株的GUS表达量都较高,再次证明CsGR-RBP3启动子具有启动基因转录的活性。 5℃低温处理后,6 株转基因拟南芥中只有#1 中GUS基因的表达量没有明显增加,其他5 株转基因苗的GUS基因电泳条带灰度明显加深,表明低温处理能够增强CsGR-RBP3启动子活性。
3 讨论与结论
植物能感知低温胁迫信号并迅速作出反应,以降低低温胁迫对自身造成的伤害[18,19]。 诱导自身耐冷基因表达是植物应对低温胁迫的一种重要方式[20,21]。 低温胁迫处理显著诱导番茄(Solanum lycopersicum)HSP17.7的表达,SlHSP17.7 能与膜定位蛋白SlCCX1-like 相互作用,保持胞质内Ca2+稳态,过表达SlHSP17.7增加了细胞内蔗糖积累,减少了活性氧含量,从而增强了番茄抗冷性[22]。 水稻(Oryza sativa)RBGD3 是一个富甘氨酸RNA 结合蛋白,在耐旱水稻N22 品系中,低温、干旱和盐胁迫均对OsRBGD3表达展现出明显的诱导效应,组成型过表达OsRBGD3赋予了转基因拟南芥更强的耐冷性[23]。 本研究中,5℃低温处理明显上调了采后黄瓜的CsGR-RBP3表达,表明CsGR-RBP3是一个低温诱导型基因;在拟南芥中过表达CsGR-RBP3,提高了转基因拟南芥幼苗的抗冷性和抗冻性[15];采后黄瓜对低温十分敏感,在低于10℃的环境中贮藏即可发生冷害[24]。 这些研究表明,低温诱导CsGR-RBP3表达可能是采后黄瓜应对冷害胁迫的重要方式。
基因启动子区域含有的顺式作用元件决定了该基因的诱导表达模式[25]。 LTR 顺式作用元件普遍存在于干旱、高盐、低温胁迫应答基因的启动子中[26,27],其可能在植物应答非生物胁迫过程中起着重要作用。 拟南芥RD29A是一个逆境诱导基因,在其启动子区域中也鉴定到LTR 元件[28]。本研究中,我们克隆并分析了黄瓜GR-RBP3启动子区,发现CsGR-RBP3启动子区除具有真核生物典型的核心启动子元件TATA-box 和CAAT-box外,还含有响应低温的LTR 元件以及响应干旱和光照等其他环境条件的顺式作用元件,表明其不仅受低温胁迫诱导,可能还参与黄瓜对干旱胁迫的响应过程。 低温胁迫信号可能通过LTR 元件激活CsGR-RBP3启动子活性,进一步诱导该基因的转录。 然而,要确定LTR 元件对CsGR-RBP3表达的核心作用,还需要采用基因工程方法截短启动子或突变LTR 元件,以明确该元件对CsGRRBP3启动子活性的影响。
转录因子在调控靶基因表达过程中发挥重要作用,通过与靶基因启动子中的反式作用因子结合位点相结合,调控靶基因表达[29]。 在拟南芥中,绝大多数低温诱导基因COR(cold responsive gene)启动子中含有MYC 元件,CBF 直接通过与COR基因启动子中的MYC 元件结合,调控下游基因的表达[30]。 低温胁迫显著诱导水稻的Os-MYB38与OsRBGD3表达,酵母单杂交文库筛选结果显示,OsMYB38可能与OsRBGD3启动子结合,调控OsRBGD3表达[23]。 小桐子的JcDnaJ20是一个低温诱导基因,启动子中也含有MYB 和MYC 元件[27]。 植物DnaJ 蛋白是一类小分子热休克蛋白,通常作为分子伴侣行使生物学功能[31,32]。 与DnaJ 蛋白类似,GR-RBP 蛋白也具有分子伴侣功能,且他们有着相似的氨基酸结构,都含有锌指结构域和富含甘氨酸的结构域[4,33]。本研究从CsGR-RBP3启动子中鉴定到了多个MYB 和MYC 结合位点,表明MYB 和MYC 类转录因子可能调控CsGR-RBP3表达。 本课题组近期的研究结果证实,转录因子CsMYB62 能直接与CsGR-RBP3启动子中的MYB 元件结合,并激活其表达[34]。 是否其他转录因子也参与CsGRRBP3的表达调控,还需要采用分子生物学手段,如酵母单杂交、凝胶迁移实验、双荧光素酶报道基因实验等方法,进一步确认转录因子与CsGRRBP3启动子的结合。
逆境诱导型启动子对下游基因的表达调控具有明显的时空特异性,即只在逆境胁迫条件下才诱导其大量转录,避免过量表达浪费植物自身的物质与能量,影响其正常生长发育[35]。 拟南芥的AtCOR15a是一个典型的低温诱导基因,过表达该基因能显著增强拟南芥对低温的抗性,且启动子也具有低温诱导特性[36];AtSOC1是控制拟南芥开花的一个重要调节基因,将AtCOR15a启动子与AtSOC1基因全长融合,构建融合表达载体并转化菊花,可实现通过干旱胁迫控制菊花开花时间[37]。 表明AtCOR15a启动子具有响应逆境信号并激活下游基因表达的能力。 此外,将AtCOR15a启动子与GUS标记基因融合,重组载体转化马铃薯,结果发现低温处理明显增强马铃薯叶片GUS活性[38]。 许多拟南芥冷诱导基因(如CBF、LEA、COR、ERD等)的启动子也都表现出明显的低温诱导特性[39]。 本研究中,低温处理可诱导冷藏黄瓜的CsGR-RBP3表达,在烟草和拟南芥中转化该基因启动子驱动的GUS融合表达载体,能驱动GUS表达,且低温处理显著提高GUS 的基因表达量和活性,表明该启动子具有低温诱导活性,低温通过增强CsGR-RBP3启动子活性,诱导采后黄瓜的CsGR-RBP3表达。
总之,CsGR-RBP3是一个低温诱导型基因,其表达上调是采后黄瓜应对低温冷害的重要方式。CsGR-RBP3启动子中含有响应低温的LTR元件,并具有启动基因转录的活性。CsGR-RBP3启动子能驱动GUS表达,且低温处理明显提高GUS基因的表达量。 表明低温通过LTR 元件活化启动子活性,进一步激活CsGR-RBP3表达。本研究为理解CsGR-RBP3在冷藏黄瓜中的作用奠定了基础,同时为后续耐冷黄瓜新品种培育积累潜在基因资源。

