稀土元素铈对钢中非金属夹杂物改性和腐蚀影响的第一性原理研究
刘瀚泽,张 静✉,张 继,张立峰,盖彦峰
1) 燕山大学车辆与能源学院,秦皇岛 066004 2) 北京科技大学冶金与生态工程学院,北京 100083 3) 北方工业大学机械与材料工程学院,北京 100144 4) 燕山大学理学院,秦皇岛 066004
钢中非金属夹杂物是影响钢材寿命、质量、韧性、抗腐蚀性等参数的重要因素[1].在这些基础参数中,耐腐蚀性受到很多学者的关注.研究表明,腐蚀是由于钢中出现部分缺陷或者产生钝化膜,在钢材服役过程中,缺陷逐渐扩大从而导致了基体耐腐蚀性变差.钢中夹杂物是发生腐蚀,产生缺陷的主要来源[2].不同类型的夹杂物具有不同的性质,引起钢铁材料腐蚀的原因也不同.夹杂物的成分、尺寸、形状以及热性质等都与局部腐蚀有一定的关系[3].
点蚀是不锈钢发生局部腐蚀的一种主要形式,点蚀导致了不锈钢表面形成针状坑点且从表面向内扩展形成孔穴,这种腐蚀的危害性在于材料会在均匀腐蚀很不明显的情况下腐蚀穿孔.稀土元素作为冶金工业中重要的添加剂,对钢中S、O夹杂物改性具有十分显著的作用[4].Ghahari等[5]通过原位同步加速器X射线研究不锈钢点蚀,发现腐蚀坑的扩展与钢的微观结构有关,可能受到硫化物夹杂物影响.Liu等[6]研究Q460NH耐候钢在海洋环境出现腐蚀的初始阶段,通过掺入稀土元素对夹杂物产生影响,形成2种主要类型的夹杂物,(RE)2O2S-(RE)xSy,并且观察到两种不同形态的凹坑.与基体相比,(RE)2O2S-(RE)xSy具有低电势,通过溶解优先发生腐蚀,这表明夹杂物的腐蚀抗性比基体差.李亚波等[7]在研究不同含量的Ce对低硫铁素体不锈钢00Cr12的抗点蚀性能影响时发现,在低硫的情况下,铁素体不锈钢的点蚀性能与晶粒尺寸的相关性较强,稀土元素Ce的添加可细化晶粒,点蚀击穿电位下降.Cai与Li[8]研究表明,低镍奥氏体不锈钢中添加稀土元素Ce会形成含有CeAlO3和Ce2O2S的多相夹杂物,Ce在钢中加入,由于改性后的夹杂物和基体中电极电位提高,增加了耐蚀性,可以预防腐蚀.习小军等[9]通过添加稀土元素Ce,研究了Ce处理后的钢中夹杂物变化,通过改性钢中的MnS夹杂物,生成含Ce氧化物夹杂物、含Ce硫化物夹杂物及含Ce的氧硫复合夹杂物.对于稀土元素Ce而言,稀土不锈钢的耐点蚀性与添加的Ce含量息息相关,随着Ce含量的不断增加,稀土不锈钢的耐点蚀性能先提高再降低,稀土不锈钢的耐点蚀性总是优于未加入稀土的不锈钢[8,10-11].关于添加Ce元素的腐蚀实验研究很多,但从微观层面的机理研究相对较少.本文通过第一性原理计算方法,对比了不同夹杂物及夹杂物间不同晶面对功函数与本征电势差的影响,从微观角度探索了含有Ce元素的夹杂物诱导点蚀机理.
1 理论计算与实验方法
1.1 电子功函数
电子功函数[12]的定义为电子从固体材料内部向固体表面逃逸所需的最小能量,也称电子从费米能级逃逸到真空能级所需的最小功.研究表明,电子功函数与腐蚀电位密切相关,可作为研究腐蚀磨损机理的敏感参数[13].该参数很好的反映了材料本身的腐蚀倾向,可由式(1)计算.

式中,W表示电子功函数;EVac表示该材料的静电势能;EF表示材料内部费米能级.
为对比夹杂物与晶面的功函数,可通过计算本征电势差[14]进行分析,如式(2)所示.

式中,ΔU为钢基体与夹杂物的本征电势差,Wincl为夹杂物的电子功函数,WFe为bcc-Fe(100)面的电子功函数,e为电子电荷.功函数低于钢基体的夹杂物作为阳极首先溶解,易诱导点蚀的产生.当夹杂物比钢基体功函数过高时,夹杂物充当阴极被保护,钢基体倾向于优先腐蚀从而产生夹杂物的掉落.
1.2 计算参数
本研究基于密度泛函理论(DFT)的从头算量子力学程序包VASP[15-16]进行计算,采用周期性边界条件,并采用平面缀加波(PAW)[17]赝势描述离子与价电子之间的相互作用,电子交换关联能采用Perdew-Burke-Ernzerhof (PBE)的广义梯度近似(GGA)方法.采用Gaussian Smearing方法决定电子占据,Smearing的宽度为0.1 eV.几何优化采用BFGS算法,并自洽求解Kohn-Sham方程,电子自洽收敛标准为1×10-5eV,原子弛豫收敛标准采用力的收敛标准为0.01 eV,采用共轭梯度算法优化原子的位置.在倒易空间中,对平面波截断能和K点网格数进行收敛性测试,对硫化物与氧化物的计算,设置平面波截断能分别为250和600 eV.
势差理论被广泛应用于解释电化学局部腐蚀机理,通常认为,钢基体与周围的夹杂物之间的电流耦合导致了基体或者夹杂物的选择性溶解.这一理论可以很好的用于解释硫化物、氧化物等具有导电性夹杂物的腐蚀倾向[12,18].本文研究了稀土元素Ce处理不锈钢后的抗腐蚀机理,Ce处理前,钢中含有的MnS及氧化物夹杂物,这些夹杂物一定程度上影响着钢的腐蚀性能;经过Ce处理后,大量MnS及氧化物夹杂物被改性成CeS、Ce2O3和Ce2O2S[10,19-20],钢中存在部分Al元素还会出现CeAlO3.对比这几种夹杂物对腐蚀性能影响,主要通过考虑夹杂物的(100)、(110)、(111) 3个不同的低指数面来分析.选择低指数面的原因在于材料的低指数面通常具有较低的表面能,而具有较低表面能的晶面稳定性较高,有更大存在的可能性,更有可能暴露在外,与钢基体发生接触.
表1为计算所需钢基体与夹杂物的晶体结构参数,钢基体与5种所研究的夹杂物(MnS、CeS、Ce2O3、Ce2O2S、CeAlO3) 的结构示意图如图1所示.
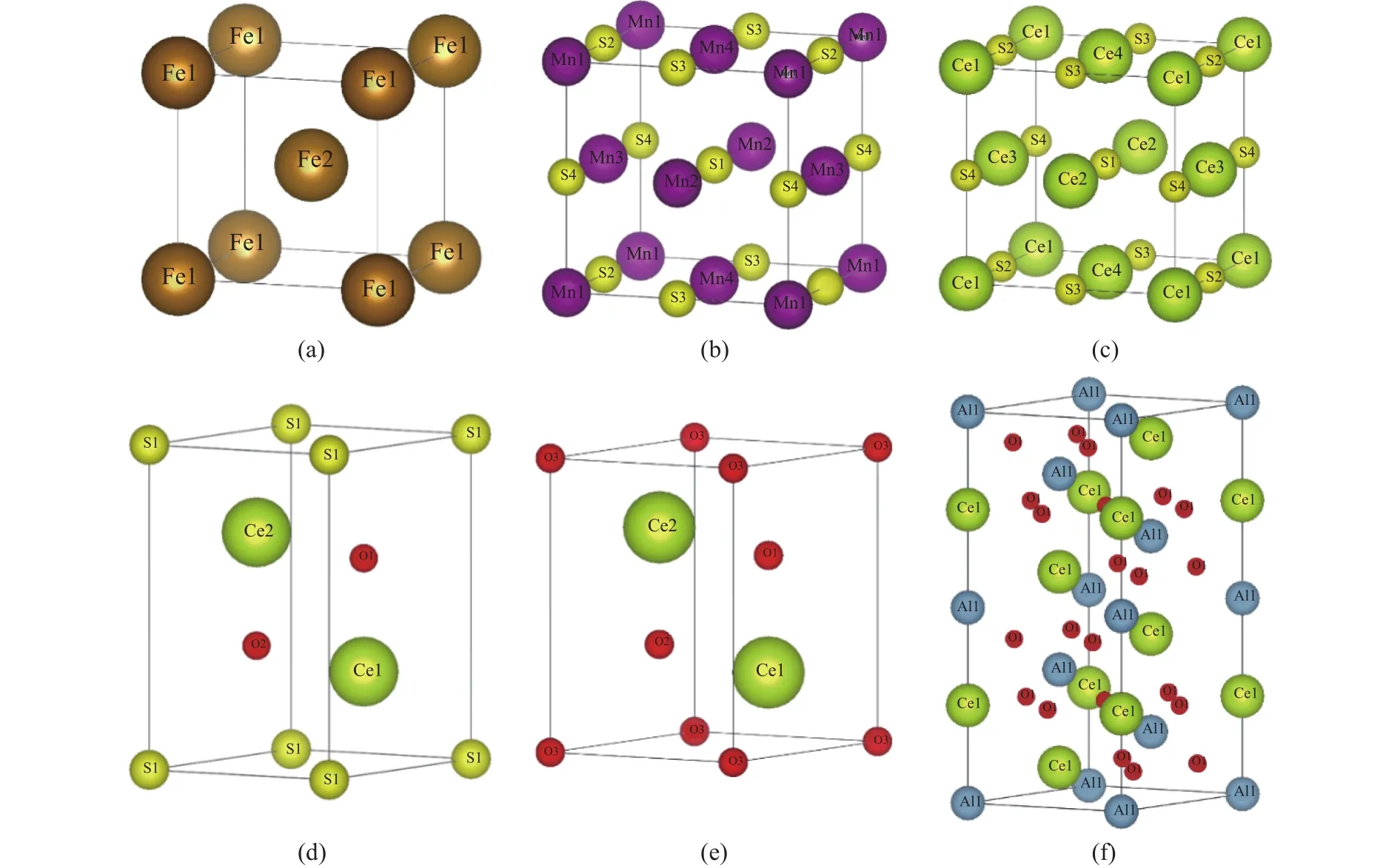
图1 晶体结构.(a) bcc-Fe;(b) MnS;(c) CeS;(d) Ce2O3;(e) Ce2O2S;(f)CeAlO3Fig.1 Crystal structures: (a) bcc-Fe; (b) MnS; (c) CeS; (d) Ce2O3; (e) Ce2O2S; (f) CeAlO3
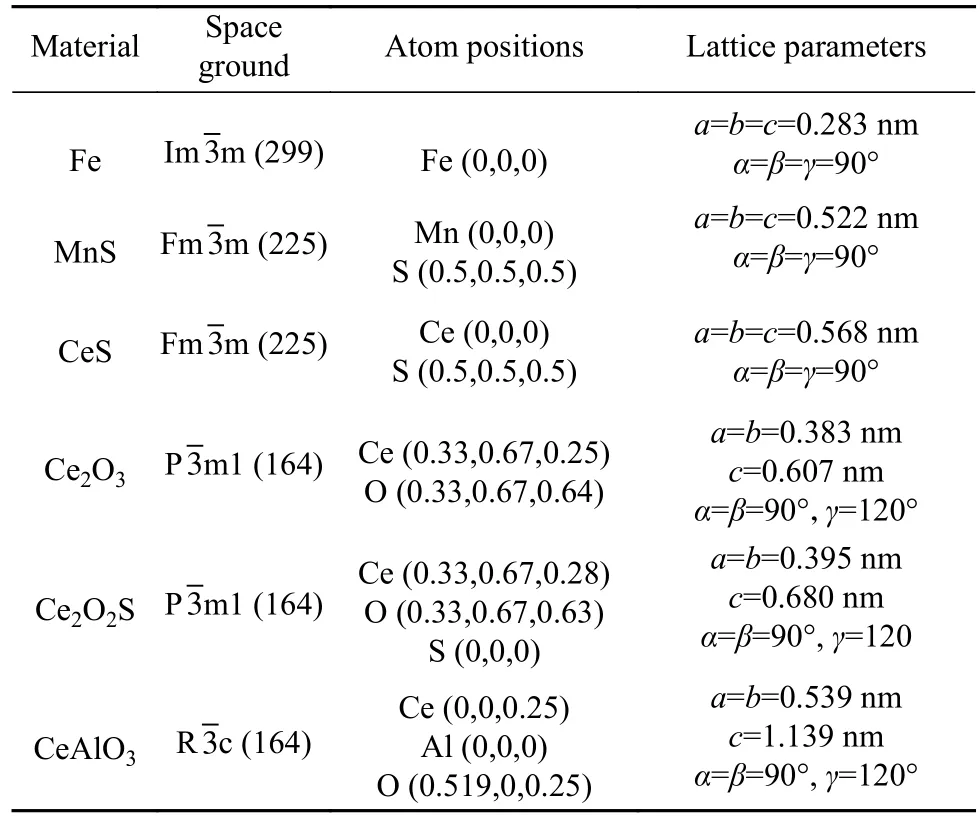
表 1 Fe与夹杂物晶体结构参数Table 1 Inclusion crystal structure parameters
1.3 实验方法
本研究中钢为J5不锈钢,化学成分如表2所示.大约700 g钢样品在直径为52 mm、深度为120 mm的MgO坩埚中使用装有MoSi2的电阻炉熔化.在纯氩气下以2 L·min-1的流速加热.在钢水中加入一定量的CeFe合金,并在炉冷前保持30 min.不锈钢中的Ce含量为430×10-6.将10 mm×10 mm×10 mm的试样于自动磨样机研磨,用0.5 μm金刚石膏抛光,然后用去离子水冲洗在酒精中脱脂,并立即干燥.

表 2 J5不锈钢化学成分(质量分数)Table 2 Chemical composition of J5 stainless steel %
2 结果与讨论
2.1 夹杂物分析
本文以J5不锈钢为研究对象,通过稀土元素Ce改性钢中夹杂物从而探究含Ce夹杂物对腐蚀性能的影响.不锈钢中MnS的存在将影响钢的耐腐蚀性能,通过扫描电镜分析,发现不锈钢中含有的典型MnS夹杂物,如图2所示.稀土元素有很强的化学活性,很容易与钢中的O、S元素发生反应.如图3和图4所示,向不锈钢中添加稀土元素Ce后,分别得到了CeAlO3-Ce2O2S与Ce2O3-Ce2O2S 2种典型的复合夹杂物.由于氧的相对原子质量较轻,复合夹杂物中氧的质量分数较低,扫描电镜图中氧含量不明显.图中添加了夹杂物的元素分析,在元素中检测到O的含量,因此两种复合夹杂物的类型为CeAlO3-Ce2O2S与Ce2O3-Ce2O2S.

图2 MnS夹杂物的形貌及元素分布Fig.2 Morphology and element distribution of the MnS inclusions

图3 CeAlO3-Ce2O2S夹杂物的形貌及元素分布Fig.3 Morphology and element distribution of the CeAlO3-Ce2O2S inclusions

图4 Ce2O3-Ce2O2S夹杂物的形貌及元素分布Fig.4 Morphology and element distribution of the Ce2O3-Ce2O2S inclusions
形成能是化合物生成能力的反映,可用于评价夹杂物的形成难易程度,对图1中的晶体结构模型优化,分别计算了稀土元素Ce可能改性出夹杂物的形成能.形成能可由式(3)计算[21]:
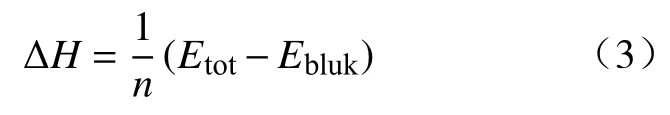
式中,ΔH为形成能,Etot为整个晶胞的能量,Ebulk为基态晶体的原子总能量,n为原子数量.当形成能为负时,表示晶体可以稳定存在;形成能越小,晶体结构越稳定.
计算结果如表3所示.Ce2O3(-3.33192 eV·atom-1)的形成能低于 Ce3S4(-2.41476 eV·atom-1)、Ce2S3(-2.43052 eV·atom-1), 或 CeS (-2.38639 eV·atom-1).也就是说Ce2O3比Ce3S4、Ce2S3或CeS更容易形成,Ce2O3更稳定.在所研究的系统中,Ce2O2S(-3.20334 eV·atom-1) 和 CeAlO3(-3.22015 eV·atom-1)的形成能同样相对较小,因此容易形成.Liu等[22]对洁净钢中的稀土夹杂物研究,通过热力学计算确定了在测试钢中稳定的含Ce夹杂物,本文计算与其结果一致.从形成能来看,含Ce夹杂物中Ce2O3、CeAlO3和Ce2O2S相对来说比较稳定,计算结果与Ce元素改性不锈钢后的夹杂物生成互相符合,为接下来的计算提供了依据.
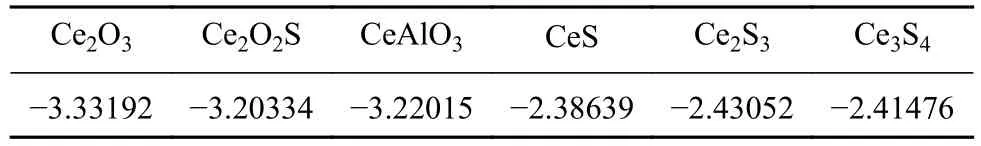
表 3 含Ce夹杂物的形成能Table 3 Formation energy of inclusions eV·atom-1
2.2 钢基体的功函数计算
Fe单质可以分为 α-Fe、γ-Fe和 δ-Fe 3种相结构,Fe单质在1185 K以下具有体心立方 (bcc) 晶格结构,称之为α-Fe;当温度处于1185~1667 K区间,Fe具有面心立方 (fcc) 晶格结构,称之为γ-Fe;温度继续升高,液态Fe又具有bcc晶格结构,称之为δ-Fe.我们选择计算了bcc-Fe 3个低指数面的电子功函数与表面能,并分别对不同厚度的表面进行能量收敛性测试.如Fe (100)-2 面厚度为3、5、7、9、11分别对应表面能为 2.225、2.363、2.391、2.437、2.425 和 2.430 J·m-2经测试后此面表面能为2.4374 J·m-2,其余测试结果如表 4 所示.
对比可知,Fe (100) 面的第二终止面的表面能最低,说明夹杂物的低指数面暴露后,与Fe (100)晶面的第二终止面的接触几率最大,所以设此面的电子功函数为基准,讨论的腐蚀机理与现实情况最为符合.通过对比文献中实验以及其他文献中DFT计算测得Fe (100) 晶面的表面能与电子功函数,本文所计算的数据与其大体相吻合.
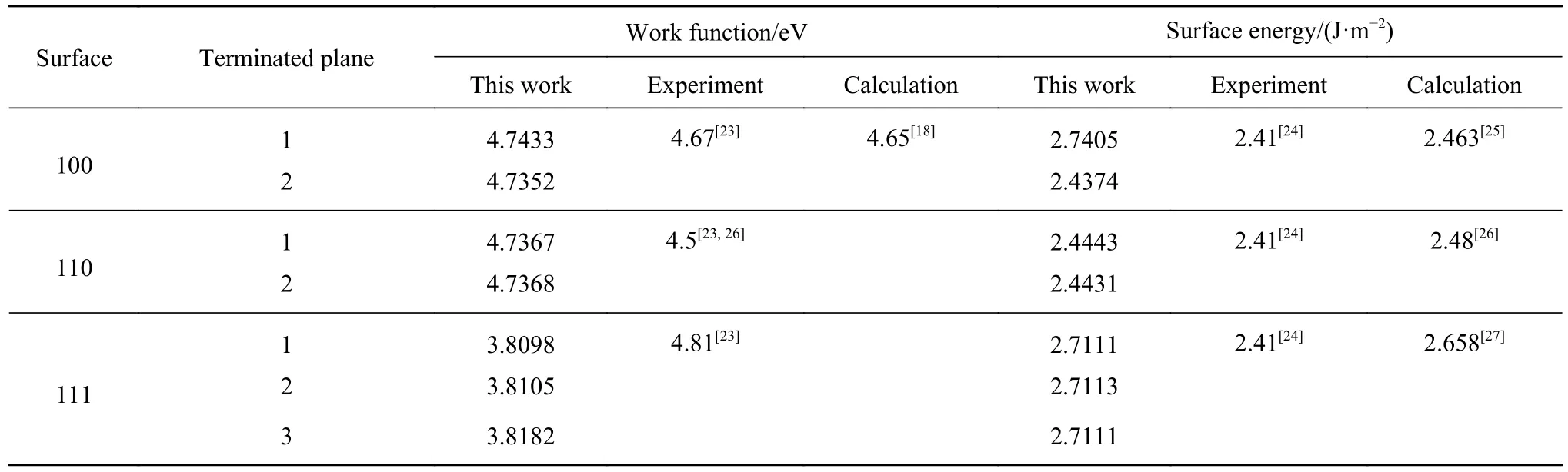
表 4 Fe不同终止面的电子功函数与表面能Table 4 Electronic work function and surface energy of different termination surfaces of Fe matrix
图5为计算Fe (100) -2slab模型的静电势曲线,0 eV对应的黑线为费米能级 (Ef),另一条为真空静电能 (EVac),二者之间的差异为电子功函数 (W).图像上下对应,在切面 (100) 晶面后添加2 nm的真空层,下图slab模型由左到右在c方向对应上图.在1.5 nm左右的位置,也就是真空层隔开的位置,功函数为4.7352 eV,以下计算功函数的方法以此类推.
2.3 夹杂物的功函数分析
将3种晶体结构进行切面,生成不同的slab模型如图6~8所示.图6所示为MnS和CeS的(100)、(110)、(111)晶面slab模型,因为2种夹杂物都为立方结构,在(100)面与(110)面分别有2种截取方法,在(111)面有6种截取方法.通过不同模型对比数据可得出,在同一晶面不同截取位置的终止面原子排列不同,所截面功函数不同;不同晶面的原子位置以及结构的较大差异,也会导致表面的功函数有所差异.

图6 MnS和CeS的slab模型Fig.6 Slab model of MnS and CeS
表5为MnS不同终止面的电子功函数,3个低指数面的功函数范围在3.36~5.82 eV.(100)与(110)晶面的功函数在4.13左右,不同终止面(暴露在最外层的原子)计算数据相差不大,而在(111)晶面中随着终止面的不同数据变化较大.在功函数较低的1、3、5终止面的slab模型均为Mn原子所在面,而在功函数较高的2、4、6均为S原子所在面,S封锁电子的能力比Mn更强,这也与S为非金属元素的规律相符合.

表 5 MnS不同终止面的电子功函数Table 5 Electronic work function of different termination surfaces of MnS
相较钢基体而言,MnS平均功函数较低.图9为不同晶面计算出的不同终止面(Top)与本征电势差的关系.(100)与(110)面本征电势差均为-0.6 eV左右,这两晶面暴露于钢基体会作为负极优先腐蚀从而保护MnS夹杂物附近的钢基体,但夹杂物的溶解也是钢中的危害来源.随暴露在电化学环境中时间变化,点蚀将从MnS的溶解开始,而后随着金属阳离子的水解和O2的溶入,介质溶液中pH值降低,溶解的夹杂物形成腐蚀坑,影响夹杂物附近的钢基体进一步腐蚀.在(111)面出现了部分电势差为1.0859 eV的情况,此类终止面暴露会导致钢基体优先腐蚀,虽会保护夹杂物,但随MnS附近基体腐蚀后会导致MnS夹杂物的掉落,形成腐蚀坑.两种腐蚀坑的形成均可称为点蚀,(111)面较其余两面电势差绝对值更大,诱导点蚀发生的趋势更强.MnS夹杂物具有很强的腐蚀倾向,这也符合之前的计算结果[28-29].

图9 MnS夹杂物与钢基体间的电势差Fig.9 Potential difference between MnS inclusions and steel matrix

图7 Ce2O3的 slab 模型Fig.7 Slab model of Ce2O3

图8 Ce2O2S的slab模型Fig.8 Slab model of Ce2O2S
表6为CeS不同终止面的电子功函数.由表可知,CeS不同晶面的电子功函数波动较大,范围为2.32~5.34 eV.在(100)面和(110)面上不同终止面的功函数差异不大,但是在(111)面上随着终止面改变功函数呈现了周期性变化.与Fe(100)的电子功函数4.74 eV作比较,各个晶面的腐蚀情况有所不同.
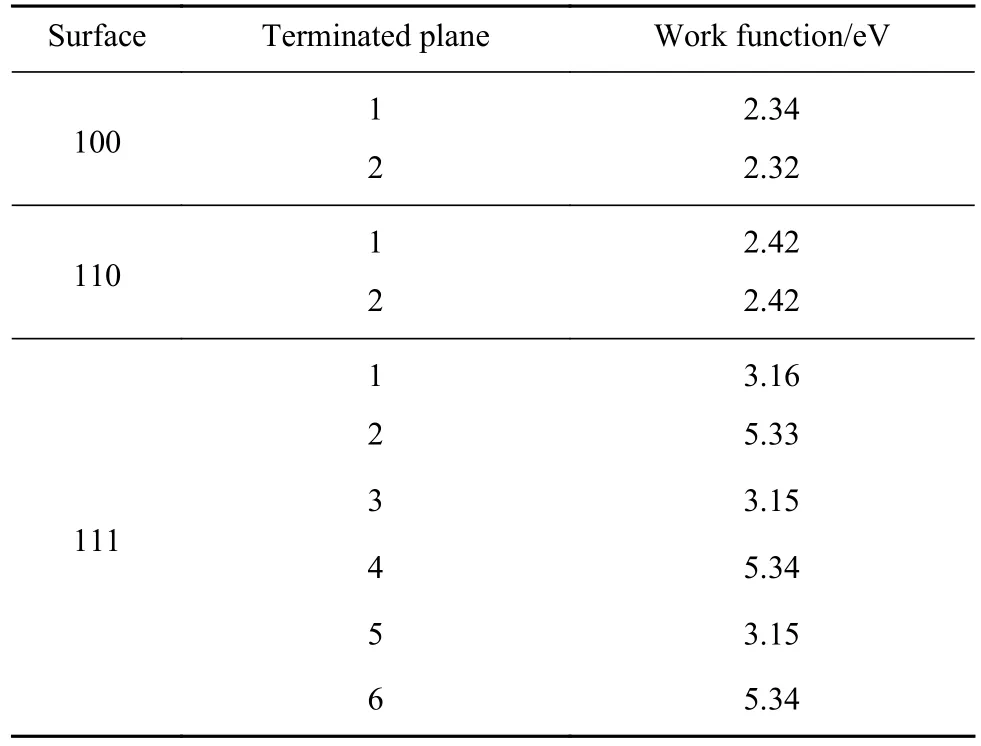
表 6 CeS不同终止面的电子功函数Table 6 Electronic work function of different termination surfaces of CeS
图10为CeS夹杂物与钢基体间的本征电势差,3个低指数面的电势差为-2.4117~0.6024 eV.其中CeS的(111)面中2、4、6终止面的电子功函数高于Fe (100)面,功函数为5.34eV,此类终止面暴露在电化学环境中,功函数低的钢基体会优先腐蚀,CeS被保护.腐蚀将从CeS周围的钢基体开始,随着钢基体的腐蚀,CeS从腐蚀坑中陷落.而CeS的(111)面中1、3、5终止面电子功函数为3.15 eV,均小于Fe(100)面,本征电势差为-1.58 eV;CeS的(100)面与(110)面的电子功函数最大值分别为2.34和2.42 eV,本征电势差均为负,当这些面暴露在腐蚀环境中,将被优先腐蚀.根据电势差而言,相较MnS的诱导腐蚀趋势,CeS并不能提高钢的抗腐蚀性能,反而有所降低.
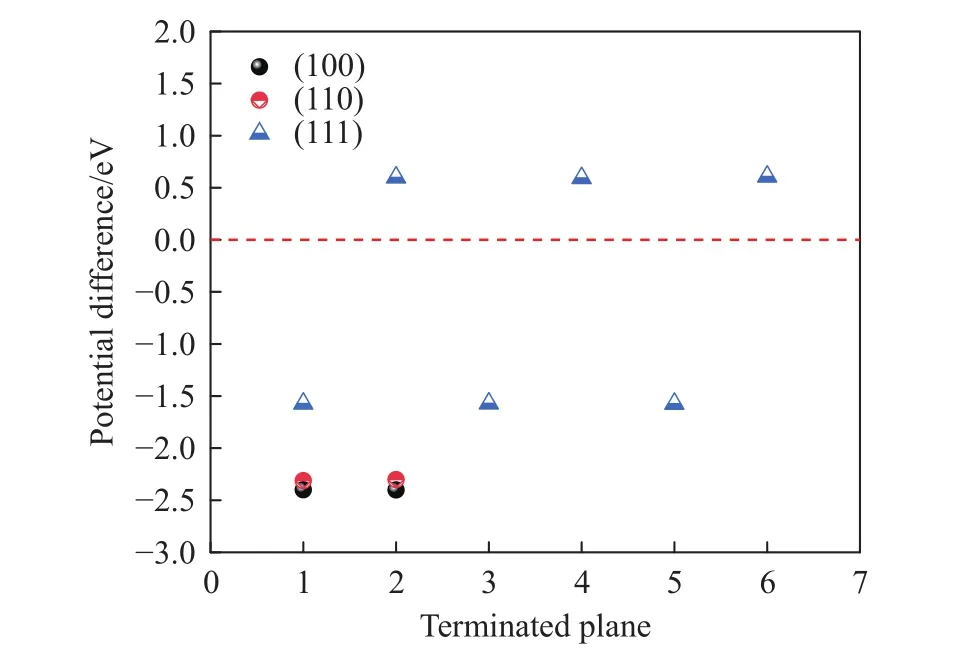
图10 CeS夹杂物与钢基体间的电势差Fig.10 Potential difference between CeS inclusions and steel matrix
表7为Ce2O3的各晶面的电子功函数,3个低指数晶面功函数范围为1.85~4.74 eV.根据所切(100)面分6个终止面,但无论所切面为Ce原子与O原子,功函数范围波动不大,为2.05~3.08 eV,(110)面分2个终止面,功函数均为1.85 eV左右.在切(111)晶面时,出现了上下不对称的slab表面,需要计算过程中添加参数消除偶极矩影响.
常见夹杂物的低指数晶面如(100)、(110)晶面存在较好的周期性,建立的slab模型顶端与低端的表面对称.经过收敛性测试确定,放开不低于两层原子来模拟表面,其余原子固定.在建立(111)晶面时,出现了上下非对称表面的slab模型,分为上表面与下表面考虑.在添加2 nm真空层后,同时开放最上端与最下端的两层原子,共开放4层原子模拟表相,剩余原子层固定.
图11为Ce2O3夹杂物与钢基体间的电势差,由图表可知,Ce2O3夹杂物与钢基体电势差均小于0.在(100)面的6个终止面的本征电势差在-2.68~-1.68 eV,随着所切表面原子的不同,数值有所变化.在(111)面的10个终止面上更加清晰的体现出Ce与O原子分别暴露表面的功函数不同,而随着终止面的位置递增,表面原子的位置有所改变,这些都会影响功函数的变化.第1终止面上端为O原子功函数为2.49 eV,下端为Ce原子功函数为2.12 eV;第2终止面上端为Ce原子功函数为2.42 eV,下端为O原子功函数为4.72 eV;第3终止面上端为O原子功函数为2.74 eV,下端为O原子功函数为2.58 eV.前2个终止面表现出了O原子相对于Ce原子有较强的束缚电子的能力,而第3终止面则表现出相同原子所在不同位置功函数也会有所差异.此晶面的其他终止面也可以体现出此规律,Ce2O3与钢基体电势差均小于零,在腐蚀过程中Ce2O3优先腐蚀保护钢基体,但对比CeS与MnS平均功函数而言,更倾向于诱导点蚀的产生.
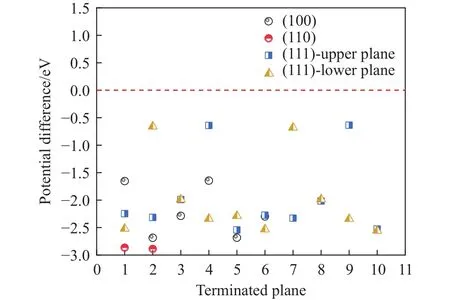
图11 Ce2O3夹杂物与钢基体间的电势差Fig.11 Potential difference between Ce2O3 inclusions and steel matrix

表 7 Ce2O3不同终止面的电子功函数Table 7 Electronic work function of different termination surfaces of Ce2O3
表8为Ce2O2S的各晶面的电子功函数,3个低指数晶面功函数范围为2.00~4.72 eV,所切晶面大体与Ce2O3夹杂物相同,在(100)面切出的6个终止面呈现出上述规律性更加明显,在(111)面切了7个终止面相对较少.在(100)面中,第1终止面为S原子功函数为4.52 eV;第2终止面为Ce和O原子功函数为2.11 eV;第3终止面为O和Ce原子功函数为2.52 eV;对束缚电子的能力S原子最强,而2、3终止面上Ce、O原子位置的不同也导致功函数有些许差别,且2种原子在同一表面并未体现出较强的束缚电子的能力.

表 8 Ce2O2S不同终止面的电子功函数Table 8 Electronic work function of different termination surfaces of Ce2O2S
图12为Ce2O2S夹杂物与钢基体间的电势差,在(111)面的第2、7终止面的下端面出现了电势差接近0的情况,这两个终止面均为上端Ce原子功函数较小,下端O原子功函数较大情况;第1终止面上端为S原子功函数为3.44 eV,下端为Ce与O原子功函数为2.00 eV,单独的O原子与S原子均有较强束缚电子的能力,而加入Ce原子后一定程度上可以降低O原子束缚能力.MnS和Ce2O2S的功函数范围分别为3.38~5.82 eV和2.00~4.72 eV.在部分(100)与(111)面中,Ce2O2S具有比MnS 更高的功函数值,与钢基体的电势差更接近于0.表明Ce改性MnS后在一定程度上提高了耐蚀性,与MnS相似,对于大多数表面取向,Ce2O2S的功函数低于基体.
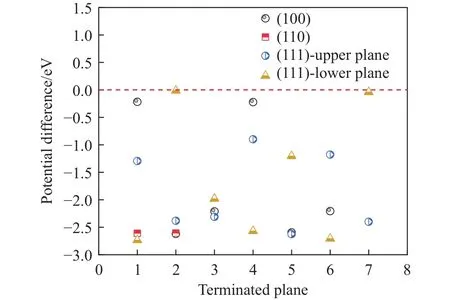
图12 Ce2O2S夹杂物与钢基体间的电势差Fig.12 Potential difference between Ce2O2S inclusions and steel matrix
表9为CeAlO3不同终止面的电子功函数,CeAlO3的3个低指数晶面功函数为1.28~6.50 eV.其中Al终止面功函数普遍在4~5 eV,O终止面功函数为6.5 eV.其余终止面均为Ce原子和O原子的组成面,随着两种原子位置、数量不同体现出的功函数也不同.
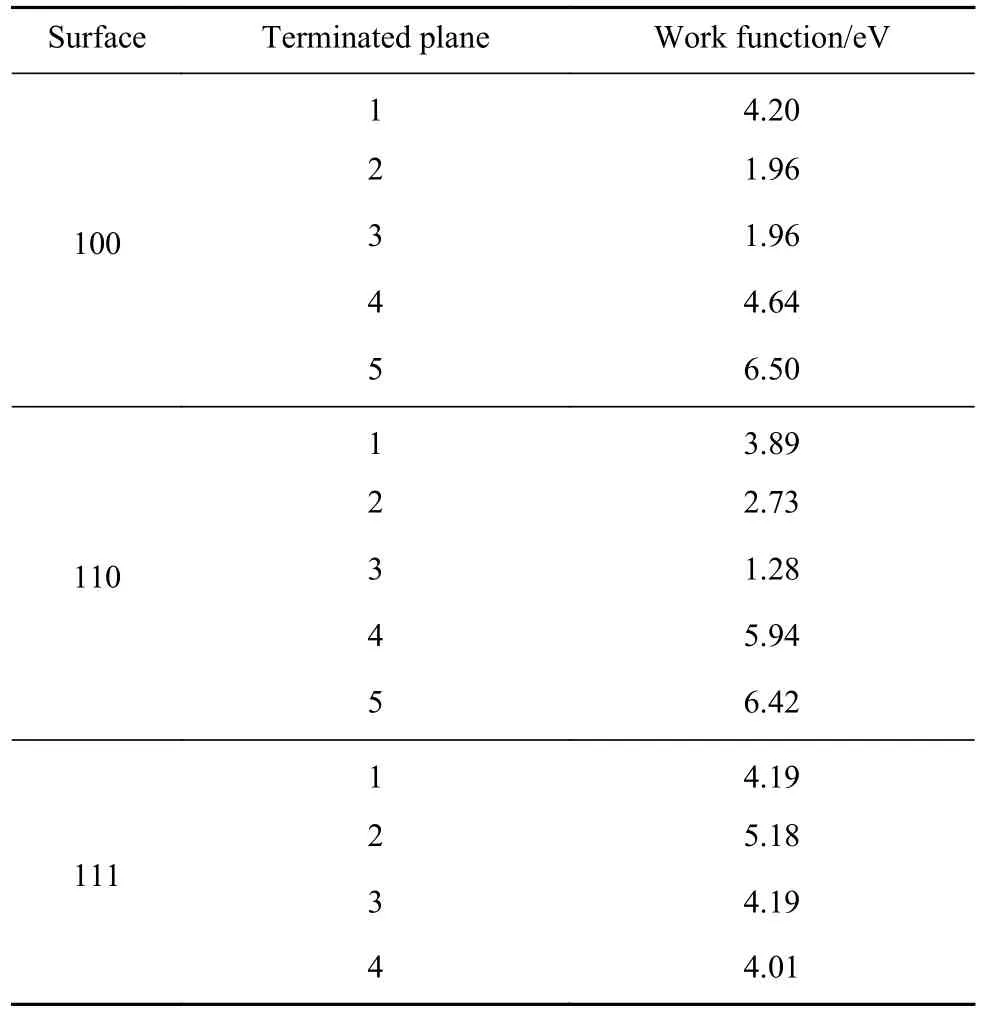
表 9 CeAlO3不同终止面的电子功函数Table 9 Electronic work function of different termination surfaces of Ce2O3
图13为CeAlO3夹杂物与钢基体间的电势差,在(100)与(110)晶面中Al终止面与Ce、O组成终止面与钢基体间电势差均小于0,为-3.4568~-0.0926 eV.(111)晶面的电势差为-0.5471~0.44 eV,电势差在0 eV左右.相比MnS,CeAlO3诱导点蚀的可能性大幅度降低,在Ce改性的夹杂物中明显提高了原始钢中的抗腐蚀性能.

图13 CeAlO3夹杂物与钢基体间的电势差Fig.13 Potential difference between CeAlO3 inclusions and steel matrix
2.4 浸泡实验分析
本文通过浸泡实验原位观察,分析了室温下含Ce不锈钢在质量分数为0.16%HCl+6%FeCl3腐蚀溶液中的耐腐蚀性能.使用去离子水和分析级化学品制备溶液,在溶液中浸泡样品不同时间(0、1和5 min),浸泡后,将样品在乙醇中超声冲洗,然后用热空气流干燥,采用扫描电镜观察分析夹杂物的形貌变化.如图14所示,其中图14(a)、14(b)、14(c)为MnS夹杂物的腐蚀形貌变化.随着浸泡时间增加,明显发现点蚀发生在MnS与钢基体的交界处,并逐渐向内部延伸.在图14(b)中,腐蚀1 min后MnS内存在部分腐蚀情况,到5 min后,MnS已完全被腐蚀形成腐蚀坑.此过程中,MnS与钢基体存在于酸性溶液,MnS功函数低于钢基体,容易作为电偶腐蚀中的负极优先腐蚀形成坑洞,与上述计算结果一致.在图14(d)、14(e)和14(f)中,为典型的CeAlO3-Ce2O2S腐蚀过程,可以看到相对于MnS而言腐蚀并不剧烈.根据元素分析中Al含量多于S含量,可以看出CeAlO3的存在能够有效保护钢基体,降低发生点蚀概率.根据计算结果,CeAlO3的功函数与钢基体相近,较其他夹杂物而言,最不易与钢基体发生电偶腐蚀.在图14(g)、14(h)和14(i)中,为Ce2O3-Ce2O2S的腐蚀过程.根据形貌变化,在图14(h)腐蚀1 min中后Ce2O3、Ce2O2S与钢基体的交界处均存在点蚀源头,但Ce2O3的腐蚀进程明显剧烈,已经出现大面积的腐蚀坑.Ce2O2S只发生细微的腐蚀,在与钢基体交界存在小面积的腐蚀坑.图14(i)腐蚀5 min中后,Ce2O3基本完全腐蚀,Ce2O2S与钢基体间的腐蚀坑变大,但未完全腐蚀.分析得知,Ce2O3较Ce2O2S更易诱导点蚀的发生,二者都能与钢基体发生电偶腐蚀,都能够作为负极优先溶解于钢基体,与功函数计算中的Fe>Ce2O2S>Ce2O3结果十分吻合.

图14 钢中典型夹杂物在0、1和5 min浸泡后的形貌图Fig.14 Morphologies of typical inclusion in the Ce-bearing steel after 0, 1, and 5 min immersion
在实验的基础上,本文也总结了一些前人的实验结果.根据Liu等[6]的研究,通过原位腐蚀实验观察了Q460NH耐候钢中(RE)xSy和(RE)2O2S 2种夹杂物诱发的凹坑的萌生和扩展过程.对于(RE)2O2S-(RE)xSy夹杂物,在夹杂物溶解过程中会产生点蚀.随着时间的增加,夹杂物完全溶解然后在钢表面形成稳定的凹坑.对于(RE)AlO3-(RE)2O2S-(RE)xSy夹杂物,由于夹杂物中(RE)2O2S-(RE)xSy区域的溶解,点蚀在夹杂物中心开始出现.(RE)2O2S-(RE)xSy区域完全溶解后,(RE)AlO3区域和周围的基质开始溶解.最后,夹杂物完全溶解,形成稳定的凹坑.本文计算结果与文献中的实验结果相符.当含有稀土Ce元素的夹杂物与钢基体同时暴露于酸性腐蚀溶液下,Ce2O2S、CeS和Ce2O3作为负极先于钢基体溶解,CeAlO3平均功函数虽然大于钢基体,但差距不明显,在稀土氧、硫化物溶解后,随着浸泡时间增加,CeAlO3与钢基体也会发生溶解.相对来说,CeAlO3与钢基体间存在电偶腐蚀的可能性最小.Zhang等[30]的研究中,观察了低合金钢中腐蚀过程,发现了腐蚀是由于(Al,RE)-氧硫化物的溶解而引发的.由本文计算的CeAlO3电势差可知,CeAlO3在(111)晶面上与钢基体的电势差最接近0,但在(100)与(110)两个低指数面的 2、3、5终止面上,依旧存在电势差在-2~-4 eV以及1~2 eV的情况,这就说明CeAlO3可以作为腐蚀的源头,与钢基体形成正负极关系溶解.但CeAlO3夹杂物相对其他含Ce夹杂物而言,诱导腐蚀可能性较小,可以提高钢的耐腐蚀性.Wang等[31]在13Cr4Ni马氏体不锈钢,发现了(La、Ce、Cr、Fe)-O型氧化物,是腐蚀发生的源头.本文计算的结果表明,Ce2O3平均功函数最小,3个低指数面与钢基体间的电势差均为负值,且大部分都在-1.5~-3.0 eV,是最易诱导点蚀形成的含Ce夹杂物.验证了本文的计算结果.
综上所述,通过添加Ce改性钢中夹杂物时,钢中S元素与活泼的Ce元素生成了CeS和Ce2O2S夹杂物,占据了S含量,从而减少了凝固过程中MnS的生成;而部分氧化物夹杂物改性成了Ce2O3、Ce2O2S和CeAlO3夹杂物.对比夹杂物的功函数范围,MnS 为3.38~5.82 eV,CeS 为2.32~5.34 eV,Ce2O3为1.85~4.09 eV,Ce2O2S 为2.00~4.72 eV,CeAlO3为1.96~6.50 eV.5种夹杂物以及钢基体的平均功函数大小顺序为CeAlO3>Fe>MnS>CeS>Ce2O2S>Ce2O3,当这几种夹杂物与钢基体暴露于电化学腐蚀中,Ce2O3诱导发生的点蚀概率最高,而CeAlO3可以有效的提高钢的耐腐蚀性能.
3 结论
(1) 根据形成能的计算,不锈钢中MnS与各种氧化物夹杂物经过稀土元素Ce处理后,生成稳定的 Ce2O3、Ce2O2S、CeAlO3夹杂物.
(2) 与Fe (100)-2面的电子功函数4.7352 eV相比,MnS以及改性后3种夹杂物CeS、Ce2O3和Ce2O2S电势差大多小于0,CeAlO3的电势差在0 eV左右.
(3) 5种夹杂物以及钢基体的平均功函数大小顺序为 CeAlO3>Fe>MnS>CeS>Ce2O2S>Ce2O3,当这几种夹杂物与钢基体暴露于电化学腐蚀中,Ce2O3诱导发生的点蚀概率最高,CeAlO3可以有效的提高钢的耐腐蚀能.

