花青素生物合成途径及关键酶研究进展
刘淑华,臧丹丹,孙燕,3,李金霞,赵恒田
(1.中国科学院 东北地理与农业生态研究所 黑土区农业生态重点实验室,黑龙江 哈尔滨 150081;2.中国科学院大学,北京 100049;3东北农业大学 园艺园林学院,黑龙江 哈尔滨 150038)
0 引 言
花青素(Anthocyanins)为黄酮类多酚化合物,广泛分布于植物的果实、叶片、花瓣和种子中,是重要的植物次生代谢产物。花青素最早于1947年发现,截止目前,已陆续在蓝靛果、黑枸杞、茶叶等7 000多种植物中发现了700余种不同种类的花青素[1]。花青素是果实成熟的标志,因为大多数水果只在其成熟阶段积累该化合物,对果实的品质有重要影响[2]。花青素是水溶性物质,其颜色随着酸碱度的变化而产生差异。花青素使植物花和果实呈现出多种多样的色彩,不仅提高了植物的观赏性,还可促进昆虫授粉和种子传播,对于植物的繁殖具有非常重要的意义。除此之外,花青素还能够增强植物的抗性,提高植物抵抗病毒、细菌等生物胁迫,吸收过量可见光和紫外线照射,清除非生物胁迫下过量的活性氧[3]。对于人类而言,花青素具有丰富的功能活性。研究发现,花青素作为天然抗氧化剂,可以有效清除自由基,在抗氧化、抗衰老方面效果显著,同时,对于抗炎症、预防肥胖、预防慢性代谢性疾病、保护心血管及改善视力等也有良好的功效[4]。这些生物学功能使花青素具有极大的科研价值和经济价值,可广泛应用于食品、保健品、化妆品以及医药等领域。因此,花青素逐渐受到科研工作者们的广泛关注。目前,关于花青素生物合成的研究已经成为植物次生代谢领域的热点问题,对于提高植物花青素含量、利用生物技术培育新品种等具有重大意义。本文综述了花青素的结构和种类,重点对花青素的生物合成途径及合成关键酶研究进展进行总结,旨在为深入研究花青素生物合成机制以及植物的分子改良提供参考。
1 花青素的结构及种类
1.1 花青素的结构
2-苯基苯并吡喃是花青素的基本母核单元,也被称为花色基元(图1),含有一个苯并吡喃环(C环),一个融合芳香环(A环)和一个苯基成分(B环)。在阳离子形式下,花青素的C环上有两个双键,因此带有正电荷,2-苯基苯并吡喃的3-、5-、7-位上通常会发生羟基取代[5]。与其他黄酮类物质不同的是,花青素在游离状态下是极不稳定的,为了增加其稳定性,花青素通常发生糖基化形成稳定的花青素苷[4]。大多数植物中,花青素只发生O-糖基化,最近的报道中也发现了几种存在C-糖基化的植物,糖基化水平的提高会大大增强花青素的稳定性,花青素中糖的酰基化也可以促进其化学稳定性[6]。另外,花色苷的吡喃环结构决定抗氧化能力,糖基化B 环结构也可对抗氧化活性造成影响[7]。
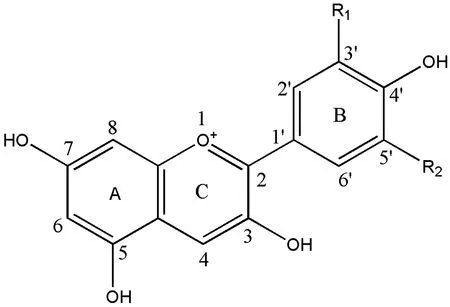
注:图1-8为A、C环碳位号;1′-6′为B环碳位号。Note:1-8 indicate the position number of carbon A and C;1′-6′ indicate the position number of carbon B.图1 花青素基本结构单元Fig.1 The basic structure of anthocyanins
1.2 花青素的种类
由于取代基团和取代位置的不同,花青素分为不同种类。1947年,法国科学家Jack博士首先在花生仁的包衣中发现花青素。目前,已在27个科、73个属的7 000多种植物发现了700余种不同花青素。其中,最常见的花青素为矢车菊素(Cyanidin),天竺葵素(Pelargonidin)、飞燕草素(Delphindin)、芍药素(Peonidin)、矮牵牛素(Petunidin)和锦葵素(Malvidin)(表1)[6]。其中,矢车菊素在植物中分布最为广泛,因此,在测量花青素含量时,通常以矢车菊色素作为标准。不同植物中,花青素种类和含量不尽相同,几种常见植物中含量最高的花青素如表2所示[8]。

表1 六种常见花青素Table 1 Six kinds of common anthocyanins

表2 几种常见植物中含量最高的花青素种类Table 2 Anthocyanins with the highest content in several common plants
2 花青素的合成途径
花青素的生物合成是植物次生代谢中的重要分支,虽然不同物种中花青素的种类和积累模式不同,但其合成过程基本相同。关于花青素合成过程的研究在20世纪下叶就已进入相对成熟阶段[9],目前,在拟南芥、矮牵牛、紫甘蓝等植物中已被基本揭示。一般来说,花青素的合成主要分为五个阶段(图2):
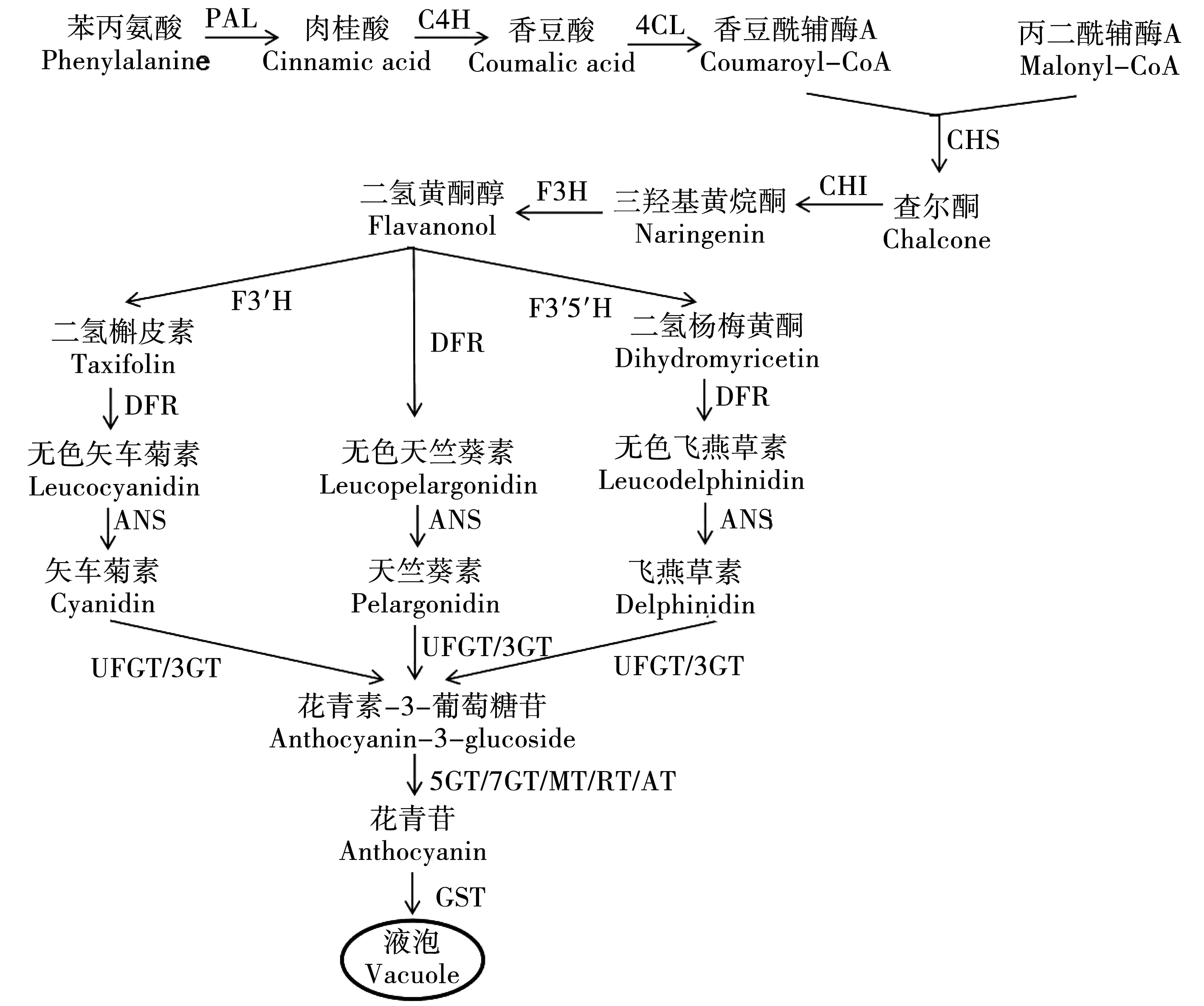
图2 花青素合成途径Fig 2 Anthocyanin synthesis pathway
第1阶段:类黄酮代谢的初始反应。苯丙氨酸在苯丙氨酸裂解酶(Phenylalanineammonialyase,PAL)、肉桂酸羟化酶(Cinnamate4-hydroxylase,C4H)、香豆酰辅酶A连接酶(4-coumarateCoAligase,4CL)的作用下生成香豆酰辅酶A(4-coumarateCoA)。这一阶段为类黄酮代谢共有[10]。
第2阶段:类黄酮代谢的重要反应。查尔酮在植物中含量很少,但其在类黄酮代谢过程中发挥重要作用,可为黄酮类化合物的合成提供碳骨架。查尔酮由查尔酮合成酶(Chalconesynthase,CHS)催化丙二酰辅酶A和香豆酰辅酶A生成,随后,查尔酮异构酶Chalconeisomerase,CHI)将查尔酮异构成三羟基黄烷酮,黄烷酮-3-羟化酶(Flavanone-3-hydroxylase,F3H)将三羟基黄烷酮进一步羟基化形成二氢黄酮醇。二氢黄酮醇在不同酶的催化作用下生成不同的物质,其中一部分通过类黄酮-3′-羟化酶(Flavonoid-3′-hydroxylase,F3′H)将B环3′位羟基化生成矢车菊素的前体物质二氢槲皮素,还有一部分通过类黄酮-3′,5′-羟化酶(Flavonoid-3′,5′-hydroxylase,F3′5′H)将B环3′,5′位置羟基化,生成飞燕草素的前体物质二氢杨梅黄酮[11]。
第3阶段:花青素的合成。二氢黄酮醇、二氢槲皮素和二氢杨梅黄酮在二氢黄酮醇还原酶(Dihydroflavonol-4-reductase,DFR)和花青素合成酶(Anthocyanidinsynthase,ANS)作用下形成有色花青素,这一过程通常需要亚铁离子的存在[6]。在植物细胞中花青素通常不能以单体的形式存在,因此他们往往会与糖苷结合,在类黄酮糖基转移酶(Uridinediphosphateglucose-flavonoidglucosyltransferase,UFGT)的催化下转化成稳定的花青素苷[10]。
第4阶段:花青素的骨架修饰。花青素在被植物正式利用之前通常需要经过结构上的修饰。绝大部分花青素的3位都会被UFGT糖基化,除此之外,某些植物花青素的5位或7位,也会在类黄酮5-葡糖基转移酶或类黄酮7-葡糖基转移酶的催化作用下发生糖基化。花青素酰基转移酶在花青素的酰基化修饰中发挥重要作用,它可以催化芳香酸或脂肪酸与花青素结合,从而使花青素更稳定且更易溶于水,还可以改变其吸收波长。经糖基化修饰的花青素继续被酰基化后会导致花的颜色变为蓝色或红色[12-13]。
第5阶段:花青素的运输和积累。花青素的合成过程和修饰作用在细胞质和内质网中进行,然后运输到液泡中储存。目前,对花青素运输和积累的机制还没有深入的研究。据报道,谷胱甘肽 S-转移酶(GlutathioneS-Transferase,GST)可催化谷胱甘肽与花青素苷结合或GST作为载体将花青素苷运输至液泡膜,位于液泡膜上的多药耐药抗性相关蛋白识别花青素苷并将其跨膜转运至液泡。除此之外,基质金属蛋白酶及液泡的产生过程也与花青苷的运输和积累密切相关。植物细胞还可以利用膜包被囊泡将花青素分子传送到液泡中,该过程不需要GST和多药耐药抗性相关蛋白参与。目前我们对花青素苷转运的了解仅仅关于花青素苷被转运至液泡的过程,对花青素苷如何流出液泡,进出细胞,被转运至细胞核、叶绿体、亚细胞区室却了解较少,有待进一步深入研究[14-15]。
3 花青素合成关键酶
苯丙氨酸在酶的催化下最终合成花青素。在其合成过程中存在一些关键酶,包括PAL、CHS、CHI、F3H、F3′H、F3′5′H、DFR、ANS、UFGT等。
3.1 苯丙氨酸裂解酶(PAL)
PAL能催化苯丙氨酸生成肉桂酸,是花青素合成的起始酶。花青素生物合成需要PAL的参与早在1960年就已被发现[16],1961年,Connl和Kouko[17]首先从植物中将其分离并纯化了出来。PAL在不同种类植物中的氨基酸组成和分子量存在差异,PAL通常包含4个亚基且呈酸性,分子量大约为220~330 kD。目前,科学家们已在核桃、芒果、桉树及山葡萄等植物中克隆得到了该基因[18-21]。宋慕波[22]克隆了荸荠的PAL基因,其cDNA序列长度为2 485 bp,开放阅读框(OpenReadingFrame,ORF)为2 142 bp,编码713个氨基酸。潘文等[23]发现尾叶桉PAL基因组全长4 507 bp,其中,氨基酸编码序列为2 172 bp,内含子为1 759 bp。研究发现,PAL活性受外界环境因素影响,董春娟等[24]以黄瓜幼苗为研究对象,发现在低温条件下,叶片PAL基因的表达显著升高,且产物活性也有所提高。程春振等[25]也发现,利用少量紫外线对梁平柚果皮进行照射处理,可诱导PAL活性的增强。
3.2 查尔酮合成酶(CHS)
CHS是类黄酮代谢途径中的关键酶,它可以催化查尔酮的生成,其作用底物是香豆酰辅酶A和丙二酰辅酶A,生成产物为查尔酮。1983年,Reimold等[26]在荷兰芹中克隆到了第1个CHS基因,随后,兰花、矮牵牛、玉米、拟南芥及高粱中的CHS基因也被克隆[7]。黄琼林等[27]发现青天葵叶的CHS基因编码区为1 173 bp,编码391个氨基酸。王毅等[28]从泡核桃中克隆了一个由冷冻损伤诱导的CHS基因,基因全长为1 490 bp,ORF长1 170 bp,编码389个氨基酸。研究表明,CHS基因与植物颜色变化之间存着显著的相关性,van der Krol等[29]向紫色矮牵牛中导入CHS的反义基因后花色变白。
3.3 查尔酮异构酶(CHI)
CHI可将查尔酮催化成三羟基黄烷酮。1987年,Mehdy等[30]首先从豌豆中分离出CHI基因,此后,科学工作者们又陆续在菜豆、翠菊、玉米及矮牵牛等植物中获得该基因[7]。杨哲等[31]克隆了红掌栽培品种CHI基因,测序结果显示,该基因全长1 117 bp,包含777 bp的ORF,编码258个氨基酸。根据催化底物的不同,CHI基因可被划分为两种完全不同的类型,Ⅰ型编码的酶蛋白只能作用于1种底物;Ⅱ型编码的酶蛋白则可作用于两种底物[32]。据报道,CHI基因发生变异或下调表达,都会导致查尔酮含量显著升高,使类黄酮合成途径受阻。Nishihara等研究发现抑制烟草CHI基因的表达后,花瓣因无法积累类黄酮而使颜色变黄[33]。
3.4 类黄酮3-羟化酶(F3H)
F3H可将三羟基黄烷酮催化成二氢黄酮醇,是花青素合成通路的中枢位点。李鹏等[34]对来自山竹、银杏及龙眼等12种植物F3H的基因序列及相应的氨基酸序列进行数据分析后发现,它们的ORF大约为1 100 bp,大多数蛋白质的分子量在41.10 kD左右,理论等电点都在7以下,显示F3H是酸性蛋白。外界因素可影响F3H表达,Castellarin等[35]研究证明,植物缺水可诱导F3H基因表达,从而增加花青素的积累;Zheng等[36]发现被己糖激酶磷酸化的糖类可以诱导F3H的表达以及花青素的积累,而己糖激酶的特异性抑制剂葡萄糖胺和甘露七糖可以阻断这一诱导过程。EL-Kereamy等[37]发现葡萄果实在经过乙烯处理后,F3H基因转录水平明显提高。
3.5 类黄酮3′羟化酶(F3′H)
F3′H属于细胞色素P450(CytochromeP450,CYP450)亚家族[38],在类黄酮合成途径中,F3′H催化二氢黄烷酮生成二氢懈皮素。1999年Brugliera等[39]从矮牵牛中首次分离出F3′H基因后,越来越多的科研工作者在不同的植物中也克隆到了F3′H基因。刘海峰等[40]从山葡萄中克隆得到了F3′H基因,其cDNA序列长度达到1 844 bp,ORF长1 530 bp,编码509个氨基酸。Zou等[41]从杭菊中克隆了F3′H,测序结果显示,cDNA全长1 562 bp,ORF长1 527 bp,编码508个氨基酸。景宗慧等[42]获得了芡叶F3′H的cDNA序列,其ORF长1 566 bp,编码521个氨基酸,是亲水性蛋白,预测定位于细胞质膜。研究表明,F3′H基因影响花瓣颜色形成,若使菊花中F3′H基因沉默可使花瓣由红色或粉色变为蓝色[43]。
3.6 类黄酮3′,5′-羟化酶(F3′5′H)
F3′5′H也属于CYP450家族[38],可将二氢黄烷酮催化成二氢杨梅黄酮。F3′5′H基因是第一个克隆到的植物CYP基因[44],马璐琳等[45]从藤乌中克隆到了一个全长1 563 bp的F3′5′H基因,其ORF编码的蛋白质含有506个氨基酸。方颖等[46]以华丽龙胆5个不同开放阶段的蓝色花冠为试材,克隆到了F3′5′H基因,其ORF为1 560 bp。研究表明,F3′5′H基因与蓝色花色形成密切相关,因此被称为蓝色基因[47]。研究人员以白色香石竹为研究对象,利用基因工程技术将F3′5′H基因和DFR基因导入其中,得到了紫色植株[6],这是最早的F3′5′H转基因花卉。Whang等[48]发现石斛兰念珠花被颜色的缺失与F3′5′H基因有关。Mori研究团队向矮牵牛中导入F3′5′H基因,发现部分植株的花瓣颜色变成深红色,并出现了深紫色的区域[49]。
3.7 二氢黄酮醇还原酶(DFR)
DFR是一种短链还原酶[50],该酶可以催化二氢黄烷酮、二氢杨梅黄酮、二氢槲皮素生成无色花青素。1985年,DFR基因首先由O′Reilly等人从玉米和藤草中得到[51],随后,从水稻、葡萄和紫苏等植物中也克隆出来[52]。张波等[53]采用同源克隆的方法从‘贵妃’芒果的果实中分离到了一个长1 260 bp的DFR基因,该基因包含一个编码328个氨基酸长987 bp的ORF。Meyer等[54]将DFR基因导入白花矮牵牛后,花色变为淡砖红色。这是使用转基因技术对花色进行改造的第1个实验,Tanaka等[55]向矮牵牛中导入玫瑰DFR基因,结果发现,转基因植物花瓣和花药呈橙红色,含有天竺葵素,这种花青素在矮牵牛中很不常见。
3.8 花青素合成酶(ANS)
ANS可将无色花青素催化为有色花青素。ANS基因首先在紫苏中被克隆[56],随后在芜菁、山药、桑树等中也克隆到了该基因[57]。Shi等[58]从玉兰中克隆了一个ANS基因,该基因长1 171 bp,其ORF编码的蛋白含有360个氨基酸,长为1 080 bp。ANS基因在植物组织中的表达具有特异性,Rosati等[59]对金钟连翘的ANS基因进行表达分析,结果显示该基因的表达只发生在萼片中,并不发生在花瓣和花药中,使花瓣不能积累花青素。研究证明,抑制或促进ANS基因的表达,可以使花色发生改变,Nakamura等[60]通过沉默ANS基因,获得了白色的蝴蝶草。由此可见,通过ANS基因对花卉颜色进行改造已成为研究热点。
3.9 类黄酮糖基转移酶(UFGT)
UFGT是花青素合成通路的最后1个酶,作用是催化花青素形成稳定的花青素苷。王迪等[61]获得了欧李叶片的UFGT基因,发现其开放阅读框为1 425 bp,编码475个氨基酸,其对应的蛋白质相对分子质量为51.63 kD,是稳定的疏水性蛋白,带正电荷。研究发现,光照、温度、水分、介质酸碱度及外源物质,对UFGT基因表达有很大影响[62]。张圣美等[63]利用人工气候室对紫色茄子进行高温处理,发现高温环境可降低茄子果皮UFGT基因的表达量,同时,类黄酮和花青素的含量都有所降低。Peppi等[64]研究发现,用脱落酸处理无核葡萄,能有效促进UFGT基因的表达。
利用基因工程技术对这些酶进行调控,可以有效影响花青素的合成过程,实现植物花色的改变,从而达到品种改良的目的。如向植物中导入一个或多个外源花青素合成关键酶基因,或抑制植物中原有的花青素合成关键酶基因,使其产生不同的花色。目前,主要通过F3′H、F3′5′H这两种酶对花色进行改良,除此之外,通过DFR、ANS改良花色也是未来的重要研究方向之一。
4 展 望
花青素使植物具有丰富的色彩,同时,有助于植物防御病毒及细菌等生物胁迫,吸收过量可见光和紫外线照射,清除非生物胁迫下过量的活性氧,这对植物本身至关重要。目前,花青素合成途径已基本清楚,也已从大量植物中克隆出了花青素合成关键酶基因,已知激活或抑制这些基因或诱导其突变可改变植物颜色,提高植物的观赏价值,但仍存在很多问题,如花青素的修饰及运输、积累等机制还不清楚,植物的再生体系和转基因体系难以建立,这些问题也是接下来研究的热点问题。
花青素具有强大的医药、保健和营养价值,对人体健康有很大的帮助,但由于我国对于花青素的研究起步较晚,依然有许多生物学功能未得到开发利用,因此,加快提取和鉴定技术的发展,在更多植物中发现新种类的花青素,以及加大花青素在抗炎症、抗肿瘤及保护心脑血管疾病等方面的利用是十分有必要的。
——矮牵牛

