糖尿病和前循环动脉瘤破裂风险之间的相关性研究
张阳,赵德强,栗志弘,张兴海,柴宇飞,王震,姜扬
颅内动脉瘤(intracranial aneurysm,IA)破裂所导致的蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是神经外科常见的出血性卒中类型。IA破裂后会引起SAH,从而带来很高的病死率和致残率(约30%~50%)[1]。除芬兰和日本外,这种疾病的发病率约为每100 000人中6~7人/年。同时对于大多数未破裂的IA,终生破裂的风险较低。因此,对IA破裂风险的全面评估将有助于临床做出下一步的治疗决策,例如保守观察、介入手术或开颅手术。关于IA破裂的危险因素目前的报道很多(表1)。这些因素包括高血压、吸烟、颈动脉内膜厚度、不规则的IA形态、血液动力学因素、遗传因素等[2]。 在可改变的危险因素中,糖尿病与缺血性中风有关,这种关联的原因可能与糖尿病相关的代谢紊乱综合征引起的动脉粥样硬化有关[3]。然而,对于糖尿病与IA破裂风险之间关系的研究尚缺乏足够报道。因出血性脑血管疾病和缺血性脑血管疾病通常具有相似的发病基础,如都有对血管壁的损害,因此本研究回顾性分析2014年10月—2019年8月铁岭市中心医院及沈阳市第一人民医院收治的680例IA患者的临床资料,旨在验证糖尿病和IA破裂风险之间是否存在相关性。

表1 动脉瘤破裂相关的危险因素(根据关联度)
1 资料与方法
1.1 一般资料 共纳入680例IA患者(967个IA),根据SAH的存在与否(通过CT或腰椎穿刺证实),将患者分为破裂组200例(289个IA)和未破裂组480例(678个IA)。破裂组中,男 73 例,女127 例;年龄45~76岁,平均(55.7±10.3)岁;未破裂组中,男 167例,女 313例;年龄43~78岁,平均(55.6±10.0)岁。纳入标准:(1)患者病历信息完整;(2)DSA诊断该患者为IA。排除标准:(1)以下疾病的伴随动脉瘤:烟雾病、硬脑膜动静脉瘘、脑动静脉畸形、颈动脉海绵窦瘘;(2)图像数据或病历不完整的患者;(3)以下类型的IA:创伤型IA、感染型IA、纺锤型IA;(4)入院前接受开颅或介入治疗的患者。本研究所有患者及家属均签署知情同意书。由于是回顾性分析,无需伦理委员会审批。
1.2 方法 收集患者病历系统中有关糖尿病,年龄,性别,高脂血症,高血压,冠心病,房颤,超重或肥胖,近期饮酒,近期吸烟,IA家族史,缺血性卒中病史,SAH病史等方面的信息。同时,收集IA的形态学指标,如不规则,多发,位置-前交通动脉(anterior communicating artery,ACoA)/大脑前动脉(anterior cerebral artery,ACA),大小≥8 mm(多项的大型临床研究显示对于未破裂的动脉瘤而言,一旦直径大于7 mm会出现较大的破裂风险,而比7大的最接近的整数值是8,所以本研究中将直径大小设定为≥8 mm)[4-6],宽颈等(表2)。
其中,糖尿病的诊断是根据1996年世界卫生组织的诊断标准。即任意时间的血糖≥11.1 mmol/L,或空腹血糖≥7 mmol/L,或者餐后2 h血糖≥11.1 mmol/L。这三项当中,以上结果在非同日的测量中可以重复,其中有一个值达到上述数值,就可以诊断为糖尿病。身体质量指数(body mass index,BMI)≥25被定义为超重或肥胖。最近3个月或以上的每周饮酒量≥150 g被定义为近期饮酒史。在过去3个月或更长时间里,每天吸烟超过20支被定义为近期吸烟史。如果动脉瘤含有小叶或囊状气泡,则将其定义为不规则动脉瘤。具有两个或多个动脉瘤的患者,被定义为多发动脉瘤。宽颈动脉瘤是指颈部宽度> 4 mm或颈/体比率>1/2的动脉瘤。以上形态学信息是通过观察术前血管造影的结果收集的。这项工作是由三位高年资神经介入医师完成的。当他们的判断结果存在差异时,由第三位神经介入医师确定最终结果。当存在多个动脉瘤时,分别根据破裂动脉瘤(破裂组)和最大动脉瘤(未破裂组)的结果进行形态学测量。
1.3 统计学分析 对于单变量分析,使用独立样本t检验或χ2检验来评估连续或分类变量。对于多变量分析,采用Logistic回归分析进行评价。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同类别的统计结果 两组多发性动脉瘤的患者人数分别为41例(20.5%)和108例(22.5%)。破裂组和未破裂组的患者有糖尿病的比例分别为22.5%、13.7%。破裂组(动脉瘤个数289个) 平均直径(9.61+0.54)mm,未破裂组(动脉瘤个数678个)平均直径(9.59±0.55)mm;两组平均直径t=0.520,P=0.301>0.05,两组动脉瘤平均直径无统计学差异,其余结果见表2。
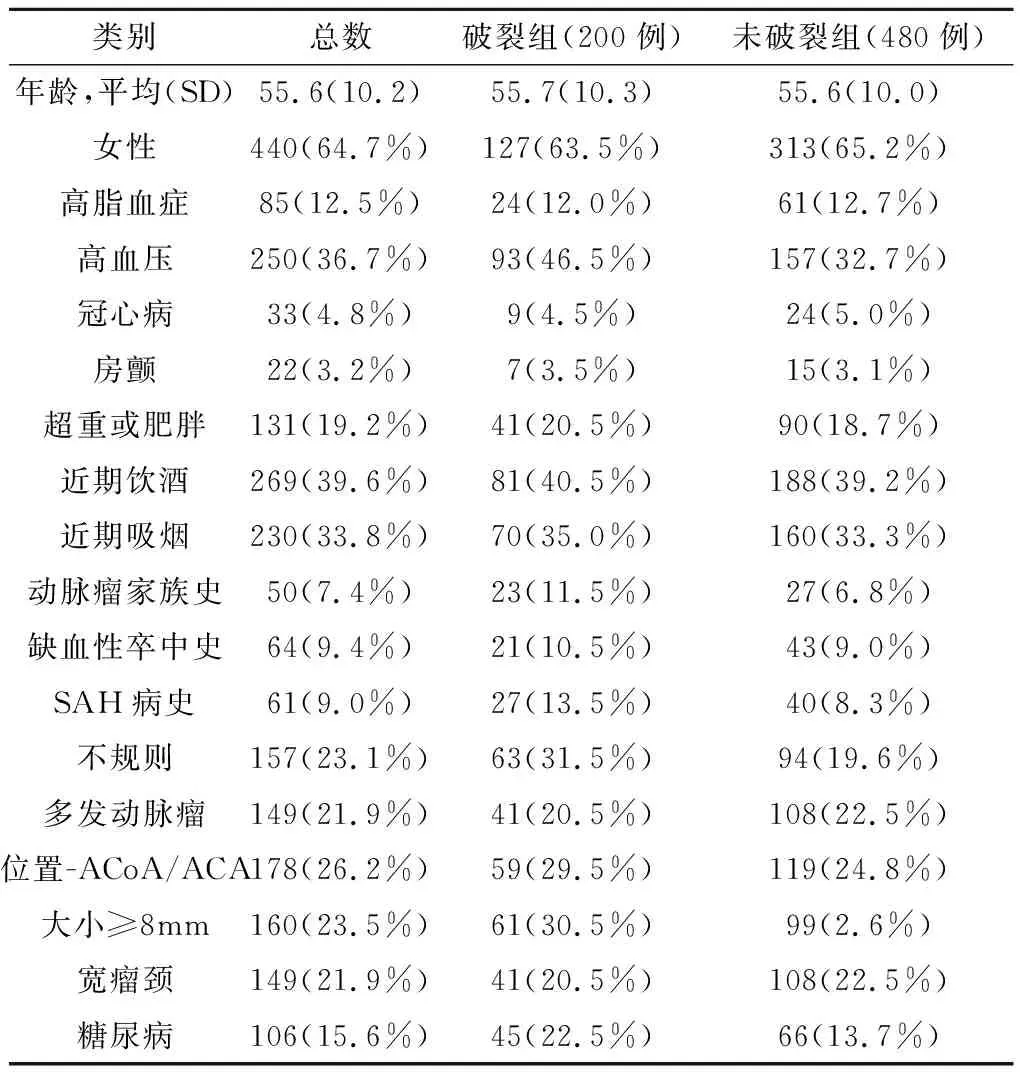
表2 破裂组和未破裂组患者的统计结果
2.2 单变量和Logistic回归分析结果 在单变量分析中,高血压(P=0.001),IA家族史(P=0.007),SAH病史(P=0.039),不规则(P=0.001),大小≥8 mm(P=0.006),糖尿病(P=0.005)的差异有统计学意义。排除混杂因素的影响后,多变量分析结果表明,在破裂组和未破裂组中,糖尿病的比例存在统计学差异(OR=1.678,95%CI:1.160~2.470,P=0.043)。同时,多变量回归分析的结果显示,在两组患者中,高血压、动脉瘤家族史、形态不规则、大小≥8 mm等指标也存在统计学差异。见表3。

表3 糖尿病和IA破裂风险的单因素和多因素分析结果
3 讨 论
动脉瘤性SAH是出血性卒中的重要类型,其发病急,病死率和致残率均较高。IA形成和破裂的确切病理生理机制目前尚不清楚,大多数认为是遗传和环境之间相互作用的结果。目前文献已经报道了一些可能增加IA破裂风险的可改变因素,如吸烟、高血压等[7]。目前对于糖尿病和IA破裂风险之间的关系,尚存在很大争议。一些学者认为糖尿病可能是IA破裂的保护因素[8-10],也有学者认为降糖治疗有助于减少破裂风险[11],还有部分学者认为糖尿病和IA破裂风险之间无相关性[12]。本研究中,在排除了混杂因素的干扰后,多因素的结果显示破裂组(22.5%)糖尿病患者比例高于未破裂组(13.7%),且差异有统计学意义,这意味着糖尿病可能是IA破裂的危险因素。一项针对降糖药物应用和IA破裂风险关系的研究显示,应用降糖药物有利于降低IA破裂风险,说明血糖高可能是导致破裂的危险因素。当然,也可能降糖药本身具有降低破裂风险作用。
本研究发现,高血压、动脉瘤形态不规则、动脉瘤≥8 mm、动脉瘤家族史可能也是动脉瘤破裂的危险因素。其中,高血压导致破裂风险增加的原因不难理解。动脉瘤壁本身已经非常薄弱,由于高血压导致血管壁受到的冲击力增加,故而容易破裂。另外,形态不规则是破裂的危险因素,可能与其导致的血流动力学不稳定有关系[13]。一项包含1 931 例患者的临床研究表明,形状不规则是IA破裂的危险因素[14]。IA的大小与破裂之间是否存在关联尚存在争议。有研究认为小的未破裂IA破裂风险较低,然而也有文献报道SAH更容易发生在小的IA患者中[15]。甚至部分研究者认为大的IA不容易破裂,这是因为血流在大的IA中减慢,容易形成瘤内血栓[16]。本研究结果显示,动脉瘤≥8 mm是破裂的危险因素。另外,本研究也显示了患有IA家族史也是破裂的危险因素。导致这种现象的原因可能和部分基因的变异有关,如弹性编码基因7q11[17],这种基因突变的存在导致血管壁发育过程中更容易导致动脉瘤形成、发展和破裂。
对于糖尿病导致IA破裂风险增加的可能机制,本研究认为可能包含如下几个方面:(1)代谢紊乱相关血管病变:根据中国 2017年版的2型糖尿病防治指南报道,糖尿病患病率约为10.4%,在急性脑卒中住院患者中糖代谢异常的患病率为68.7%,糖尿病的患病率为42.3%。其中,糖尿病患者通常会发生胰岛素抵抗、高胰岛素血症,这些变化常伴随高血压、血脂异常、肥胖等代谢综合征表现。并且,糖尿病导致的血管内皮、凝血和血小板功能等的变化,都会导致动脉粥样硬化等血管损伤,进而引起血管病变[18]。另外,此类患者容易反复发生感染,引起交感神经兴奋性高血压,血管内壁容易因受到冲击受到损伤,血液内的脂质、血小板、白细胞等成分就会容易黏附、沉积到血管壁内,引起动脉粥样硬化。(2)脑紧密连接蛋白表达减少:高血糖可以导致脑紧密连接蛋白表达降低[19-20],这种紧密连接蛋白是血脑屏障的重要组成部分,其受到损伤后可能导致脑循环内血流动力学紊乱,进而导致血管分叉处血管壁受到机械冲击,加速动脉瘤破裂。(3)基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)的表达增加:糖尿病血管中的还原糖和蛋白质、脂质或核酸上的胺残基之间的非酶反应形成了一组复杂的化合物,称为晚期糖基化终产物,晚期糖基化终产物受体已被证明能诱导MMP9的表达[21]。MMP9已被证明参与炎症反应,并在组织重塑中发挥重要作用;同时炎症细胞可以通过MMP9的介导进一步诱导血管壁变性,导致动脉瘤破裂风险增加。(4)糖尿病相关基因(SLC2A9、TOX)的突变:张利通等[22]通过对119例糖尿病患者的基因进行测序发现,位于 SLC2A9 基因的rs7660895和TOX基因上的 rs11777927位点与IA相关。SLC2A9可以编码葡萄糖转运体,后者在血管平滑肌细胞局部或系统释放的营养因子的作用下转型为增生状态,从而引起血管病变[23-24]。TOX基因存在于人8号染色体q12.1位置,参与基因的表达调控等过程,它可编码一类能和DNA结合参与基因表达调控的家族蛋白,或者调控诸如转录、复制及DNA修复的过程。推测TOX基因可能参与了细胞周期过程中某些基因,如细胞分裂周期基因CDC家族、癌基因的调控,从而调节细胞增殖[25]。TOX还能够影响T细胞、B淋巴细胞发生、发育、分化的过程。炎症细胞介导的异常血管重塑,被认为是导致各种血管疾病发展的一个关键病理环节。在此过程中,炎症细胞、补体、抗体等参与的炎症反应诱导了多重蛋白酶表达,这个过程被认为是动脉瘤形成的重要原因[26]。
关于糖尿病对人体健康影响的报告越来越多,已经证实糖尿病与心血管疾病、缺血性卒中等发病率密切相关[27-28]。在临床工作中,也经常可以观察到一种现象,即糖尿病患者的IA出血风险可能增加。然而,目前对两者之间关系的研究尚缺乏统一的报道。因此,本研究对糖尿病与IA破裂风险之间的关系进行了回顾性分析。通过这项研究,发现患有糖尿病的患者IA破裂的可能性可能会增加。此外,本研究回顾了文献并分析了这种相关性的潜在机制,为后续研究奠定了基础。根据这项研究的结果,提醒在临床工作中应加强对伴有糖尿病的IA患者的宣教,即改变不良生活方式、使用药物控制糖尿病,还有控制高血压、血脂异常、肥胖、吸烟等可能导致动脉粥样硬化的因素,以减少动脉瘤破裂的风险。
本研究需要纳入更多病例来减少结果偏倚。此外,在选择协变量时,选择了文献报道的有关联性且易于评估的危险因素作为协变量,以排除对兴趣变量的干扰。通过多元回归分析建立了一个拟合模型,以评估糖尿病与IA破裂风险之间的相关性。实际上,仍存在许多潜在的危险因素,很难建立一个完全准确的模型来避免偏倚的发生。另外,如果能够根据血糖水平分级探索和IA破裂风险的关系,将更加有利于指导临床应用,这也是未来研究的重点。本研究的结果显示,糖尿病可能会增加IA破裂的风险。这种风险可能和糖尿病导致的代谢紊乱相关血管病变、糖尿病相关基因(SLC2A9、TOX)的突变等有关。
利益冲突:所有作者均声明不存在利益冲突。

