膳食纤维干预炎症性肠病研究进展
乔汉桢,刘佳琪 ,杨元森,朱玉龙,葛 豪,周 硕,刘学龙,甘利平,王金荣,
(1.河南工业大学生物工程学院,河南郑州 450001;2.浙江大学动物科学学院,浙江杭州 310058)
炎症性肠病(Inflammatory bowel disease,IBD)是种病因尚不明确的肠道慢性炎症病变[1],患者常表现为持续性腹泻、腹痛、带血黏液脓便等胃肠道症状,严重者甚至会出现并发症或发展为结肠癌[1-3]。近年来,随着人们饮食结构逐渐西方化(即高糖、高脂、低纤维),IBD 在世界范围内的发病率逐年上升,已成为全球性公共卫生难题[2]。IBD 发病机制复杂,涉及多种因素,其中饮食是最重要的环境因素之一。国内外大量文献表明,植物来源的膳食纤维(Dietary fiber,DF)具有多重营养及保健功能,在干预IBD 方面已表现出巨大的潜力。因此,本文就IBD 的致病因素和DFs 干预IBD 的作用机制进行综述,为寻求IBD 治疗新途径和功能性DFs 的开发应用提供理论依据。
1 DFs 概述
DFs 是不能在小肠消化或吸收,但可部分或完全由后肠发酵,产生短链脂肪酸(Short-chain fatty acid,SCFA)等代谢物的可食用植物性成分[4-5]。既往研究表明,DFs 在改善肠道菌群结构、强化肠道屏障功能、减轻肠道炎症症状[1,6-7]等方面功效显著,是缓解及治疗肠道炎症性疾病的理想活性物质。根据水溶性,DFs 可分为可溶性膳食纤维(Soluble dietary fiber,SDF)和不溶性膳食纤维(Insoluble dietary fiber,IDF)(图1),二者特性不同,呈现的功能也不尽相同[5]。科学合理地开发功能性DFs 资源,不仅可以提高DFs 的经济附加值,还能为IBD 提供一种新的有效治疗模式,避免药物的毒副作用和残留问题,具有安全、疗效确切、不良反应少等诸多优点。
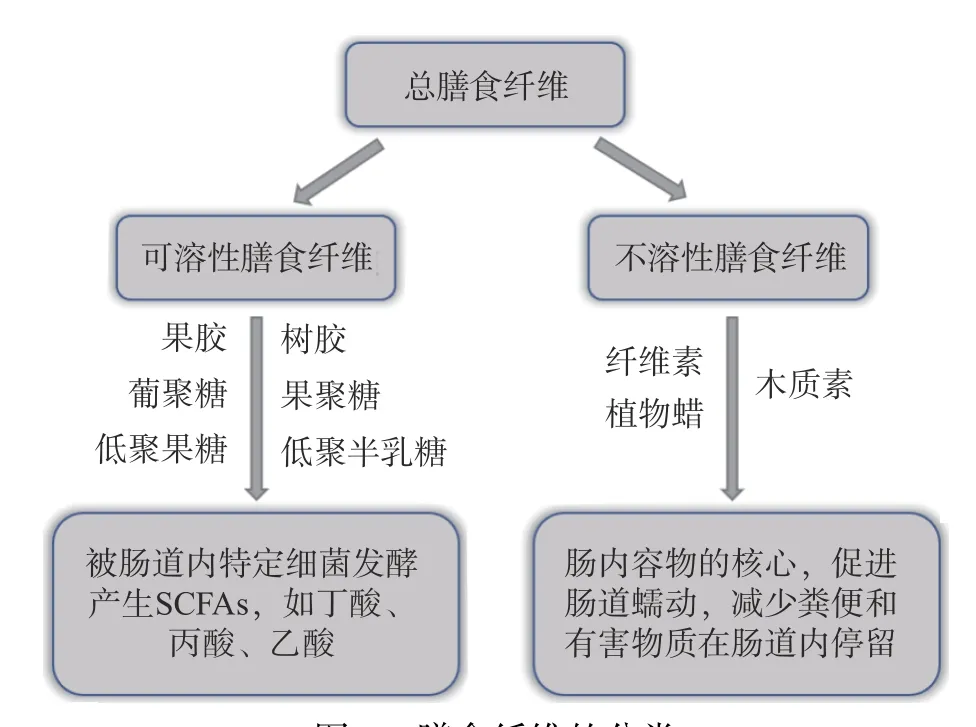
图1 膳食纤维的分类Fig.1 Classification of dietary faber
2 IBD 概述
IBD 以溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn disease,CD)为代表,二者在临床表现、病理特征、病变范围、诊断治疗等方面存在重叠性和差异性(表1)。UC 的病变部位局限于结肠、直肠的黏膜下层和盲肠端,一般从直肠发病,逆行蔓延至结肠,最后累及整个大肠[1,8],以结肠黏膜和黏膜下层的弥漫性炎症为特征[3]。而CD 涉及整个胃肠道,病变可位于口腔到肛门之间的任意胃肠道部位,炎症呈节段性分布,以肠道贯壁性破坏和增值性炎症改变为特征[9]。这两种亚型均可发生于任何年龄阶段,一般易发于20~40 岁人群。21 世纪以前,IBD 高发于北美洲和欧洲等地[10-11]。近年来随着生活方式的西方化以及社会经济的快速发展,亚洲、非洲、南美、东欧等地IBD 的发病率和流行率开始迅速攀升[2]。包括中国在内的众多发展中国家,IBD 已较为常见,逐步成为消化系统疾病和慢性腹泻的主要原因,严重威胁人类健康,因此也越发受到全球医疗和科研工作者的关注。目前,治疗IBD 尚无特效药,临床上主要依赖抗生素、激素等药物控制症状,但以药物治疗为靶点的研究结果喜忧参半,药物残留和细菌耐药性等问题严重威胁人类健康和生态环境的可持续发展[12],因此,寻求对IBD 有缓解作用且副作用小的天然活性物质迫在眉睫。

表1 UC 和CD 的异同点Table 1 Similarities and differences between UC and CD
3 DFs 干预IBD 的机制分析
IBD 的病因和发病机制尚未完全阐明,目前业界普遍认为是遗传、环境、免疫反应、肠道菌群等多个因素综合作用的结果,深入探究IBD 的病因和发病机制将对寻求针对性干预治疗策略起到一定的指导作用。DFs 在IBD 防治方面虽已表现出巨大的潜力,但其中作用机制尚未十分明确,且SDF 与IDF功能特性也不尽相同。已有研究提示,DFs 对IBD的缓解作用与改善肠道菌群结构、修复肠黏膜屏障、抗炎、免疫调节等多途径有关(图2)。
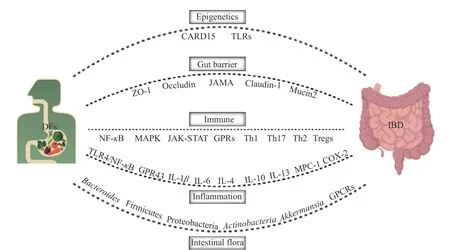
图2 膳食纤维干预炎症性结肠炎的机制Fig.2 Mechanism of dietary fiber intervention in IBD
3.1 调控表观遗传修饰
表观遗传是指在不改变DNA 核苷酸序列的前提下,通过DNA 甲基化、组蛋白修饰和RNA 甲基化等形式引起基因表达的可遗传性改变,参与多种生命过程,在IBD 发病中有重要作用[13]。此外,表观遗传可随地域发生改变,从基因型到表型的改变可能是由于一系列环境因素(营养等)所引起的[14]。最新流行病学资料[2,10-11]显示,IBD 的发病率和流行特点在不同地区、种族间存在较明显的差异。总体看来,英美等西方发达国家IBD 的总体发病率远高于亚太地区国家,且IBD 后代患CD 或UC 的危险性比正常人群高2~13 倍[15]。表观遗传学相关基因的表达变化与肠黏膜免疫和防御反应密切相关,表明IBD 的表观遗传变化和炎症存在直接的关系[14]。目前,与IBD 进程相关联的易感基因位点尚未完全探明,多集中在:细胞凋亡募集结构域家族成员15(Caspase recruitment domain-containing protein 15,CARD15)、Toll样受体(Toll-like receptors,TLR)等[15],这些基因可能参与致病过程。营养供给决定了代谢产物的丰度,某些代谢产物是表观遗传酶的必要辅助因子,因此能影响基因表达的表观遗传调控[16]。有研究表明[13],DFs 等营养的摄入可以修饰关键基因的表达,改变表观遗传现象,控制机体生理、病理等过程。此外,肠道菌群可能会将饮食因素和消化成分转化为调节炎症表观遗传学的代谢物。目前,DFs 影响机体表观遗传修饰调控IBD 的研究未见直接报道,但DFs 经肠道菌群代谢所产生的SCFAs 可提高机体结肠、肝脏、脂肪等组织组蛋白的乙酰化水平[17]。肠道菌群代谢产生的丁酸盐、乙酸盐等生物活性小分子物质,能够参与到宿主表观修饰和生理功能的调控中,从而影响宿主细胞发育、功能以及基因的表达[18]。DFs 是否可直接调控或通过肠道菌群代谢间接影响宿主表观遗传过程继而缓解IBD 有待深入研究。
3.2 修复肠道屏障
尽管遗传因素在IBD 进程中的作用不容忽视,但仅有25%的IBD 遗传关联性被阐明,且随着发展中国家物质生活条件的改善,本流行于西方国家的IBD 在发展中国家也出现了流行趋势[2]。由此可见,除了遗传因素,饮食等环境因素也是刺激IBD 易感人群发病的重要因素[19],可通过影响机体肠道通透性和黏液层等机制调控肠道炎症[20]。肠黏膜屏障是维持机体内环境稳态和肠道通透性稳定的重要结构,肠上皮细胞破坏、肠道紧密连接蛋白异常和肠道通透性增加是IBD 的重要病理组织学变化[21]。当肠道不断接受外源性抗原刺激时肠道屏障可被破坏,肠道通透性增加,致使机体产生过度的抗原应激和氧化应激,引发反复炎性反应,最终导致或加重IBD 等肠道炎症疾病。研究表明,富含饱和脂肪酸饮食和加工肉类的长期过多摄入会破坏肠道屏障的完整性,增加肠道通透性,提高IBD 的患病风险[22]。摄入富含蛋白质食物的人,肠道中大肠杆菌等腐败菌数量明显增多,也会增加IBD 的发病风险,这可能与硫化代谢物过多,影响肠上皮细胞的功能有关[23]。据统计,IBD 患者总纤维摄入量显著低于健康群体,其中超过80%的IBD患者每日纤维摄入量达不到相应的国家推荐量(25~30 g/d)[24]。补充DFs 对预防及缓解IBD 具有积极作用。
3.2.1 SDF SDF 对机体肠道屏障的损伤修复作用已有大量报道。摄入10%(w/w)的瓜尔胶(Guar gum,GG)和部分水解瓜尔胶(Partially hydrolyzed guar gum,PHGG)可以缓解DSS 诱导IBD 大鼠的体重损失、IBD 症状及肠黏膜屏障的损伤,抑制中性粒细胞的浸润和积累,上调紧密连接蛋白(ZO-1、Occludin、JAMA 等)的表达,且粪便中有机酸含量增加,表明SDF 在肠道发酵产生的SCFAs 等有机酸是保护屏障功能的重要介质,可改善IBD 小鼠的肠道屏障缺陷和炎症,抑制肠道中的炎症免疫反应[25]。SCFAs作为结肠黏膜上皮细胞的主要能量来源,可促进上皮细胞增殖,对维持肠黏膜屏障完整性,防止细菌移位起到重要作用[26]。IRAHA 等[27]研究也发现了类似的结果,褐藻SDF 可以剂量依赖方式阻止H2O2诱导的肠上皮屏障功能的破坏,显著提升了跨膜阻力,调控细胞通透性,同时上调肠上皮紧密连接蛋白Claudin-1 等表达水平,并抑制TNF-α、IFN-γ、IL-13等炎性因子对肠道屏障的损伤,增强上皮的保护功能,促进上皮再生。
3.2.2 IDF IDF 对机体肠道屏障也有较好的保护作用。小鼠饲喂添加1.52%的大麦叶IDF 日粮,能够上调DSS 诱导结肠炎小鼠结肠紧密连接蛋白Occludin 和Mucin 2 的蛋白表达,下调Claudin-1 的蛋白表达,保护结肠屏障功能[28],而Claudin-1 与IBD 患者症状严重程度呈正相关,且Claudin-1 蛋白表达上调可抑制杯状细胞分化,并通过Notch 依赖途径促进结肠癌的发生[29],因此,补充大麦叶IDF 可通过降低Claudin-1 蛋白表达达到缓解DSS 诱导小鼠IBD 症状的目的[30],其可能机制是IDF 对肠道黏膜有直接的刺激作用,促进肠黏膜细胞的增长,防止肠道内有害菌过度生长及附着,维持肠道正常菌群,进而保护肠道屏障;同时,IDF 也可刺激胆汁和胰液分泌,减少胆胰源性肠黏膜萎缩的发生[31-32]。由于木质纤维素在体内较难降解,因此,DFs 成分和肠道菌群之间的互作对屏障完整性的调节也至关重要,在制定使用DFs 化合物增强肠道屏障完整性的策略时,考虑肠道屏障不同组分间的互作十分必要[27]。
3.2.3 混合DFs 血浆D-乳酸浓度、二胺氧化酶(Diamine oxidase,DAO)活性、结肠形态等是评估肠粘膜屏障功能障碍的常用指标。在乙酸灌肠法诱导的大鼠IBD 模型中,摄入SDF(菊粉:阿拉伯胶:果糖=1:1:1)和IDF(纤维素:抗性淀粉:大豆纤维=1:1:1)配制的复合DFs,可显著降低IBD 大鼠血浆中D-乳酸浓度、DAO 活性、结肠大体形态损伤以及结肠病理组织学评分[33],表明DFs 的摄入可降低肠粘膜通透性,修复肠粘膜屏障,可能是DFs 被肠道菌群酵解产生的SCAFs 发挥了作用。AHL 等[34]的研究也有类似结果,表明丁酸可显著上调结肠隐窝上皮紧密连接蛋白(ZO-1 和Occludin)的蛋白表达,强化肠道屏障功能,缓解肠道炎症症状。综上,DSS 诱导IBD 小鼠摄入SDF 和IDF 后,均可通过酵解产生的SCFAs 等代谢产物在一定程度上修复肠道屏障功能。通常SDF 较IDF 更易被菌群发酵产生SCFAs,表现出更多的生物活性,美国供能委员会推荐膳食纤维中IDF 占70%~75%,SDF 占25%~30%为宜,SDF 与IDF 的最佳比例受DFs 来源、特性等诸多因素影响,还需更多实验进行进一步验证。
3.3 调节机体免疫
IBD 是种非特异性肠道炎症疾病,与非特异性免疫关系密切[35]。非特异性免疫能够识别抗原、抑制致病微生物入侵、刺激并调节T/B 细胞分化[36],在IBD 的发生发展过程中发挥重要作用。初始CD4+T细胞接受抗原刺激后,在不同细胞因子诱导下可分化为不同功能的T 细胞亚群,如辅助性T 细胞1(T helper cell 1,Th1)、Th17、Th2、调节性T 细胞(Regulatory T cells,Tregs)等。研究表明[37-38],UC 患者肠黏膜中IL-13、IL-4 等Th2 相关细胞因子mRNA 表达量上调,而CD 患者肠粘膜中IL-23、IL-18、IL-12 等Th1 和Th17 相关细胞因子mRNA 表达量上调,提示Th2 主要介导UC 的黏膜炎症,Th1 和Th17 主要介导CD 的透壁炎症。IBD 大鼠受到外源性病原体或细胞损伤的刺激时,TLRs 会与白细胞分化抗原14(CD-14)和髓样分化蛋白-2(MD-2)共同作用,激活NF-κB 和丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路,产生大量肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)、IL-1、IL-6等炎性细胞因子,加重炎症反应[39]。
3.3.1 SDF SDF 及其代谢物可通过受体介导的信号通路,调节机体免疫。海带和酿酒酵母来源的β-葡聚糖可在不改变Tregs 相关靶点的情况下经JAKSTAT 途径对Th17 相关细胞因子(IL-17A、IL-17F和IL-22)及受体(IL-23R 和IL-6)的表达均有免疫抑制作用,能够减轻IBD[40]。此外,阿拉伯木糖和菊粉饲喂能显著提升大鼠肠道中的黏蛋白水平,进而促进Akkermansia利用黏蛋白代谢产生丙酸,并通过Gpr43 受体作用于肠道组织,从而引起一系列通路变化以达到免疫调节作用[41]。也有研究表明,SDF 的代谢产物SCFAs 可通过GPR 途径激活NALP6 蛋白,促进肠道黏膜中杯状细胞分泌黏液,使细菌和肠上皮细胞分离,放在细菌毒素入血引起过度免疫反应[42]。可见,不同来源的SDF 调节肠道免疫途径不尽相同,可通过活化免疫细胞,调控炎性因子分泌,阻止有害菌黏附等途径缓解IBD。
3.3.2 IDF IDF 通过调节肠道免疫缓解IBD 的报道相对较少,通常以肠道菌群代谢产物或调控菌群方式间接影响肠道免疫。野山杏果肉IDF 在肠道内酵解产生的SCFAs 可降低肠道内pH,起到抑制大肠杆菌、金黄色葡萄球菌,促进乳酸杆菌和双歧杆菌的作用[43]。乳酸杆菌、双歧杆菌等益生菌的益生效果归因于其代谢产物(SCFAs、细菌素、氢过氧化物、二级胆汁酸和乳酸等)能够促进肠道环境中细胞成分的释放,进而激活免疫反应,调节IBD 中的肠道微生态失衡[44]。乳酸菌能够调节Treg 细胞频率和树突状细胞(Dendriticceils,DCs)的激活,与DCs 细胞之间的互作可能会影响随后对Th1、Th2、Th17 或Treg细胞的抗原特异性T 细胞应答[45]。此外,饲喂高纤维素饲料的小鼠显示其褪黑素受体(Melatonin receptors-1/2,Mt1 和Mt2)基因表达增加,这些基因已被发现通过抗凋亡和免疫调节在结肠炎等验证模型中发挥保护作用[46]。总之,IDF 调节肠道免疫的功能十分有限,与SDF 联用也许能发挥更好的免疫调节作用。
3.3.3 混合DFs DFs 被肠道菌群酵解产生的SCFAs(及其盐类)可调节T 细胞、B 细胞、免疫细胞(巨噬细胞、Tregs 等)以及多种信号通路(TLRs、NF-κB等)参与免疫调节,并抑制促炎因子(IL-1、IL-6、IL-17、TNF-α等)、促进抗炎因子(IL-4、IL-10、IL-13 等)等的表达,进而修复损肠粘膜,减轻肠道炎症[47]。羊栖菜和薏苡的DFs 能抑制NF-κB 转录激活以及炎性细胞中髓过氧化物酶的活性,阻止中性粒细胞和巨噬细胞的浸润,最终实现DFs 对肠道的保护[48]。此外,丁酸盐可抑制脂多糖诱导的单核细胞NF-κB 等炎性因子表达及迁移,NF-κB 的转录活性也随之降低,达到缓解肠道炎症的目的[47]。因此,DFs 酵解产生的SCFAs(及其盐类)可介导NF-κB 等信号通路在免疫和炎症反应中发挥积极作用,也可作用于免疫细胞,影响其分化、增殖和凋亡,进而影响IBD 的发生发展进程。此外,SDF 和IDF 可通过调节肠道菌群结构,上调益生菌(乳酸菌、拟杆菌等)丰度,进而与免疫系统互作维持肠道健康,间接参与机体免疫调控[28,49]。
3.4 缓解肠道炎症
炎症是机体对于刺激的一种防御反应,能够保护宿主免受非生物和生物因素引发的伤害,炎性因子是治疗肠道炎症的潜在靶点之一。炎性因子包括促炎因子(IL-1、IL-6、IL-17、TNF-α等)和抗炎因子(IL-4、IL-10、IL-13 等),二者的动态表达是平衡宿主正常免疫的关键,也是导致IBD 潜在病理学的重要原因。DFs(或肠道菌群代谢产物SCFAs)具有较好的抗炎作用,能促进抗炎因子的表达,抑制促炎因子的表达[50],从而缓解IBD 等炎性疾病。
3.4.1 SDF SDF 能被肠道菌群代谢分解为乙酸、丙酸、丁酸等SCFAs,发挥抗炎效果。阿拉伯木聚糖可通过激活INF-γ依赖的Thp 1 样免疫反应发挥抗炎作用[51],还可通过上调TLR-4 刺激COX-2,并有助于减少结肠癌细胞系中的促炎细胞因子IL-8 和TNF-α表达[52]。果胶在结肠内可被多种微生物(拟杆菌、芽孢杆菌、酵母等)完全酵解产生SCFAs 及气体(CO2、H2、CH4等)[53],抑制toll 样受体(TLR)1,2,4 通路[54],减少促炎细胞因子IL-1β表达,降低小鼠的结肠炎症反应[55]。相比DSS 模型组,IBD 小鼠饲喂大豆皮SDF 和IDF(每次100 mg/kg 体重,每日三次)均可下调结肠NF-κB 的蛋白表达和抑制TNF-α的激活,进而阻断TLR-4/NF-κB 炎症信号通路缓解IBD,但SDF 对IBD 小鼠的治疗效果优于IDF,可能是由于SDF 具有较强的发酵特性[49]。在IBD 的多种动物模型中,饲粮添加低聚果糖、果胶等SDF 已被证明可以缓解肠道炎症,其效果是增加了SCFAs产量或改变微生物菌群结构[22,56]。在一些研究中,DFs 补充剂只有结合特定饮食才有效,这也为了解饮食与DFs 补充剂间的协同效应机制提供了线索[56-57]。
3.4.2 IDF 高DFs 饮食通过改变小鼠肠道菌群和代谢物维持肠道内环境平衡,进而达到改善肠道炎症,预防IBD 的效果[46],并且可以通过全身抗炎作用提高败血症小鼠的存活率[53]。饲喂添加1.52%的大麦叶IDF 日粮,小鼠体内脱氧胆酸、熊去氧胆酸、石胆酸水平显著升高,与体重减轻、病理评分、DAI 评分和促炎细胞因子(IL-6、TNF-α和IL-1β)表达呈高度负相关,显著减轻DSS 诱导的急性IBD 症状[28],其机制可能是微生物源胆汁酸可通过胆汁酸核受体增加结肠RORγ+Treg 细胞的数量,减轻宿主对IBD的易感性,从而缓解IBD 动物模型的肠道屏障损伤和炎症。此外,纤维素可被微生物(拟杆菌、梭菌、瘤胃球菌等)发酵生产SCFAs 等产物,SCFAs 进一步通过GPR43 介导途径发挥抗炎作用,而GPR43 在结肠上皮和免疫细胞均表达,GPR43 的缺失可加重IBD[22]。
3.4.3 混合DFs 在DSS 诱导的高脂饮食小鼠IBD模型中发现,摄入豌豆DFs 可通过改善IBD 小鼠的疾病活动指数评分,降低中性粒细胞浸润,抑制单核细胞趋化蛋白1(Monocyte chemoattractant protein,MPC-1)和炎症标志物(IL-6、IL-17、环氧合酶2(Cyclooxygenase-2,COX-2)等)的mRNA 表达等途径发挥抗炎作用,缓解IBD 症状[58]。此外,糙米DFs 也可通过抑制IBD 小鼠炎症因子(COX-2,TNF-α,IL-1β等)表达、上调调节性T 细胞比例和盲肠细菌多样性(类杆菌丰度下调,肠球菌丰度上调,其中类杆菌可导致腹泻,与IBD 和结直肠癌进程有关)等途径缓解小鼠结肠炎症[59],机制可能是肠内菌群酵解DFs释放的SCFAs 和酚类化合物被肠细胞重吸收入血,进而发挥抗炎作用[60]。总的来说,DFs 可被肠道菌群发酵,改善菌群多样性,维持肠道屏障功能,此外酵解产生具有抗炎特性的SCFAs,可抑制NF-κB 等促炎因子的转录,缓解肠道炎症,降低患IBD 的风险[61]。
3.5 调节肠道菌群
肠道菌群指寄居在肠道内的微生物群(包括细菌、真菌、病毒和原生动物),是连接外界环境和肠道黏膜的纽带,与肠道健康关系密切,也是IBD 治疗药物的重要靶点[62]。肠道菌群失调,会激活T 淋巴细胞,进而产生一系列细胞因子,促发不同特征的免疫病理损伤。研究表明[63],相比健康受试者,IBD 患者肠道菌群多样性及丰度差异显著,其中拟杆菌门(Bacteroides)和厚壁菌门(Firmicutes)中的乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)等有益菌群丰度显著下调,变形菌门(Proteobacteria)和放线菌门(Actinobacteria)中的大肠杆菌(Escherichia coli,E. coli)等潜在致病菌的丰度则显著上调。其他研究也有类似结果[64-65]。据统计,健康人的胃肠道菌群以厚壁菌门和拟杆菌门成员为主,而IBD 则表现为厚壁菌门比例较低、变形菌门丰度增加为主要特征的菌群失调有关[66]。饮食摄入的DFs 主要借助肠道菌群的中介作用防治IBD 等肠道炎症疾病,主要表现在对肠道菌群多样性、丰度及代谢产物的影响[22],还可为肠道菌群提供生长底物,改善有益菌的生存环境,维护肠道内环境稳态[67]。
3.5.1 SDF SDFs 由于其可发酵性,能较显著影响肠道菌群。大鼠经高脂饮食和注射低剂量链脲佐菌素(30 mg/kg 体重)诱导肠道菌群紊乱模型,每天摄入菊粉(3 g/kg 体重)可上调大鼠肠道内乳酸杆菌(Lactobacillus)、拟杆菌(Bacteroides)、考拉杆菌(Phascolarctobacterium)等有益菌丰度,下调大肠杆菌等有害菌丰度,改善大鼠肠道菌群失调,促进肠道菌群结构正常化[6]。通过对64 项相关指标进行Meta 分析也发现类似结果[68],表明SDFs,特别是果聚糖和低聚半乳糖的干预,会显著上调肠道乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)等益生菌的丰度。SDF 发酵产生的SCFAs(乙酸酯、丁酸酯、丙酸酯等)通过多途径发挥益生作用,可为结肠黏膜细胞提供能量,减轻IBD 炎症[69-70];也可以降低肠腔pH,使肠道呈酸性状态,有助于共生保护菌株的生长,抑制拟杆菌科等病原菌的定植[71]。乳酸菌、肠球菌、双歧杆菌等肠道菌群直接负责SCFAs 的产生[72-73],SCFAs 产生的数量和速率取决于肠道菌群的丰度和多样性[74],这也说明了可通过调控肠道菌群影响SCFAs 的产生和吸收,缓解IBD。
3.5.2 IDF IDF 对机体肠道菌群结构也具有重要调节作用。小鼠饲喂添加1.52%的大麦叶IDF 日粮28 d,可显著减轻DSS 诱导的急性IBD 症状,提高Parasutterella(参与胆汁酸代谢),Erysipelatoclostridium(丁酸产生菌)和Alistipes(与IBD 症指数高度负相关)的丰度,显著降低Akkermansia丰度,其中,Akkermansia具有黏蛋白降解特性,过量Akkermansia会加剧DSS 诱导IBD 小鼠肠道屏障的破坏,加剧症状[75];当抗生素耗尽肠道菌群时,IDF 的抗IBD作用随之消失,表明IDF 的抗IBD 作用高度依赖于肠道菌群[76];通过微生物代谢产物分析,发现IDF 可增加DSS 诱导小鼠粪便中SCFAs 和二级胆汁酸的产量,表明大麦叶IDF 可通过调节小鼠肠道菌群组成和增加菌群衍生代谢物,激活特异性G 蛋白偶联受体(Gprotein-coupled receptors,GPCRs),抑制组蛋白去乙酰化酶,抑制促炎因子(IL-6、TNF-α、IL-1β)表达,强化屏障功能,发挥抗炎作用[28],类似研究结果在富含低聚果糖的菊粉、抗性淀粉和车前草DF 中均有报道[28]。
3.5.3 混合DFs DFs 在调节机体肠道菌群结构、改善肠道健康方面已有诸多报道[77-78]。SHANG 等[79]研究发现,妊娠后期母猪饲粮中添加麦麸DFs,可显著提升仔猪结肠中的乳杆菌科丰度,进而改善肠道健康。SDF 和IDF 虽然物化特性不同,但经肠道菌群酵解的主要代谢产物SCFAs(包括丁酸盐、丙酸盐等),可作为信号分子通过信号转导途径调节宿主体内多种代谢通路[80],维护肠道微生态平衡。研究发现[81],结肠癌患者粪便中丁酸盐、乙酸盐的水平显著低于健康群体,而DFs 的摄入能够显著提高乙酸盐的水平,缓解肠道炎症,表明摄入高DFs 食物,可以调节肠道SCFAs 产量及组分。因此,高DFs 饮食的保健功能可能很大程度上与SCFAs 的益生作用有关。
3.6 抑制有害菌
活动期IBD 患者肠道菌群紊乱,条件性致病菌(肠杆菌、变形杆菌等)丰度增加,可加重IBD 肠道损伤症状[81]。桂玲等[82]通过体外研究发现,大豆DFs在酶解(50 ℃,pH4.8,半纤维素酶)初始阶段对致病菌(大肠杆菌、金黄色葡萄球菌、假单胞菌等)无抑菌效果,酶解160 min 后出现抑菌效果,240 min 后抑菌效果趋于稳定,抑菌圈直径可达9.7~11.3 mm,最低抑菌浓度为5.9%,可能是由于大豆DFs 酶解到一定分子量,低聚半乳糖醛酸和半乳糖醛酸等产物可表现出明显的抑菌性。同样,山楂果胶本身也无抑菌活性,但被果胶酶水解到一定程度后,会产生小片段聚半乳糖醛酸等果胶寡糖,对大肠杆菌、金黄色葡萄球菌等均表现出较强的抑菌作用[83]。而草食动物肠道中枯草芽孢杆菌、黑曲霉等益生菌均可分泌半纤维素酶、果胶酶等。通常,IDF 相比SDF 更难降解,且酶解效率与酶活,酶解温度、pH,纤维来源、结构等因素均有关系。IBD 患者也可适当补充益生菌促进DFs 的酵解和代谢,预防或缓解IBD 的发展。此外,DFs 的另一酵解产物SCFAs,同样具有较好的抑菌效果[59]。
4 结语与展望
综上所述,补充SDF 和IDF 均能起到一定的预防和辅助治疗IBD 的效果,SDF 由于更易被肠道菌群酵解产生SCFAs(及其盐类)、次级胆汁酸等代谢产物,因而能通过强化肠道屏障功能,抑制有害菌、促进有益菌生长,调节肠道不同类型细胞的免疫反应,抑制炎性因子表达,阻止炎性细胞浸润等多途径表现出更强的缓解肠道炎症的功效,发挥益生功能。DFs在IBD 中的作用机制仍未十分明确,很难确认哪一种机制在DFs 缓解IBD 中占据主导地位,且不同来源及特性的DFs 其物化、结构和功能特性也不尽相同,对IBD 的治疗作用还需进一步研究。虽然目前多数文献指出DFs 缓解IBD 可能基于肠道菌群酵解产生的SCFAs,但随着代谢组学和超高效液相色谱技术的发展,更多菌群代谢物的结构和功能将被解析,有助于更深入挖掘DFs 缓解IBD 的机制。此外,目前多数研究数据仅限于得到最佳DFs 添加水平和治疗效果,而饮食本身是复杂的,需要把饮食作为一个整体来评估,因而不同类型的高纤新型饮食模式对IBD 的治疗效果也需更多的临床研究来证实。

