前臂截肢者残肢运动时的脑源特征:基于标准化低分辨率脑电磁断层扫描成像技术
郭峰,郝莹,陈渔
1.沈阳体育学院运动人体科学学院,辽宁沈阳市 110102;2.辽宁省优抚医院,辽宁沈阳市 110021
0 引言
2015年世界卫生组织统计显示,全球残疾人数量约占世界人口总数的15%[1]。截肢后残疾人运动功能康复一直是一个难题,原因在于学者们对截肢后大脑中枢神经系统功能变化知之甚少。
目前,仅有少数学者在这方面开展相关研究。Cusack 等[2]观察截肢者在佩戴假肢模仿假体演示运动时大脑的激活模式。Aziz-Zadeh 等[3]发现,截肢者残肢在执行运动任务时,会特异性地激活右侧颞-顶交界处的皮质区。Blank等[4]发现,上肢截肢者残肢在执行运动任务时,会特异性地激活大脑枕后区皮质。Makin 等[5]发现,人体上肢截肢后,大脑的感觉运动皮质区发生重组。
国内学者在这方面也开展一些研究。蒋光耀[6]通过功能性磁共振成像(functional magnetic resonance imaging,fMRI)技术发现,下肢截肢后大脑视觉运动皮质区的大脑皮质变薄,但是鉴于fMRI 测试时不允许受试者运动,未探究运动态下脑激活模式。同样,受到fMRI 技术对运动限制的影响,吕元媛[7]仅仅观察截肢者运动想象时脑激活源的特征,并未对残肢的实际运动进行深入研究。
以上研究结果表明,截肢患者在脑结构和脑功能方面都发生一定的可塑性变化,但是研究结果不一致。fMRI 的时间分辨率相对较低,相关研究无法探测截肢者残肢运动触发瞬时其大脑皮质采用的神经策略。因此,寻找一种具有较高时间分辨率的脑成像技术探究残肢者运动任务态下的脑神经机制显得更加重要。
脑电图具有较高的时间分辨率,可以探测到毫秒级的神经元活动[8]。因此,可以使用记录到的脑电图数据,通过特定的方法,计算出神经活动的发生源。标准化低分辨率脑电磁断层扫描成像(standard low resolution brain electromagnetic tomography,sLORETA)技术通过特定的数学算法,将在头皮上记录到的脑电图数据进行逆运算,从而得到神经元电活动发生源的强度及三维空间分布[8]。与其他脑源成像技术相比,如脑电源分析(brain electrical source analysis,BESA)、时空最大后验概率估计(spatio-temporal maximum a posteriori,ST-MAP),sLORETA定位精度更高,在精准性和抗噪声方面均具有较强的优越性[9]。目前,sLORETA 技术已经应用于各种神经中枢机制的研究中[8-11]。前期研究对上肢截肢后大脑运动皮质区的可塑性进行综述[12],总体来看,截肢后大脑可塑性变化的机制尚不清楚。
本研究通过探讨前臂截肢者残肢运动时大脑神经元活动的脑源特征,阐明人体截肢后大脑的可塑性变化特征,为截肢患者的功能康复提供基础理论支持,同时也希望为截肢患者的临床治疗和预后观察提供潜在的影像学标记。
1 资料与方法
1.1 一般资料
2019 年6 月至9 月,于沈阳市当地社区、残联以及沈阳体育学院非体育专业(如运动人体科学)共募集受试者24例,其中健全组15例,截肢组9例。两组年龄、身高、体质量无显著性差异(P>0.05)。见表1。
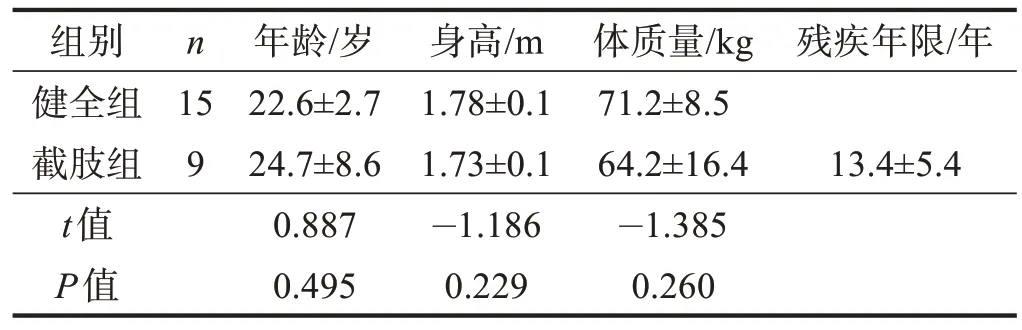
表1 两组一般资料比较
纳入标准:①年龄18~35 岁;②右利手;③非运动爱好者,且无长期运动经历;④健全组1 年内无重大疾病,无肩关节损伤史,无双上肢手术史;⑤截肢组截肢年限均在6 年以上,均为右侧腕肘关节间的肢体缺失,并无幻肢痛或手术留下的疼痛;⑥在访视期间,所有受试者的右肩(残肢)活动范围均在正常关节活动范围内。
排除标准:①肩关节有外伤史、慢性疾病或活动异常;②48 h内未充分休息或酗酒。
试验前向受试者详细介绍整个试验流程,所有受试者均同意参与本研究,并在试验前签署知情同意书。本研究经沈阳体育学院伦理委员会审批通过(伦理字[2019]1号)。
1.2 试验设计
受试者坐在座椅上,身体放松,两臂自然下垂,分别进行左右侧上臂直臂屈伸运动,包括运动前的放松、运动准备、运动执行以及运动后的再放松,共8 s,每侧肢体完成50 次屈伸运动。运动过程中要求受试者注意力集中,双眼注视电脑屏幕,在每一个阶段,电脑屏幕会出现相应的提示语。试验开始后,首先出现黑色屏幕,提示受试者保持放松;然后屏幕会出现倒计时的数字,提示受试者要注意力集中,即将开始运动;倒计时结束后会出现“运动”的指示标记,提示受试者完成上臂直臂屈曲运动,上臂屈曲到水平位置时结束,该过程需要2 s,然后上臂自然回到初始位置;此时电脑屏幕再次变成黑色,受试者再次进入休息放松阶段。重复进行,直到试验结束。两侧上肢运动顺序按照随机原则,两侧上肢运动任务之间休息5 min。运动过程中同步采集受试者的脑电(electroencephalography,EEG)信号和三角肌前束的表面肌电(surface electromyography,sEMG)信号。
1.3 sEMG信号采集与处理
sEMG 信号的采集采用双极差分记录法,两个记录通道均来自脑电采集系统,以保证EEG 和sEMG 数据采集的同步化。三角肌前束的sEMG 信号主要用于确定肌肉的激活时刻。为了更好地确定肌电激活点,将原始肌电数据采用均方根振幅法[13]进行全波整流。
1.4 EEG信号采集与分析
采用eegoTMmylab EEG 系统对受试者EEG 信号进行采集,脑电帽为64 通道的Waveguard 帽,电极分布按照10-20 国际标准分布,采样频率2 000 Hz,放大器的带通滤波范围0.1~100 Hz。接地电极位于Fpz 与Fz之间,参考电极为CPz点。测试前,受试者洗净头发并吹干。主试者为受试者佩戴脑电帽,注射导电膏、拨离头发,降低阻抗,使每个电极阻抗均<5 kΩ。
以肌电激活点作为事件相关点,选取肌电触发时刻到触发后的2 000 ms 时间窗为脑电段(0~2 000 ms),每侧肢体运动都包含50 个EEG 分段数据。原始EEG数据滤波,频率范围0.5~30 Hz,随后进行陷波50 Hz处理,以去除50 Hz 交流电干扰;将原始EEG 数据的采样频率降到250 Hz;将各个电极的重参考设置为全脑平均参考;使用独立成分分析(independent component analysis,ICA)方法对EEG 信号进行降噪处理;使用阈值法再次进行伪迹去除,阈值标准设置为±80 μV。最终,执行左上肢运动任务时的健全组无干扰的脑电分段数为(45.0±1.1)个,截肢组为(45.6±1.0)个;执行右上肢运动任务时的健全组无干扰脑电分段数为(43.7±2.7)个,截肢组为(43.1±2.4)个。两组的分段脑电数量之间均无显著性差异(t左=-1.337,P=0.195 ;t右=0.548,P=0.589)。
1.5 sLORETA处理与分析
使用加拿大蒙特利尔神经科学研究所(Montreal Neurological Institute,MNI)的MNI152 头模[14]。系统将颅内脑模拟成由6 239 个立体像素组成的数字化结构,每个立体像素之间的最小分辨率为5 mm。每个立体像素对应一个标准化电流密度,密度大小可以反映脑源的激活情况,其值越大,说明被激活区域的脑源激活强度越强;每个立体像素都对应着一个三维坐标(X,Y,Z)。根据Talairach Daemon 数据库的脑图谱将坐标位置与布罗德曼分区(Brodmann area,BA)相对应。
选取与运动相关的β 脑电波段(13~30 Hz)[9],对预处理后的脑电进行sLORETA 脑成像分析[13,15]。将电极帽电极进行三维坐标转换,根据本研究中数据特征,经过数据筛选后,最终确定61个脑电电极,这些电极基本覆盖大脑的额叶、颞叶、顶叶以及枕叶区皮质。将这61 个电极位置坐标与MNI152 中Talairach 脑图谱的坐标位置进行数字化匹配。利用头皮电极坐标对应的Talairach 脑图谱坐标进行矩阵转化,生成矩列文件,计算每个受试者特定频率段内的标准化电流密度值以及对应的激活像素位置坐标。鉴于每个BA 分区内激活的像素数目不一致,为了将标准化电流密度值在组间进行比较,将激活的立体像素所对应的标准化电流密度总和除以总的激活像素数目。
1.6 统计学分析
采用SPSS 17.0 统计学软件进行数据分析。激活的像素数目以及标准化电流密度以()表示,两组间比较采用独立样本t检验。显著性水平α=0.05。
2 结果
2.1 残肢运动
健全组上肢运动时,主要激活前额叶和顶叶皮质区(图1A)。截肢组残肢运动时,前额叶皮质激活程度低于健全组,且截肢者在顶枕区皮质激活更强(图1B)。
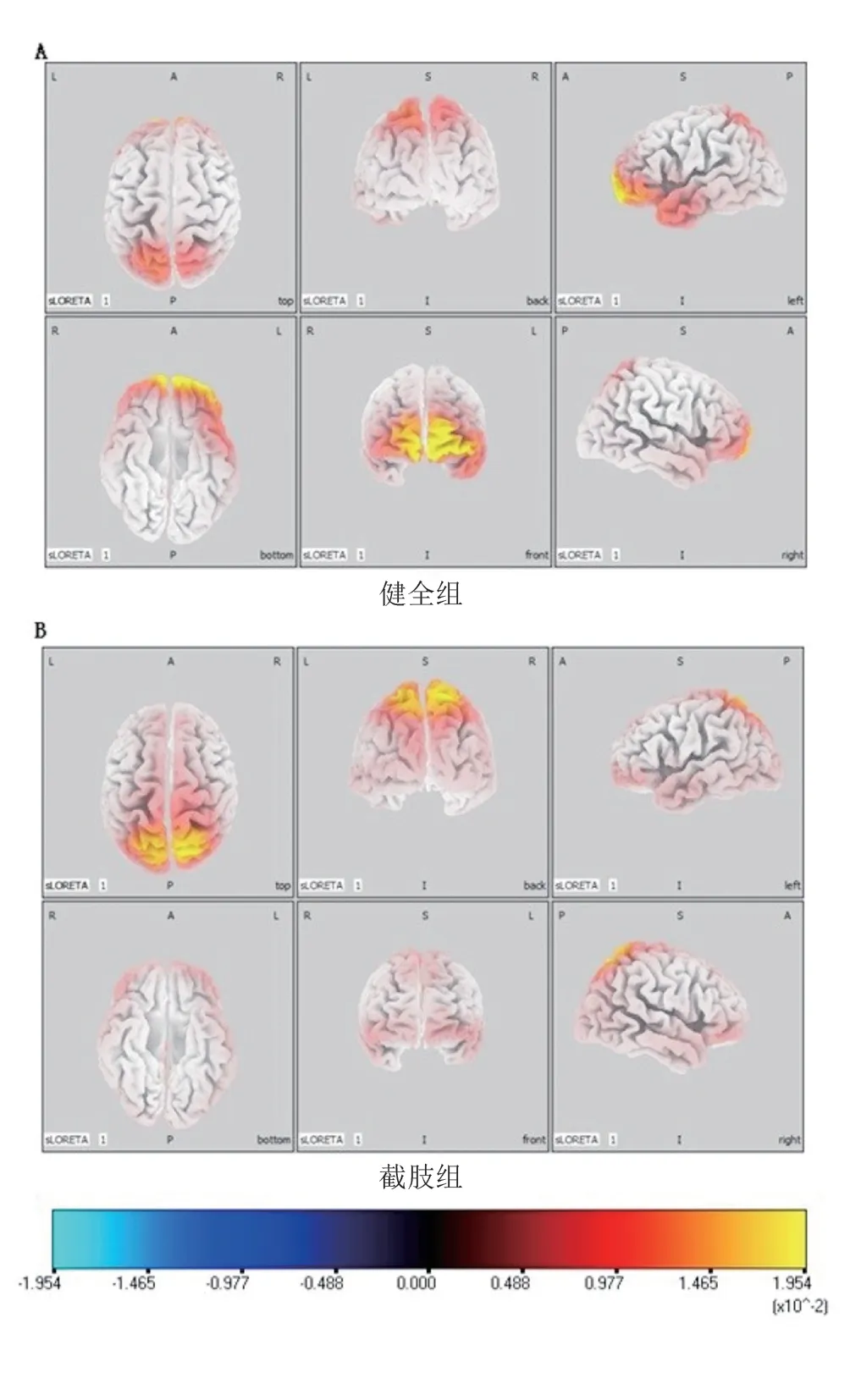
图1 截肢组残肢与健全组同侧肢体运动时β波段脑电sLORETA电流在大脑皮质的分布
健全组运动时,平均最大电流密度值为2.36×10-2μV/mm2,坐标为(-10 mm,63 mm,-7 mm),位于额叶额上回的BA10 区(图2A)。截肢组平均最大标准化电流密度值为1.00×10-2μV/mm2,坐标为(15 mm,-60 mm,63 mm),位于顶叶皮质区的顶上小叶的BA7 区(图2B)。从大脑最强激活位置坐标来看,截肢组最强激活点移向运动同侧的枕后区。见图2。
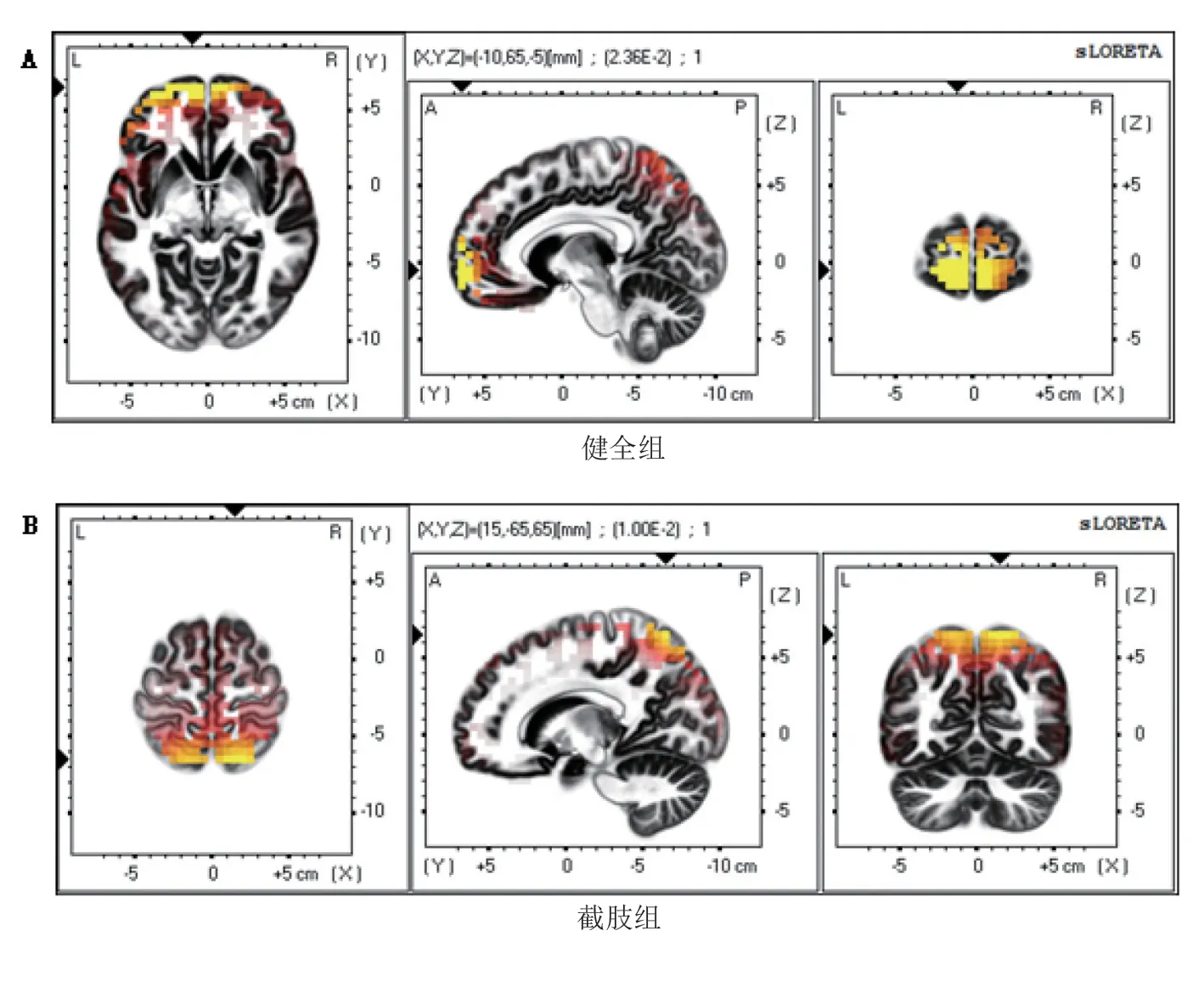
图2 截肢组残肢与健全组同侧肢运动时β波段脑电sLORETA电流最大值在大脑三个不同平面的分布
2.2 健肢运动
健全组肢体运动时主要激活大脑前额叶的额上回、额中回及顶叶皮质(图3A)。截肢组健肢运动时主要激活区与健全组相似,主要为前额叶的额上回、额中回以及顶叶皮质,但其在前额叶的激活强度更大(图3B)。

图3 截肢组健肢与健全组同侧健肢运动时β波段脑电sLORETA电流在大脑皮质的分布
健全组平均最大电流密度值为1.05×10-2μV/mm2,坐标为(5 mm,62 mm,-16 mm),位于额叶的额中回BA11 区(图4A)。截肢组平均最大电流密度值为2.51×10-2μV/mm2,坐标也为(5 mm,62 mm,-16 mm)(图4B)。从额状面可以看出,截肢组的激活强度高于健全组。见图4。

图4 截肢组健肢与健全组同侧健肢运动时β波段脑电sLORETA电流最大值在大脑三个不同平面的分布
2.3 不同脑区像素及电流密度
健全组与截肢组在上肢前臂执行直臂屈伸运动时,激活的大脑区域主要涉及中央前回、额上回、额下回、中央后回、顶上小叶、顶下小叶。截肢组残肢进行运动任务时激活的像素最多的位置与健全组同为BA7,其次是额叶BA6 以及BA10,且截肢组位于大脑枕叶的BA18、BA19 区激活的立体像素数高于健全组(P<0.05)。而截肢组在进行健肢(左臂)运动任务时,大部分脑区激活的立体像素位置与进行左臂任务的健全组无显著性差异(P>0.05)。见表2。
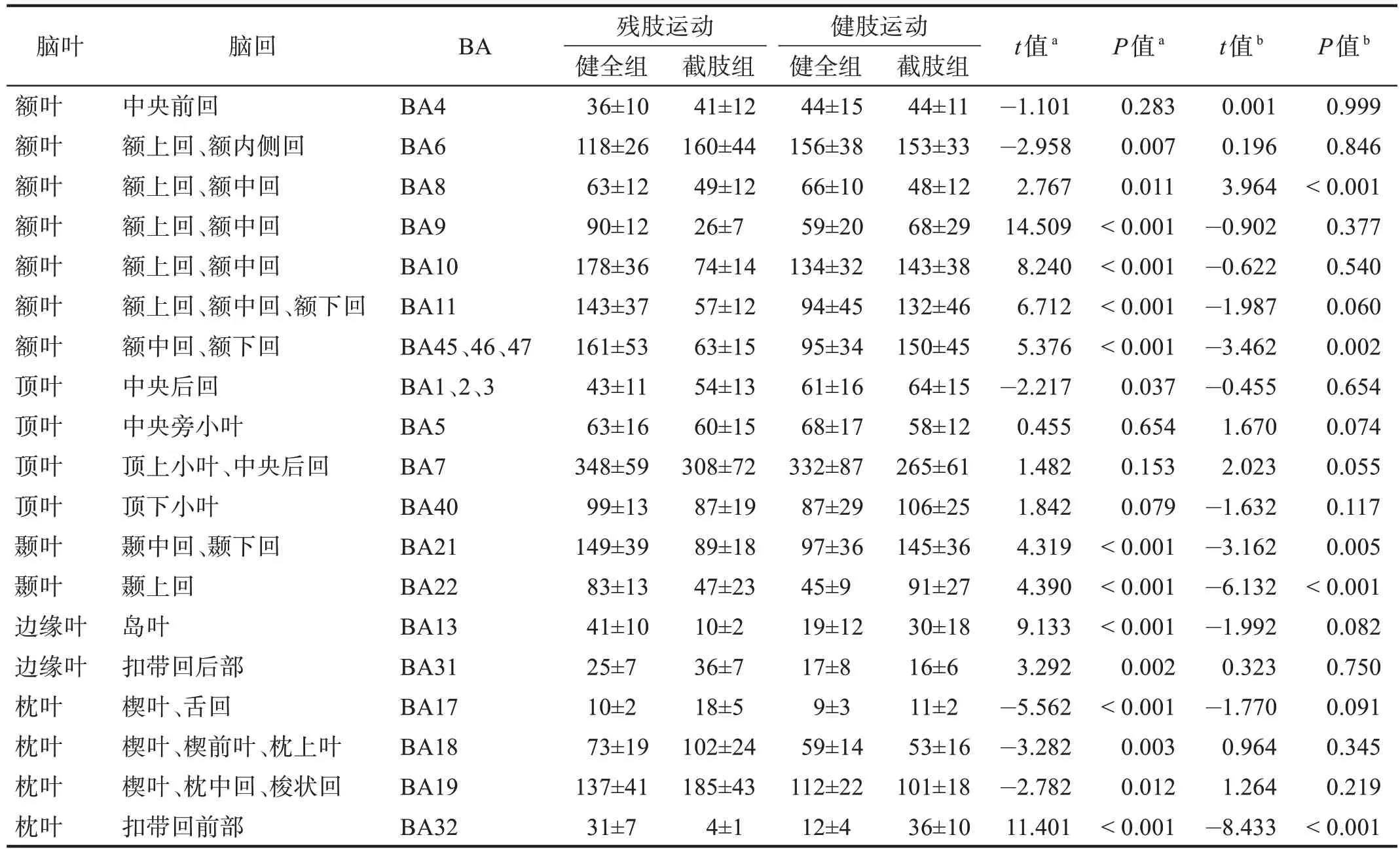
表2 两组运动执行阶段大脑不同布罗德曼分区内sLORETA立体像素激活数目 单位:n
残肢运动时,顶叶皮质BA7区内产生的电流密度值最高,其次是额叶皮质的BA5 区、枕叶皮质BA19区以及初级运动皮质区的BA4区。健全组完成同样运动任务时,激活最强的区域位于额叶额上回和额中回的BA10区,其次是BA7区、BA11区、BA5区。
截肢组残肢在执行运动任务时,额叶皮质的BA8、BA9、BA10、BA11、BA45、BA46、BA47,顶叶的BA7、BA13、BA21、BA22、BA40 区的电流密度均低于健全组(P<0.05),枕叶皮质的BA17、BA19 区的电流密度高于健全组(P<0.05)。健肢执行运动任务时,健全组与截肢组均表现为BA10 区的电流密度最高,而且主要集中在额叶皮质区,大部分分区的平均电流密度无显著性差异(P>0.05),枕叶以及额叶的额上回和额下回位置有非常显著性差异(P<0.01)。见表3。
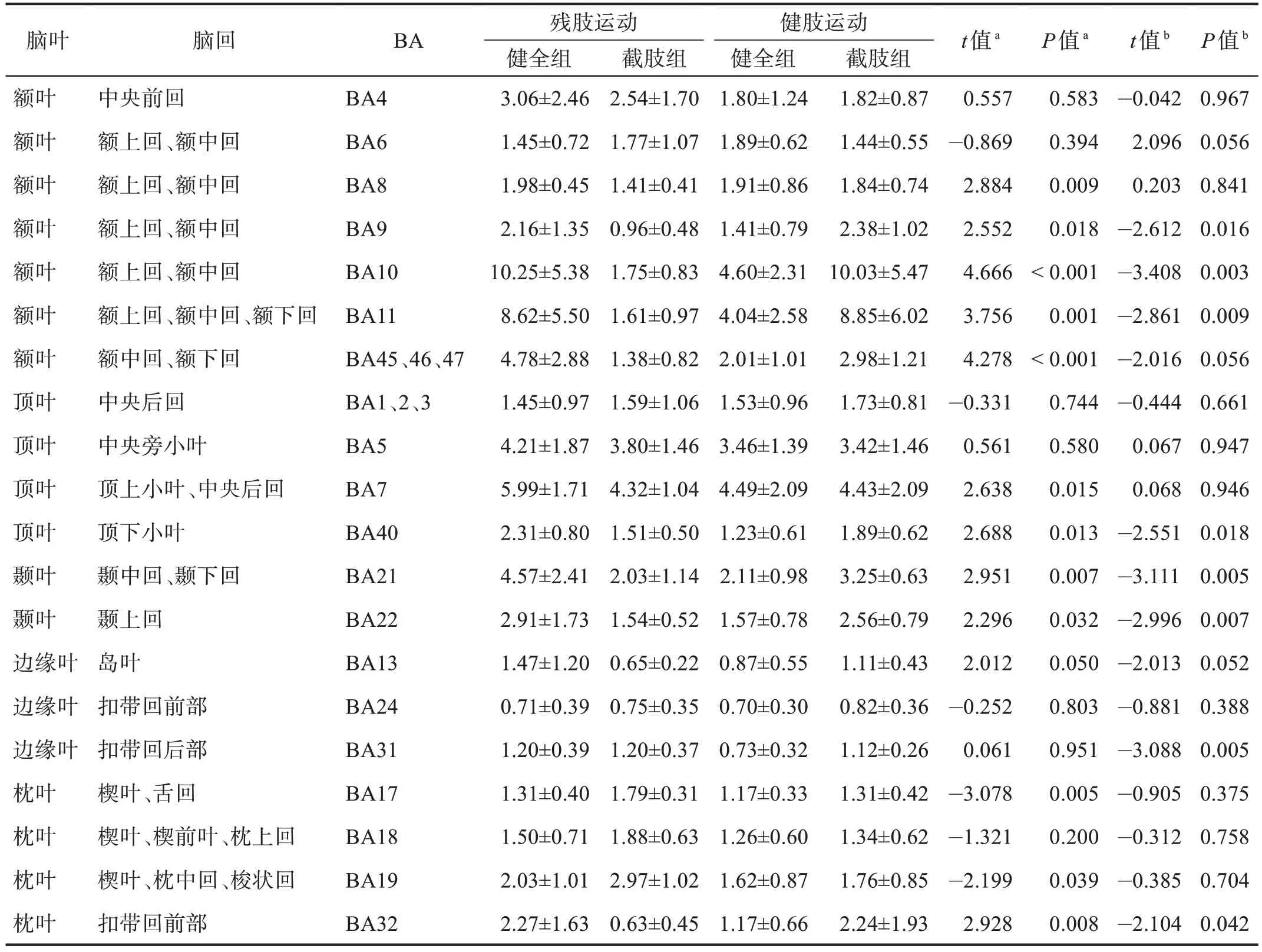
表3 两组运动执行阶段大脑不同布罗德曼分区平均sLORETA标准化电流密度 单位:×10-3 μV·mm-2
3 讨论
目前,有关人体截肢发生后,其大脑对残肢运动功能控制发生变化的脑机制研究很少,本研究以单侧(右侧)上肢截肢者为测试对象,观察受试者在进行单侧残肢和健肢运动时,大脑不同皮质区神经元电活动发生的变化,同时利用脑成像技术进行定量评估。
本研究发现,健全组和截肢组健侧上肢进行直臂屈伸运动时,其激活的大脑皮质区域比较相近。激活的脑区主要有BA1、BA2、BA3、BA4、BA5、BA6、BA7、BA8、BA9、BA10、BA11、BA21、BA22、BA24、BA31、BA32、BA40、BA45、BA46、BA47,这些脑区主要覆盖初级运动皮质区、额内侧回、额中回以及额上回皮质以及扣带回皮层,这与Nakata 等[16]的研究结果一致。而残肢进行运动时,其大脑激活模式有所不同,截肢组激活的脑区主要涉及BA1、BA2、BA3、BA4、BA5、BA6、BA7、BA8、BA17、BA18、BA19、BA22、BA24、BA31、BA32、BA40,这些区域主要涉及与视觉空间信息加工密切相关的枕区皮质[17]以及与运动相关的顶区皮质[18-19]。Bao 等[20]对上肢截肢者进行静息态下大脑fMRI 扫描后发现,大脑顶区皮质发生重组,并且认为顶区皮质重组与截肢后的幻肢感有密切关系。
截肢组残肢在执行运动任务时,激活区域与健全组同侧健康肢体运动时存在显著性差异。与健全组相比,截肢组脑源激活区域有向运动同侧(右半球)大脑后部枕区移动的趋势。BA17 为视觉皮质区,接受来自眼睛对侧视野的视觉信息;大脑枕区BA18、BA19中的楔前叶与情景记忆、自我相关信息处理以及意识等许多高级认知功能密切相关[21]。Cusack 等[2,21]发现,当截肢者进行某种无法像健全人精准完成的动作时,大脑会出现运动同侧顶、枕区皮质的激活;而模仿其他截肢者动作时,则主要表现为对侧顶、额区皮质的激活。Cusack 等[2]还发现,假肢使用者在模仿假体演示时,可以观察到典型的左侧顶、额区皮质的激活。但假肢使用者在模仿健全人动作时,会观察到另一种脑激活模式,即在右侧顶、枕区皮质表现出更强的激活模式。另外,Bruurmijn 等[22]发现,发生上肢截肢(肘关节以上)多年后,在其残肢同侧大脑半球的感觉运动皮质区,能够提取出与幻肢手部运动有关的特征性脑电信号。同样,Aziz-Zadeh 等[3]发现,截肢者残肢在执行运动任务时,除了激活左侧额叶皮质区外,还会激活其他与运动相关的区域,如右侧颞顶交界处。而Blank等[4]发现上肢截肢者残肢在执行运动任务时,大脑枕后区皮质激活。本研究结果与以上研究结果相近。Bramati等[23]认为,这种人体截肢后大脑功能发生的变化可能是由于创伤性肢体截肢后神经输入抑制,破坏了感觉运动皮质区在大脑的分布所导致。
蒋光耀[6]通过fMRI技术观察下肢截肢者大脑神经解剖学的可塑性变化,发现其大脑视觉运动区的灰质和白质成分明显减少,提示截肢者的顶、枕皮质区的功能可能发生可塑性变化。这与本研究结果基本一致。截肢组进行上臂直臂屈曲动作,出现大脑半球双侧顶、枕区激活。而顶、枕区的激活通常与运动过程中视觉空间信息的加工过程增强有关[24],也可能与其为了理解不经常使用的动作而观察动作的意图有关[25]。人体80%以上的感知信息来自于视觉[26];截肢者更多依赖视觉-运动协调信息来完成运动任务[4]。如Aziz-Zadeh 等[3]发现,截肢者残臂运动可激活同侧颞-顶区皮质的交界处。吕元媛[7]也发现,右侧上肢截肢者的大脑运动和感觉通路以及联合皮质(额叶和视觉皮质)的结构均发生萎缩;通过fMRI 技术观察右侧上肢截肢者静息态下脑网络连接的特征后发现,上肢截肢后感觉运动皮质区与视觉区的功能联系增强。这可能与截肢后适应性行为有关,即截肢者在残肢执行运动任务时,视觉信息起到重要作用[4,27]。
在本研究中,顶叶BA7区也出现了比较明显的激活,它的一个主要功能是视觉-运动协调功能。事实证明,手眼协调任务需要这些皮质区域的高度参与[28-29],这些任务可能有助于受损害肢体的感觉运动皮质区功能恢复,这为本体感觉受损后可能引起运动皮质以外的其他皮质区域发生显著变化这个论断提供了有力证据。本研究要求受试者跟随电脑屏幕的提示进行运动,需要视觉与动作配合,所以该皮质区在健全组中的激活也比较明显。总体来看,截肢组残肢在执行运动任务时激活脑区向运动同侧半球的枕区移动,这可能与截肢者神经功能重建有关,原因可能在于执行任务时运动同侧大脑半球以及视觉相关区域代偿。
综上所述,截肢者健肢执行运动任务时与正常人的脑源激活区相似。但是,在其残肢执行运动任务时,脑源激活区域有向与视觉有关的大脑枕区皮质移动的趋势,这可能是截肢者截肢后大脑出现的一种可塑性变化。
利益冲突声明:所有作者声明不存在利益冲突。

