Netrin-1、Slit2在夹脊电针结合神经松动术调节兔坐骨神经损伤后Rho GTPases失衡的作用
张立,吴珊红,赵乐乐,王艳
1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市 150001;2.黑龙江中医药大学,黑龙江哈尔滨市 150040;3.浙江省中医院,浙江杭州市 310003
0 引言
周围神经连接中枢神经与靶器官,与中枢神经系统不同的是,周围神经损伤后可自主再生修复[1],但该过程受细胞内外微环境的影响,故调节介导神经再生的相关因子,对于周围神经损伤后轴突的再生修复具有重要意义[2-3]。
Netrin-1 和Slit2 为神经生长导向因子的代表,其中Netrin-1 为神经生长吸引性信号分子,Slit2 为神经生长排斥性信号分子[4-5],二者分别与其受体DCC 和Robo 结合发挥作用,共同促进受损神经功能的恢复[6]。Rho GTPases酶系统代表分子有Rac1、Cdc42 和RhoA。Rac1、Cdc42 促进神经轴突再生[7],RhoA 抑制神经元生长迁移[8-9]。周围神经损伤后一段时间Netrin-1 和Slit2 保持高表达,而Rac1、Cdc42 表达降低,RhoA 表达升高。因此,我们推断夹脊电针结合神经松动术对周围神经损伤的治疗作用可能是通过调控Netrin-1、Slit2 的表达进而调节Rho GTPases酶系统平衡实现的。前期实验证实,夹脊电针结合神经松动术可上调Netrin-1 和Slit2 的表达,调控Rho GTPases 酶系统平衡,促进神经再生[10-11],但其作用的通路还需进一步探讨。因此,本实验构建Netrin-1、Slit2 腺病毒进一步验证Netrin-1、Slit2 在夹脊电针结合神经松动术调节兔坐骨神经损伤后Rho GTPases 失衡的作用机制。
1 材料与方法
1.1 实验动物及分组
选取新西兰家兔216 只,7~8 月龄,雌雄各半,体质量2.5~3.0 kg,由沈阳生物万类有限公司提供,生产许可证号SCXK(津)2016-0001。单笼饲养,自然光照,室温22~25 ℃。随机数字表法分为正常对照组、病毒空载组、夹脊电针结合神经松动术组、Netrin-1 组、Slit2 组和Netrin-1+Slit2 腺病毒结合组,按术后1、2、4 周3 个时间点分为3 个亚组,每个亚组12 只。实验过程均遵守国家关于善待动物的相关规定。
本实验由黑龙江中医药大学附属第二医院医学伦理委员会批准。
1.2 主要仪器及试剂
超纯水系统:香港HEAL 公司。超速冷冻离心机:湖南湘仪实验室仪器开发有限公司。微量移液器:苏州BIOHIT公司。真空干燥箱:上海SYSBERY公司。紫外分光光度计:美国THERMO 公司。荧光定量PCR 仪:韩国BIONEER 公司。水平摇床、电泳仪、转移槽、双垂直蛋白电泳仪、凝胶成像系统:北京六一生物科技有限公司。酶标仪:美国BIOTEK 公司。电热恒温培养箱:天津泰斯特公司。
全蛋白提取试剂盒、BCA 蛋白浓度测定试剂盒、一抗二抗去除液、SDS-PAGE 电泳液、SDS-PAGE 蛋白上样缓冲液、ECL发光液、Racl抗体、Cdc42抗体、RhoA 抗体、羊抗兔IgG-HRP、内参抗体β-action:万类生物科技有限公司。预染蛋白分子量标准:加拿大FERMENTAS公司。
1.3 模型制备
家兔(除正常对照组)称重标号,麻醉采用肌注速眠新0.2 mL/kg,腹腔注射10%水合氯醛2 mL/kg,结合耳缘静脉注射10%水合氯醛(剂量不超过2 mL)。待兔麻醉后,于左股部手术区域常规备皮、消毒、铺巾,股正中切口,长2 cm,游离并暴露坐骨神经股部。将止血钳的头端套输液管套,垂直深入,全齿夹神经干,时长5 min,损伤2 mm。将无菌塑料导管剪成的圆片于神经损伤平肌肉处固定作为标记。坐骨神经损伤模型由同一个人、同手法制备。
模型制备成功标准如下。①镜下观察:轴索、髓鞘、内膜断裂,神经束膜完整,符合Sunderland Ⅲ度损伤。②行为学观察:兔移动时身体重心右移,左侧髋部下降,左侧足下垂、拖地。
1.4 干预方法
正常对照组:无任何处理。
病毒空载组[12-13]:于模型制备时进行空载病毒注射。分别于神经损伤处上3 mm、下3 mm 各注射5 μL。微量注射器针头斜面朝上,切入神经外膜(切勿损伤神经内膜),深度2 mm。针头稳定后,将其旋转使针头切面朝下,缓推活塞,将病毒缓慢注入神经外膜下,可见光镜下有白色小泡鼓起。待病毒注射完成,缓慢将注射器拔出,逐层缝合。
夹脊电针结合神经松动术组:术后3 d 治疗,先行夹脊电针治疗,继神经松动术治疗。夹脊电针操作:家兔俯卧位固定,以直径0.25 mm、长25 mm 针灸针于兔L4-6脊髓节段对应椎体棘突旁0.5~1 寸内进行直刺,深度1 cm,每侧3 针,于脊柱两侧的针柄上连接电针仪。波形为疏密波,频率2 Hz/100 Hz,强度以家兔背部针柄颤动为度,每次30 min,每天1 次,每周6 d。神经松动术操作:家兔俯卧位固定,左下肢于治疗台外悬空,起始姿势为髋关节前屈45°固定,胫骨与股骨夹角30°;沿坐骨神经走向,迅速将左膝关节伸展至130°,之后放松还原至起始位置。每次操作拉伸1 s,放松5 s,每天10次,每周6 d。
Netrin-1组:于制备模型时,注射Netrin-1腺病毒(滴度为1.2×108个病毒颗粒/mL),具体操作方法与病毒空载组一致。
Slit2 组:于制备模型时,注射Slit2 腺病毒(滴度为1.6×108个病毒颗粒/mL),具体操作方法与病毒空载组一致。
Netrin-1+Slit2 腺病毒结合组:于模型制备时,注射Netrin-1 腺病毒、Slit2 腺病毒,操作方法与病毒空载组一致。
实验所需的Netrin-1 和Slit2 腺病毒的包装、纯化和滴度测定均由上海吉凯基因化学技术有限公司完成。
1.5 动物取材
术后1、2、4 周治疗结束后,取各组家兔坐骨神经(卡压处为中心,长度约2 cm)和L4-6脊髓节段(长度约3 cm 的组织)。坐骨神经:清洁无菌条件下,剪开兔皮肤、筋膜、肌肉,将坐骨神经暴露,以卡压点为中心,取2 cm神经组织。手术刀片将神经组织纵向切开,一半放入液氮中速冻,继而存入-80 ℃冰箱,一半放入4%多聚甲醛溶液中固定,以待检测。脊髓:家兔背部剃毛、备皮、消毒,以L4-6脊髓节段对应椎骨为中心做纵形切口,用剪骨钳取出目标椎骨节段,剔除周围肌肉、软组织及椎板,取出脊髓组织。以实验刀片将脊髓组织纵向分离,一半放入液氮中速冻,继而存入-80 ℃冰箱,一半放入4%多聚甲醛溶液中固定,以待检测。
1.6 检测指标
1.6.1 坐骨神经神经传导速度检测
家兔于术后第1、2、4 周,在屏蔽肌电图室内,于取材前,在体检测神经传导速度。游离损伤坐骨神经,以钩状电极刺激坐骨神经损伤部位的近远端神经干。记录刺激两点之间的潜伏期及两点距离。

1.6.2 荧光实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,qPCR)检测Netrin-1、Slit2基因表达
取出预先冻存于-80 ℃冰箱内的坐骨神经及脊髓组织。用TRIpure 试剂裂解样本,提取样本总RNA,将所得到的RNA 样本反转录得到对应cDNA,将cDNA、上下游引物、SYBR GREEN mastermix、ddH2O进行反应,采用Exicycler TM 96 荧光定量仪(韩国BIONEER公司)进行荧光定量分析。
引物序列如下。
Netrin-1:上游5'-GCA GAA CGA ACA GGA GGC A-3';下游5'-TCG GAC ACG GCG TAG AAG-3'
Slit2:上游5'-TAA TCC CTG CTT ATC CAA-3';下游:5'-TGT TTA CAC GGG TTA CTG A-3'
β-actin:上游5'-CCA GGT CAT CAC CAT CGG-3';下游5'-TGT CCA CGT CGC ACT TCA-3'
1.6.3 Western blotting
取出预先冻存于-80 ℃冰箱内坐骨神经及脊髓组织。用RIPA 裂解液提取细胞总蛋白,BCA 反应测定蛋白浓度,制备上样液。等量蛋白,经相应浓度SDSPAGE 分离,转至PVDF 膜(美国MILLIPORE 公司)。滴入相应一抗、二抗进行免疫反应。ECL 发光液底物显影。扫描胶片,凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带相对光密度值。各组目的蛋白与对照组蛋白的光密度比表示相对表达量。
1.6.4 免疫荧光双染检测Netrin-1、Slit2蛋白定位
取出预先固定于4%多聚甲醛溶液中的组织,脱水、透蜡、包埋,使其形成坚硬的蜡块。将蜡块切成厚5 μm 的薄片,先后放入99%二甲苯、乙醇(浓度梯度依次为95%,85%,75%)、PBS 中浸泡,滴山羊血清,依次加入相应一抗、二抗进行免疫反应。滴DAP复染核,PBS 浸泡,胶头滴管滴加抗荧光淬灭剂,盖玻片封片。荧光显微镜下观察染色效果,并在400×镜下拍照。
1.7 统计学分析
采用SPSS 22.0 进行统计分析,计量资料符合正态分布,以() 表示,采用ANOVA 方差分析,LSD Post-Hoc test 进行事后两两比较;若不符合正态分布,多组间比较采用秩和Kruskal-Wallis检验。显著性水平α=0.05。
2 结果
2.1 坐骨神经传导速度
术后1、2、4 周同时间点,病毒空载组及各治疗组神经传导速度均低于正常对照组(P<0.05);夹脊电针结合神经松动术组、Netrin-1+Slit2 腺病毒结合组神经传导速度高于Netrin-1 组、Slit2 组(P<0.05);夹脊电针结合神经松动术组与Netrin-1+Slit2 腺病毒结合组比较无显著性差异(P>0.05);Netrin-1 组与Slit2 组比较无显著性差异(P>0.05)。术后1 周时,病毒空载组神经传导速度高于其他治疗组(P<0.05);术后2、4周,病毒空载组低于其他治疗组(P<0.05)。除正常对照组和病毒空载组,其余各治疗组神经传导速度均在术后4周时最快。见表1。

表1 各组术后1、2、4周坐骨神经传导速度比较 单位:m·s-1
2.2 Netrin-1、Slit2 基因表达
2.2.1 Netrin-1
术后1、2、4 周同时间点,在坐骨神经及脊髓节段中,病毒空载组、夹脊电针结合神经松动术组、Netrin-1 组、Slit2 组和Netrin-1+Slit2 腺病毒结合组的Netrin-1 mRNA表达均高于正常对照组(P<0.05);Netrin-1 组和Netrin-1+Slit2 腺病毒结合组Netrin-1 mRNA表达高于病毒空载组和Slit2组(P<0.05);病毒空载组与Slit2 组间比较无显著性差异(P>0.05);Netrin-1 组与Netrin-1+Slit2 腺病毒结合组比较无显著性差异(P>0.05);夹脊电针结合神经松动术组、Netrin-1组和Netrin-1+Slit2 腺病毒结合组趋势一致,且均高于病毒空载组(P<0.05);Netrin-1 mRNA 的表达随时间推移逐渐上调,以4周表达最佳。见表2、表3。
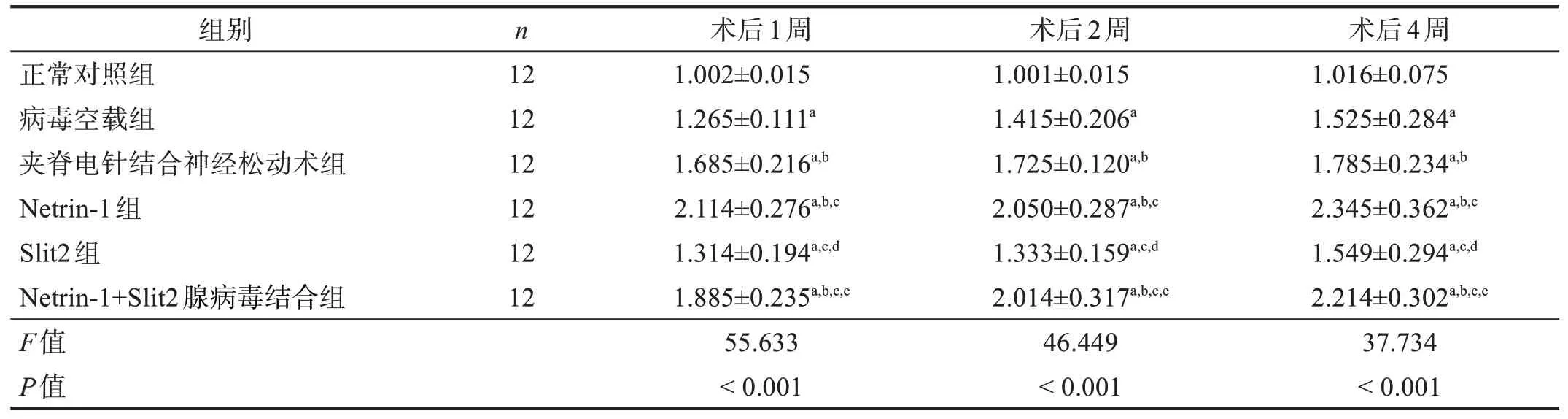
表2 各组术后1、2、4周坐骨神经Netrin-1 mRNA表达
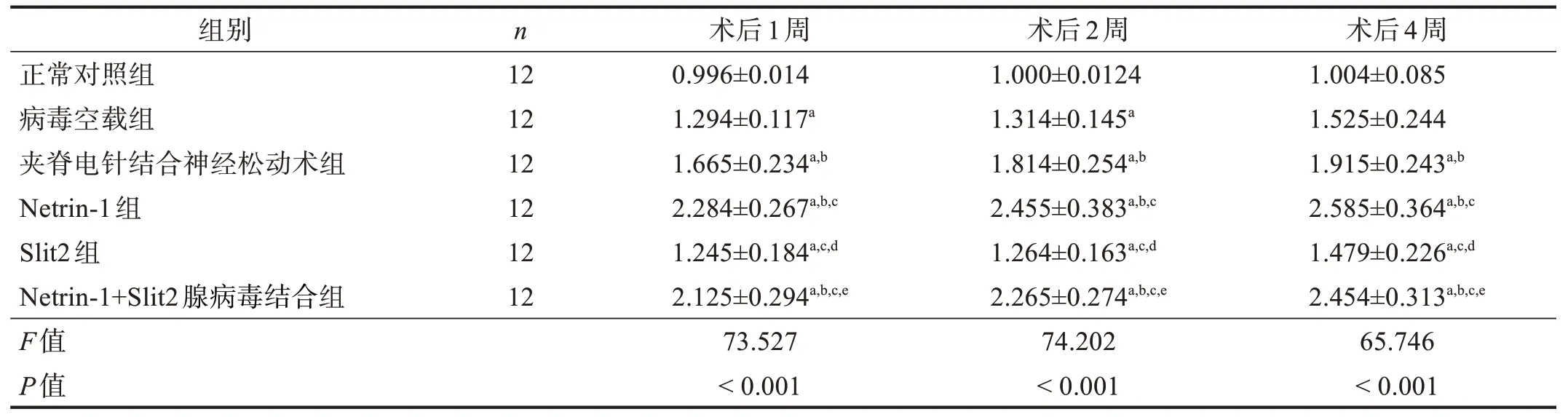
表3 各组术后1、2、4周脊髓节段Netrin-1 mRNA表达
2.2.2 Slit2
术后1、2、4 周同时间点,在坐骨神经和脊髓节段中,病毒空载组、夹脊电针结合神经松动术组、Netrin-1 组、Slit2 组和Netrin-1+Slit2 腺病毒结合组Slit2 mRNA表达均高于正常对照组(P<0.05);Slit2组和Netrin-1+Slit2 腺病毒结合组Slit2 mRNA 表达高于病毒空载组和Netrin-1 组(P<0.05);病毒空载组与Netrin-1 组间、Slit2 组与Netrin-1+Slit2 腺病毒结合组间比较无显著性差异(P>0.05);夹脊电针结合神经松动术组与Slit2组、Netrin-1+Slit2腺病毒结合组趋势一致,且均高于病毒空载组(P<0.05);Slit2 mRNA的表达随时间推移逐渐上调,以4 周表达最佳。见表4、表5。
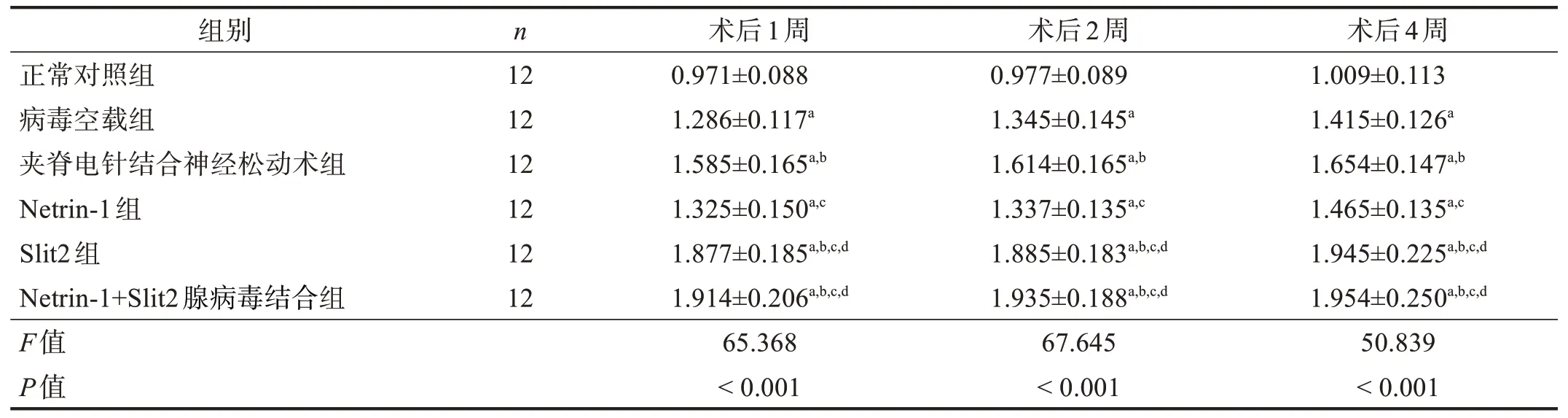
表4 各组术后1、2、4周坐骨神经Slit2 mRNA表达

表5 各组术后1、2、4周脊髓节段Slit2 mRNA表达
2.3 Rac1、Cdc42、RhoA蛋白表达
2.3.1 Rac1
术后1、2、4 周同时间点,在坐骨神经和脊髓节段中,病毒空载组、夹脊电针结合神经松动术组、Netrin-1 组、Slit2 组和Netrin-1+Slit2 腺病毒结合组Rac1表达均低于正常对照组(P<0.05);夹脊电针结合神经松动术组、Netrin-1+Slit2腺病毒结合组Rac1表达高于病毒空载组、Netrin-1组和Slit2组(P<0.05);Netrin-1 组Rac1 表达高于病毒空载组和Slit2 组(P<0.05);病毒空载组和Slit2 组比较无显著性差异(P>0.05)。在坐骨神经中,术后1 周,夹脊电针结合神经松动术组Rac1 表达高于Netrin-1+Slit2 腺病毒结合组(P<0.05)。在脊髓节段中,术后1、4 周,夹脊电针结合神经松动术组Rac1 表达高于Netrin-1+Slit2 腺病毒结合组(P<0.05)。见表6、表7。
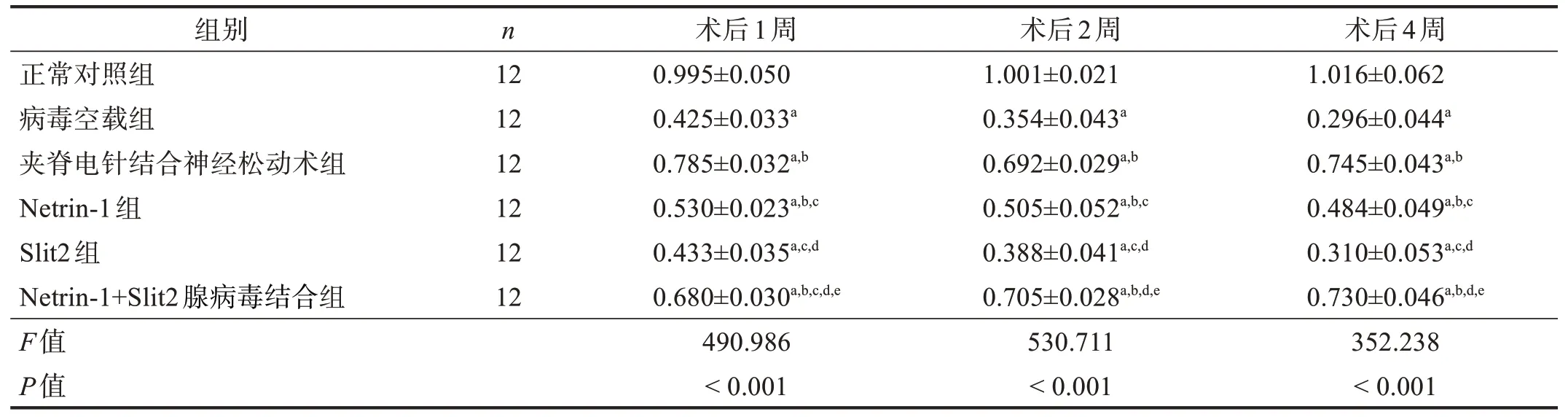
表6 各组术后1、2、4周坐骨神经Rac1蛋白表达

表7 各组术后1、2、4周脊髓节段Rac1蛋白表达
2.3.2 Cdc42
术后1、2、4 周同时间点,在坐骨神经和脊髓节段中,病毒空载组、夹脊电针结合神经松动术组、Netrin-1 组、Slit2 组和Netrin-1+Slit2 腺病毒结合组Cdc42 表达均低于正常对照组(P<0.05);夹脊电针结合神经松动术组、Netrin-1+Slit2 腺病毒结合组Cdc42表达高于病毒空载组、Netrin-1组和Slit2组(P<0.05);Netrin-1 组Cdc42 表达高于病毒空载组和Slit2 组(P<0.05);病毒空载组与Slit2 组间比较无显著性差异(P>0.05)。在坐骨神经中,术后1 周,夹脊电针结合神经松动术组高于Netrin-1+Slit2 腺病毒结合组(P<0.05);术后2、4周,Netrin-1+Slit2腺病毒结合组高于夹脊电针结合神经松动术组(P<0.05)。在脊髓节段中,术后1、4 周,夹脊电针结合神经松动术组高于Netrin-1+Slit2 腺病毒结合组(P<0.05);术后2 周,Netrin-1+Slit2 腺病毒结合组高于夹脊电针结合神经松动术组(P<0.05)。见表8、表9。

表8 各组术后1、2、4周坐骨神经Cdc42蛋白表达
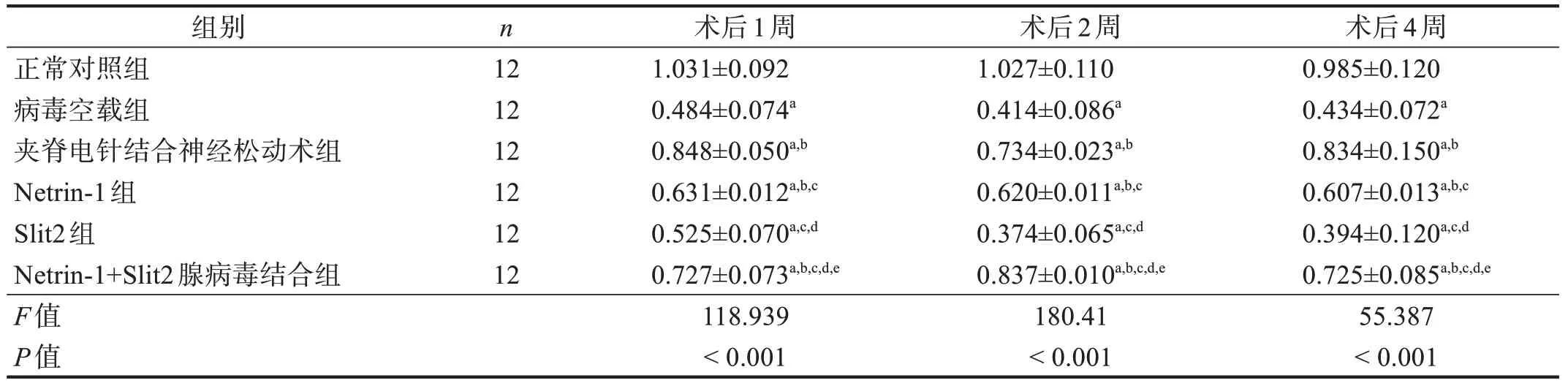
表9 各组术后1、2、4周脊髓节段Cdc42蛋白表达
2.3.3 RhoA
术后1、2、4 周同时间点,在坐骨神经和脊髓节段中,病毒空载组、夹脊电针结合神经松动术组、Netrin-1 组、Slit2 组和Netrin-1+Slit2 腺病毒结合组RhoA 表达均高于正常对照组(P<0.05);夹脊电针结合神经松动术组、Netrin-1+Slit2 腺病毒结合组RhoA表达低于病毒空载组、Netrin-1组、Slit2组(P<0.05);Slit2 组RhoA 表达低于病毒空载组、Netrin-1 组(P<0.05);病毒空载组、Netrin-1 组间比较无显著性差异(P>0.05)。术后1、4周,Netrin-1+Slit2腺病毒结合组RhoA 表达低于夹脊电针结合神经松动术组(P<0.05);术后2 周,夹脊电针结合神经松动术组低于Netrin-1+Slit2腺病毒结合组(P<0.05)。见表10、表11。

表10 各组术后1、2、4周坐骨神经RhoA蛋白表达

表11 各组术后1、2、4周脊髓节段RhoA蛋白表达
2.4 Netrin-1、Slit2 蛋白定位
2.4.1 坐骨神经
Netrin-1、Slit2 蛋白定位与PCR 表达结果趋势一致。见图1~图3。

图1 术后1周坐骨神经Netrin-1、Slit2蛋白定位(免疫荧光双染,×400)
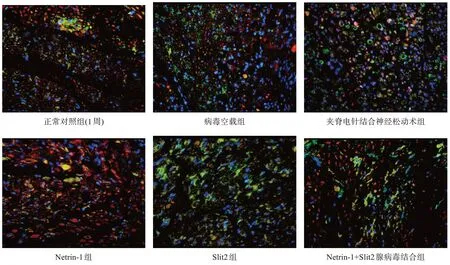
图2 术后2周坐骨神经Netrin-1、Slit2蛋白定位(免疫荧光双染,×400)

图3 术后4周时坐骨神经Netrin-1、Slit2 蛋白定位(免疫荧光双染,×400)
2.4.2 脊髓节段
Netrin-1、Slit2 蛋白定位与PCR 表达结果趋势一致。见图4~图6。
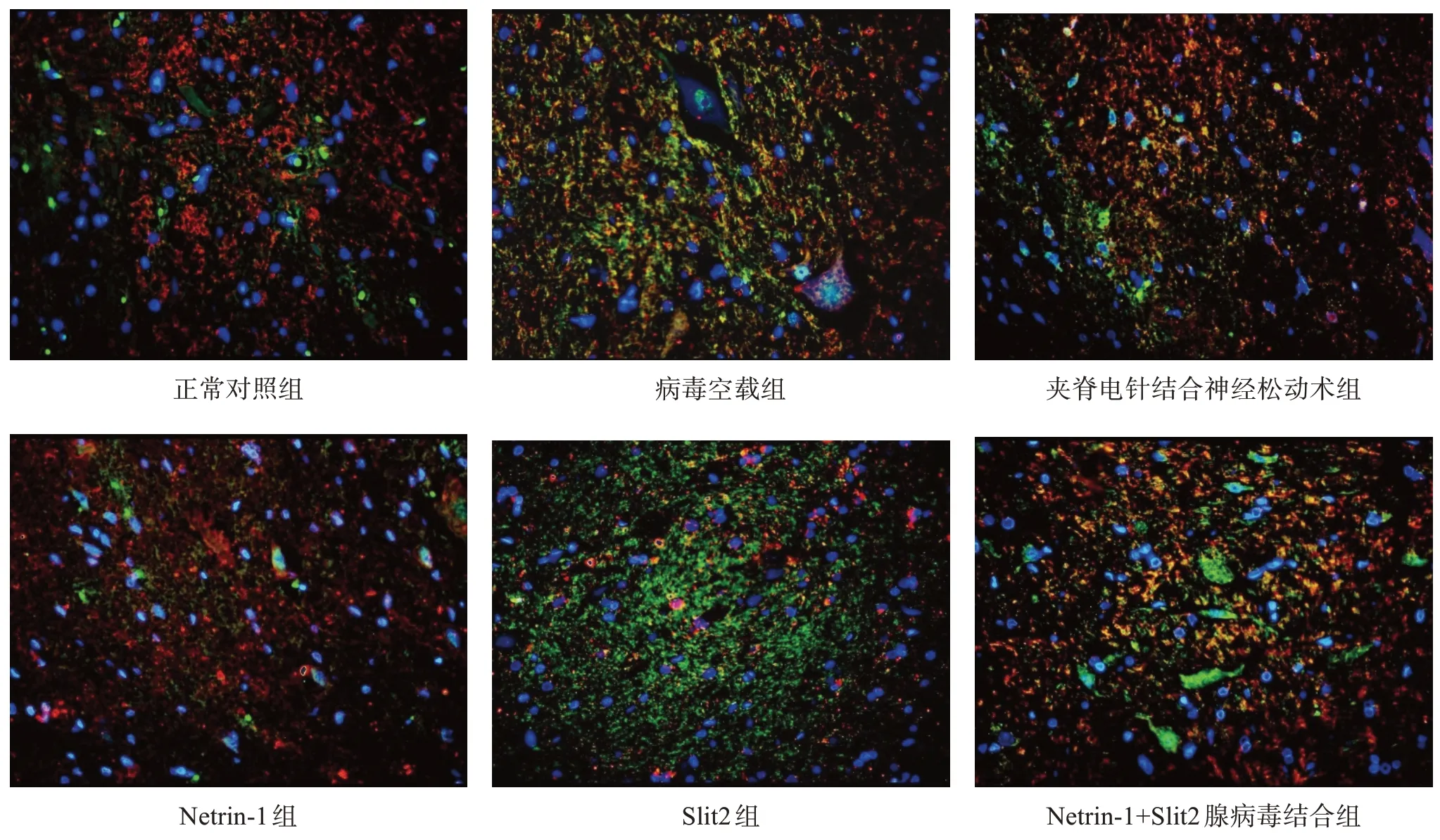
图4 术后1周脊髓组织Netrin-1、Slit2 蛋白定位(免疫荧光双染,×400)
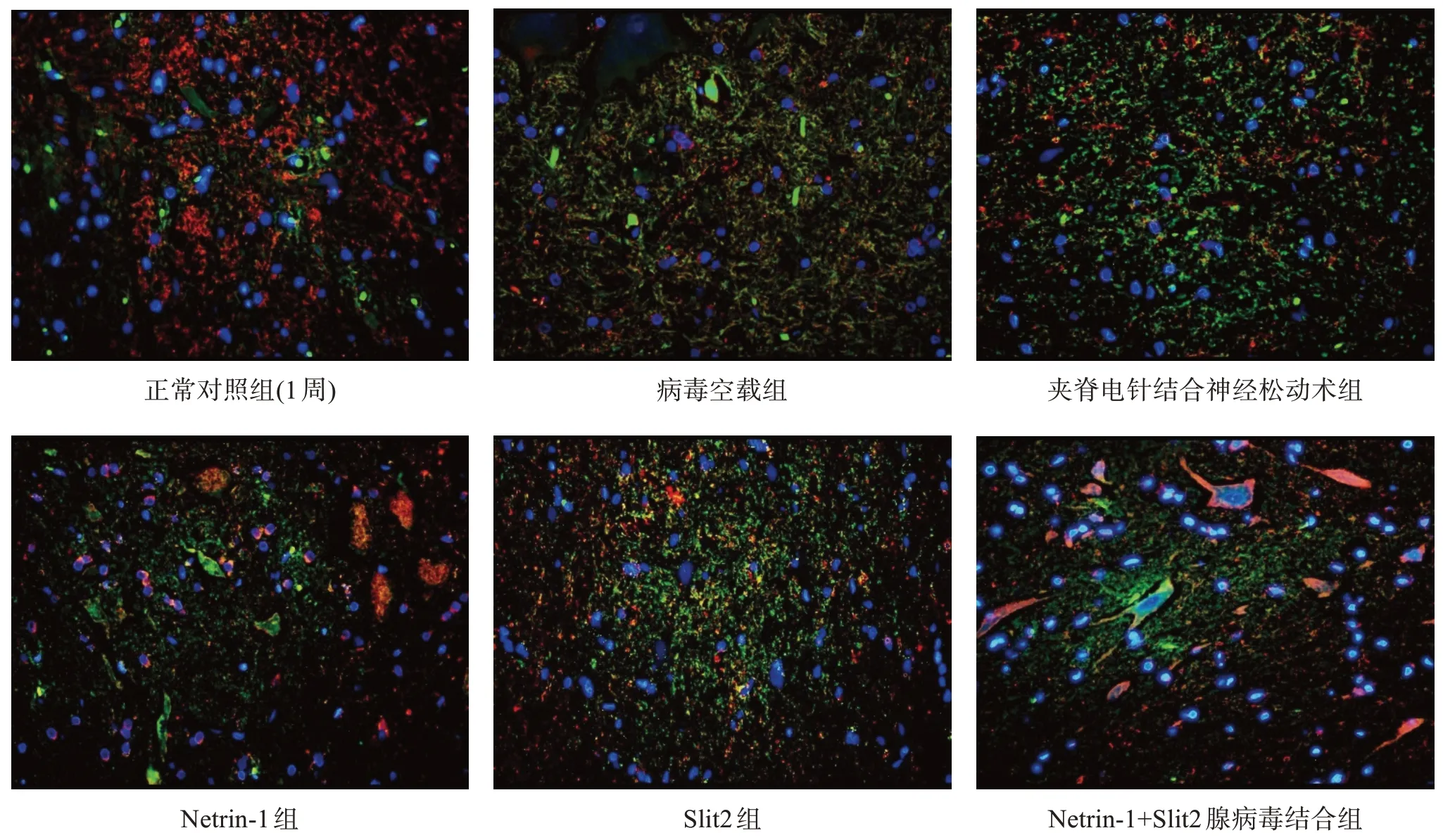
图5 术后2周脊髓组织Netrin-1、Slit2 蛋白定位(免疫荧光双染,×400)

图6 术后4周脊髓组织中Netrin-1、Slit2蛋白定位(免疫荧光双染,×400)
3 讨论
周围神经损伤后,细胞内微环境中相关吸引及排斥因子引导生长锥延伸;轴突生长方向对损伤神经的修复再生起到重要的作用。Netrin-1 和Slit2 作为神经导向因子,对于轴突再生、细胞骨架重排的调控作用是通过与其相应的受体DCC、Robo2 结合后,调控Rho GTPases 酶系统实现的。Rho 作为细胞内外信号传递的关键因子,可介导神经轴突、树突的生长,分支及导向[14]。其中Rac1、Cdc42 受吸引性信号分子Netrin-1 调控,Rac1 引导神经元迁移、增殖和存活,促进轴突生长[15],Cdc42 促进丝状伪足细胞突起、塑造细胞形态、诱导细胞迁移生长[16]。而RhoA 受排斥性信号分子Slit2 调控,过度激活RhoA,会引起生长锥塌陷,致使轴突再生障碍[17]。有研究指出[18-21],Netrin-1 与受体DCC 结合,激活下游Rho 鸟嘌呤核苷酸交换因子(guanine nucleotide-exchange factor,GEFs),促进GDP 转化为GTP,使Rho GTPases 酶系统活化,选择性调节下游因子Rac1、Cdc42,从而诱导细胞骨架重排、引导生长锥朝向、转向运动及迁移,促进轴突稳定再生,介导周围神经再生修复。胞外Slit2分子与受体Robo2 结合后,激活GAP 家族中的slit-robo GTPases 酶激活蛋白(srGAP),srGAP 与Robo2 的胞内域CC3 结合后使GAP 构型产生改变,从而将胞外信息传至细胞核,激活Rho GTPases 信号系统,细胞根据传入信息进行相应的转录翻译,介导RhoA 表达,并将信号传导至远端的生长锥,重新排列细胞骨架。由此可见,Netrin-1、Slit2 这对导向分子的吸引、排斥共同作用,整合调整再生轴突的投射轨迹,通过Rho GTPase的开关效应,将导向信号传递至生长锥中的细胞骨架,致细胞骨架重组并不断选择和修正方向与靶器官建立精确联系。周围神经损伤后Rac1、Cdc42 表达降低,RhoA 表达升高,Rho GTPases 酶系统表现失衡状态[22-23]。因此,我们推测在周围神经损伤的治疗中可通过作用Netrin-1、Slit2,从而上调Rac1、Cdc42 表达,下调RhoA 表达,促进损伤神经的轴突再生及结构功能的恢复。
前期研究显示,夹脊电针结合神经松动术可上调Netrin-1 和Slit2 及其相应受体DCC 和Robo2 的表达,促进损伤后周围神经再生[10,24];夹脊电针结合神经松动术可纠正Rho GTPases 酶系统不平衡,促进神经轴突再生[11,25-26]。可见夹脊电针结合神经松动术对周围神经损伤再生恢复效果较好[27-30]。因此,本研究通过Netrin-1+Slit2 腺病毒结合组模拟夹脊电针结合神经松动术在坐骨神经损伤后上调Netrin-1和Slit2表达的现象,进一步阐述Netrin-1、Slit2 在夹脊电针结合神经松动术治疗后对兔坐骨神经损伤Rho GTPases 失衡的调节机制。本研究显示,夹脊电针结合神经松动术可显著改善兔坐骨神经损伤后神经传导速度,促进神经功能的恢复,且各组均在术后4 周最佳。病毒空载组在1周时神经传导速度高于其他治疗组,可能是周围神经损伤后发生Wallerian 变性,在1 周时神经坏死不完全,在没有任何介入治疗的情况下,Wallerian 变性的时间段可能更长;在术后1、2、4 周同时间点,夹脊电针结合神经松动术组的Netrin-1 和Slit2 均有表达,且术后4 周达高峰,Netrin-1 组、Slit2 组、Netrin-1+Slit2 腺病毒结合组在注射病毒之后均出现相应目的基因的表达,且表达趋势与夹脊电针结合神经松动术组一致,可知周围神经损伤后夹脊电针结合神经松动术疗法可上调轴突导向因子Netrin-1 及Slit2 共同表达,促进受损神经功能恢复,与课题组前期研究结果一致;术后1、2、4 周同时间点,病毒空载组对目的基因调控性差,因此可以排除病毒对于目的基因表达的影响,Netrin-1 组和Slit2 组对于Rho GTPases 酶系统的调控优于病毒空载组,但低于夹脊电针结合神经松动术组、Netrin-1+Slit2 腺病毒组,说明单独Netrin-1或Slit2 均可调控Rho GTPases 酶系统的失衡,两者结合调控更强。
夹脊电针结合神经松动术可促进周围神经损伤后神经导向因子Netrin-1 和Slit2 的表达,同时能够调控失衡的Rho GTPases 酶系统,使该系统趋于平衡。此外,Netrin-1+Slit2 腺病毒结合组调控Netrin-1 蛋白和Slit2 蛋白表达后也会引起Rho GTPases 酶系统向平衡状态发展,与夹脊电针结合神经松动术组表达趋势相同。因此,课题组认为夹脊电针结合神经松动术促进周围神经损伤再生的作用机制可能是由Netrin-1、Slit2/Rho GTPases 酶系统信号通路介导。最后,本实验由于其他不可抗因素,选择的时间点相对较少,可能忽视神经损伤后的即刻反应,后期实验将进一步细化。
利益冲突声明:所有作者声明不存在利益冲突。

