核桃乳DNA提取方法优化与DNA条形码鉴定
黄灵芝,姜广泽,丁艳菲,朱 诚,*
(1.中国计量大学 生命科学学院,浙江省特色农产品品质及危害物控制技术重点实验室,浙江 杭州 310018; 2.杭州迪安医学检验中心有限公司,浙江 杭州 310030)
近年来我国乳饮料行业迅猛发展,以核桃乳为代表的植物蛋白饮料产量、销量成快速增长态势。核桃乳是采用现代工艺、科学加工而成,不仅口感细腻、营养丰富,还是多种微量元素的良好来源,具有健胃、补血等功效,在我国一直属于畅销产品。然而,核桃乳掺杂使假现象层出不穷,手段和方式五花八门,检测和鉴定困难重重,因过敏源成分不明对消费者的人身健康构成威胁,影响乳饮料产业稳定发展。因此,急需建立一种快捷、准确的真伪鉴定方法。DNA条形码(DNA barcoding)是一种新型的物种鉴定技术,它利用标准的短基因区域作为标记对物种进行快速、准确和高效鉴定。近年来DNA条形码已广泛应用于中草药、水产品与加工食品等多领域的物种鉴定。Stoeckle等构建了茶饮料通用条形码和,并对凉茶进行鉴定。李梅阁利用DNA条形码技术对浆果及其果汁饮料进行了种源物种真伪鉴定。但是目前基于DNA条形码技术的核桃乳饮料真伪鉴定尚缺乏研究。
高质量的核桃乳DNA对开展核桃乳DNA条形码真伪鉴定尤为重要。核桃乳属于深加工食品,繁琐的加工过程使种源物种核桃的DNA严重破坏降解,且富含多种次生物质,DNA提取更加困难。国外至今尚无对核桃乳DNA提取方法的报道,有关乳制品DNA提取方法相关研究集中在牛奶、羊乳上。Psifidi等在基于PCR的绵羊乳基因分型研究中比较分析了6种提取绵羊乳DNA的方法。Usman等通过比较2种改良试剂盒和1种传统试剂提取方法,得到了适合大量牛奶DNA提取的试剂盒方法。郭梁等通过比较3种DNA提取方法,得到适合乳制品DNA提取的试剂盒方法。总结国内外文献关于乳饮料DNA提取方法的研究,将DNA提取方法分为传统试剂CTAB方法、试剂盒方法与改良试剂盒方法。任君安等对果蔬汁饮料DNA提取方法做了研究,通过比对CTAB与植物DNA提取试剂盒方法,得到了改良试剂盒方法。韩晴等在利用植物DNA条形码技术对杏仁露中花生源性成分鉴别的研究中,采用改良深加工食品试剂盒方法,得到具备扩增条件的杏仁露DNA。杨硕等采用植物核酸提取试剂盒得到核桃乳DNA,质量体积分数为10~40 ng·μL,/为1.6~2.2。上述方法提取的DNA浓度偏低,纯度不高,质量不佳。因此,本研究筛选得到核桃乳DNA提取最佳预处理方式,比较不同核桃乳DNA提取方法,筛选出适合核桃乳DNA高质量提取的最佳组合方法。在此基础上,设计针对核桃的特异性基因--,对样本进行核桃乳成分鉴定;并选取常见植物候选DNA条形码基因-,测序比对以完成核桃乳掺假鉴定。
1 材料与方法
1.1 材料与试剂
从国内市场购得国内一二线城市在售的10种核桃乳和10种坚果。该10种核桃乳中的核桃含量基本一致,均有蛋白沉淀,但色泽不同。每种样品各取3个生物学重复,且随机排序并编号(1~30)。10种坚果分别为核桃、腰果、巴旦木、夏威夷果、碧根果、榛子、杏仁、大豆、花生、松子。样品置于4 ℃保存。
十六烷基三甲基溴化铵(CTAB)、乙二胺四乙酸(EDTA)、Tris-HCl、氯化钠(NaCl)、异丙醇、Tris饱和酚、氯仿购于杭州米克化工仪器有限公司;康为新型植物基因组DNA提取试剂盒(简称康为试剂盒)购于北京康为世纪生物科技有限公司,爱思进植物基因组DNA提取试剂盒(简称爱思进试剂盒)购于爱思进康宁生命科学有限公司,天根深加工食品DNA提取试剂盒(简称天根试剂盒)购于天根生化科技(北京)有限公司;核酸染料goldview购于北京庄盟国际生物基因科技有限公司,低电渗琼脂糖购于生工生物工程(上海)股份有限公司;普通PCR试剂盒ExPrimix和DNA marker购于宝生物工程(大连)有限公司。引物与测序由生工生物工程(上海)股份有限公司完成。
1.2 仪器与设备
快速PCR仪,AnalytikJenaAG德国耶拿;电泳仪与凝胶成像系统,上海天能,EPS300,5200Multi;冷冻离心机,美国BeckmanCoulter,Microfuge20R;真空冻干仪,美国LABCONCO FreeZone2.5Plus;微量核酸蛋白测定仪,杭州奥盛仪器,Nanodrop-100。
1.3 方法
1.3.1 核桃乳与坚果DNA提取
预处理方法筛选。方法1(静置抽提):核桃乳静置30 min,底部吸取0.5 mL沉淀乳直接提取。方法2(异丙醇沉淀):吸取1 mL核桃乳,加入等体积异丙醇,混合均匀,沉淀10 min,室温12 500×离心5 min,弃上清后重复操作1次,所得沉淀进行DNA提取。方法3(抽真空冻干):将核桃乳混匀后分装至一次性培养皿,真空冻干机冷冻48 h,所得干粉进行DNA提取。利用国家食品药品监督管理总局《植物蛋白饮料中植物源性成分鉴定》中的方法,分别对不同预处理的核桃乳进行DNA提取。
DNA提取方法比较。采用微量提取,每种方法对每个样品进行3次重复实验。对6种DNA提取方法进行比较,分别为2种CTAB裂解沉淀方法、3种试剂盒方法和CTAB与爱思进试剂盒结合方法。其中,2种CTAB裂解沉淀方法依照参考文献和国家标准方法操作,CTAB方法1参照《果蔬汁饮料DNA提取方法比较研究》的方法;CTAB方法2根据国家食品药品监督管理总局《植物蛋白饮料中植物源性成分鉴定》提供的植物蛋白饮料DNA提取方法。3种试剂盒方法分别为康为试剂盒、爱思进试剂盒和天根试剂盒,操作流程以说明书为准。CTAB与爱思进试剂盒结合方法详细步骤如下:
1)称取真空冻干样品100 mg至研钵中,加液氮轻轻研磨,将研钵放于56 ℃水浴至样品粉末刚开始融化,加入500 μL预热的改良CTAB裂解液(质量分数3% CTAB、0.1 mol·LTris-HCl,pH调控为8.0,0.02 mol·LEDTA,1.4 mol·LNaCl,体积分数0.2%-巯基乙醇,质量分数2%聚乙烯吡咯烷酮)、4 μL RNaseA和10 μL Proteinase K(20 mg·mL),混合成乳液,转移至灭菌的2 mL Eppordorf管中,加入300 μL Buffer C-L,漩涡振荡30 s。
2)56 ℃水浴孵育2 h,其间每隔5~10 min上下颠倒振荡1次,裂解至越澄清越好。
3) 加入500 μL Tris饱和酚∶氯仿∶异戊醇(体积比25∶24∶1),混匀,加入500 μL Buffer P-D,轻轻振荡1 min,室温抽提10 min,12 500×离心10 min,离心温度15 ℃。
4)将上层水相转移至新的离心管中,加入等体积的氯仿∶异戊醇(体积比24∶1),充分混匀,静置5 min,12 500×离心8 min。
5)将上清液转移至新的离心管中,加0.8倍体积的异丙醇(4 ℃ 冰箱预冷),轻轻混合均匀,-20 ℃冰箱静置20 min,12 500×离心10 min,弃上清液,保留沉淀。
6)加入500 μL的70%乙醇,上下颠倒,充分洗涤。12 500×g离心3 min,弃上清,加入500 μL的无水乙醇,上下颠倒,充分洗涤,12 500×g离心3 min。
7)用滤纸吸干多余水分,在超净台吹干或室温晾干。加入50 μL预热洗脱缓冲液TE,静置15 min。测DNA浓度与质量。
坚果DNA提取。坚果经液氮研磨成粉末后取0.1 g,采用CTAB沉淀法提取DNA。
基因组DNA纯度和浓度检测。利用NanoDrop Lite微量核酸蛋白测定仪测定以上不同方法提取的核桃乳DNA,由/和浓度(ng·μL)判定DNA的纯度和浓度;通过琼脂糖凝胶电泳检测所提DNA片段质量。
1.3.2 PCR扩增与产物测序
采用文献报道植物通用基因-03对不同方法所提核桃乳DNA进行PCR扩增,检测所提DNA是否具备扩增条件。依据常见植物候选DNA条形码基因-,设计核桃物种特异性基因--对10种核桃乳样品DNA进行PCR扩增,对样本进行造假情况鉴定。利用常见植物候选DNA条形码基因-对10种市售核桃乳样品DNA进行PCR扩增,对样本进行掺假情况鉴定。引物序列见表1。
PCR扩增采用25 μL体系:12.5 μL的ExPrimix,正反引物各0.5 μL,DNA模板1 μL,无菌水10.5 μL。PCR程序为:95 ℃预变性5 min,共35个循环(95 ℃变性30 s、退火30 s、72 ℃延伸30 s);72 ℃终延伸10 min,最后4 ℃保温。PCR产物经琼脂糖凝胶进行电泳,并由生工生物工程(上海)股份有限公司进行双向测序。将测序结果在NCBI上进行BLAST比对,利用DNA条形码分析鉴定核桃乳是否掺假。
2 结果与分析
2.1 核桃乳最佳预处理方法
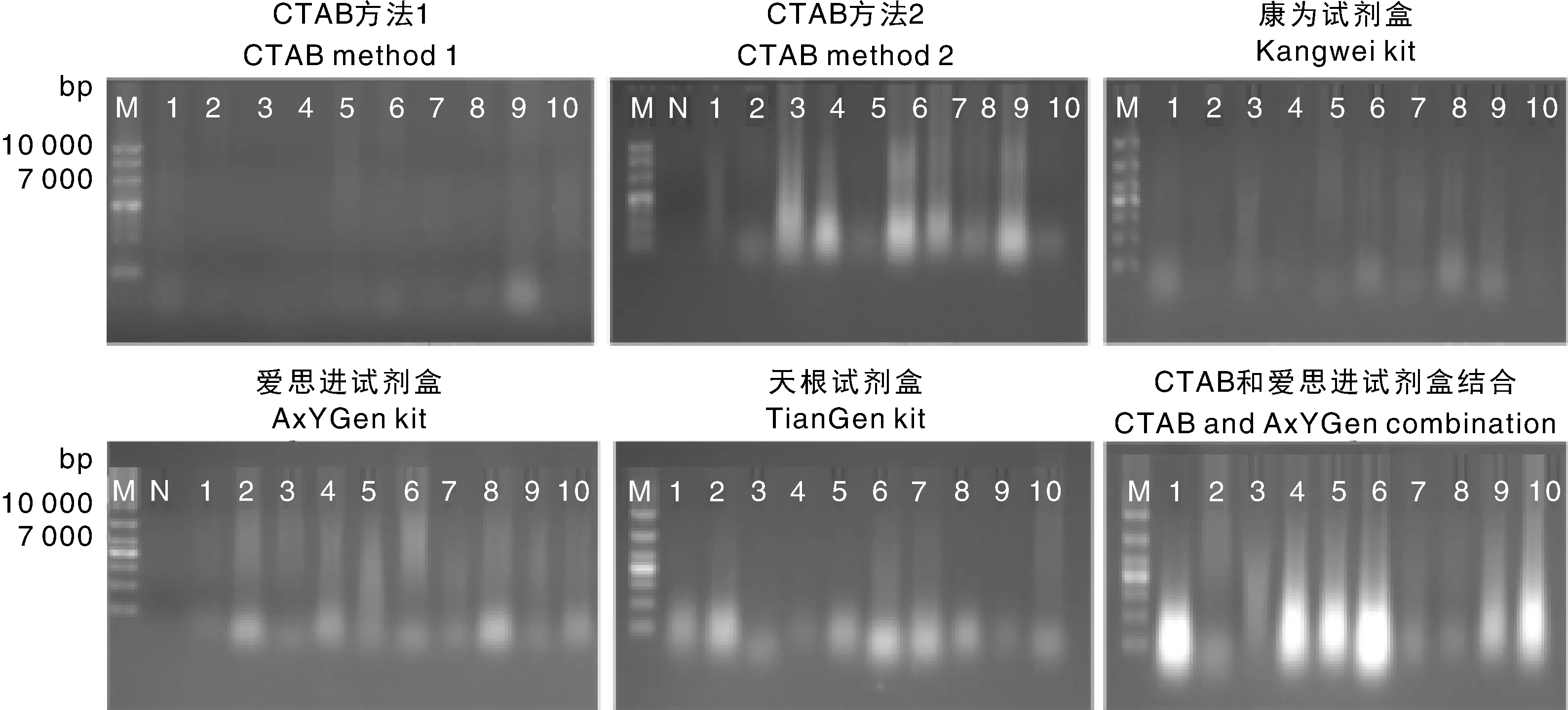
核桃乳是深加工食品,DNA破坏严重。所得大部分DNA片段小,部分长片段DNA因浓度低,电泳图上无清晰完整条带。3种预处理方法DNA电泳图差异明显(图1),方法1静置沉淀方式处理后所得DNA只有个别存在DNA小片段,方法2异丙醇离心方式处理所提DNA全部呈现降解弥散状,方法3抽真空冻干方式所提DNA存在明显小片段。由表2可以看出,方法1与方法2的浓度高低不均,/普遍超出DNA标准范围;方法3测定的浓度符合扩增要求且纯度值接近DNA标准值1.80。因此,方法3抽真空冻干预处理方式最适合用于核桃乳DNA提取。
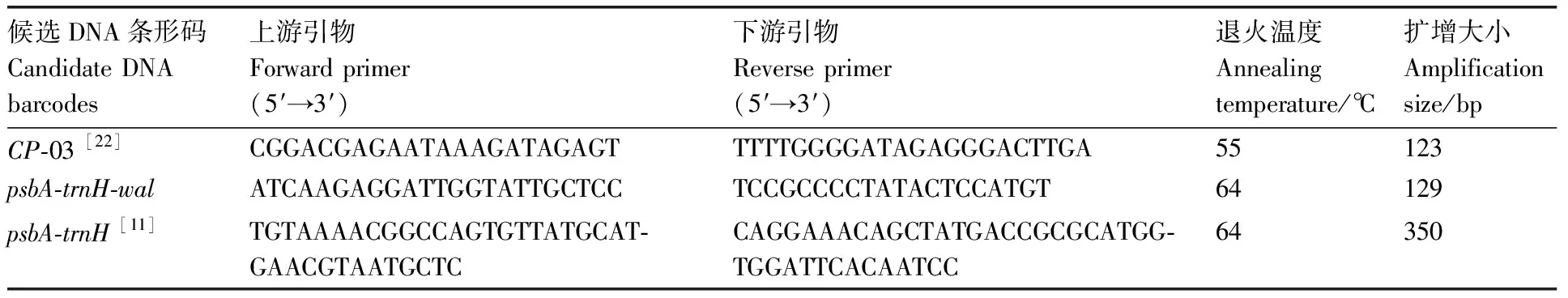
表1 基因引物序列

M,10 000 bp DNA 分子量标准;N,空白对照;方法1,静置沉淀;方法2,异丙醇沉淀;方法3,抽真空冻干;1~30,核桃乳样品编号1~30。M, 10 000 bp DNA marker; N, Negative; Method 1, Static extraction; Method 2, Isopropanol precipitation; Method 3, Vacuum lyophilization; 1-30: Sample serial number 1-30.图1 三种不同预处理方法提取的核桃乳DNA电泳图Fig.1 DNA electrophoresis of walnut milk extracted by three different pre-treatment methods
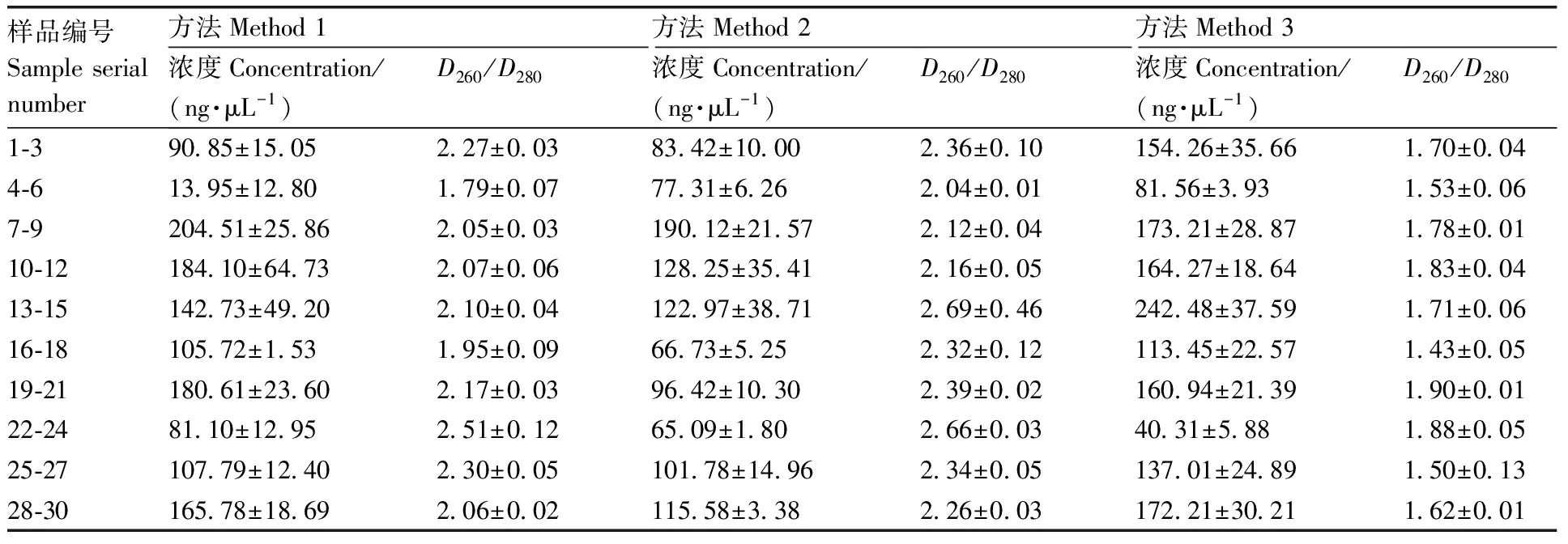
表2 三种预处理方法提取的核桃乳DNA浓度和纯度
2.2 六种DNA提取方法的比较结果
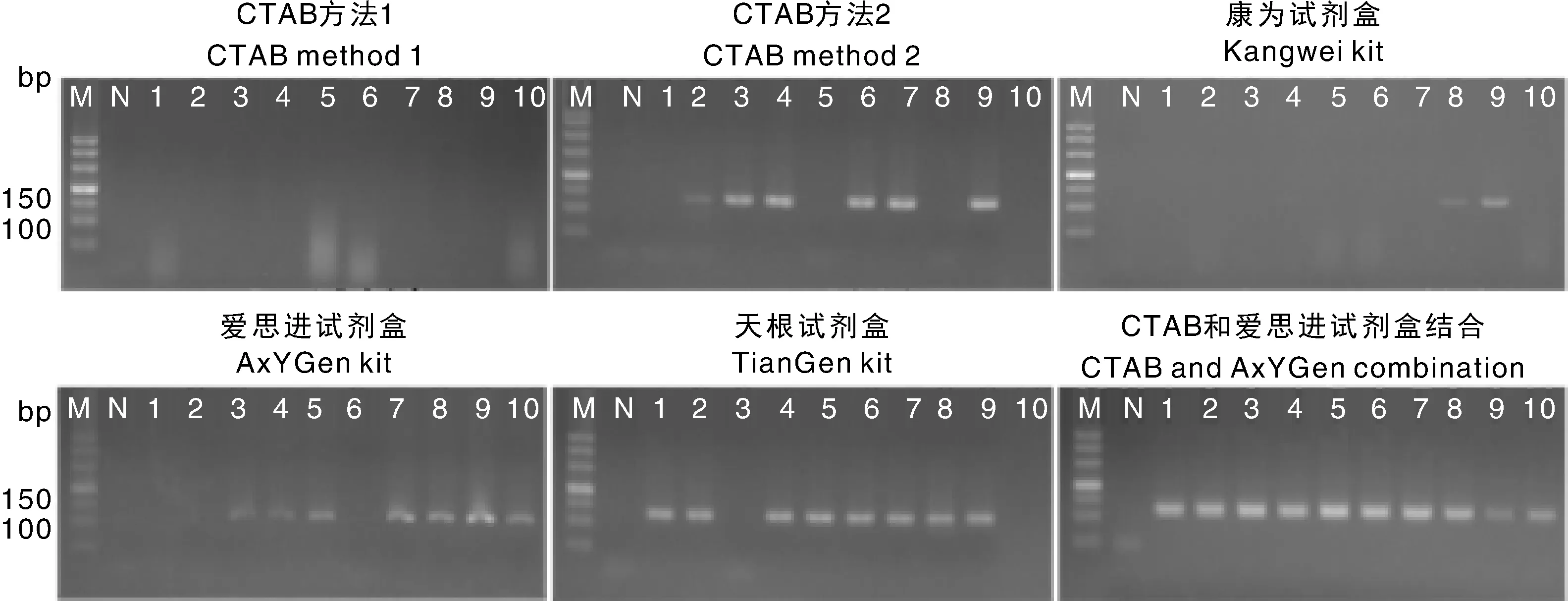
分别采用CTAB方法1、CTAB方法2、康为试剂盒、爱思进试剂盒、天根试剂盒和CTAB与爱思进试剂盒结合这6种方法,对真空冻干预处理的核桃乳进行DNA提取,并进行琼脂糖凝胶电泳。结果(图2)显示,天根试剂盒方法和CTAB与爱思进试剂盒结合2种方法所提核桃乳DNA质量优于其他方法,尤其是CTAB与爱思进试剂盒结合方法,所提DNA条带明亮且片段长,相对完整性好。表3显示:CTAB与爱思进试剂盒结合方法所得DNA纯度最高,最接近DNA标准值1.80,且浓度高于其他3种试剂盒方法;CTAB方法1虽浓度高,但纯度差。利用植物通用基因-03对6种方法所提核桃乳DNA进行PCR扩增,扩增结果如图3所示。与其他提取方法比较,CTAB与爱思进试剂盒结合方法、天根试剂盒方法提取的核桃乳DNA的扩增效率较高。其中,CTAB与爱思进试剂盒结合方法所提核桃乳DNA在123 bp处有明显条带,条带单一且无引物二聚体,与-03基因片段大小相符,扩增效率为100%,符合DNA条形码后期实验扩增要求。因此,CTAB与爱思进试剂盒结合方法为核桃乳DNA的最佳提取方法。
M,10 000 bp DNA分子量标准;N,空白对照;1,样品编号1-3;2,样品编号4-6;3,样品编号7-9;4,样品编号10-12;5,样品编号13-15;6,样品编号16-18;7,样品编号19-21;8,样品编号22-24;9,样品编号25-27;10,样品编号28-30。M, 10 000 bp DNA marker; N, Negative; 1, Sample serial number 1-3; 2, Sample serial number 4-6; 3, Sample serial number 7-9; 4, Sample serial number 10-12; 5, Sample serial number 13-15; 6, Sample serial number 16-18; 7, Sample serial number 19-21; 8, Sample serial number 22-24; 9, Sample serial number 25-27; 10, Sample serial number 28-30.图2 六种方法提取核桃乳DNA电泳图Fig.2 DNA extraction of walnut milk by six methods
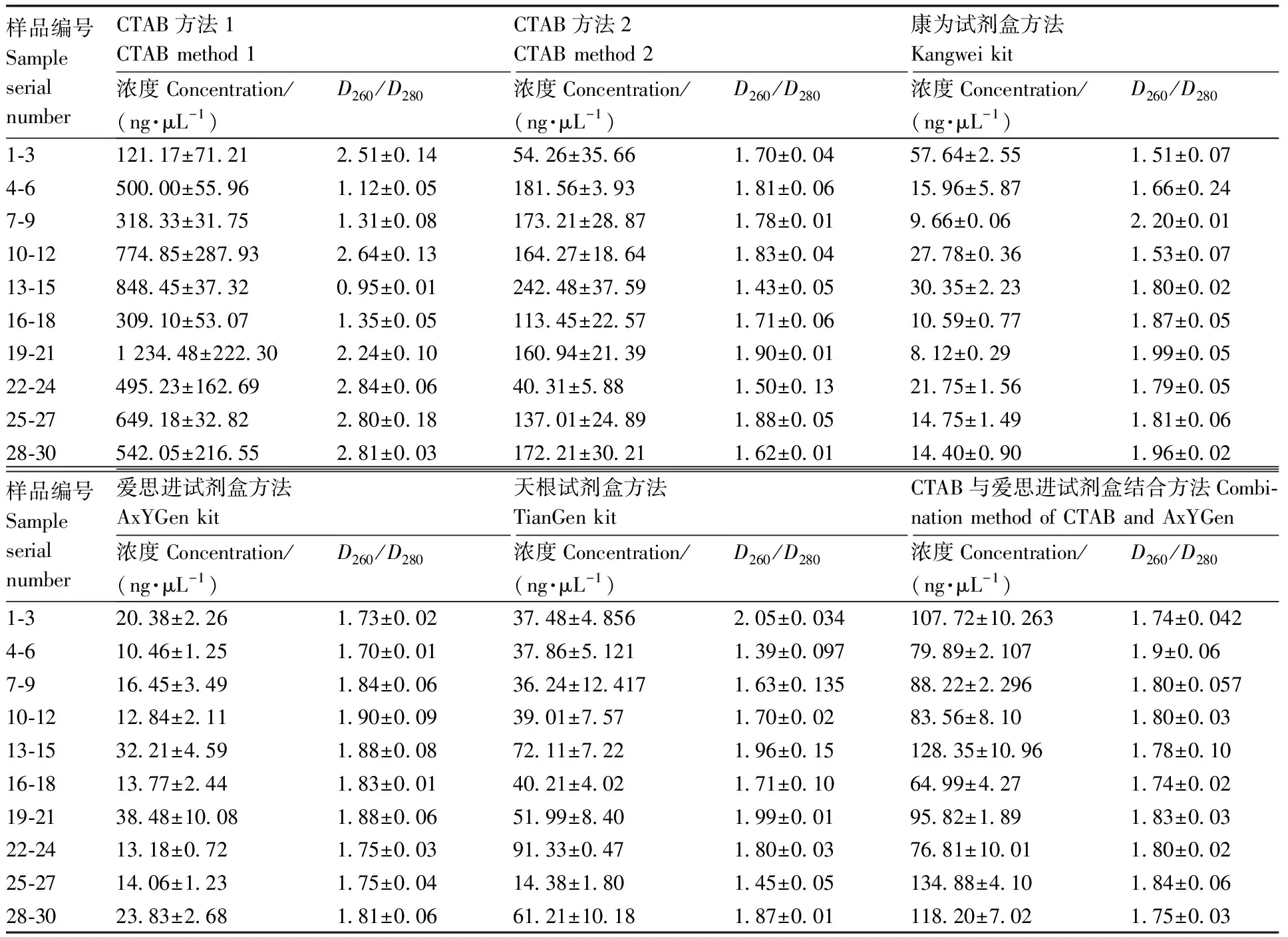
表3 六种方法提取核桃乳DNA浓度与纯度(n=3)
M,500 bp DNA 分子量标准;N,空白对照;编号1-10同图2。图5同。M, 500 bp DNA marker; N, Negative; Numbers 1-10 were the same as in figure 2. The same as figure 5.图3 六种方法提取核桃乳CP-03基因扩增结果Fig.3 Amplication results of CP-03 gene from walnut milk by six methods
2.3 核桃物种特异性基因psbA-trnH-wal鉴定结果
对样本进行核桃乳成分鉴定,设计核桃物种特异性引物Wal-F和Wal-R,对10种不同品牌核桃乳和10种坚果的DNA样品进行PCR扩增,3次生物学重复。结果显示,10种坚果(图4-A)中只在核桃的3组DNA样本(样品编号1-3)中有扩增条带,说明引物特异性良好;10种核桃乳(图4-B)中有29个DNA样品中有扩增条带,第25号样品没有扩增出条带,第26和27号成功扩增出条带,说明该样品含有核桃成分;而第25号样品可能在实验操作上出现了问题,故没有扩增出条带。表明这10种核桃乳均含有核桃成分。
2.4 常见植物候选基因psbA-trnH鉴定和测序比对结果
为了验证核桃乳是否存在掺假行为,以CTAB与爱思进试剂盒结合方法提取的10种品牌30个核桃乳DNA为模板,分别用DNA条形码基因-进行PCR扩增检测,并将产物进行测序。核桃乳DNA均能扩增出单一且清晰、长度为350 bp的目的条带(图5)。将扩增序列在NCBI数据库进行BLAST分析,结果显示,绝大部分核桃乳样品(1-21号、25-30号)测序比对结果为核桃,与标签中的优质核桃仁相符。22-24号品牌标签为优质核桃仁,但是其DNA扩增测序比对结果为花生,比对结果相似度为100%,与标签标注的原材料不一致,存在标签错误标注行为。
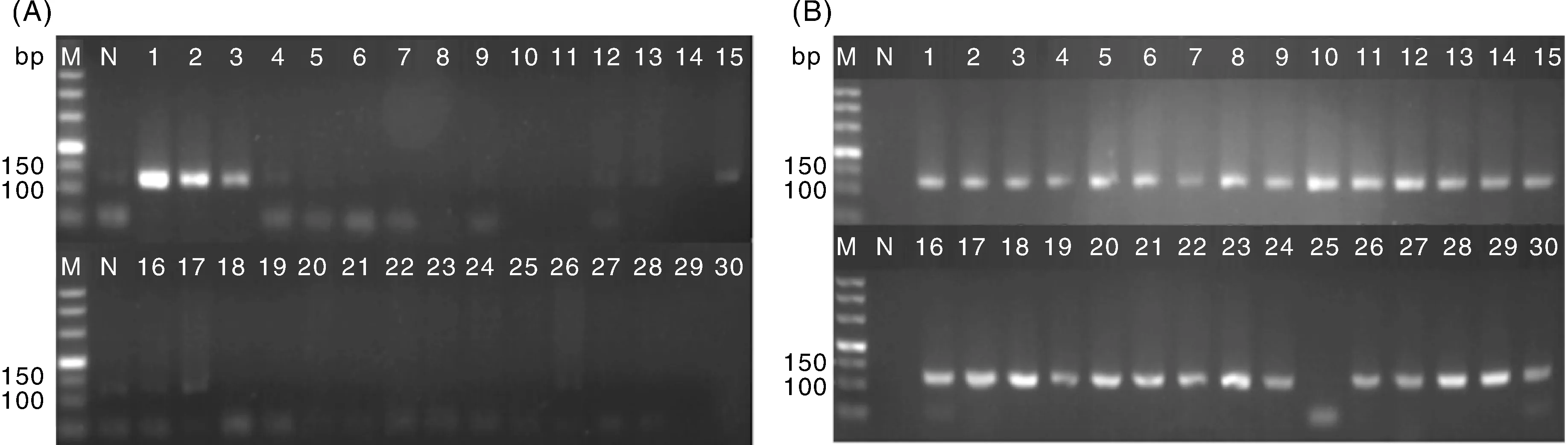
M,500 bp DNA分子量标准;N,阴性对照。图A中:1~3,核桃;4~6,腰果;7~9,巴旦木;10~12,夏威夷果;13~15,碧根果;16~18,榛子;19~21,杏仁;22~24,大豆;25~27,花生;28~30,松子。图B中:1-30为核桃乳样品编号,同表2。M, 500 bp DNA marker; N, Negative; In figure A: 1-3, Walnuts; 4-6, Cashews; 7-9, almonds; 10-12, Queensland nuts; 13-15, Pecans; 16-18, Hazelnuts; 19-21, Apricots; 22-24, Soybeans; 25-27, Peanuts; 28-30, Pine nuts. In figure B, 1-30 were sample serial number of walnut milk, and were the same as in Table 2.图4 十种坚果和十种核桃乳样品的特异性引物Wal-F和Wal-R PCR扩增结果Fig.4 PCR amplification results of 10 kinds of nuts and 10 kinds of walnut milk samples using specific primer Wal-F and Wal-R

图5 核桃乳DNA条形码基因psbA-trnH的PCR扩增结果Fig.5 PCR amplification results of DNA barcode gene psbA-trnH of walnut milk
3 讨论
目前食品真伪的鉴定已从传统形态学发展到依赖蛋白质和DNA序列分析的分子生物学方法。在饮料真伪鉴定中应用蛋白质检验的主要方法包括免疫学检测、新型电泳和质谱色谱技术。这些技术虽然在检测新鲜产品时非常有效,但应用于深度加工食品时效率较低。而以DNA为基础的方法可以对残存量非常低的有机原料进行提取和鉴定,目前,该方法已应用于对多种食品材料组合的检测。DNA条形码技术是利用一段或几段标准DNA序列实现动物、植植物和真菌物种快速鉴定的方法,弥补了传统鉴定方法的不足,具有检测范围广、操作简单、准确度高、鉴别效率高、信息化等优点。DNA条形码技术已广泛应用于食品等各个领域的鉴定。Lee等利用DNA条形码技术对茶的品种与来源进行了鉴定。Uncu等利用DNA条形码基因对橄榄油掺假进行了研究,结果表明,利用DNA条形码技术可对植物油中植物源成分进行鉴定。可见国外主要是集中在茶与油产品,而对植物蛋白饮料尚未进行真伪鉴定研究。
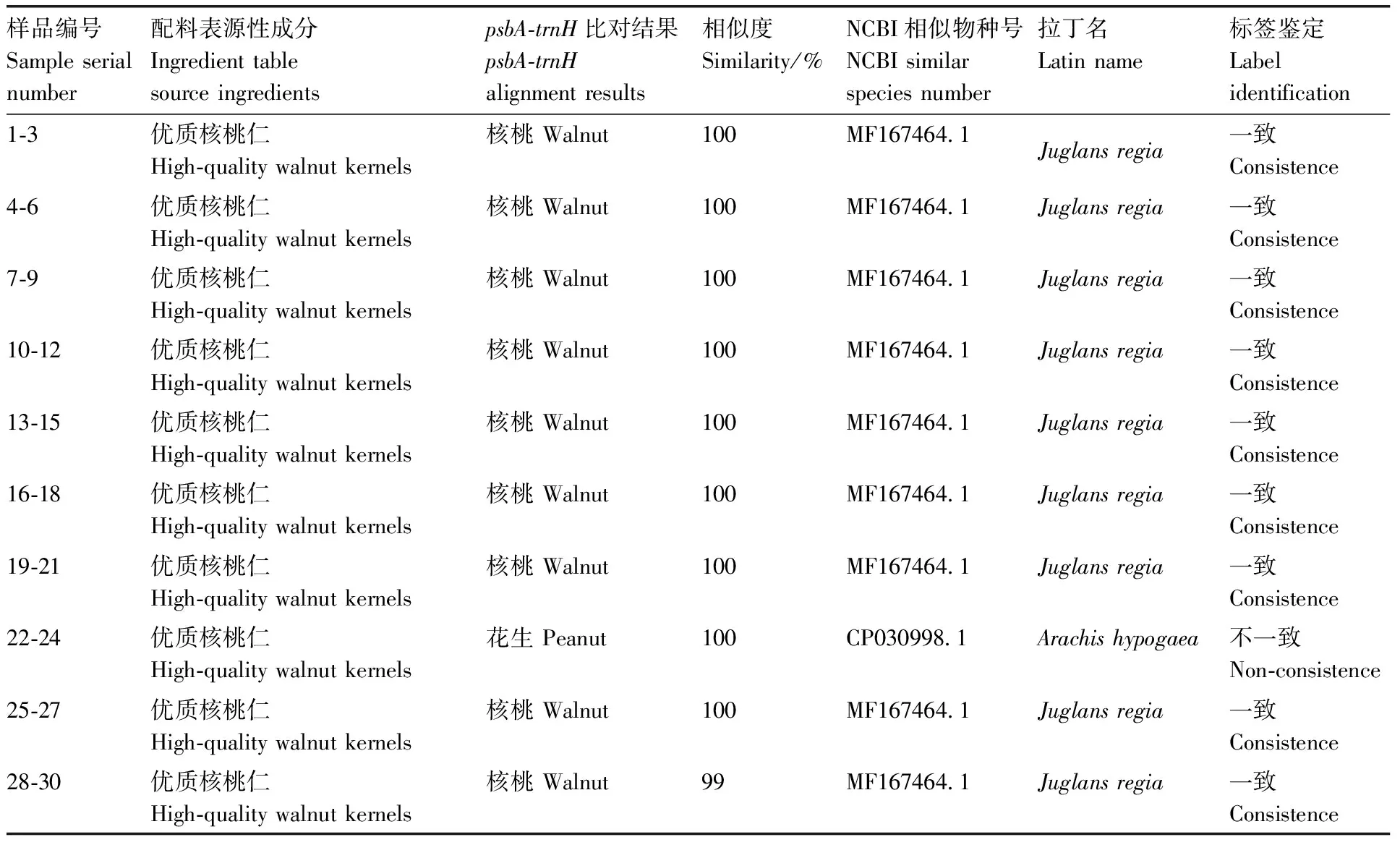
表4 psbA-trnH基因扩增序列比对结果
高质量的DNA是进行DNA条形码鉴定研究的基础。目前乳、饮料类食品的DNA提取方法主要分为传统试剂法与商业试剂盒两种方法。商业化的植物DNA提取试剂盒有适用范围广、时间短和操作简单的优点,但不同食品尤其是深加工食品对试剂盒的适用性不同,所提DNA质量存在明显差异。夏义苗等通过对大豆油不同DNA提取方法进行比较分析,总结有益经验,得到大豆油最佳提取方法。不同的加工工艺对食品DNA提取也存在不同程度的影响。深加工食品核桃乳DNA破坏严重,多糖多酚与色素生物碱等次生物质的存在提高了DNA提取难度。多酚能被氧化褐变,与DNA结合形成不可逆复合物,使最终提取的DNA呈褐色现象,降低DNA活性。为了防止酚类褐变,本研究在CTAB裂解液中加入β-巯基乙醇。选择合适浓度的NaCl可以增加多糖在乙醇中的溶解度,避免与DNA产生共沉淀现象,从而除去DNA中的多糖物质。增加乙醇洗涤力度,以求最大程度去除杂质。考虑到试剂盒吸附柱无法存留小片段DNA,采用离心沉淀方法代替吸附柱。本研究从静置抽提、异丙醇沉淀、抽真空冻干3种不同预处理方式中,筛选得到了抽真空冻干方法为核桃乳DNA提取的最佳预处理方式。并选择6种DNA提取方法或试剂盒进行实验,其中,爱思进试剂盒是一种多源植物基因组DNA提取试剂盒,利用特殊的裂解液C-L和沉淀缓冲液P-D,能有效地把蛋白质、色素、碳水化合物和脂质与基因组DNA分开,DNA制备膜会选择性吸附DNA,所提取的DNA杂质少,从而达到基因组DNA纯化目的。但爱思进试剂盒存在裂解能力弱的缺点,而CTAB裂解沉淀方法正好可以弥补此弱点,故在此基础上利用CTAB与爱思进试剂盒结合方法来提取核桃乳的DNA。结果显示,CTAB与爱思进试剂盒结合的新方法能够得到高质量的核桃乳DNA,纯度值在1.7~1.9,浓度在60~140 ng·μL,且扩增效率好,符合DNA条形码对核桃乳目的种源成分真伪鉴定的后续实验要求。
-序列是植物分子系统发育研究中常用且可靠的叶绿体条形码基因,有着较快的进化速率和较高的物种鉴别效率。Sun等利用7个候选DNA条形码对44个金银花及其近源物种进行鉴定,发现-鉴定效率高达100%。本研究利用DNA条形码基因-对10种核桃乳DNA进行PCR扩增测序检测。扩增测序结果显示10种核桃乳样品中有1款核桃乳成分测序比对结果为花生,该样品属于掺假产品。
4 结论
抽真空冻干方法为核桃乳DNA提取的最佳预处理方式,CTAB与爱思进试剂盒结合的方法更适合从核桃乳中提取DNA。利用自行设计的特异性基因--鉴定核桃乳样品中是否含有核桃成分,确定造假情况;选择常见植物候选基因-鉴定核桃乳样品中是否含有其他成分,确定掺假情况。基于-基因的DNA条形码建立的核桃乳掺假造假鉴定方法,可以在植物蛋白饮料的鉴定应用中贡献绵薄之力。

