蛙类歪头、破头与白眼综合征病原分析
李旭东,刘永涛,杨先乐,杨移斌,*,艾晓辉,
(1.河南省水产技术推广站,河南 郑州 450008; 2.中国水产科学研究院 长江水产研究所,湖北 武汉 430223; 3.上海海洋大学 水产与生命学院,上海201306)
我国蛙类养殖历史悠久,目前养殖的主要品种包括黑斑蛙()、牛蛙()、棘胸蛙()、林蛙()等。养殖蛙类主要以药用和食用为主,如棘胸蛙、林蛙等均是重要药用材料来源,而黑斑蛙、牛蛙则主要用于食用。随着社会经济水平的发展,人们对蛙类产品的需求日益增多,导致野生种群数量急剧减少,如棘胸蛙已被我国列为易危等级,同时也被世界自然保护联盟(IUCN)确定为全球性易危物种。鉴于野生种群无法满足人们生活需要,蛙类养殖产业迅猛发展,据《2020中国渔业统计年鉴》显示,蛙类年产量已经达到10.7万t,其中,江西年养殖产量达3.8万吨,位居全国第一。蛙类养殖产业的发展,在一定程度缓解了需求压力,也给养殖户带来了较好的经济效益。但与此同时,也激发了养殖户对蛙类养殖的热情,养殖密度、产量不断上升,养殖环境日益恶化,发病率不断升高。蛙类主要疾病病原有病毒、霉菌、寄生虫、细菌等。
2017年6月份起,福建、湖北等蛙类主养区陆续发生以歪头、破头与白眼为主要病征的疾病,蛙类发病后死亡率不高,但发病率非常高,症状呈现多样性,影响了蛙类销售,损失极大。本研究就该系列疾病进行了流行病学调查、病原确定与药物筛选等,以期为该系列病害防控提供一定的参考。
1 材料与方法
1.1 试验材料
试验动物:2017年6月份开始在福建、湖北蛙主养区采集具有典型症状的牛蛙、黑斑蛙样品,带回实验室后用于诊断和病原分离。用于感染实验的黑斑蛙购自无此类病史农场,所购黑斑蛙跳跃能力强,外表无伤痕,体重(25±2)g。健康的黑斑蛙置于水桶中暂养7 d,养殖用水不超过蛙脖子,无异常后用于感染试验。
试验试剂:普通营养琼脂培养基、普通营养肉汤培养基、水解酪蛋白琼脂培养基、药敏纸片和细菌生化微量鉴定管均购自杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒购自生工生物工程(上海)股份有限公司,引物合成与测序均由该公司完成。
1.2 试验方法
1.2.1 疾病流行病学调查
对发病蛙养殖场养殖环境、水源情况进行调查,了解发病时气温、水温与水质条件,并调查蛙类养殖发病史和用药史。对濒死并具有典型症状的病蛙进行体表检查与解剖观察,总结病害基本特征。另取具有典型症状的蛙带回实验室进一步研究。
1.2.2 病原分离纯化
利用光学显微镜对具有典型症状的蛙脑和内脏器官进行压片观察,检查有无寄生虫、真菌寄生。在二级生物安全柜中进行细菌分离。将待解剖濒死已麻醉的蛙置于冰上,蛙解剖前全身用75%乙醇消毒。用接种环分别蘸取每只蛙的脑和内脏组织后划线于营养琼脂平板上,在28 ℃培养24 h。挑取优势菌株再进行划线纯化,在纯化菌株中加入15%甘油混匀冻存于-80 ℃备用。分批多次进行上述操作。
1.2.3 细菌16S rRNA鉴定
将分离株接种于营养琼脂平板上,置于恒温28 ℃培养18 h,挑取单菌落于10 μL无菌水中,并吹打均匀,即可作为菌液PCR的模板。
16S rRNA的通用引物为27F:5′-AGAGTTTGATC(C/A)TGGCTCAG-3′,反向1492R: 5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系:2×PCR Mix 50 μL、ddHO 47 μL、正反向引物各1 μL,模板1 μL。反应条件:95 ℃ 1 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 10 min。扩增产物经1%琼脂糖凝胶电泳验证为目的片段大小后,送生工生物工程(上海)股份有限公司进行纯化和测序。
用NCBI中的BLAST对分离株QW08的16S rRNA基因序列进行比对,根据比对结果选取伊丽莎白菌属()和水产重要病原菌的16S rRNA序列,采用Clustal X软件进行多序列匹配分析,通过MEGA6.0软件Neighbor-Joining法构建系统进化树,10 000次Bootstrap检验置信度。同时基于16S rRNA序列对所分离的40株菌进行聚类分析。
1.2.4 细菌形态学观察与生化鉴定
根据以上实验结果,选择典型分离株QW08进行进一步生化鉴定,将分离株QW08接种于营养琼脂平板上,置于28 ℃恒温培养24 h后,采用细菌微量生化鉴定管参照《伯杰氏系统细菌学手册》和文献[7-9]的方法测定分离株的理化指标。
1.2.5 人工感染
将分离株QW08接种于营养琼脂平板上,28 ℃培养18 h,然后使用无菌NaCl溶液洗下菌苔,利用麦氏比浊调整细菌悬浮液浓度大约1×10、1×10和1×10CFU·mL。将120只健康黑斑蛙随机分为A、B、C、D共4个组,每组30只,其中,A、B、C为实验组,D组为对照组。A、B、C组的每只蛙腹腔注射0.1 mL菌悬液,菌悬液的浓度分别为1×10、1×10、1×10CFU·mL,即每只注射剂量分别为1×10、1×10、1×10CFU,对照D组的蛙则在相同部位注射等剂量PBS缓冲液。试验期间正常投喂饲料,溶氧保持在7.5~8.5,气温控制在24~26 ℃,使用充分曝气的自来水进行养殖,养殖用水不超过蛙脖子,每个水桶加盖灰色盖子,防止蛙逃跑,并每天进行换水操作。观察实验蛙状态直到最后停止死亡。每天记录实验蛙情况,统计死亡率,同时采集濒死蛙内脏组织进行细菌分离纯化,并再次通过16S rRNA测序鉴定所纯化的细菌。
1.2.6 组织病理学观察
取带有典型发病症状的黑斑蛙的脑、肾、肝、脾、肠道,用10%的中性福尔马林固定液固定,乙醇梯度脱水,二甲苯透明,石蜡包埋、切片(厚度4 μm),苏木精-伊红(HE)染色,中性树脂胶封片后,显微镜观察并拍照。
1.2.7 药敏特性研究
参照NCCLS抗微生物药物敏感性实验执行标准,采用纸片扩散法对分离株药敏特性进行分析。将分离株QW08接种于营养肉汤中,28 ℃恒温振荡(200 r·min)培养24 h,用PBS缓冲液稀释成浓度为1×10CFU·mL的菌悬液,取100 μL菌液涂布于MH琼脂上,在平板上贴上选择好的药敏纸片,将平板置于28 ℃恒温培养24 h,测量抑菌圈直径。
2 结果与分析
2.1 疾病流行病学调查结果
经流行病学调查发现,湖北、福建等多地蛙养殖场均有此类疾病暴发,发病率高,有的养殖池甚至达到90%,但死亡率不高,发病规格10~1 000 g均可发生,无明显的个体差异。气温高低与发病率呈正相关,温度高、水质差则发病率高。蛙此次病害的外观表现为破头、歪头与白眼等(图1)。虽死亡率不高,但卖相不佳,影响出售,加上发病导致养殖成本上升,因此,该病害给养殖户造成了重大经济损失。
实验室经光学显微镜压片镜检,未在蛙体内发现寄生虫和真菌感染。经细菌学研究,分离纯化得到40株菌落颜色、形态与大小基本一致的细菌。
2.2 细菌分离与鉴定
利用通用引物对40株分离细菌的16S rRNA基因进行扩增,得到16S rRNA片段大小约1 500 bp,与预期片段大小一致。将经测序得到的分离株16S rRNA基因序列(GenBank登录号见表1)采用NCBI-BLAST程序进行分析比对,结果显示,分离菌株均与伊丽莎白菌属的同源性最高。选取分离株QW08、数株伊丽莎白菌属种类和水产重要病原菌种类的16S rRNA基因序列,构建了基于16S rRNA基因序列的发育树,结果(图2)显示,分离株QW08跟米尔伊丽莎白菌聚为一个分支。利用细菌微量生化鉴定管对分离株QW08进行生化指标测定,结果表明,分离株的生化指标也与米尔伊丽莎白菌一致(表2)。结合分离株的理化特性与基因分析结果,综合判定40株分离株均为米尔伊丽莎白菌。用40株分离菌株的16S rRNA构建进化树,结果如图3所示,虽然分离株均为伊丽莎白菌属,但不同来源的菌株也存在一定的遗传差异。

图1 蛙临床症状Fig.1 Clinical symptoms of frogs

表1 分离的40株细菌的16S rRNA序列GenBank登录号
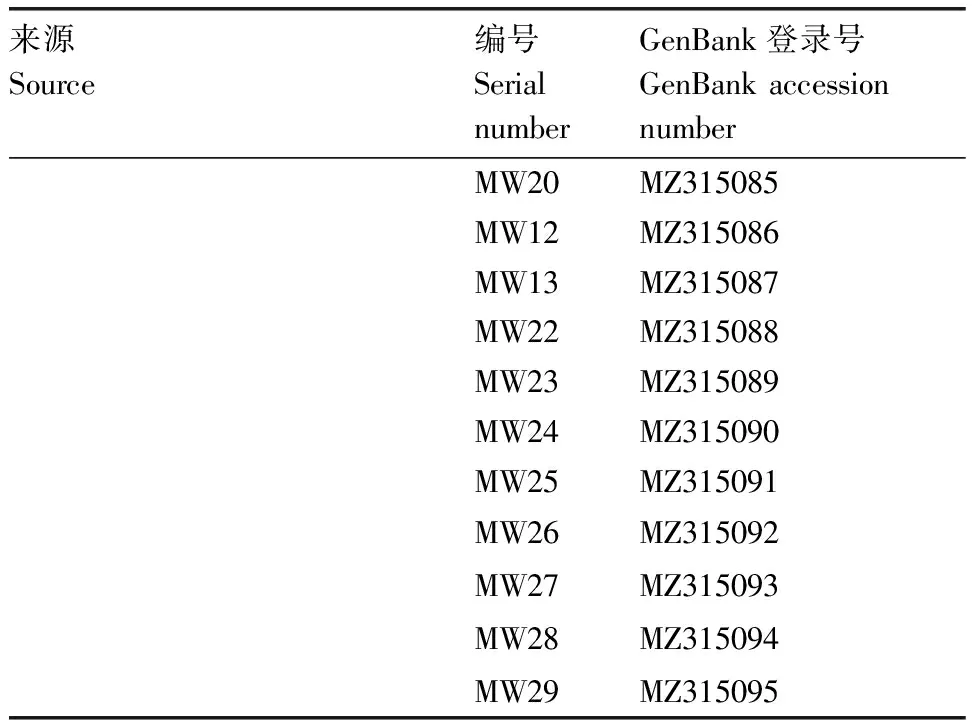
续表1 Continued Table 1
2.3 人工感染
在致病性研究中,实验组的黑斑蛙均出现不同程度死亡(图4)。其中A、B、C组死亡率分别达到90%、50%、16.67%,并出现与自然发病类似症状,如歪头、破头与白眼,而对照组未见患病或者死亡。从濒死的蛙体内再次分离到米尔伊丽莎白菌。感染实验符合科赫氏法则,表明米尔伊丽莎白菌是此次蛙类病害的病原菌。
2.4 组织病理学观察
患病蛙肠道黏膜层结缔组织增生,胶原纤维增生,可见成纤维细胞和纤维细胞,如黑色箭头所示;血管扩张淤血,如红色箭头所示;淋巴细胞灶性浸润,如黄色箭头所示(图5-A)。患病蛙部分肝细胞细胞质呈透明空泡状,如黑色箭头所示;部分细胞内未见细胞核,如红色箭头所示;肝窦内可见大量的炎症细胞,如黄色箭头所示;多处肝窦内可见棕黑色色素沉积,如绿色箭头所示(图5-B)。患病蛙大量神经细胞胞质呈空泡状,如黑色箭头所示;并可见淋巴细胞灶性浸润,如红色箭头所示(图5-C)。患病蛙脑膜处可见几层排列较整齐的红细胞,如黑色箭头所示;并伴有少量淋巴细胞,如红色箭头所示(图5-D)。患病蛙脾红细胞大量减少,脾淋巴细胞增多,如黑色箭头所示(图5-E)。近曲小管肾小管上皮细胞内可见大量红色滴状物,如黑色箭头所示;间质中有大量炎症细胞,如红色箭头所示;部分肾小管坏死钙化,如黄色箭头所示;肾小球囊腔扩张,囊腔内可见少量炎症细胞,如绿色箭头所示(图5-F)。
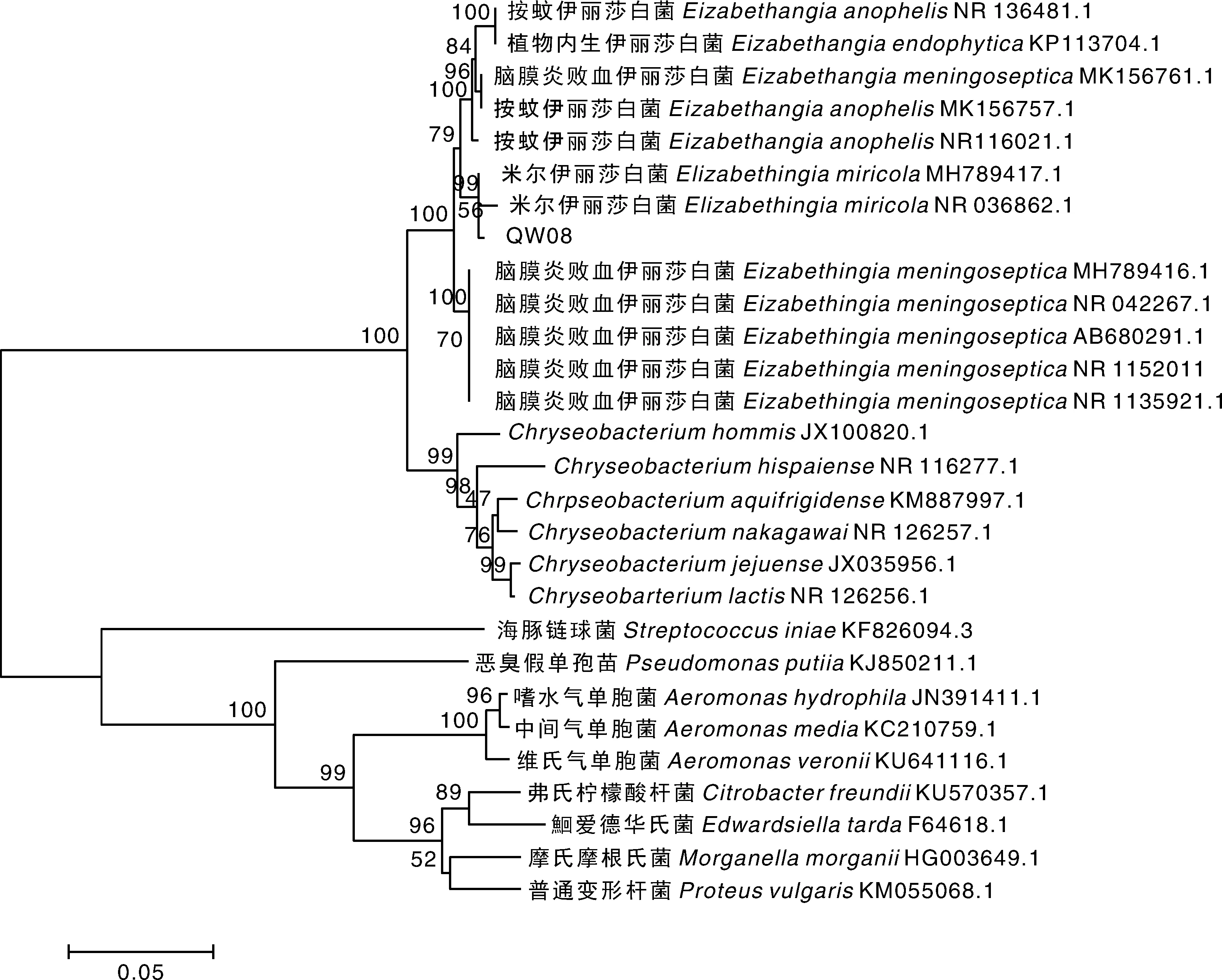
图2 基于16S rRNA构建的QW08与其他水产病原菌的进化树Fig.2 Phylogenetic tree for 16S rRNA sequence of QW08 and other aquatic pathogens

表2 菌株QW08的生化特性
2.5 药敏特性
测定了分离株QW08对20种抗生素的敏感性,结果(表3)表明,分离株QW08仅对氟苯尼考高度敏感,对其他药物均出现不同程度的耐药。
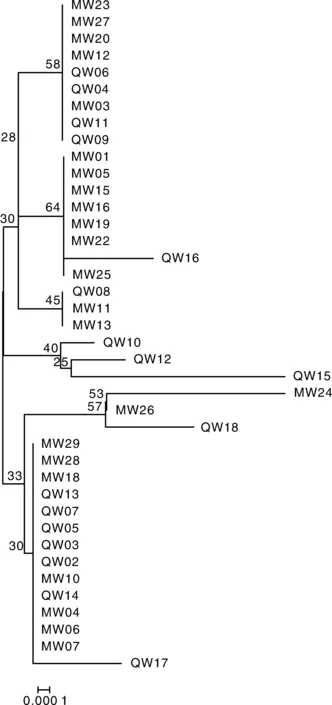
图3 基于16S rRNA构建的40株分离细菌的进化树Fig.3 Phylogenetic tree of 40 isolated bacterias based on 16S rRNA sequence

A、B、C组每只注射齐量分别为1×107、1×105、1×103 CFU。D组每只注射0.1 mL PBS缓冲液。Each frog in group A, B and C was injected 1×107, 1×105 and 1×103 CFU, respectively.Each frog in group D was injected 0.1 mL PBS buffer.图4 菌株QW08的人工感染试验结果Fig.4 Artificial infection results of QW08 strain
3 讨论
伊丽莎白菌是自然界广泛存在的一类条件致病菌,自然水体、土壤和医院环境等均发现了其踪迹。公共卫生安全方面,伊丽莎白菌感染人类的机率比较低,但一旦感染,死亡率比较高。引起人类疾病的种类主要包括脑膜炎、败血症、肺部和软组织感染等。另外,伊丽莎白菌也是宠物和多种水产养殖动物的重要病原菌。目前在罗非鱼()、胡子鲶()、中华鲟()等多种水生动物体内发现了伊丽莎白菌的感染,造成较大经济损失,特别是影响中华鲟的种族延续,值得重点关注。在养殖的两栖类动物中也发现了伊丽莎白菌的感染,如虎纹蛙()、非洲爪蟾()、牛蛙、黑斑蛙、棘胸蛙等。感染伊丽莎白菌的养殖蛙类会表现出明显的歪头、破头与白眼等典型症状。该病原自1993年被鉴定以来,随着细菌分类学的不断发展,病原命名一直在变化,目前认可度较高的是米尔伊丽莎白菌。本研究病例症状与以上研究基本一致。通过回归感染,进一步确定了蛙类此疾病病原为米尔伊丽莎白菌。经对40株分离菌进行系统发育分析,发现部分不同病例来源的分离菌株亲缘关系有明显差异,其中宿主与区域是影响亲缘关系的重要因素,分离株具体亲缘远近与病原特性关系有待于进一步研究。
组织病理学研究发现,感染蛙的脑部神经细胞受伤,并有炎性浸润,很可能是米尔伊丽莎白菌透过血脑屏障进入脑部,从而对蛙脑部产生严重危害,使得蛙在临床上表现为歪头、破头与白眼等症状。但对于米尔伊丽莎白菌如何突破血脑屏障,其分子机制如何尚待进一步研究。
据文献显示,米尔伊丽莎白菌可产生多种-内酰胺酶,从而具有多重耐药性,如对碳青霉烯类和头孢类高度耐药。研究发现,本次分离到的米尔伊丽莎白菌仅对氟苯尼考高度敏感,在实际养殖生产中,虽然使用氟苯尼考阻止了病情的进一步蔓延,但病情在养殖周期内反复暴发。药敏试验与雷雪平等的研究结果一致,但与以往的研究存在很大不同。究其原因可能是不同养殖环境、不同用药水平或不同时空导致的。另外,由于米尔伊丽莎白菌致病的特殊性,从病理学与临床表现上可以看出其主要是蛙类脑组织产生损害,因此,米尔伊丽莎白菌可以穿过血脑屏障,在病原分离过程中我们也在蛙脑中检测到病原菌。目前国家标准渔药中仅磺胺类药物具备一定的穿过血脑屏障能力,因此,在蛙类生产实践上使用较多,导致伊丽莎白菌普遍耐药。实际上很多药物是不能穿过血脑屏障的,如水产中常用的氟苯尼考、恩诺沙星等,这些抗生素只能杀灭血液中的病原菌,而无法清除脑中的病原菌,因此在临床发现,尽管体外氟苯尼考等对伊丽莎白菌抑菌效果很好,但并不能有效治愈已经产生明显症状的蛙类。病原菌一旦突破血脑屏障,尽管血液中细菌被清除,一段时间后细菌又可快速重新感染,导致疾病反复暴发。因此,生产上常常产生误区,认为可能是用药量不够等造成的,养殖户常常采取加大药量与用药频次,这样可能诱导细菌耐药,并且蛙类的重要器官如肾也会受损,导致病情加重,使得疾病防控更加困难。建议该病的防控以免疫预防为主,加强疫苗、免疫增强剂和中草药制剂等的开发,减少抗生素的使用;同时采取合理控制养殖密度、减少应激等措施以降低病害发生的概率。

A,肠;B,肝;C,脑;D,脑;E,脾;F,肾。A, Intestines; B, Liver; C, Brain; D, Brain; E, Spleen; F, Kidney.图5 自然发病蛙的不同组织病理学变化Fig.5 Pathological changes in different tissues of naturally diseased frog
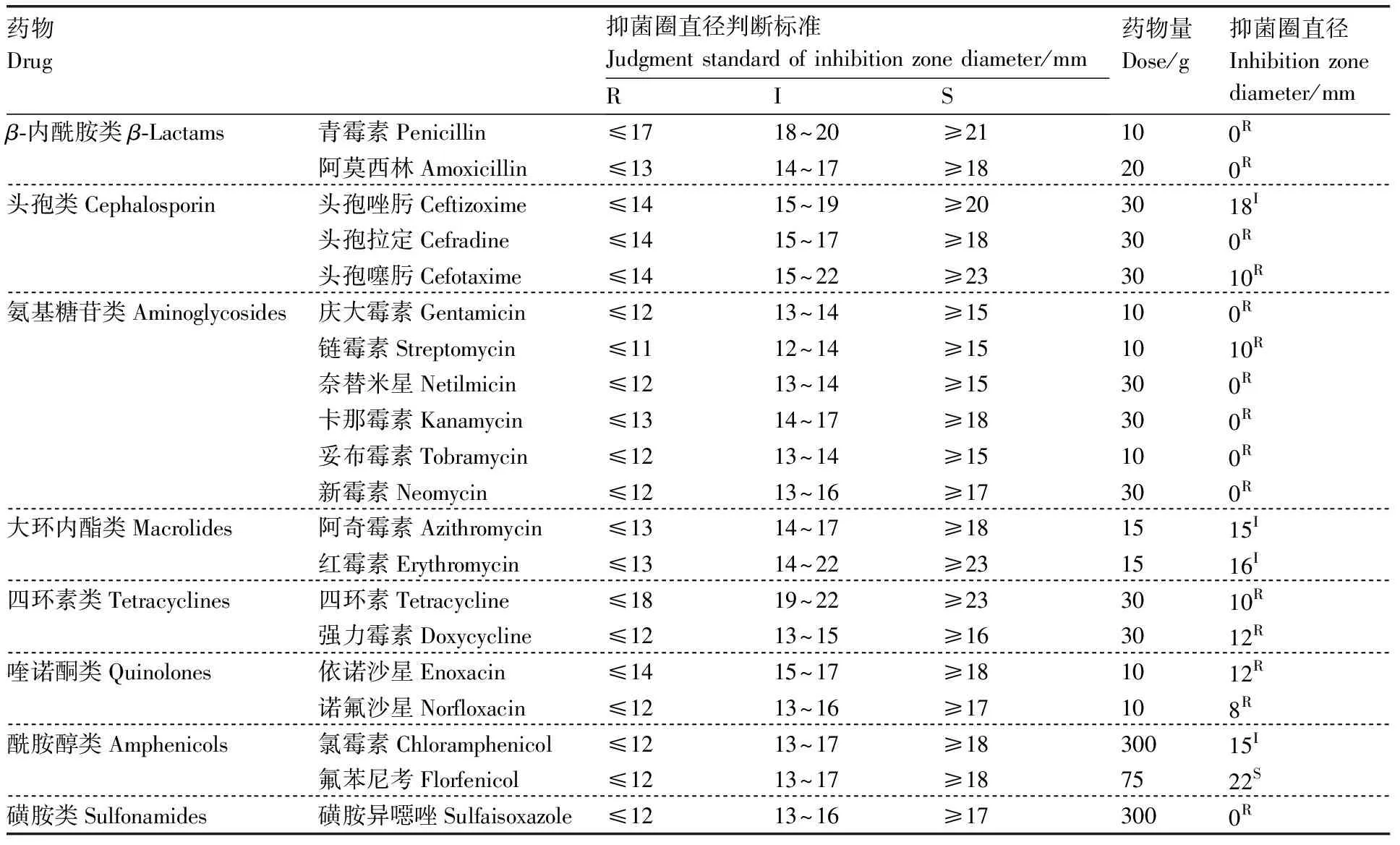
表3 菌株QW08对药物敏感性试验结果

