地稔中6种成分含量测定及其与抗氧化活性的相关性分析Δ
刘 静 ,明惠仪 ,麻秀萍 ,钱 松 ,杨 菁 ,4,吴登莉 ,郭江涛 ,4(.贵州中医药大学药学院,贵阳 55005;.织金县人民医院药剂科,贵州毕节 5500;3.国家苗药工程技术研究中心/贵州中药炮制与制剂工程技术研究中心,贵阳 55005;4.贵州中医药大学茶大健康食品开发研究中心,贵阳 55005)
地稔为野牡丹科植物地菍Melastoma dodecandrumLour.的新鲜或干燥全草,是贵州地区常用民族药,具有清热解毒、活血止血的功效,临床常用于治疗高热、肺痈、水肿、带下、产后腹痛、痈肿等症[1]。现代研究表明,地稔含有黄酮、有机酸、甾体及其苷、鞣质、多糖等多种化学成分,具有抗氧化、抗炎、止血、降脂、降血糖等作用[2-3]。《贵州省中药材、民族药质量标准》中仅记载了地稔的性状、鉴别、性味归经等,尚无含量测定项目,不能有效评价其质量。已有文献报道采用外标法测定地稔中没食子酸、芦丁、牡荆素、异牡荆素、鞣花酸等成分的含量[4-6],但所报道的方法仅能同时测定1~2种成分,难以经济、有效地评价地稔的质量,故建立同时测定地稔中多指标成分含量的方法很有必要。
一测多评(quantitative analysis of multi-components by single-marker,QAMS)法是以性质稳定且廉价易得的某个成分为内参物,建立该成分与其他成分的相对校正因子(fs/i)来计算待测成分含量的方法,可实现多个成分同时测定[7-8]。该方法既解决了对照品不稳定、价格昂贵等问题,也节约了工作时间,降低了含量测定成本[8]。活性氧是一系列参与人体病理和退行过程的代谢物,过量的活性氧会诱导器官及组织的自由基损伤,从而加速多种疾病的发展[9]。有研究表明,地稔可有效地清除氧自由基,发挥抗氧化作用[10],但目前对其发挥抗氧化活性的有效成分尚不明确。本研究选择地稔中6种含量相对较高的成分(包括酚酸类成分没食子酸、原儿茶酸,黄酮类成分牡荆素、异牡荆素、芦丁,鞣质类成分鞣花酸)为对象,建立QAMS法同时测定其含量,并分析上述6种成分含量与抗氧化活性的相关性,旨在为地稔的质量分析及控制提供准确、可行、经济的评价方法。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Agilent 1290 InfinityⅡ系列超高效液相色谱(UPLC)仪(美国Agilent公司)、MS205DU型十万分之一电子天平(美国Mettler Toledo公司)、FA2204N型万分之一电子天平(上海菁海仪器有限公司)、1530型酶标仪(美国Thermo Fisher Scientific公司)等。
1.2 主要药品与试剂
没食子酸对照品(批号110831-201906,纯度91.5%)、原儿茶酸对照品(批号110809-201906,纯度97.7%)、牡荆素对照品(批号111687-201704,纯度94.9%)、鞣花酸对照品(批号111959-201903,纯度88.8%)均购自中国食品药品检定研究院;芦丁对照品(批号C100001-200628,纯度98.0%)和异牡荆素对照品(批号C101499-201219,纯度98.00%)均购自贵州迪大生物科技有限责任公司;甲醇(色谱纯)购自美国Tedia公司;其余试剂均为分析纯;水为超纯水。
23批地稔药材采集于贵州、广东、广西、湖南、浙江等地,由贵州中医药大学药学院孙庆文教授鉴定均为野牡丹科植物地菍M.dodecandrumLour.的全草。地稔药材来源信息见表1。
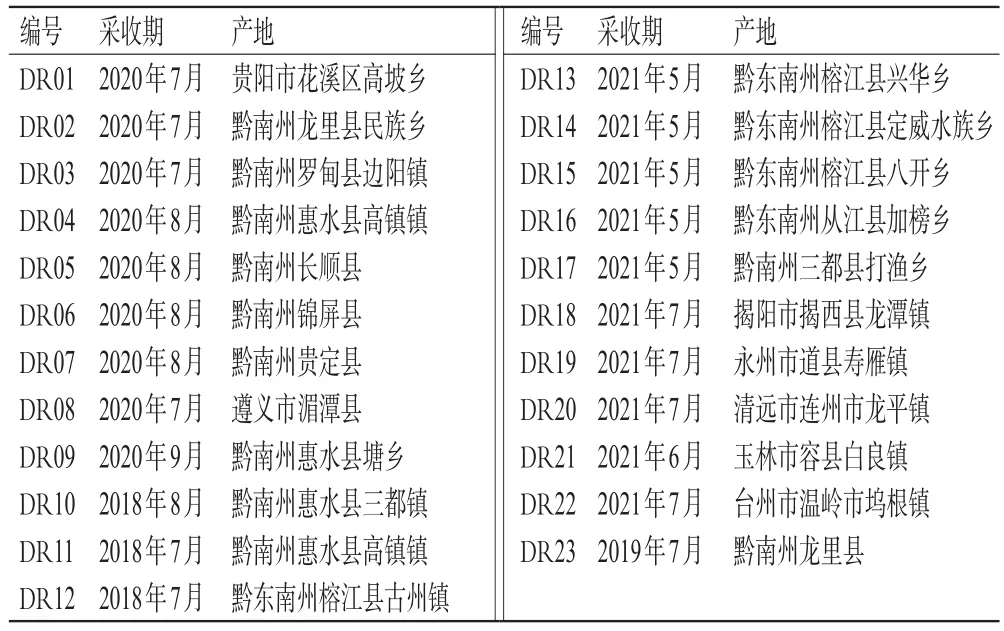
表1 地稔药材来源信息
2 方法与结果
2.1 色谱条件
以 Waters ACQUITY UPLCHSS T3(2.1 mm×100 mm,1.8 μm)为色谱柱,以0.1%磷酸溶液为流动相A、甲醇为流动相B进行洗脱梯度(0~4 min,3%B;4~6 min,3%B~5%B;6~18 min,5%B~10%B;18~23 min,10%B~25%B;23~27 min,25%B~30%B;27~42 min,30%B~35%B;42~44 min,35%B;44~48 min,35%B~40%B;48~50 min,40%B~50%B);流速为0.2 mL/min;柱温为30℃;检测波长为260 nm;进样体积为0.8 μL。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取没食子酸、原儿茶酸、牡荆素、异牡荆素、芦丁对照品各适量,加甲醇溶解,分别制成质量浓度为0.361、0.314、0.325、0.400、0.454 mg/mL的单一对照品溶液。另精密称取鞣花酸对照品适量,加入二甲基亚砜2 mL使溶解,再以甲醇稀释制成0.165 mg/mL的鞣花酸对照品溶液。取上述6种单一对照品溶液适量,置于同一量瓶中,加甲醇稀释至所需浓度制成混合对照品溶液。
2.2.2 供试品溶液 取地稔粉末(过2号筛)1 g,精密称定,置于锥形瓶中,精密加入75%甲醇25 mL,称定质量,85℃水浴回流提取1 h,取出放冷,用75%甲醇补足减失的质量,摇匀,以0.22 μm微孔滤膜滤过,即得。
2.3 方法学验证
2.3.1 专属性考察 分别精密量取空白溶剂(75%甲醇)、混合对照品溶液、供试品溶液各0.8 μL,按“2.1”项下色谱条件进样分析,记录色谱图。结果显示,空白溶剂对6种待测成分的检测无干扰,方法专属性好。色谱图见图1(空白溶剂图略)。
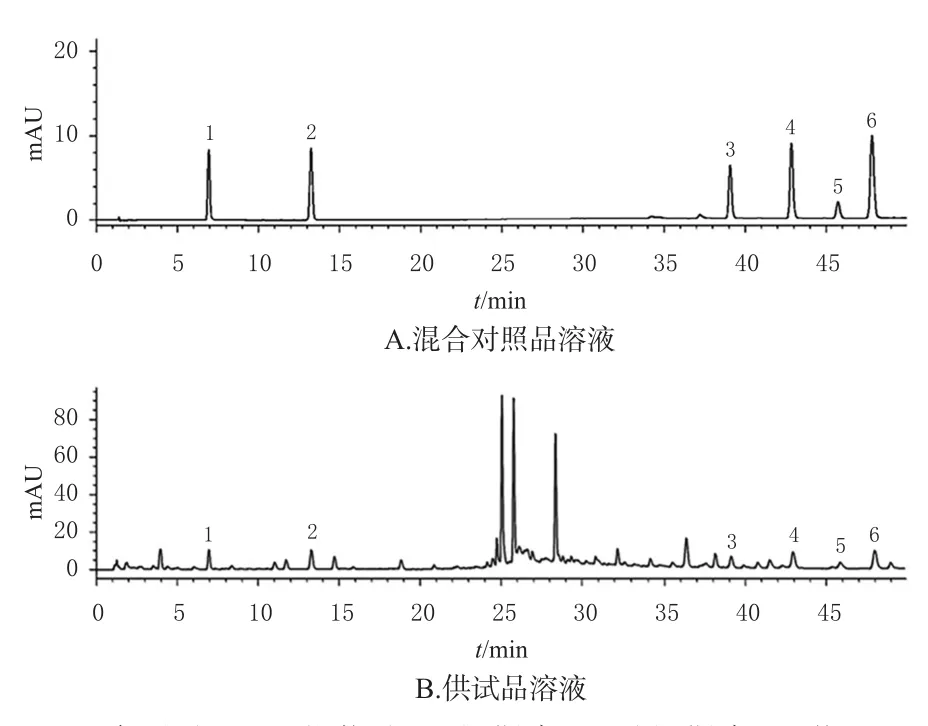
图1 地稔中6种待测成分的UPLC图
2.3.2 线性范围考察 精密吸取“2.2.1”项下各单一对照品溶液各适量,加甲醇稀释制成6个不同质量浓度的系列混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积。以各待测对照品的质量浓度(x)为横坐标、峰面积(y)为纵坐标,进行线性回归。结果见表2。
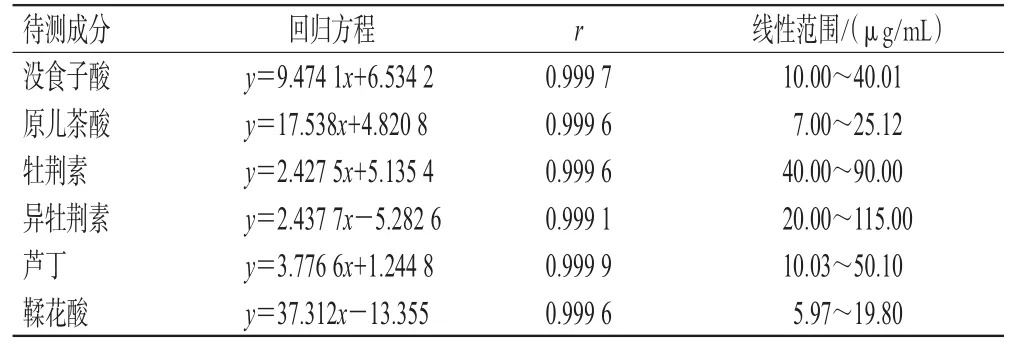
表2 地稔中6种待测成分的线性关系考察结果
2.3.3 精密度试验 精密吸取“2.3.2”项下线性范围下限浓度的混合对照品溶液,按“2.1”项下色谱条件连续进样6次,记录峰面积。结果显示,没食子酸、原儿茶酸、牡荆素、异牡荆素、芦丁、鞣花酸峰面积的RSD分别为0.36%、0.28%、0.64%、0.29%、0.20%、0.69%(n=6),表明仪器精密度良好。
2.3.4 稳定性试验 精密吸取供试品溶液(编号DR23),分别于室温放置2、4、6、8、10、24 h时按“2.1”项下色谱条件进样分析,记录峰面积。结果显示,没食子酸、原儿茶酸、牡荆素、异牡荆素、芦丁、鞣花酸峰面积的RSD分别为0.27%、0.38%、0.56%、0.60%、0.29%、2.96%(n=6),表明供试品溶液在24 h内稳定性良好。
2.3.5 重复性试验 取同一批地稔药材(编号DR23)6份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,记录峰面积,代入回归方程计算各成分的含量。结果显示,没食子酸、原儿茶酸、牡荆素、异牡荆素、芦丁、鞣花酸含量的RSD分别为2.06%、1.64%、1.57%、2.36%、2.93%、2.49%(n=6),表明该方法重复性良好。
2.3.6 加样回收率试验 取同一批地稔药材(编号DR23)6份,每份0.5 g,精密称定,分别加入与地稔中各成分含量相当的对照品溶液,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录峰面积并计算加样回收率。结果显示,没食子酸、原儿茶酸、牡荆素、异牡荆素、芦丁、鞣花酸的平均加样回收率分别为 97.79%、100.18%、97.84%、96.45%、91.84%、108.06%,RSD分别为1.71%、2.32%、1.41%、1.48%、1.20%、6.66%(n=6),表明该方法准确度较好。
2.4 QAMS法的建立
2.4.1fs/i的计算 分别精密吸取“2.3.2”项下的系列混合对照品溶液,按“2.1”项下色谱条件进样分析,记录各成分的峰面积。以牡荆素为内参物,采用多点校正法计算没食子酸、原儿茶酸、异牡荆素、芦丁、鞣花酸的fs/i:fs/i=(As×ci)/(cs×Ai)(As为内参物的峰面积,ci为待测成分的质量浓度,cs为内参物的质量浓度,Ai为待测成分的峰面积)[11]。结果显示,没食子酸、原儿茶酸、异牡荆素、芦丁、鞣花酸的fs/i分别为0.255、0.140、1.038、0.654、0.070,RSD分别为1.46%、1.18%、2.51%、0.91%、3.28%(n=6)。
2.4.2 不同色谱柱、柱温和流速对fs/i的影响 采用Agilent 1290 InfinityⅡ系列UPLC仪,考察不同色谱柱(Waters ACQUITY UPLC HSS T3、Agilent ZORBAX Eclipse Plus C18、Agilent ZORBAX Stable Bond SB-C18,规格均为 2.1 mm×100 mm,1.8 μm)、柱温(25、30、35 ℃)、流速(0.18、0.20、0.22 mL/min)对各成分fs/i的影响。结果显示,在不同色谱柱、柱温和流速下,没食子酸、原儿茶酸、异牡荆素、芦丁、鞣花酸的平均fs/i分别为0.259、0.141、1.061、0.616、0.076,RSD 分别为 0.72%、0.83%、0.73%、1.07%、1.48%(n=9),表明不同色谱柱、柱温和流速对5种待测成分的fs/i无明显影响。
2.4.3 不同色谱柱、柱温和流速对相对保留时间和相对保留时间差的影响 以牡荆素为内参物,计算没食子酸、原儿茶酸、异牡荆素、芦丁、鞣花酸的相对保留时间和相对保留时间差,考察“2.4.2”项下不同色谱柱、柱温、流速对相对保留时间和相对保留时间差的影响。结果显示,5种成分的平均相对保留时间分别为0.175、0.336、1.092、1.166、1.215,RSD分别为10.27%、7.27%、0.96%、1.40%、1.99%(n=9);平均相对保留时间差分别为-25.628、-31.860、3.546、6.439、8.344,RSD 分 别 为1.70%、1.89%、13.95%、12.76%、13.77%。可见,异牡荆素、芦丁、鞣花酸均可利用相对保留时间值法进行准确定位。由于没食子酸和原儿茶酸的相对保留时间偏小,其相对保留时间的RSD均大于5%,利用相对保留时间值法对没食子酸和原儿茶酸准确定位较为困难;而二者相对保留时间差的RSD均小于5%,表明二者可利用相对保留时间差值法进行准确定位,此外还可结合二者的紫外吸收特征对色谱峰进行定位。
2.5 地稔中6种成分含量的测定
取23批地稔药材,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录峰面积。以牡荆素为内参物,通过fs/i分别计算没食子酸、原儿茶酸、异牡荆素、芦丁、鞣花酸的含量,同时采用外标法计算没食子酸、原儿茶酸、牡荆素、异牡荆素、芦丁、鞣花酸的含量。采用SPSS 25.0软件对外标法与QAMS法的含量测定结果进行独立样本t检验。平行2份操作,取平均值,结果见表3。

表3 23批地稔药材中6种成分外标法与QAMS法的含量测定结果(n=2,%%)
2.6 地稔抗氧化活性的测定
2.6.1 DPPH自由基清除法 参考文献[12]的方法制备1,1-二苯基-2-三硝基苯肼(DPPH)工作液。取“2.2.2”项下供试品溶液,用75%甲醇稀释200倍,得到生药质量浓度为0.2 mg/mL的供试品溶液。将96孔板分为空白组、样品组、对照组,每组设置4个平行样。空白组加入75%甲醇溶液100 μL+DPPH工作液100 μL,样品组加入供试品溶液100 μL+DPPH工作液100 μL,对照组加入供试品溶液100 μL+75%甲醇100 μL。3组样品均于室温下避光静置20 min,在517 nm波长下测定吸光度,依次记为A0(空白组)、A1(样品组)和A2(对照组)。按下式计算自由基清除率:自由基清除率=[1-(A1-A2)/A0]×100%。结果见表4。
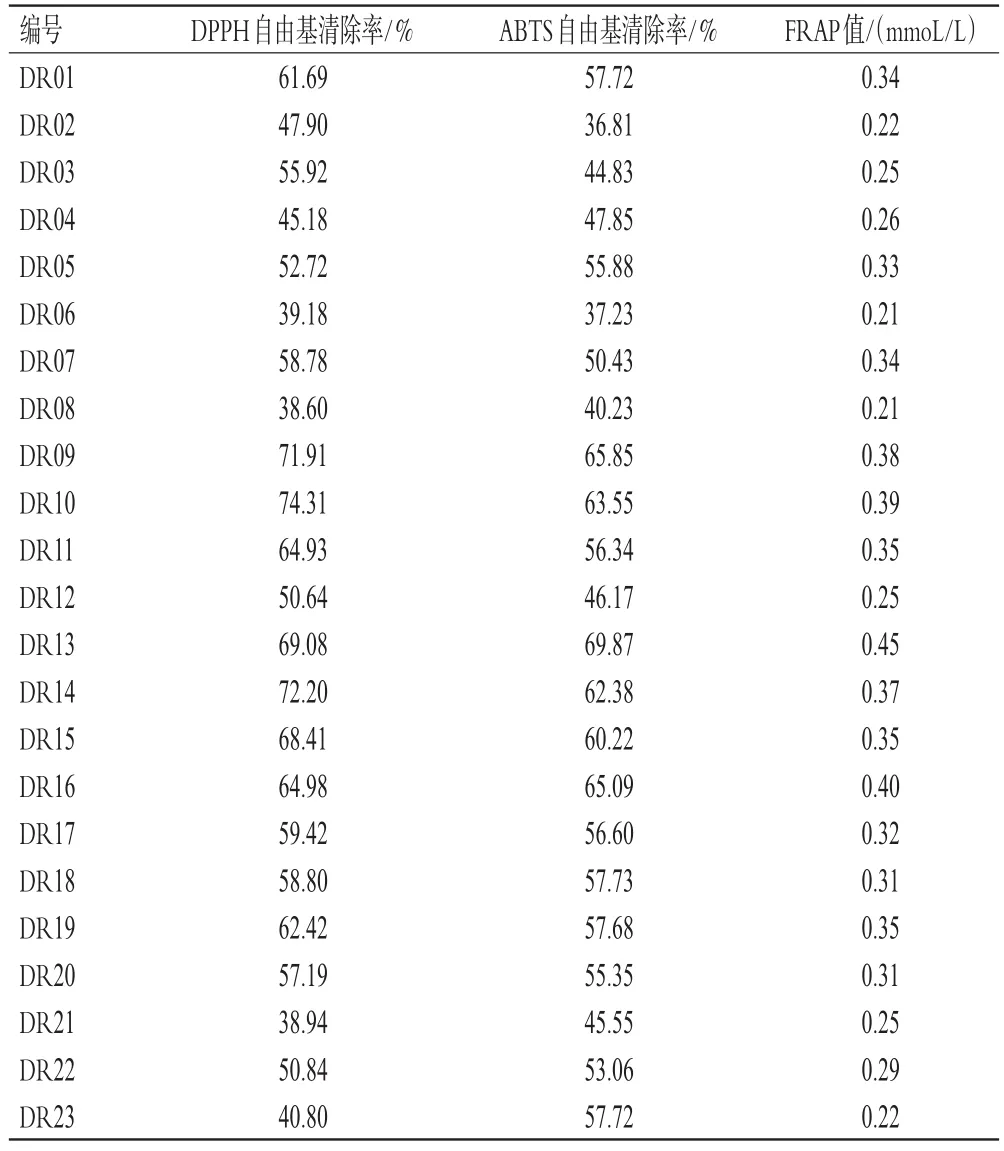
表4 23批地稔药材的抗氧化活性测定结果(n=4)
2.6.2 ABTS自由基清除法 参考文献[12]的方法制备2,2′-联氮-二(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(ABTS)法工作液。取“2.2.2”项下供试品溶液,用75%甲醇稀释100倍,得到生药质量浓度为0.4 mg/mL的供试品溶液。将96孔板分为空白组、样品组、对照组,每组设置4个平行样。空白组加入75%甲醇溶液20 μL+ABTS工作液180 μL,样品组加入供试品溶液20 μL+ABTS工作液180 μL,对照组加入供试品溶液20 μL+水180 μL。3组样品均于室温下避光静置30 min,在734 nm波长下测定吸光度,依次记为A0(空白组)、A1(样品组)和A2(对照组)。按“2.6.1”项下公式计算ABTS自由基清除率。结果见表4。
2.6.3 FRAP法 参考文献[13]的方法制备铁离子还原/抗 氧 化 能 力(ferric ion reducing/antioxidant power,FRAP)工作液。将96孔板分为样品组和空白组,每组设置4个平行样。样品组加入“2.6.2”项下生药质量浓度为0.4 mg/mL的供试品溶液20 μL+FRAP工作液180 μL,空白组加入75%甲醇20 μL+FRAP工作液180 μL。2组样品均于37℃下静置10 min,在593 nm波长下测定吸光度,分别记为Ai(样品组)、Aj(空白组)。另分别配制浓度为0.10、0.20、0.40、0.60、0.80、1.00 mmoL/L的硫酸亚铁溶液,按上述方法测定吸光度后绘制标准曲线。将供试品溶液的吸光度(Ai-Aj)代入标准曲线方程计算对应的硫酸亚铁浓度,记为“FRAP值”。结果见表4。
2.7 6种成分的含量与抗氧化活性的相关性分析
2.7.1 灰色关联度分析 采用Excel 2010软件,对23批地稔药材中6种成分的含量与抗氧化活性进行灰色关联度分析。结果显示,没食子酸、原儿茶酸、牡荆素、异牡荆素、芦丁、鞣花酸含量与抗氧化活性的关联系数均大于0.6,表明关联度较高[13]。6种成分对DPPH自由基清除率贡献大小顺序为异牡荆素>鞣花酸>牡荆素>芦丁>原儿茶酸>没食子酸,对ABTS自由基清除率贡献大小顺序为异牡荆素>芦丁>牡荆素>鞣花酸>原儿茶酸>没食子酸,对FRAP值贡献大小顺序为异牡荆素>牡荆素>芦丁>鞣花酸>原儿茶酸>没食子酸。结果见表5。
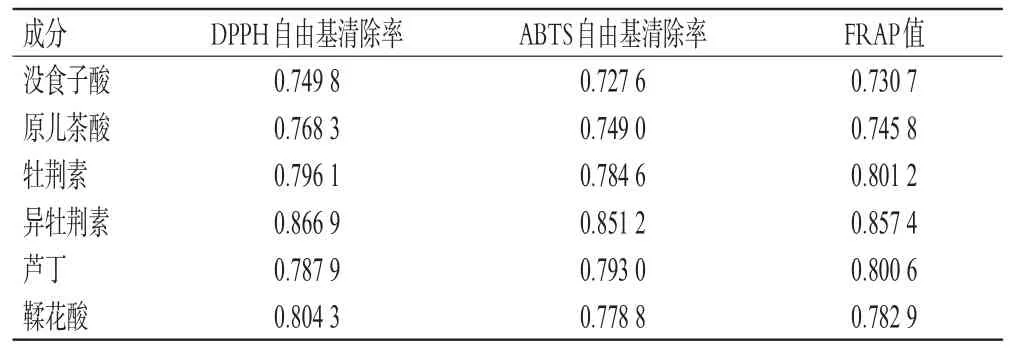
表5 地稔中6种成分含量与抗氧化活性的灰色关联系数
2.7.2 双变量相关性分析 采用SPSS 25.0软件进行双变量相关性分析。结果显示,牡荆素、异牡荆素、芦丁含量与DPPH自由基清除率呈显著正相关(P<0.05或P<0.01),原儿茶酸含量与DPPH自由基清除率呈显著负相关(P<0.05)。在ABTS自由基清除率和FRAP值分析中,牡荆素、异牡荆素、芦丁含量与抗氧化活性呈显著正相关(P<0.05或P<0.01),没食子酸、原儿茶酸含量与抗氧化活性呈显著负相关(P<0.05)。结果见表6。
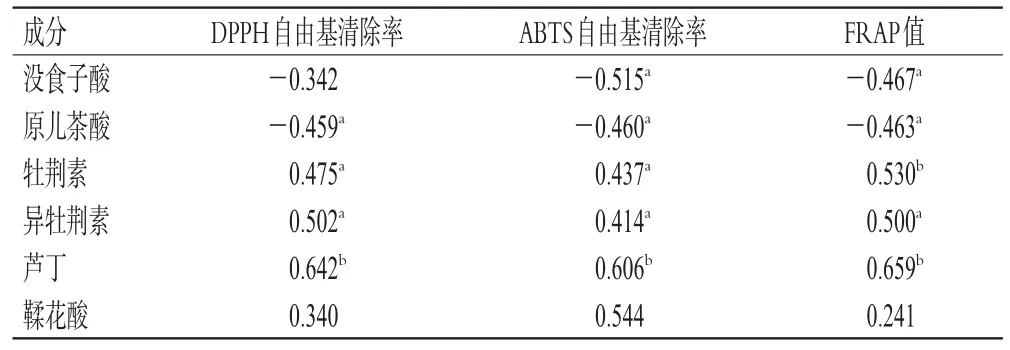
表6 地稔中6种成分含量与抗氧化活性的双变量相关系数
3 讨论
3.1 供试品溶液制备条件及检测波长的筛选
本研究预实验对供试品溶液的制备条件[提取方式(回流、超声)和甲醇体积分数(25%、50%、75%、100%)]进行了比较,并对不同检测波长进行了考察。以6种成分的提取率为指标,综合优选采用75%甲醇回流提取制备供试品溶液。6种成分在254 nm和260 nm波长下均有较大吸收,牡荆素和异牡荆素在260 nm波长下较254 nm波长下响应值高,因此选择检测波长为260 nm。
3.2 混合对照品溶液稳定性的考察
本研究预实验考察了混合对照品溶液在5 d和2、3个月内的稳定性。结果显示,没食子酸、原儿茶酸、异牡荆素、芦丁溶液放置3个月的fs/i的RSD均小于3.00%,表明稳定性较好;鞣花酸溶液在上述3个时间段的fs/i的RSD分别为2.36%、3.70%、7.00%,表明稳定性相对较差。由于鞣花酸同时含有亲脂结构(4个环)和亲水结构(4个酚基和2个内酯环),导致其亲水性及亲脂性均较差,微溶于水和醇,溶于二甲基亚砜,故制备鞣花酸对照品溶液时需加适量二甲基亚砜助溶[14]。本研究还发现,鞣花酸的fs/i会随放置时间延长而增大,故不宜保存过久,尽量在5 d内测定。
3.3 地稔中6种成分的抗氧化活性分析
酚类化合物中羟基的数量、位置、相关的糖基化以及其他取代基在很大程度上决定了其自由基清除活性,其中邻二羟基是所有酚类化合物显示出高活性最重要的结构特征[15]。黄酮类化合物骨架中2,3-双键、4-酮基、3′,4′-邻二酚羟基和C-3位羟基结构对抗氧化活性起重要作用[16-17]。已有研究报道,鞣花酸、没食子酸对地稔抗氧化活性贡献显著,原因可能与其含量及结构中邻二酚羟基有关[3]。灰色关联度分析结果显示,6种成分的含量与抗氧化活性均有较高关联度,其中异牡荆素与抗氧化活性关联度最高,没食子酸与抗氧化活性关联度最低;双变量相关性分析结果显示,芦丁与抗氧化活性相关性最显著,而鞣花酸与抗氧化活性无显著相关性。这一结果差异可能是因为制备的地稔供试品溶液未经水解,致使没食子酸含量偏低,而鞣花酸理化性质特殊,单纯使用75%甲醇提取率较低所致。
综上所述,本研究成功建立了QAMS法同时测定地稔中6种成分的含量,测定结果与外标法无显著差异;地稔中6种成分与抗氧化活性均有较高相关性。

