bvfA基因对布鲁氏菌S19株生物学特性及睾丸支持细胞影响的研究
贾 芳,王 鑫,王玉炯,刘 军*,周学章
(1.宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021;2.内蒙古医科大学基础医学院内蒙古自治区分子生物学重点实验室,内蒙古 呼和浩特 010110;3.中国农业科学院长春兽医研究所,吉林 长春 130122)
布鲁氏菌是一种胞内寄生的革兰阴性小杆菌,无荚膜、芽孢等细菌毒力物质,其毒力主要体现于其在专职和非专职吞噬细胞中生存和增殖能力[1]。布鲁氏菌感染巨噬细胞后,在巨噬细胞内破坏囊泡运输并创造一个独特的细胞内复制环境供其增殖[2]。
布鲁氏菌在胞内生存与其毒力因子有关,包括外膜蛋白[3-4]、脂多糖[5]、二元调控系统[6]、Ⅳ型分泌系统(T4SS)[7]等,其中virB 操纵子调控的T4SS 分泌系统在布鲁氏菌胞内的生存、复制中发挥重要作用,因此T4SS 分泌系统受到广泛关注。bvfA布鲁氏菌毒力因子A(Brucellavirulence factor A)是在研究T4SS 分泌系统时发现的一个新的毒力基因,也是布鲁氏菌属特有的一种基因, 研究发现猪布鲁氏菌B. suis1330bvfA::kan突 变 体 在THP1 细 胞、J774 细 胞和HeLa细胞内增殖显著低于亲本株,同时该研究发现B.suis1330bvfA::kan突变体感染小鼠第4 周和8 周时,脾脏中的布鲁氏菌数量显著少于亲本株[8]。B. suis1330bvfA::kan突变体在体内和体外模型中毒力均高度减弱,表明bvfA基因在布鲁氏菌体内外生存中起重要作用。然而,bvfA基因是否对布鲁氏菌的生长和对适应宿主内环境的影响未见报道。另外,布鲁氏菌感染常引起动物生殖器官疾病,雄性动物感染布鲁氏菌常引起睾丸炎和附睾炎。睾丸支持细胞能为生殖细胞的分化提供营养和支持,能吞噬、消化精子形成过程中腔内残留的细胞质和发育中部分退化的生精细胞,以维持稳定的微环境,最终实现精子发生[9]。而bvfA基因是否影响布鲁氏菌对睾丸支持细胞的侵入和增殖未见报道。
因此,本研究分析了bvfA基因对布鲁氏菌S19 菌株生物学特性及睾丸支持细胞影响的研究,证实bv-fA基因参与调控布鲁氏菌S19 菌株对环境的适应性,揭示bvfA基因对布鲁氏菌与细胞共存以维持细菌的增殖起重要的作用,为布鲁氏菌致病机制和bvfA基因的功能解析提供实验依据。
1 材料与方法
1.1 菌株、细胞系及实验动物布鲁氏菌S19 菌株(亲本株)、 S19ΔbvfA(缺失株)和S19ΔbvfA/bvfA(回补株)均在长春兽医研究所P3 实验室完成构建;小鼠睾丸支持细胞(TM4 细胞)购自国家实验细胞资源共享服务平台(http://www.cellresource.cn/);5 周龄SPF级雌性BALB/c 小鼠(进实验室适应1 周开始实验)、垫料和鼠粮购自北京斯贝福公司。小鼠饲养在P3 实验室小鼠隔离笼系统Isocage TM 中(意大利,Tecni-plast)。
1.2 主要试剂DMEM 高糖培养基(SH30022.01B)购自Hyclone 公司;胎牛血清(04-001-1A)购自Bio-logical Industrial 公司;胰酪胨大豆肉汤培养基(TSB)和胰蛋白胨大豆琼脂培养基(TSA)购自青岛海博生物技术有限公司;CCK-8(CK04-1000T)购自日本Dojindo;乳酸脱氢酶检测试剂盒(LDH Assay Kit,C0017)购自上海碧云天生物技术有限公司。
1.3 各菌株生长曲线的测定将S19、S19ΔbvfA和S19 ΔbvfA/bvfA菌株分别接种于TSA 平板,37 ℃培养60 h后挑取单菌落接种到TSB 培养基中,置于37 ℃,120 r/min 震荡培养,每隔2 h 测其吸光值(OD600nm),每组3 个重复,以OD600nm平均值为纵坐标,时间为横坐标绘制生长曲线。
1.4 各菌株体外应激水平的检测将生长至对数期的3 株菌以1:100 的比例分别接种于高热(42 ℃40 min)、高盐(1.5 mol/L NaCl,37 ℃,40 min)、高渗(0.5 mol/L山梨醇,37 ℃,40 min)、氧化压力(0.003% H2O2,37 ℃,40 min)、酸(pH 4.0,37 ℃,10 min)和含抗菌素(0.5 mol/L多粘菌素B,37 ℃,40 min)的TSB培养基让其适应后,取菌液10 倍倍比稀释取100 μL 涂布于TSA 平板,37 ℃培养72 h 后进行菌落计数,取对数,比较各组菌落数,每组3个重复,检测其应激水平。
1.5 各菌株侵入TM4 细胞能力的测定将对数生长期细胞按1.0×105/孔接种于12 孔板,于37 ℃5% CO2条件下培养12 h,弃上清,PBS 洗涤3 次,3 株菌分别以MOI 100 感染TM4 细胞,培养3 h、12 h、24 h和48 h 后弃上清,每孔加1 mL 含100 μg/mL 庆大霉素的DMEM 高糖培养基培养2 h 以杀死细胞外粘附的布鲁氏菌。收集细胞加入500 μL 0.1%Triton X-100 于4 ℃静置20 min 裂解细胞。10 倍倍比稀释后取100 μL裂解液涂布于TSA 平板,置于37 ℃培养72 h 后菌落计数,取对数,计算每组菌落形成数(cfu/孔)。
1.6 各菌株对TM4 细胞活性影响的检测将对数生长期的细胞按1×104个/孔接种于96 孔板,3 株菌分别以MOI 100 感染TM4 细胞,37 ℃5%CO2培养3 h、12 h、24 h、48 h 后弃上清。PBS洗涤3次,每乳加入110 μL DMEM细胞培养原液(含10 μL CCK-8),继续孵育4 h,测OD450nm值。按照说明书公式计算TM4细胞存活率(SR)=[(AsOD450nm值-AbOD450nm值)/(AcOD450nm值-AbOD450nm值)]×100%,其中Ab 为空白对照组(不含细胞)、Ac为阴性对照组(仅含细胞)、As为实验组(含细胞并分别感染3株菌),每组设6个重复。
1.7 各菌株对TM4 细胞损伤性的测定将TM4 细胞以1×104个/孔铺于96 孔板中,3 株菌分别以MOI 100 感染TM4 细胞,感染后培养至12 h、24 h、48 h后离心取上清120 μL 到另一96 孔板中,各孔均加入60 μL LDH 检测工作液,混匀,室温避光孵育30 min后测OD490nm值。按照说明书公式计算细胞死亡率(%)=(处理样品吸光值-样品对照OD490nm值)/(细胞最大酶活性OD490nm值-样品对照OD490nm值)×100,其中测得的各组吸光值均应减去背景空白对照组吸光值,样品对照组为未感染菌株的TM4 细胞。每组设6 个重复。
1.8 各菌株对小鼠毒力的测定将S19 和S19ΔbvfA菌株以1×106cfu/mL/只的剂量分别腹腔注射BALB/c 雌性小鼠,对照组为注射等体积生理盐水组(100 μL/只),每组3只。在注射1周、2周、3周和4周后颈部脱臼迫杀小鼠称重后取脾脏,称脾重以计算脾指数,脾指数=脾脏重量(g)/体质量(g)×100%[10]。将脾加入1 mL 0.1%Tri-ton X-100[11]匀浆(Tissuelyser-24L,上海净信科技),取匀浆液作10倍倍比稀释,取合适的稀释度100 μL涂布于TSA 培养基上,37 ℃培养72 h 后进行菌落计数并取其对数,计算脾分离菌量(logcfu/脾)。
1.9 统计学分析实验数据采用平均值(-x)±标准差(s)或百分率%表示。计量资料多个样本比较采用方差分析,两两比较用Student-Newman-Keuls 和Dun-nett 法。计数资料样本间的比较用χ2检验。
2 结 果
2.1 各菌株生长曲线的测定结果通过测定不同时间段细菌培养液的吸光值并绘制细菌生长曲线,结果显示:3 株菌均在12 h~30 h 处于对数生长期,亲本株和回补株在30 h~60 h 逐渐进入平台期,60 h后进入衰亡期。而缺失株在大多数时间点较亲本株和回补株生长缓慢(P<0.05、P<0.01),且在30 h 后进入衰亡期(图1)。结果表明:bvfA基因缺失会减弱菌株体外增殖活性,与缺失株相比,S19ΔbvfA/bvfA菌株在基因组上回补了bvfA基因后增加了布鲁氏菌的体外增殖能力。

图1 布鲁氏菌的生长曲线Fig.1 Growth curves of B.abortus strains
2.2 各菌株体外应激水平的检测结果模拟环境因素检测菌株的体外应激能力,结果显示:与亲本株相比,缺失株在高热(P<0.01)、高盐(P<0.05)、高渗(P<0.05)、强酸和多粘菌素B压力下(P<0.001)生长均受到抑制,而在氧化压力下生长状况良好(P<0.001)。而回补株在高热(P<0.05)、高盐(P<0.01)、高渗(P<0.05)和强酸压力下(P<0.001)生长均好于缺失株,但并未提高其对氧化应激和抗菌素的适应能力(P>0.05)(图2)。结果表明,bvfA基因对布鲁氏菌适应环境起到了显著的调控作用。

图2 布鲁氏菌的体外应激水平检测结果Fig.2 Anti-stress level of B.abortus in vitro
2.3 各菌株侵入TM4 细胞能力的测定结果分别将感染3 株菌的TM4 细胞裂解液稀释至10-5、10-6和10-7后,取100 μL 接 种 到TSA 平 板,培 养60 h 后 进行菌落计数,检测细菌的侵袭力。结果显示:3 h 时,仅有亲本株和回补株侵入细胞内,缺失株未见侵入。12 h 时,3 株菌均能侵入TM4 细胞,缺失株侵入TM4细胞富集到的菌落数显著少于亲本株(P<0.01)。24 h和48 h 时,3 株菌均能侵入TM4 细胞,且数量无显著性差异(P>0.05)。表明缺失bvfA基因后布鲁氏菌对TM4 细胞的侵入能力减弱。缺失株在侵入TM4 细胞12 h 之内生长慢于亲本株(图3),表明bvfA基因仅在感染早期影响布鲁氏菌在TM4细胞中的增殖能力。

图3 布鲁氏菌对TM4细胞侵入能力影响的检测Fig.3 Detection of the ability of B.abortus to invade in TM4 cells
2.4 各菌株对TM4 细胞活性影响的检测结果利用CCK-8 法测定3 株菌对TM4 细胞增殖的影响,结果显示:除了12 h 时S19ΔbvfA/bvfA菌株感染的TM4 细胞活性为63%外,在3 h、12 h、24 h 和48 h 时其他各组TM4 细胞的细胞活性均大于100%,尤其在3 h 时,各组细胞均生长良好,各组在各时间点的活性均差异不显著(P>0.05)(图4)。结果表明,bvfA对TM4 细胞的活性无影响。
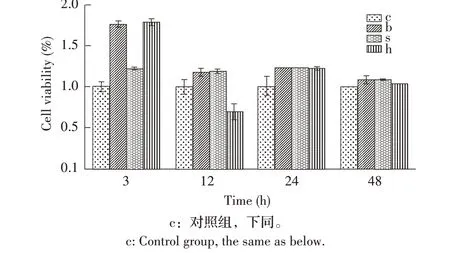
图4 布鲁氏菌对TM4细胞增殖活性影响的检测Fig.4 Detection of the effects of B.abortus on T4 cell viability
2.5 各菌株对TM4 细胞损伤的测定结果利用LDH测定3 株菌对TM4 细胞的损伤,结果发现:12 h 时,缺失株、亲本株和回补株感染的TM4 细胞死亡率分别为13.39%、7.14%和6.53%,缺失株在12 h 时对TM4 细胞损伤大于亲本株和回补株(P<0.001);24 h 时缺失株、亲本株和回补株感染的TM4 细胞死亡率分别为14.97%、12.40%和5.99%,缺失株在24 h 时对TM4细胞损伤大于亲本株和回补株(P<0.001); 12 h~24 h时,缺失株和亲本株感染的TM4 细胞死亡率的差距在缩小,即从6.25%(13.39%~7.14%)减小到2.57%(14.97%~12.40%)。48 h 时,3 株布鲁氏菌对TM4 细胞的损伤性均增大,其中缺失株和亲本株对TM4 细胞的损伤无显著差异(P>0.05)(图5)。结果表明:bvfA基因在布鲁氏菌感染的早期在和细胞共存机制中发挥重要作用。

图5 各菌株感染后的TM4细胞死亡率Fig.5 Mortality of TM4 sertoli cells
2.6 各菌株对小鼠毒力的测定结果将S19 菌株和S19ΔbvfA菌株经腹腔感染小鼠,结果显示:缺失株感染小鼠4 周时脾指数分别为0.65%、1.78%、3.69%和3.36%;亲本株感染小鼠4 周时脾指数分别为0.87%、2.88%、3.84%和3.34%。缺失株和亲本株在感染小鼠1 周时的毒力均较弱;在2 周时,与对照组相比缺失株和亲本株感染小鼠的脾指数增均极显著增加(P<0.001),但缺失株感染小鼠的脾指数明显低于亲本株(P<0.01)。在3 周和4 周时,缺失株和亲本株与对照组的脾指数差异显著(P<0.01), 但感染缺失株和亲本株小鼠脾指数无显著性差异(P>0.05)。另外,小鼠脾分离菌量在感染后1 周~4 周迅速增加,除3 周外,缺失株感染小鼠脾分离菌量均小于亲本株感染组(P<0.05)(图6)。上述结果表明:bvfA基因的缺失降低了布鲁氏菌在脾组织中的增殖能力,进而降低了布鲁氏菌对小鼠的毒力。

图6 布鲁氏菌感染小鼠的脾指数(A)和脾分离菌量(B)的检测Fig.6 Spleen index(A)and microbial isolated number(B)in mice infected with B.abortus
3 讨 论
bvfA基因是布鲁氏菌属特有的一种毒力基因,其在布鲁氏菌体内外的生存发挥重要作用。现有研究多见于对布鲁氏菌bvfA基因的检测,伊朗Fars 2005 年~2011 年间从流产胎儿中分离的42 株马耳他布鲁氏菌B. melitensis中有33 株含有bvfA基因(78.6%)[12]。另有报道,bvfA基因在临床马耳他布鲁氏菌分离株中的检出率分别是93%和92.9%[13-14]。在前期研究中对S19 菌株bvfA基因进行核酸序列比对发现,S19 菌株bvfA基因与猪布鲁氏菌bvfA基因、马耳他布鲁氏菌bvfA基因、犬布鲁氏菌bvfA基因序列同源性均为100%,将bvfA基因提交GenBank 获得基因序列号MN651999[15],并将bvfA基因进行同源性BLAST 分析,结果显示其他细菌未见相似性序列,验证了bvfA基因是布鲁氏菌的特有基因。
前期实验构建了布鲁氏菌S19ΔbvfA株,本研究发现bvfA基因缺失株与亲本株相比生长较慢,表明bvfA基因缺失对布鲁氏菌S19 的体外生长有一定的影响。S19ΔbvfA菌株体外应激试验结果显示,该缺失株对高热、高盐、高渗、强酸和抗菌素的适应能力减弱,但抗氧化性增强,表明bvfA基因参与调控布鲁氏菌S19 株对环境的适应性,对维持布鲁氏菌S19 株抗氧化能力具有重要作用。有研究显示布鲁氏菌M28 株缺失tatA基因后对H2O2的敏感性增加[16],但也有报道称布鲁氏菌S19 株中mglA基因的缺失可导致该菌对H2O2耐受性的增强[17],表明不同布鲁氏菌不同基因对H2O2的敏感性的不同,然而bvfA基因是否在增强布鲁氏菌抗氧化方面与mglA基因具有相似机制有待进一步研究。
利用bvfA基因缺失株感染小鼠TM4 细胞3 h 和12 h 时,在细胞内富集到的菌落数均少于亲本株,而在24 h 和48 h 时二者无显著差异。有研究在比较绵羊附睾布鲁氏菌B. ovisPA 及其Δcgs、ΔvirB2和ΔvjbR突变株感染人滋养层细胞JEG-3 和绵羊睾丸上皮细胞OA3.Ts 时发现,细胞中的ΔvirB2和ΔvjbR突变株数量在44 h 之内一直在减少,而Δcgs突变株和亲本株在20 h之内数量不变,20 h后数量增加,直到44 h时数量增加了1 log[18]。说明不同的基因在维持布鲁氏菌胞内复制中发挥作用的时间不同,bvfA基因主要在布鲁氏菌感染宿主后12 h 之内影响该菌在TM4 细胞中的增殖能力。
乳酸脱氢酶的释放是细胞坏死的典型特征[19-20],是反映细胞损伤或死亡的重要指标[21]。采用CCK-8法无法检测到布鲁氏菌对TM4 细胞活性的影响,因此,本研究利用检测TM4 细胞中的LDH 含量来分析细胞的死亡率,结果发现在12 h 时感染缺失株的TM4 细胞释放更多的乳酸脱氢酶,标志细胞坏死率大于感染其他布鲁氏菌的TM4 细胞,据此计算TM4细胞死亡率显示,在感染后12 h 时感染缺失株的TM4 细胞比感染亲本株的TM4 细胞死亡率高6.25%,24 h 时感染缺失株的TM4 细胞比感染亲本株的TM4细胞死亡率高2.57%,48 h 时感染缺失株的TM4 细胞和感染亲本株的TM4 细胞死亡率已无显著差异,可见感染缺失株的TM4 细胞和感染亲本株的TM4 细胞死亡率的差距随着感染时间的延长而缩小。结合本研究侵入试验和杀伤试验结果推测bvfA基因可能仅在布鲁氏菌感染宿主早期发挥作用,参与维持布鲁氏菌与细胞共存的作用,以便布鲁氏菌感染宿主早期时在宿主细胞中增殖。
本研究发现布鲁氏菌S19ΔbvfA缺失株感染组小鼠在2 周时脾指数小于亲本株感染组小鼠,3 周和4周时感染缺失株和亲本株小鼠脾指数无显著性差异,在1 周、2 周、4 周时缺失株感染组小鼠脾分离菌量均小于亲本株组,说明bvfA基因对布鲁氏菌S19 毒力有一定的影响。然而在3 周时感染缺失株组小鼠和感染亲本株小鼠脾分离菌量无显著差异,其原因是3周时感染布鲁氏菌的小鼠正处于从感染急性期向感染慢性期过渡,这一时期脾中仅分布少量布鲁氏菌,不足以比较感染缺失株组小鼠和感染亲本株小鼠脾分离菌量的差异[22]。
本研究证实了bvfA基因会影响布鲁氏菌S19 株的体外生长,参与调控其对环境的适应性。bvfA基因对维持布鲁氏菌S19 株在睾丸支持细胞中的复制及增殖起一定的作用。布鲁氏菌S19ΔbvfA株毒力的减弱提示其有望成为制备新缺失株疫苗的候选株,为布鲁氏菌致病机制和bvfA基因的功能解析奠定理论一定的实验基础。

