野鸟源H8N2亚型禽流感病毒的生物学特性分析
田井满,李明慧,白晓利,李玉磊,刘丽娜,李雁冰,陈化兰
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点开放实验室,黑龙江 哈尔滨 150069)
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科A 型流感病毒属,病毒粒子表面表达的两种糖蛋白分别为血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)。在世界各地的野鸟中均可分离到AIVs,根据HA 可将其划分为16 种亚型(H1~H16); 根 据NA 可 将 其 划 分 为9 种 亚 型(N1~N9),目前已经检测到140 多种HA-NA 亚型组合[1-2]。H8 亚型AIV 于1967 年首次在北美的火鸡中分离到,随后在全球均检测到了该亚型病毒[3-5]。目前在AIV 数据(https://www.gisaid.org/)中H8 亚型AIV 共有271 株,其中最常见的亚型组合是H8N4,但H8 亚型也与N2、N3、N5 和N7 等NA 亚型组合。H8 亚型AIV 为低致病性禽流感病毒(LPAIV),按照其进化关系可划分为欧亚分支和北美分支。
为了解本团队2019 年于山东省荣成市分离到的一株H8N2 亚型AIV 的生物学特性,本研究对该H8N2 亚型AIV 进行了全基因组测序,并对其特殊氨基酸位点和遗传演化作了分析,评估了其对SPF 鸡和BALB/c 小鼠的致病性,为H8N2 亚型AI 的综合防控提供参考。
1 材料与方法
1.1 主要实验材料600 份新鲜天鹅粪便样品为2019 年1 月采集自山东省荣成市。9 日龄~11 日龄的普通鸡胚、10 日龄的SPF 鸡胚及SPF 鸡红细胞购自中国农业科学院哈尔滨兽医研究所动物实验中心。RNA 提取试剂盒购自天根生化科技(北京)有限公司;RNA 反转录酶购自日本TOYOBO 公司;rTaqDNA 聚合酶购自北京全式金生物技术有限公司;PCR 产物纯化试剂盒、胶回收试剂盒美国OMEGA 公司;测序反应试剂盒BigDye Terninator 3.1 购自美国ABI 公司。
1.2 引物的设计与合成采用MEGA7 软件对AIV数据库中H8 亚型AIV 序列分析比对后,采用Primer Premier 5.0 软件根据比对结果设计扩增H8 亚型AIV8个内部基因节段的引物(表1),引物均由吉林库美生物有限公司合成。
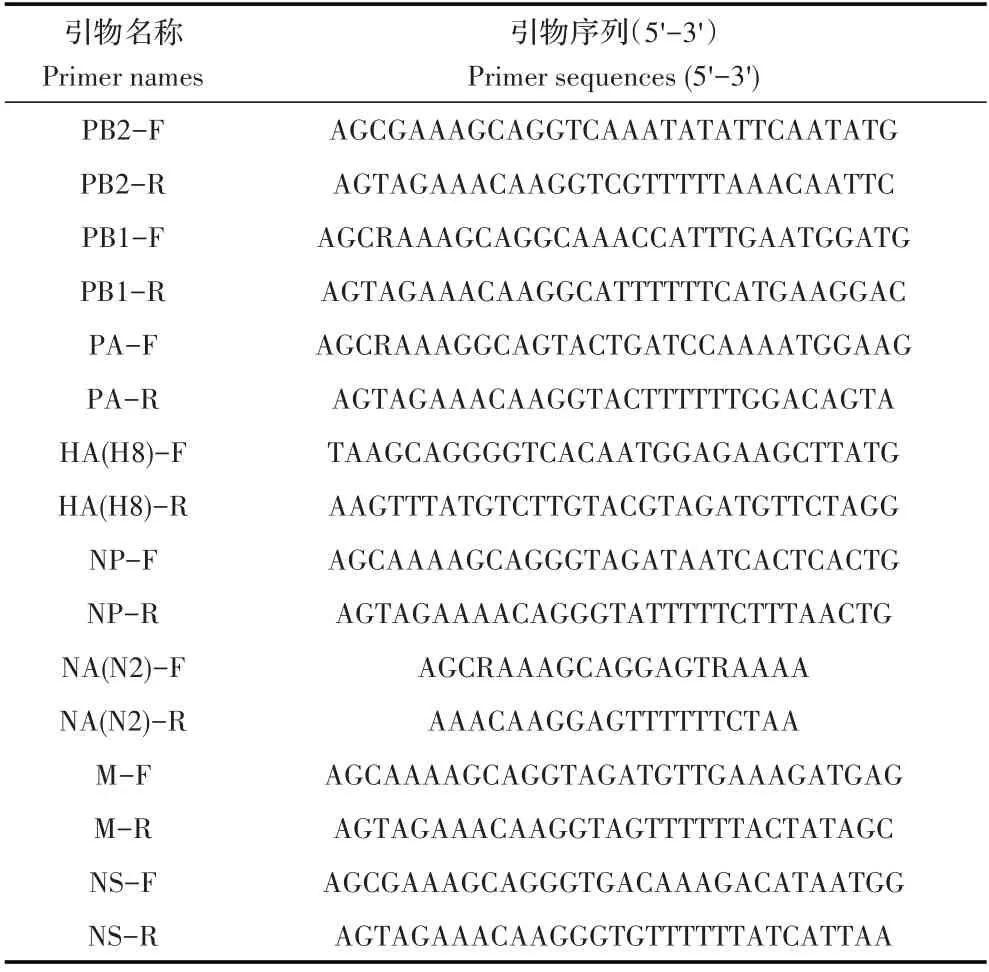
表1 本研究所用引物Table 1 Primers used in this study
1.3 病毒分离及其亚型鉴定将600 份粪便样品经旋涡震荡、离心后取上清液,以0.3 mL/枚接种9 日龄~11 日龄的普通鸡胚, 37 ℃孵化72 h 后收获鸡胚尿囊液,按常规方法测定其血凝(HA)活性,HA阳性(HA≥21)的样品再通过对H1~H16 单因子血清及新城疫(ND)标准血清的血凝抑制(HI)试验确定其HA 亚型。提取确定HA 亚型的AIV 样品RNA,采用AIV 12 bp 通用引物反转录为cDNA,参照文献[6],利用RT-PCR 进一步鉴定其NA 亚型。
1.4 病毒的纯化及半数感染量(EID50)的测定将收获的第1 代鸡胚尿囊液用PBS 10 倍倍比稀释后,每稀释度接种3 枚9 日龄~11 日龄SPF 鸡胚,置于37 ℃孵化器中培养48 h 后收集最高稀释度最高血凝价的尿囊液,连续传代纯化3 代后的尿囊液以106倍稀释后接种5 枚SPF 鸡胚,收集全部尿囊液,无菌检验后即为纯化病毒。参考文献[7]测定纯化病毒的EID50。
1.5 病毒全基因组测序及进化分析以1.3 中分离株病毒为模板,采用AIV 8 个内部基因节段特异性引物分别扩增各基因,回收纯化扩增产物后测序,利用Se-qMan 软件根据测序结果拼接全基因组,参照GISAID数据库中相关序列,经MAFFT 多重序列比对软件比对后,利用RAxMLv8.2.10 构建系统发育进化树。
1.6 病毒对SPF 鸡的致病性试验将8 只4 周龄SPF鸡经翅静脉接种100 μL(106EID50)的该分离病毒液,24 h 后放入3 只未感染的SPF 鸡,以检测病毒的水平传播能力;感染后第3 d 随机迫杀3 只感染鸡,无菌采集鸡的大脑、脾脏、胰腺、盲肠扁桃体、肾脏、法氏囊、胸腺、气管和肺脏,剩余的鸡分别在感染后第3 d、5 d、7 d、9 d 采集喉拭子和泄殖腔拭子。将采集的样品常规处理后(脏器样品加入钢珠后研磨处理;咽拭子及泄殖腔拭子经旋涡震荡处理),离心取上清液,通过病毒滴定试验检测病毒在鸡各脏器中的复制及排毒状况,利用Reed-Muench 法计算病毒滴度。另外在感染后14 d 对存活鸡经翅静脉采血分离血清,通过HI 试验来测定血清HI 抗体转阳情况。
1.7 病毒对BALB/c 小鼠的致病性试验每组8 只6周龄的雌性BALB/c 小鼠,干冰麻醉后,感染组鼻腔接种50 μL(106EID50)病毒液,对照组鼻腔接种50 μL PBS。感染后第3 d 每组随机剖杀3 只小鼠,无菌采集小鼠的大脑、脾脏、肾脏、肺脏、鼻甲,按照常规实验指导研磨、离心后通过病毒滴定试验检测小鼠各个脏器中的病毒复制情况,按Reed-Muench 法计算病毒在小鼠脏器内的滴度。其余5 只小鼠连续称重14 d,记录其体质量变化及死亡情况。
2 结 果
2.1 病毒的分离与鉴定将采集的野鸟粪便样品接种鸡胚后收获鸡胚尿囊液,进行HA 试验。结果显示有3 份样品呈现HA 阳性,样品编号分别为SD-134、SD-341、SD-442。对HA 阳性的样品进行HI 试验,结果显示SD-341 和SD-442 为新城疫病毒;SD-134可被AIV H8 亚型单因子血清所抑制,HI 效价可达到1:64,而不能被阴性血清及AIV 其他亚型单因子血清所抑制,表明该样品含有H8 亚型AIV。经RTPCR 鉴定SD-134 的NA 亚型,结果显示其为N2 亚型,表明该样品为H8N2 亚型AIV,命名为A/whoop-er swan/Shandong/S1-134/2019(H8N2),简称WS/SD/S1-134/2019(H8N2)。经纯化后检测该病毒的EID50为107.83EID50/100 μL。
2.2 WS/SD/S1-134/2019(H8N2)分离株全基因组的PCR 扩增及序列分析对WS/SD/S1-134/2019(H8N2)采用特异性引物进行内部基因组的RT-PCR 扩增,并测序后序列分析。结果显示,其HA 基因的ORF 为1 701 bp,编码566 个氨基酸,与孟加拉国的一株鸭源H8N4(A/duck/Bangladesh/37509/2019)同源性最高,为98.04%;其NA 基因的ORF 为1 401 bp,编码467 个氨基酸,与鸭源H9N2(A/Duck/China/E1158/2014(H9N2))同源性最高,为98.92%;其内部基因分别与H4N6、H6N2、H10N7、H11N2、H12N5 等亚型AIV 的部分基因具有最高核苷酸序列同源性。此外,分离株除PB2 和PA 基因与野鸟源的LPAIV 具有最高同源性外,其余基因均与鸭源的LPAIV 具有最高同源性(表2)。综上表明,WS/SD/S1-134/2019(H8N2)分离株具有多亚型AIV 重组的特点。
2.3 WS/SD/S1-134/2019(H8N2)分离株氨基酸位点分析 对WS/SD/S1-134/2019(H8N2)进行特殊氨基酸位点分析,结果显示,HA 蛋白氨基酸的裂解位点为SIEPK/GLF,仅有一个碱性氨基酸,符合LPAIV 的分子特征;在受体结合位点aa222 与aa224 均未发生突变,均为典型的禽型受体结合位点。其N2 蛋白在aa62~aa69 位发生缺失,而PB2 蛋白的aa627 与aa701均未发生突变,但PB1 蛋白发生了D622G 的突变。另外该H8N2 亚型AIV NS1 蛋白在aa80~aa84 未发生缺失,但在aa42、aa101、aa138 均发生了突变,这可能会增加其对小鼠的致病性(表3)。上述结果表明,WS/SD/S1-134/2019(H8N2)分离株具有潜在增强小鼠致病性的能力。
表3 WS/SD/S1-134/2019(H8N2)株关键氨基酸位点分析Table 3 Key residues of WS/SD/S1-134/2019(H8N2)genome
2.4 WS/SD/S1-134/2019(H8N2)分离株基因遗传进化分析 对WS/SD/S1-134/2019(H8N2)全基因进行遗传进化分析,结果显示其HA 基因与H8N2、H8N4、H8N5 亚型AIV 的HA 基因同属于一个分支,均可划分为欧亚分支(图1)。WS/SD/S1-134/2019(H8N2)的NA基因与我国家禽中广泛流行的H9N2 亚型AIV 的NA 基因聚为一支,属于欧亚分支(图2)。对其内部基因进行遗传进化分析,结果显示,除了WS/SD/S1-134/2019(H8N2)分离株的PB2 基因可以划分为北美分支外,其余5 个内部基因(PB1、PA、NP、M 以及NS 基因)均属于欧亚分支(图3)。上述结果表明WS/SD/S1-134/2019(H8N2)分离株的各个基因进化具有跨大陆、跨物种及多亚型重组的特点。
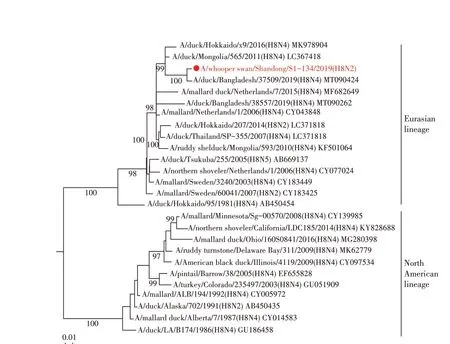
图1 WS/SD/S1-134/2019(H8N2)分离株HA基因进化树Fig.1 The HA gene phylogenetic tree of WS/SD/S1-134/2019(H8N2)
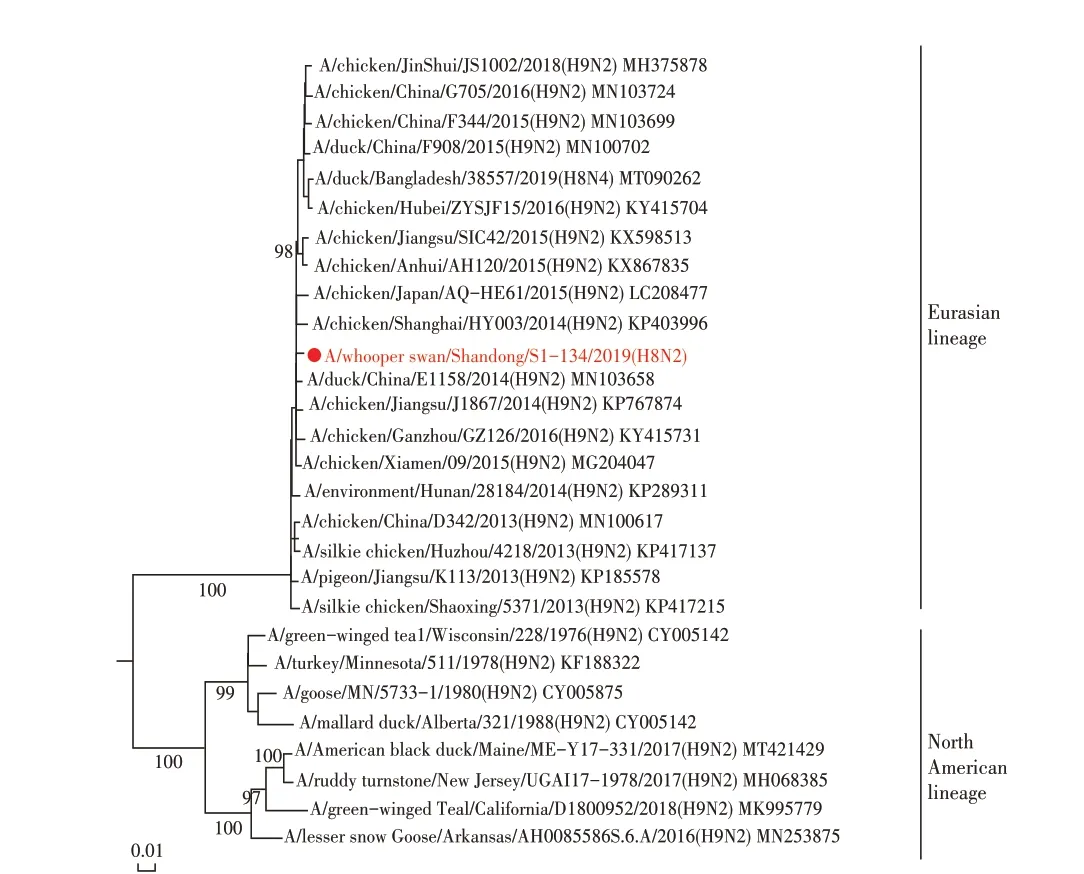
图2 WS/SD/S1-134/2019(H8N2)分离株NA基因进化树Fig.2 The NA gene phylogenetic tree of WS/SD/S1-134/2019(H8N2)
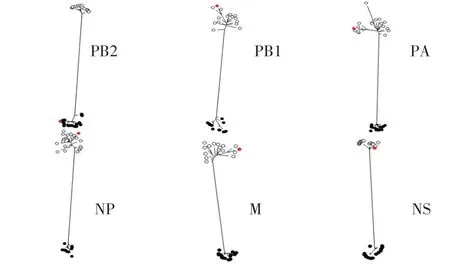
图3 WS/SD/S1-134/2019(H8N2)分离株内部基因的进化树Fig.3 The internal genes phylogenetic trees of WS/SD/S1-134/2019(H8N2)
2.5 分离株对SPF 鸡致病性试验结果WS/SD/S1-134/2019(H8N2)分离株感染SPF 鸡后感染组和同居组均未出现明显的临床症状,各脏器中也均未检测到该病毒,表明该病毒株不能在SPF 鸡中有效的复制和水平传播。在感染后各个时间点采集的喉拭子和泄殖腔拭子也均未检测到病毒,表明感染组和同居组SPF 鸡均不能向外界排毒。另外,感染14 d 后的各组鸡抗体检测中也未发现HI 抗体转阳的情况。以上结果表明WS/SD/S1-134/2019(H8N2)分离株对SPF 鸡呈现低致病力,对家禽的威胁较小。
2.6 分离株对小鼠致病性试验结果WS/SD/S1-134/2019(H8N2)分离株感染小鼠3 d 后脏器病毒滴定检测结果显示,其能在小鼠肺脏和鼻甲中有效复制,病毒滴度分别为4.25 log10EID50/mL~5.5 log10EID50/mL 和3.25 log10EID50/mL~4.5 log10EID50/mL。对照组小鼠未检测到病毒(图4)。被检3 只小鼠中两只小鼠肾脏和一只小鼠脾脏中检测到该病毒,病毒滴度分别为0.98 log10EID50/mL、2.75 log10EID50/mL 和1.5 log10EID50/mL。剩 余5 只小鼠连续观察14 d,均未出现死亡,且无明显临床症状和体质量下降。对照组小鼠也均正常(图5)。表明该分离株对小鼠呈低致病力。
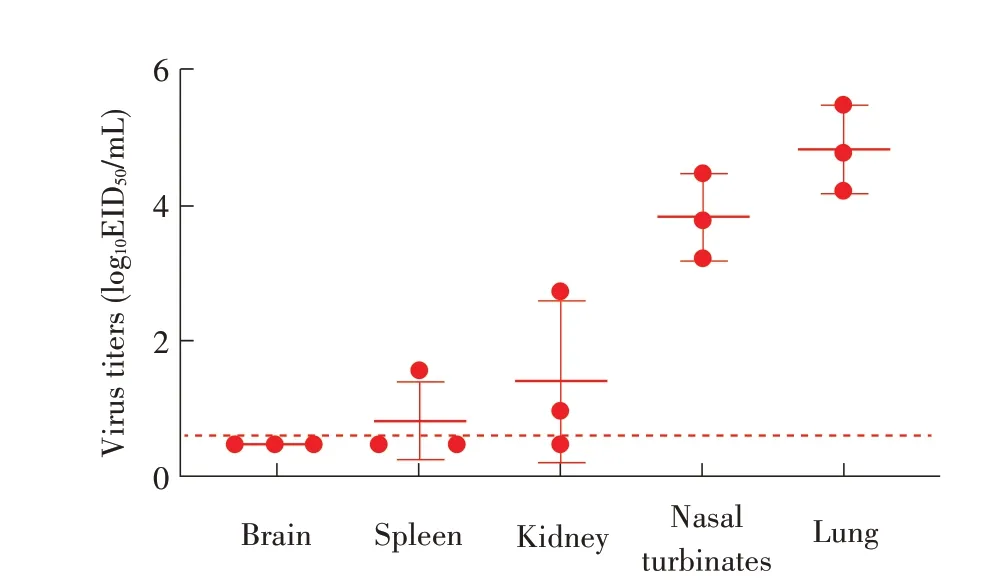
图4 分离病毒感染3 d后小鼠脏器病毒滴定结果Fig.4 Viral titers in the organs of mice at 3 d post-inoculation
图5 小鼠感染病毒后的体质量变化Fig.5 Weight change of mice post-inoculation
3 讨 论
野鸟是AIV 的自然宿主,H8 亚型AIV 主要分离自雁形目(野鸭、天鹅和鹅)鸟类[8]。在AIV 数据(https://www.gisaid.org/)中,全球共分离到271 株H8亚型AIV,其中北美大陆占64.21%(174/271),欧亚大陆占34.32%(93/271),其他地区占1.47%(4/271),不同地区的分离数量不同可能与野鸟的栖息地有关。同时随着野鸟的迁徙可能会使LPAIV 在各大洲间传播,并可能导致AIV 的进化以及重组[9-10],而在全球8 条候鸟的迁徙路线中有3 条经过中国,家养水禽可能通过和野鸟共用水源被感染,目前已有研究报道H8 亚型AIV 在家养水禽和野鸟中均被检测到[11]。因此,对该亚型AIV 的监测尤为重要,本研究从野鸟粪便分离到AIV WS/SD/S1-134/2019(H8N2)株更说明了对H8亚型AIV 监测的重要性。
本研究对分离得到的WS/SD/S1-134/2019(H8N2)株的遗传进化研究显示,该H8N2 亚型AIV 的各基因节段来源于不同地区、不同宿主以及不同亚型AIV,说明该病毒株具有跨大陆、跨物种及多亚型AIV 重组的特点。综上所述,野鸟对AIV 的进化和传播起着重要作用,越冬或中途停靠地可能是野鸟与家禽之间传播AIV 的关键。因此,需要加强对野鸟越冬或中途停靠地的监测密度及频率。
为了进一步了解WS/SD/S1-134/2019(H8N2)株分子进化特征,本研究以A/Aichi/2/1968(H3N2)的NA蛋白为参考株,分析该分离病毒NA 的颈部缺失,其余的7 个蛋白均以A/goose/Guangdong/1/1996(H5N1)的蛋白序列为参考株,分析分离株的特殊氨基酸位点及序列。NA 蛋白的颈部缺失会影响病毒的感染性和复制能力[12],本研究分离的H8N2 AIV N2蛋白在aa62~aa69 发生缺失,这可能会增强该病毒在小鼠体内的复制能力。PB2 蛋白与病毒的宿主适应性及传播能力相关[13],但本研究分离的WS/SD/S1-134/2019(H8N2)株PB2 蛋白的aa627 与aa701 均未发生突变。PB1 蛋白与PA 蛋白通过改变RNA 依赖的RNA 聚合酶(RdRP)组分之间的亲和力而影响病毒的复制能力和聚合酶活性[14],且许多单一氨基酸的突变会改变病毒对小鼠的致病性,如D622G 的突变可以增强病毒对小鼠的致病性,本研究分离的H8N2 AIV 发生了D622G 的 突 变。NS 基 因 编 码NS1、NS2 和NS3 蛋 白,其中NS1 蛋白中的单个氨基酸缺失或突变可能会影响AIV 对小鼠的致病性[15],本研究分离的H8N2 亚型AIV 在aa80~aa84 未发生缺失,但在aa42、aa101、aa138 均发生了突变,这可能会增强该病毒对小鼠的致病性。
动物致病性试验显示,本研究分离的该新型重组H8N2 亚型AIV 虽然对家禽(鸡)和哺乳动物(小鼠)呈低致病力,但是该病毒已可以在小鼠体内有效复制,且其基因组携带多个AIV 增强哺乳动物致病性的关键氨基酸位点,具有感染人的潜在风险,应加大监测力度,密切关注其在野鸟以及家禽中出现的频率和波及面,以及对哺乳动物的致病性。本研究为我国AI的综合防控及公共卫生安全提供参考数据。

