靶向CD70抗肿瘤药物的研究进展
杨凡 综述;纪锋,郭志刚 审阅(南京师范大学 生命科学学院,江苏 南京 210046)
近年来,基于特异性靶点的免疫疗法已经成为肿瘤治疗领域的热点。分化抗原簇70(cluster of differentiation 70,CD70)属于肿瘤坏死因子受体超家族成员之一,为一种Ⅱ型穿膜糖蛋白,最初与CD30一同作为霍奇金淋巴瘤的标志物,并被克隆出Ki-24抗体[1-2]。根据命名规则,将Ki-24命名为CD70[3]。早在1993年,GOODWIN 就发现了CD27 配体(CD27 ligand,CD27L)是一种Ⅱ型穿膜糖蛋白[4],一系列研究结果[5]表明CD27L 与CD70 是同一种分子。CD70与CD27结合可诱导NF-κB和c-Jun激酶信号通路的激活,进而发挥一系列生理作用,如促进细胞存活,基因表达和促炎反应等[6]。B 细胞中的CD70 通过与PI3K 和MEK 信号通路结合,使其靶标的PKB 和ERK1/2 磷酸化,促进基因的转录、细胞的增殖与分化[7-8]。正常情况下,CD70 只在活化的T 细胞和B 细胞以及成熟的树突状细胞短暂表达。而近年研究[9-14]发现,CD70在多种血液恶性肿瘤和实体瘤中异常表达,特别是在淋巴瘤、肾细胞癌、胶质母细胞瘤、鼻咽癌以及Epstein-Barr 病毒(Epstein-Barr virus,EBV)感染所诱导的肿瘤中。INAGUMA等[15]发现,在恶性胸膜间皮瘤中异常表达的CD70 可以通过调节MET 蛋白表达,激活MET-ERK 信号通路,从而增强肿瘤的迁移与侵袭能力。因此,靶向CD70所开发的药物对于肿瘤治疗来说是一种很有潜力的策略。笔者总结了近年以CD70 为靶点的抗肿瘤药物的相关研究进展,以期为抗肿瘤药物的研发提供新的思路与策略。
1 靶向CD70抗肿瘤药物的适应证
除了在血液来源正常的细胞中短暂表达外,CD70 在多种血液恶性肿瘤以及一些实体瘤中高度且稳定的表达,如霍奇金淋巴瘤、胶质母细胞瘤、黑色素瘤、肾细胞癌等。CD70在肿瘤细胞中表达的机制可能为CD70 与T 细胞表达的CD27 结合,启动凋亡蛋白Siva 使B 细胞或T 细胞产生细胞毒性作用而发生凋亡,从而发生免疫逃逸[16]。LENS等[17]发现,与正常淋巴组织相比,B细胞淋巴瘤和慢性淋巴细胞白血病异常表达CD70 与CD27,肿瘤细胞可以通过自分泌方式来利用CD27-CD70 的相互作用传递增殖信号,促进细胞增殖。研究[18]发现,CD70 在胸腺鳞状细胞癌中也呈高表达,但在非典型胸腺瘤与胸腺瘤中不表达。因此,CD70免疫组织化学可能有助于将胸腺鳞状细胞癌与其他类型胸腺的上皮肿瘤区分开来。另外,在不同类型的肿瘤中CD70表达水平也不尽相同,如在非霍奇金淋巴瘤、霍奇金淋巴瘤、原发性黑色素瘤、胸腺鳞状细胞癌以及间变性星形细胞瘤中表达高达80%以上,而在套细胞淋巴瘤和非小细胞肺癌中则低于30%[19-24]。因此,研发靶向CD70 的抗肿瘤药物对于治疗不同类型肿瘤的效果也是不同的。
1.1 CD70与血液恶性肿瘤
淋巴瘤中发生恶变的B细胞表面所表达的CD70可以作为细胞增殖促进信号的传感器,促进肿瘤的生长与转移[25]。CD27与CD70信号通路通过B细胞-B细胞相互作用可以介导旁分泌生长信号,有助于淋巴瘤的发生。CD70 表达可以通过感染病毒如EBV和外周血淋巴细胞的人类T 细胞白血病/淋巴瘤病毒1 型以及通过EBV 编码的潜伏膜蛋白1 的基因转移而增强[26]。几乎在所有霍奇金淋巴瘤病例中,永生化角质形成细胞均与EBV 感染密切相关。HO 等[27]研究发现,华氏巨球蛋白血症的细胞同时表达CD70和可溶性CD27(soluble CD27,sCD27),能够引发sCD27-CD70信号通路,促进肿瘤的发展。
1.2 CD70与实体瘤
胶质母细胞瘤是一种最常见的原发性中枢神经系统肿瘤,在胶质母细胞瘤中CD70高表达能够抑制免疫细胞的功能[28]。尽管CD70-CD27信号通路具有抗肿瘤作用,但在胶质母细胞瘤组织中异常表达CD70,可以通过CD70-CD27的相互作用启动凋亡蛋白Siva 信号通路介导免疫细胞发生凋亡[13]。与正常组织相比,肾细胞癌组织中CD70 表达明显升高,特别是在透明肾细胞癌和肉瘤样肾细胞癌中CD70 表达总体上较高[20]。表达CD70的肾细胞癌诱导淋巴细胞凋亡的机制可能有两种:一是通过表达CD27的淋巴细胞和表达CD70 的肾细胞癌细胞之间的直接接触;二是通过CD70 裂解并释放到肿瘤微环境中,随后它可以靶向肿瘤淋巴细胞,与其CD27受体相互作用并启动T 细胞凋亡[16]。因此,CD70 可能是靶向治疗肾细胞癌的一个有效靶点。
2 靶向CD70的抗肿瘤药物
CD70 在正常组织和肿瘤组织中的表达差异,使其具有最佳靶向特异性并能避免潜在的副作用。近年来,CD70被视为针对多种血液系统恶性肿瘤和实体瘤的抗体导向免疫治疗的合适靶点,一些靶向CD70 的药物被开发并获准进入临床试验阶段(表1)。表1列举了以CD70为靶点开发并应用到临床的抗肿瘤药物:单克隆抗体(monoclonal antibody,mAb)[29]、抗体药物偶联物(antibody-drug conjugate,ADC)[30]、嵌合抗原受体T(chimeric antigen receptor-T,CAR-T)细胞[31]等。
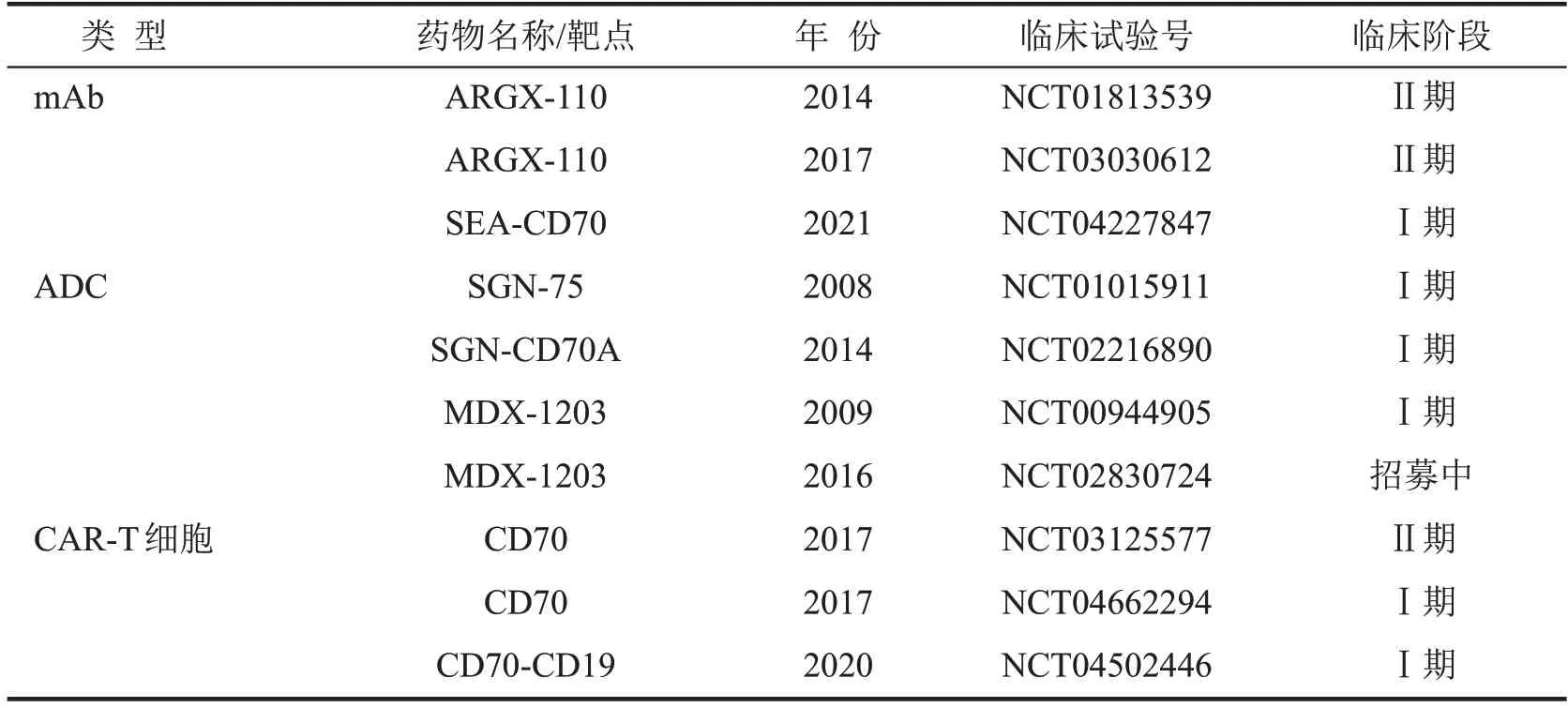
表1 靶向CD70的抗肿瘤药物的临床试验*
2.1 mAb
MCEARCHERN 等[32]合成了一种人源化IgG1 的CD70 抗体,将其命名为SGN-70。SGN-70 能够通过抗体依赖细胞毒性作用(antibody dependent cytotoxicity,ADCC)、抗体依赖的细胞吞噬作用和补体依赖的细胞毒性作用起到抗肿瘤作用。SGN-70上的可结晶片段(fragment crystallizable,Fc)与CD70结合,阻断CD70-CD27 信号通路。SILENCE 等[33]开发了一种去岩藻糖基化的IgG1 mAb,可选择性靶向并与CD70 结合,命名为ARGX-110(cusatuzumab)。去掉岩藻化糖可以显著提高抗体与其Fc 受体(FcγRIIIa)的亲和力及ADCC活性。ARGX-110通过阻断CD70-CD27 信号通路和阻碍肿瘤微环境中的Treg细胞募集或激活而发挥作用。
2.2 ADC
ADC 是一种新型治疗药物,主要是mAb 通过化学接头与生物活性药物相连形成,在肿瘤部位递送药物和释放细胞毒剂而起到杀伤肿瘤细胞的作用。合成ADC方式有多种,包括:抗体-蛋白质毒素(或抗体片段-蛋白质毒素融合)偶联物、抗体螯合放射性核素偶联物、抗体-小分子药物偶联物和抗体-酶偶联物[34]。ADC可以与肿瘤细胞表达的靶抗原特异性结合,选择性地将高效药物递送至肿瘤细胞中,治疗指数宽,循环半衰期延长,偶联物在循环中保持稳定,能够减少不良反应[35]。CD70 作为肿瘤治疗靶点的ADC 药物也被研发出来,如SGN-75、MDX-1203 与SGN-CD70A 等被应用于各种血液恶性肿瘤及一些实体瘤的治疗中[36]。
2.2.1 SGN-75 LAW等[37]制备了一种用于治疗肾细胞癌的ADC,他们通过将CD70 特异性抗体SGN-70与肿瘤药物小分子甲基澳瑞他-F(monomethyl auristatin F,MMAF)通过缬氨酸-瓜氨酸二肽接头方式连接,每个ADC 带有4 或8 个药物分子。当该ADC 与肿瘤细胞表面的CD70 结合,将MMAF 内化递送到溶酶体,在溶酶体中药物被释放并产生毒性作用进而杀死肿瘤细胞。OFLAZOGLU 等[38]以不可裂解的硫醚或马来酰亚氨基己酰基(mc)接头将SGN-70 与MMAF 偶联形成ADC,在存在抗体条件下,发现mcMMAF比vcMMAF更具有耐受性。偶联4分子MMAF 与偶联8个药物分子的ADC都具有有效的抗肿瘤作用,且偶联4 个药物分子的ADC 治疗效果更好,将其命名为SGN-75。
2.2.2 MDX-1203 MDX-1203是由CD70特异性抗体通过基于多肽的药物分子共价连接小分子药物MED-2460 或双特异性药物形成的ADC[39]。MDX-1203 是通过抗体与肿瘤细胞表面的CD70 结合将药物运输到细胞内,药物可与DNA 腺嘌呤碱基形成共价化合物,使DNA发生烷基化,阻止DNA复制,抑制细胞增殖并促使肿瘤细胞凋亡[40]。
2.2.3 SGN-CD70A PAL 等[41]通过缬氨酸-丙氨酸二肽接头将SGN-70 与PBD(pyrrolobenzodiazepine)偶联形成SGN-CD70A。PBD是一种DNA交联剂,可以与双链DNA 反应形成链间DNA 交联,从而抑制DNA的修复,发挥有效的细胞毒作用。但是,针对弥漫性大B细胞淋巴瘤和套细胞淋巴瘤患者治疗时,患者往往出现血小板减少症的副反应[42]。
2.3 CAR-T细胞疗法
CAR-T细胞疗法是一种新开发的用于针对肿瘤的个性化治疗方法[43]。通过将患者的肿瘤细胞表面表达的特异性蛋白作为靶点嵌合到患者的T 细胞表面,再回输到患者体内,使T 细胞能够特异性靶向肿瘤细胞起到杀伤作用。CAR-T细胞主要包含四个部分:抗原结合域、铰链区、穿膜域和细胞内信号域[44]。CD70在多种血液瘤以及实体瘤中表达,而在正常组织中表达较少,因此可以作为CAR-T 细胞疗法的有效靶点。
2.3.1 靶向CD70-CAR 细胞SHAFFER等[45]利 用CD70 与CD27 的相互作用,产生了靶向CD70 的CAR,它是由全长CD27 作为抗原识别域与CD3ζ 链的细胞内结构域融合形成。靶向CD70 特异性T 细胞杀死CD70阳性肿瘤细胞,并在免疫缺陷小鼠异种移植瘤模型中也具有抗肿瘤活性。WANG 等[46]通过将CD27的不同部分与CD3ζ以及共刺激信号结构域(41BB)融合嵌合形成CAR。SAUER 等[47]开发了一种CD70-CAR 细胞,用于治疗急性髓系白血病,结果发现,靶向CD70的CAR-T细胞可以特异性识别表达CD70 的活化病毒特异性T 细胞,并不影响正常的造血功能,具有广泛的应用前景。JI 等[48]通过将靶向CD70 的CAR 与聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂联合治疗CD70阳性肾癌,结果发现,PARP抑制剂可以通过调控肿瘤微环境来提高CAR-T 细胞的浸润性,增强对实体瘤的杀伤作用。
2.3.2 双靶向CD70-CAR 细胞 尽管靶向CD19 的CAR-T细胞在弥漫性大B细胞淋巴瘤的治疗中显示出抗肿瘤功效,但是经过靶向CD19的CAR-T细胞治疗,患者缓解后仍会有21%~35%的复发率[49],如在急性淋巴细胞白血病患者中的复发率超过10%,在非霍奇金淋巴瘤患者中高达38%[50]。TU等[49]设计了同时靶向CD19 与CD70 的CAR,对在经过化疗药物治疗后发生多次复发的肿瘤患者进行治疗。结果发现,分别注射靶向CD19 与CD70 的CAR-T 细胞进行治疗,能够维持患者无病生存。YANG 等[51]制备针对2 种肿瘤相关抗原CD70 和B7-H3(CD276)的二价串联CAR(Tan-CAR)细胞,虽然没有完全根除肿瘤,但与CAR-T 细胞治疗组相比,Tan-CAR-T 细胞显著延长小鼠肺癌模型的总体存活率,并且能够以更低的剂量诱导肿瘤消退。
2.4 靶向CD70抗肿瘤药物的副作用
虽然有几种ADC 药物已经进入临床试验阶段,但ADC 也存在一些缺陷:分子靶标可能在一些正常的组织表达,导致细胞毒性作用,也可能有一些ADC会过早释放抗体偶联物导致其无法充分到达靶细胞,作用效果下降[35]。如:MMAF作为ADC的药物分子,会引起眼部毒性,表现为视力模糊、角膜异常或干眼症[52]、呼吸困难、高钙血症和恶心等[39];SGNCD70A药物治疗会导致血小板减少症、疲劳、贫血和外周性水肿[41]。此外,CAR-T 细胞疗法也存在局限性,例如严重的毒性、难以浸润到肿瘤内部、T细胞耗竭、抗原逃逸和异质性,以及CAR-T细胞的体外扩增等问题[53]。在接受CAR-T 细胞治疗的晚期肿瘤患者,尤其是接受多轮次化疗的患者,可能导致获得T细胞数量少、不够健康或增殖能力低,而难以制造有杀伤力的CAR-T细胞[54]。
3 结语
CD70 在多种血液恶性肿瘤和实体瘤组织中高表达,在正常组织中的低/不表达,使得CD70 成为肿瘤免疫治疗的一个引人注目的靶点。目前,治疗CD70 阳性肿瘤的方法主要有CD70 的特异性mAb、ADC以及CAR-T细胞疗法。使用抗CD70的mAb及ADC 治疗会给患者预后带来严重的不良后果,如长期使用抗CD70 的特异性mAb 会导致T 细胞持续活化,引起T细胞耗竭;使用ADC可能会损伤正常组织细胞。尽管CAR-T细胞疗法在血液恶性肿瘤中取得了重大进展,但在实体瘤中仍存在诸多挑战。肿瘤微环境就是影响CAR-T细胞治疗效果的一个重要因素,其主要是由肿瘤细胞和基质细胞在肿瘤发展过程中逐步形成的[55]。其中,实体瘤周围的细胞外基质中含有硫酸乙酰肝素蛋白聚糖,T细胞通过表达乙酰肝素酶(heparanase,HPSE)裂解该物质,进而破坏细胞外基质,使T 细胞浸润肿瘤组织中杀伤肿瘤细胞。研究[56]发现,在长期体外培养的T 细胞中HPSE 表达会下调,导致T细胞不能浸润到肿瘤组织中。通过靶向GD2的CAR-T细胞中转入HPSE治疗胶质母细胞瘤,发现能够增强CAR-T 细胞的浸润性。在特发性肺纤维化病灶中发现,CD70可减少细胞外基质成分的产生与纤维化[57]。总之,CD70 在肿瘤治疗中具有潜在的应用价值,但仍需要更多的研究验证其作为mAb 和CAR-T 细胞的靶点在临床中的有效性及安全性。

